É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Engenharia de um hidrogel de camada dupla para controlar a diferenciação ASC
Neste Artigo
Resumo
Este protocolo é focado na utilização a capacidade inerente de células estaminais para tomar cue a partir de sua matriz circundante extracelular e ser induzidas a diferenciar-se em múltiplos fenótipos. Este manuscrito métodos estende nossa descrição e caracterização de um modelo utilizando um hidrogel de camada dupla, composto de PEG-fibrina e colagénio, ao mesmo tempo, co-diferenciar células-tronco adiposas 1.
Resumo
Polímeros naturais ao longo dos anos ganharam mais importância devido à sua biocompatibilidade hospedeiro e capacidade de interagir com células in vitro e in vivo. Uma área de investigação que tem a promessa em medicina regenerativa é o uso combinatória de novos biomateriais e células estaminais. Uma estratégia fundamental no campo da engenharia de tecidos é o uso de tridimensional andaime (por exemplo, descelularizados matriz extracelular, hidrogéis, micro / nano partículas) para dirigir a função da célula. Esta tecnologia tem evoluído a partir da descoberta de que as células precisam de um substrato sobre o qual podem aderir, proliferar, e expressar seu fenótipo diferenciado celular e função 2-3. Mais recentemente, tem sido também determinado que as células não só a utilização destes substratos para a adesão, mas também interagir e tomar pistas a partir do substrato da matriz (matriz, por exemplo, extracelular, ECM) 4. Portanto, as células e andaimes ter uma ligação recíproca queserve para controlar o desenvolvimento do tecido, organização e função final. As células-tronco adiposas (ASC) são mesenquimais, as células estaminais hematopoiéticas não-apresentar no tecido adiposo que podem exibir multi-linhagem diferenciação e servir como uma fonte prontamente disponível de células (isto é pré-vascular endotélio e pericitos). Nossa hipótese é que as células-tronco derivadas de tecido adiposo pode ser direcionado para diferentes fenótipos simultaneamente, bastando co-cultura-los em matrizes bifásicos 1. O nosso laboratório é focado sobre a cicatrização de feridas dérmica. Para este fim, foi criada uma única matriz composta a partir de os biomateriais naturais, fibrina, colagénio, quitosano e que pode imitar as características e funções de um ambiente de cicatrização da ferida dérmica específico ECM.
Protocolo
1. Isolamento de células-tronco adiposas (ASC) 1, 5
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Isolar adiposo epididimal e perirenal rato e lavar com solução de Hank estéril tamponada de sal (HBSS) contendo 1% de soro fetal bovino (FBS), como 5 descrito anteriormente. Este estudo foi conduzido em conformidade com o Animal Welfare Act, os regulamentos de execução do bem-estar animal e de acordo com os princípios do Guia para o Cuidado e Uso de Animais de Laboratório.
- Picar o tecido e transferir 1-2 g em 25 mL de HBSS contendo FBS a 1% para um tubo de 50 ml e centrifugar a 500 g durante 8 minutos à temperatura ambiente.
- Recolher o de flutuação livre camada de tecido adiposo e transferência para 125-mL Erlenmeyer e trata-se com 25 mL de colagenase tipo II (200 U / mL) em HBSS durante 45 min a 37 ° C num agitador orbital (125 rpm).
- Retire cuidadosamente a fração líquida (abaixo da camada de petróleo e adiposo) por pipetagem e filtrá-lo sequencialmente através de um 100 - filtro de malha de nylon mM - mM e 70. Centrifugar o filtrado a 500 g durante 10 min à temperatura ambiente, aspirar o sobrenadante, e lavar a pelete duas vezes com 25 mL de HBSS.
- Ressuspender o sedimento de células em 50 mL de meio de crescimento (Meio MesenPRO RS Basal) suplementado com MesenPRO Suplemento de Crescimento RS, antibiótico-antimicótico (100 U / mL de penicilina G, 100 ug / mL de sulfato de estreptomicina, e 0,25 ug / mL de anfotericina B), e 2 mM de L-glutamina e as células de pipeta em dois frascos T75 (25 ml / balão).
- Cultura da ASC em um 5% de CO 2-humidificada incubadora a 37 ° C (passagem 2-4 ASC são utilizados para todas as experiências).
2. Preparação de microesferas (MCS)
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- MCS são preparados por um processo de emulsificação de água-em-óleo, juntamente com uma técnica de coacervação iónica usando o nosso protocolo anterior 5. Emulsionar uma solução aquosa de quitosano (6 mL de 3% w / v de quitosano em 0,5 M de ácido acético) em 100 ml de uma mistura de fase de óleo consistindo em óleo de soja, n-octanol (1:2 v / v) e 5 % de sorbitano-mono-oleato de emulsionante (Span 80), utilizando sobrecarga (1700 rpm) e agitação magnética (1000 rpm) simultaneamente em sentidos opostos. Este método de dupla resultará uma mistura que micelas formadas no início antes de reticulação ocorre podem permanecer em solução e não para assentar no fundo. Além disso, a barra de agitação magnética SIDA em DE-agregação de quitosano durante micela formação e rigidization.
- Agita-se a mistura continuamente agitada durante aproximadamente 1 hora até uma emulsão de água-em-óleo estável é obtido. Iniciar transversal iónico ligação com a adição de 1,5 mL de 1% de hidróxido de w / v de potássio em n-octanol min a cada 15 durante 4 h (24 ml no total)
- Depois de se completar a reacção de reticulação, lentamente, decantar a fase de óleo da mistura contendo CSM e imediatamente adicionar a 100 mL de acetona, a solução se tornar turva, devido ao resíduo de óleo. Após 5 minutos, decanta-se, adicionar um adicional de 100 mL de acetona e incubar durante a noite à temperatura ambiente. No dia seguinte, a re-lavagem das pérolas com acetona durante cinco minutos. Depois de realizar estas série lava a solução deve ter virado claro, se não continuar a lavagem até que todo o óleo é removido ea solução de acetona é clara.
- Secam-se as esferas recuperados em um exsicador de vácuo e analisa-se sem processamento adicional. É possível determinar o tamanho médio de partícula CSM, área de superfície por miligrama, ea unidade de volume cúbico usando um analisador de tamanho de partícula.
- Para as experiências subsequentes, lavar o CSM três vezes com água estéril para remover os sais residuais e esterilizar por lavagem durante a noite com 5 mL de etanol absoluto.
3. Determinaro número de grupos amino livres em MCS
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Determinar o número de grupos amino livres presentes na MCS após transversal iónico ligando usando o benzenossulfónico trinitro (TNBS) ensaio de ácido de Bubnis e Ofner 6. Incubar 5 mg de microesferas com 1 mL de 0,5% de solução de TNBS em um tubo de vidro de 50 mL durante 4 h, a 40 ° C e hidrolisar com a adição de 3 mL de HCl 6N a 60 ° C durante 2 h.
- Arrefecer as amostras à temperatura ambiente e extrair os TNBS livres por adição de 5 mL de água desionizada e 10 mL de éter etílico.
- Aquecer uma aliquota de 5 mL da fase aquosa para 40 ° C num banho de água durante 15 min para evaporar qualquer éter residual, arrefecer até à temperatura ambiente, e diluir com 15 mL de água.
- Medir a absorvância a 345 nm com um espectrofotómetro com solução TNBS sem quitosana como em branco eo quitosano utilizado para CSM preparação para determinar o número total de grupos amino. Estimar o número de grupos amino livres da MSC em relação ao quitosano.
4. Carregando ASC no CSM
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Equilibrar 5 mg de MCS esterilizados de seção 2,5 em HBSS estéril durante a noite e adicionar a um 8 - mM tamanho dos poros da membrana de inserção placa de cultura (24-bem placa).
- Depois de os MCS se estabeleceram para a membrana, aspirar cuidadosamente os HBSS e adicionam-se 300 uL de meio de crescimento para o interior da inserção e 700 uL de meio de crescimento para o exterior do inserto.
- ASC Ressuspender a uma concentração adequada (1 × 10 4 e 4 × 10 4) em 200 uL de meio de crescimento e de sementes ao longo do CSM dentro do inserto placa de cultura. O volume final de meio de cultura dentro da inserção, após a semeadura, é de 500 uL.
- Incubcomeu o seeded ASC em MCS por 24 h em um 5% de CO 2 incubadora humidificada a 37 ° C.
5. Determinação da porcentagem de ASC Carregando e viabilidade celular em MCS
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Após a incubação, pipeta CSM a ASC-carregado num tubo de microcentrífuga esterilizado 1,5 mL, sem perturbar as células que migraram para a membrana de inserção.
- Remover o meio residual e adicionar 250 uL de meio de crescimento fresco para o tubo.
- Para cada tubo, adicionar 25 ul de MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazólio] solução (5 mg / mL) e incubar durante 4 h em um 5% de CO 2 humidificada incubadora a 37 ° C.
- Após a incubação, o meio de remover, adicionar 250 uL de sulfóxido de dimetilo, e vórtice a mistura durante 2-5 minutos para solubilizar o formazan complexo.
- Centrifugar o CSM em 2700 gdurante 5 min, pipeta fora o sobrenadante e determinar a sua absorvância a 570 nm de comprimento de onda e 630 nm, utilizando um leitor de placas de padrão, de acordo com as especificações do fabricante MTT.
- Determinar o número de células associadas com os MCS em relação aos valores obtidos a partir de números definidos ASC cultivadas para desenvolver uma curva padrão.
6. Preparação e Caracterização de ASC-CSM incorporado em PEG-fibrina Gels
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Polietileno glicol (PEG) de fibrina hidrogel (PEG-fibrina) preparado por Suggs et al 7 por dissolução do succinimidil glutarato polietileno glicol modificado (PEG; 3400 Da). Utilizando 4 mL de solução salina tamponada com tris (TBS, pH 7,8) e um filtro esterilizar com um filtro de 0,22 mícrons imediatamente antes do início da experiência. PEG dissolvido só é eficaz nesta aplicação para as primeiras horas 3-4.
- Misturar 500 μ l de estoque de fibrinogénio (40 mg / mL em TBS, pH 7,8) e 250μl de PEG estoque em um poço de cultura de uma placa de 6 poços e incubar durante 20 minutos em um 5% de CO 2 incubadora humidificada a 37 ° C. Esta mistura constitui um rácio de concentração molar de 1:10, SG-PEG-SG: fibrinogénio.
- Tome 250 uL de ASC-CSM a uma concentração de 5 mg de CSM, (≈ 2 × 10 4 células) e misturar com a solução de fibrinogénio PEGuilada.
- Imediatamente adicionar 1 ml de trombina de stock (25U/mL) e tritura-se rapidamente uma vez ou duas vezes com a pipeta. Após a mistura da trombina com o PEG-fibrinogénio, imediatamente colocar a mistura de células-gel em uma placa de 12 poços e incubadas em 5% de CO 2 incubadora humidificada a 37 ° C durante 10 min para permitir a gelificação completa. Desde o tempo de gelificação é rápido, não tentar segurar a solução de gel dentro da ponteira por mais de 5 segundos. O fibrinogénio peguilado é clivado pela trombina e forma um hidrogel de fibrina PEGuilada. Como th, tale produto gel final é referido como PEG-fibrina.
- Lavar os géis PEG-fibrina duas vezes com HBSS e incubar com alfa mínimas meios essenciais (α-MEM) suplementado com FBS 10%, em um 5% de CO 2 incubadora humidificada a 37 ° C.
- Observar a migração de células de CSM no gel durante um período de 11 dias usando técnicas de microscopia de luz padrão.
7. Preparação e Caracterização de ASC-CSM incorporado em géis de colágeno
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Mistura ASC-CSM (5 mg contendo ≈ 2 × 10 4 células) com colagénio de tipo 1 (7,5 mg / mL), extraído a partir de tendões da cauda de rato de acordo com o método de Bornstein 8 e fibrilam depois de ajustar o pH para 6,8 utilizando NaOH 2N.
- Adicionar a mistura de colagénio-ASC-CSM fibrilada para uma placa de 12 poços e incubar durante 30 min em um 5% de CO 2 humidified incubadora a 37 ° C.
- Depois de fibrilação completa, incubar os géis de colagénio-ASC-CSM para até 11 dias em um 5% de CO 2 incubadora humidificada a 37 ° C.
- Observar a migração de células de CSM no gel durante um período de 11 dias usando técnicas de microscopia padrão.
8. Desenvolvimento de bifásicos PEG-fibrina (ASC-CSM) Constrói-gel de colágeno
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Para desenvolver a bicamada construir, preparar colagénio e os géis de PEG-fibrina conforme descrito acima, com ligeiras modificações. Resumidamente, para estudar as propriedades migratórias e co-indução de uma única fonte de células-tronco usando dois bioscaffolds, "sanduíche" do ASC-MCS entre o colágeno e os andaimes PEG-fibrina, usando um processo de quatro etapas: 1) Carga ASC em CSM, 2) lançar gel de colágeno fibrilada e uma camada das pérolas ASC-CSM sobre o collagen gel, 3) fundido gel PEG-fibrina sobre o gel de ASC-CSM-colagénio e permitir gel para solidificar, e 4) adicionar meio para bem e inserir a estudar células in vitro ou remover do inserto para aplicações in vivo (ver Figura 1 ).
- Prepara-se uma tipo 1-1 mL de colagénio (7,5 mg / mL) A mistura tal como descrito acima em 7,1, sem a adição de ASC-CSM à mistura. Colocar a mistura em uma inserção de cultura de tecido de 6 poços (8-iM tamanho de poro) e incubar durante 30 min em um 5% de CO 2 incubadora humidificada a 37 ° C.
- Depois de completa a fibrilação camada, sobre o colagénio mg superfície 5 de ASC-CSM (10, 000 células / mg) suspenso em meios de cultura (200 uL). Após as microesferas têm assente sobre o gel, preparar o gel PEG-fibrina conforme descrito na secção 6.0, sem a adição de ASC-CSM-se à mistura, ea camada da solução de fibrinogénio / trombina PEGuilada sobre as camadas de colagénio ASC-CSM-. Ao preparar o gel PEG-fibrina, usar 250 uL de meio de cultura celular, em substituição de tele uL de meio contendo 250 das células.
- Uma vez concluída, incubar as construções durante 30 min em um 5% de CO 2 incubadora humidificada para alcançar a gelificação completa antes de alimentar a construção com meio de cultura.
- Após a gelificação completa, o local de 1 mL de meio na câmara superior sobre o construto e 3 mL de meio na câmara inferior.
9. Fazendo Solutions Banco
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Estoque de cloreto de cálcio (40 mM): Use somente CaCl 2 .2 H 2 O. Dissolve-se 588,4 mg de CaCl2 0,2 H2O com 100 ml de água desionizada. Esterilizar utilizando um filtro de 0,22 um.
- Polietileno-glicol: PEG é altamente reactivo com o oxigénio e pode tornar-se oxidado quando exposta ao ar ambiente. Como tal, o PEG deve ser armazenado sob azoto (N 2) atmosfera. Accurately pesar 32 mg em um tubo de centrífuga de 2 ml (certificar-se para purgar os tubos com N 2 antes da utilização) e armazenar a -80 ° C até estar pronto para utilização. Dissolve-se 32 mg de PEG em 4 mL de TBS solução antes da utilização.
As soluções a seguir deve ser feita antes de cada nova experiência. - TBS solução: (pH 7,75-7,77 a 25 ° C; pH a 25 ° C é muito critico). Para preparar 15 ml de solução de TBS, cuidadosamente dissolver um comprimido tampão no filtro esterilizado de água desionizada e ajusta-se o pH desejado. Não guarde a solução estoque de preparar-la fresca o tempo todo.
- Solução de fibrinogénio: (40 mg / ml). Dissolve-se pó de fibrinogénio em TBS para fazer a concentração de fibrinogénio 40 mg / ml. Dissolve-se durante a noite com um agitador magnético, a 4 ° C. É mais fácil para dissolver a quantidade 1-g inteiro com a quantidade necessária de TBS. No dia seguinte, remover o fibrinogénio a partir de 4 ° C (geralmente turva) e permitir que elepara aquecer num banho de água até que uma solução homogénea é obtida. Finalmente, filtrar esterilizar o fibrinogénio utilizando um filtro de 0,45 mícrons.
- A trombina solução (25 Unidades / mL): Para tornar a solução de trombina, pesar a quantidade necessária e que se dissolvem com a mM 40 preparada CaCl2 0,2 H 2 O. É sempre uma boa prática usar o frasco inteiro de trombina para fazer o estoque. Exemplo: Dissolver uma garrafa de 5 kU trombina com 200 mM de CaCl2 0,2 H2O, alíquota e armazenar a -20 ° C.
10. Os resultados representativos
O objetivo geral da técnica apresentada aqui é demonstrar o potencial de diferenciação dirigida por matriz simultânea de ASC em múltiplos fenótipos usando CSM como um veículo de entrega. Nós demonstramos uma estratégia in vitro para entregar as células-tronco a partir de MCS em uma bicamada de colágeno-PEG-fibrina andaime. Caracterização da ASC integra a presente reveale andaimed que ASC-carregados MCS pode ser "imprensada" entre uma camada de colágeno e PEG-fibrina simultaneamente e diferencialmente tomar sugestão de ambos os ambientes extracelulares a prosperar sob as novas condições. O primeiro caracteriza-se a capacidade para o sistema modelo para manter a viabilidade celular e capacidades migratórias. O colagénio suportado a capacidade de ASC para manter a sua "stemness", como foi demonstrado pela sua expressão de Stro-1 e sua morfologia de fibroblastos-like (Figura 2D e 2F). Em contraste, o PEG-fibrina induzida as ASC para diferenciar para um fenótipo vascular, como é demonstrado pela sua morfologia estrutura tubular semelhante, a sua expressão em células específicas endotelial do factor de von Willebrand (Figura 2E e 2G), e pericyte expressão específica de NG2 e crescimento derivado de plaquetas beta do receptor do factor (PDGFRβ) (dados não mostrados). Além disso, estes fenótipos observados apareceu a ocorrer no início da cultura e foram mantidas durante 11 dias, como é demtrada na Figura 3.
Tabelas e Figuras
Benefícios da bicamada Construir:
- O andaime sozinho sem células podem funcionar como um andaime bioativo.
- PEG-fibrina pode induzir as células estaminais para diferenciar sem a adição de factores de crescimento.
- O colagénio pode auxiliar na manutenção do fenótipo de células estaminais de ASC.
- Uma construção de bicamada pode ser utilizado como um substrato activo para outros tipos de células para migrar e proliferar (por exemplo, células endoteliais, fibroblastos, queratinócitos, células musculares lisas, pericitos).
- Ele pode ser usado com andaimes duro-engenharia de tecidos como o osso hydroxyaptite ou desmineralizada para regenerar tecidos duros e moles.
- Ele pode ser utilizado para desenvolver um multi-camadas, construto tecido de diversa (como dermo-vascular, vascular-epitelial, dérmica-vascular-hipodérmica, etc.)
- Ele utiliza uma única fonte de células para desenvolver simultaneamentecompartimentos multicelulares.
- Ele tem o potencial para integrar com o tecido do hospedeiro, uma vez que é de origem natural.
- CSM dentro da construção de gel proporciona uma plataforma para as células a migrar a partir de.
- A quitosana, usado para preparar CSM, é um conhecido químico ativo atrativo.
- O conceito geral aplicada neste protocolo de "dirigida por matriz diferenciação de células-tronco" pode ser aplicado a células estaminais tipos outros. No entanto, mais estudos são necessários para determinar a viabilidade da matriz baseada diferenciação. A bicamada gel andaime pode atuar como um reservatório para entregar as células de uma forma sustentada e controlada.
- Após a reconstrução, os géis podem ainda ser separado em componentes individuais.
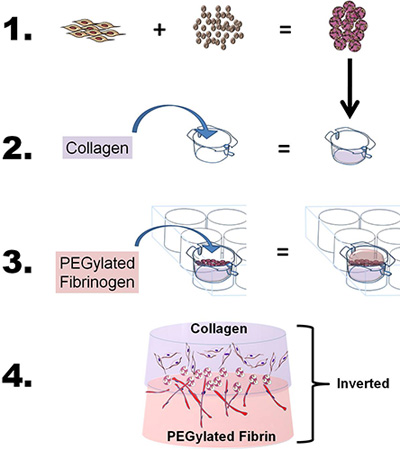
Figura 1. Esquemático que representa o objectivo global eo processo da técnica. 1) As células-tronco adiposas (ASC) são eisaded para microesferas de quitosano. 2) O colagénio é então vertida para uma inserção de 6 poços, o pH ajustado para fibrilar o colagénio ea inserção colocada em uma câmara de placa de 6 poços. As esferas ASC-carregadas da CSM são, então, colocado sobre o colágeno. 3) O fibrinogénio é ligado a PEG, em seguida, vertida sobre o colagénio (ASC-CSM) e gelificada pela adição de trombina. 4) A construção bicamada final pode então ser removido a partir da inserção de cultura e utilizado para in vitro ou in vivo análise.
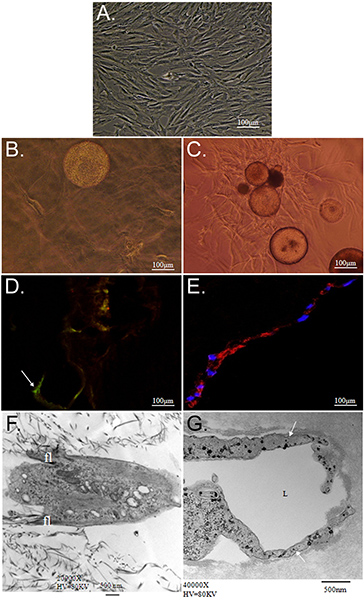
Figura 2. Caracterização de ASC cultivadas dentro de colagénio e as matrizes de PEG-fibrina 3D. A) fotomicrografia de contraste de fase de isolado ASC passadas e mantido usando rotina 2-dimensionais técnicas de cultura de células. As fotomicrografias B, D, E e F ilustram ASC-CSM cultivadas num gel de colagénio 3-dimensional; que C, E, e G mostram ASC-CSM cultivadas dentro de um 3-dimensional PEG-fibrina gel, tanto no dia 12. Em B e C), ASC são mostrados migrar para longe da esfera CSM em ambos os tipos de andaime. ASC parecem ter uma achatada, morfologia fusiforme em colagénio (B), mantendo a sua expressão do marcador de células estaminais Stro-1 (D; seta). Quando cultivados em PEG-fibrina ASC exibem mais do tubo estruturas semelhantes e são induzidas para expressar tais marcadores de células vasculares, como Factor de von Willebrand (E). Microscopia eletrônica de transmissão mostra a morfologia típica demonstrada pela ASC dentro de cada cadafalso. ASC em gel de colagénio parecem ter filopodia menor (fl) que se estende a partir do corpo da célula (F), enquanto que ASC tipicamente formados luminais (rotulado L) estruturas (g; seta).
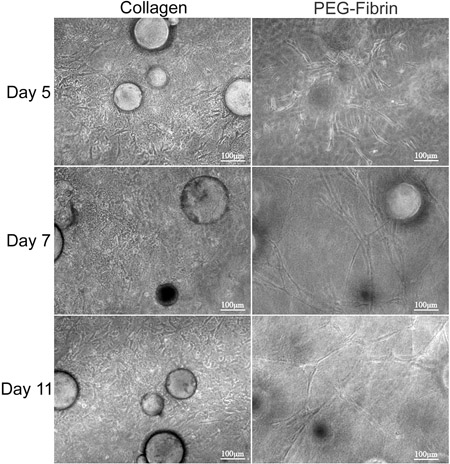
Figura 3. A análise morfológica de ASC-MCS entre bicamadas de colágeno e PEG-fibrina géis. ASC-MCS foram "sanduíche" entre colagénio e PEG-fibrina géis e mantidas em cultura durante 11 dias. O Colu esquerdamn representa ASC migram e proliferam dentro da matriz de colágeno e parece assumir uma morfologia fusiforme. A coluna da direita mostra ASC migram longe os MCS e formando tubo estruturas semelhantes ao longo do gel PEG-fibrina.
Discussão
ASC são bem conhecidos pela sua facilidade de isolamento e capacidade de diferenciar para vários tipos de células. Com as técnicas descritas neste manuscrito, somos capazes de explorar a plasticidade da ASC por expor essas células para biomatrices múltiplos simultaneamente. Como as células migram para longe de sua base CSM e entrar no seu meio ambiente extracelular, as células tomar sugestão do andaime e pode manter "stemness" (colágeno) ou ser induzido a diferenciar os tipos de células para vascula...
Divulgações
Não há interesses conflitantes financeiros existem.
Alerta
As opiniões ou afirmações contidas neste documento são as opiniões pessoais dos autores e não devem ser interpretadas como oficial ou refletindo as opiniões do Departamento de Defesa ou o Governo dos EUA. Os autores são funcionários do governo dos EUA, e este trabalho foi elaborado como parte das suas funções oficiais. Todo o trabalho foi apoiado pelo EUA Pesquisa Médica do Exército e do Comando de Material. Este estudo foi realizado ao abrigo de um protocolo revisto e aprovado pelo Comitê de Ética Médica EUA Exército e do Comando de Material Conselho de Revisão Institucional e de acordo com o protocolo aprovado.
Agradecimentos
SN foi apoiado por uma bolsa pós-doutorado da Iniciativa Engenharia de Tecidos Pittsburgh. DOZ é apoiado por uma subvenção concedida à Fundação de Genebra.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamentos | Companhia | Número de catálogo | Comentários |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175 | Consumível |
| Soro Fetal Bovino | Hyclone | SH30071.03 | Consumível |
| Colagenase do Tipo II | Sigma-Aldrich | C6685 | Consumível |
| 70-iM filtro de rede de nylon | BD Biosciences | 352350 | Consumível |
| 100-iM filtro de rede de nylon | BD Biosciences | 352360 | Consumível |
| MesenPRO Sistema Meio de Crescimento | Invitrogen | 12746-012 | Consumível |
| L-Glutamina | Gibco | 25030 | Consumível |
| CaCl 2 .2 H 2 O | Sigma | C8106 | Consumível |
| T75 frasco de cultura de tecidos | BD Biosciences | 137787 | Consumível |
| Chitosan | Sigma-Aldrich | 448869 | Consumível |
| Ácido Acético | Sigma-Aldrich | 320099 | Consumível |
| N-octanol | Acros Organics | 150630025 | Consumível |
| Sorbitano-mono-oleato | Sigma-Aldrich | S6760 | Consumível |
| Hidróxido de Potássio | Sigma-Aldrich | P1767 | Consumível |
| Acetona | Fisher Scientific | L-4859 | Consumível |
| Etanol | Sigma-Aldrich | 270741 | Consumível |
| Trinitro benzenossulfónico | Sigma-Aldrich | P2297 | Consumível |
| Ácido clorídrico | Sigma-Aldrich | 320331 | Consumível |
| Éter etílico | Sigma-Aldrich | 472-484 | Consumível |
| 8 m de tecido Placa Insere Cultura | BD Biosciences | 353097 | Consumível |
| 1,5 ml tubos de microcentrífuga | Pescador | 05-408-129 | Consumível |
| Reagente MTT | Invitrogen | M6494 | Consumível |
| Sulfóxido de dimetilo | Sigma-Aldrich | D8779 | Consumível |
| Qtracker celular Labeling Kit (QRastreador 655) | Sondas moleculares | Q2502PMP | Consumível |
| Colágeno tipo 1 | Travigen | 3447-020-01 | Consumível |
| Hidróxido de Sódio | Sigma-Aldrich | S8045 | Consumível |
| 12-Bem Cultura Pratos Tecido | BD Biosciences | 353043 | Consumível |
| Fibrinogênio | Sigma | F3879 | Consumível |
| Trombina | Sigma | T6884 | Consumível |
| Derivada Benztriazole de Polietileno | Sunbio | DE-034GS | Consumível |
| Tampão de Tris Tablet (pH 7,6) | Sigma | T5030 | Consumível |
| Centrifugar | Eppendorf | 5417R | Equivolvimento |
| Orbital Shaker | New Brunswick Scienctific | C24 | Equipamento |
| Incubadora de CO umidificado com Air-5 2% | Thermo Scientific | Modelo 370 | Equipamento |
| Agitador | IKA | Visc6000 | Equipamento |
| Agitador Magnético | Corning | PC-210 | Equipamento |
| Exsicador de vácuo | - | - | Equipamento |
| Analisador de Tamanho de Partícula | Malvern | STP2000 Spraytec | Equipamento |
| Banho de água | Fisher Scientific | Isotemp210 | Equipamento |
| Espectrofotômetro | Beckman | Beckman Coulter DU Espectrofotômetro 800UV/Visible | Equipamento |
| Vórtice | Diagger | 3030a | Equipamento |
| Leitora | Molecular Devices | Spectramax M2 | Equipamento |
| Luz / microscópio de fluorescência | Olimpo | IX71 | Equipamento |
| Microscópio confocal | Olimpo | FV-500 Laser Scanning microscópio confocal | Equipamento |
| Microscópio Eletrônico de Varredura | Carl Zeiss microfilmagem | Leo 435 VP | Equipamento |
| Microscópio eletrônico de transmissão | JEOL | JEOL 1230 | Equipamento |
Referências
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados