È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Progettazione di un Hydrogel doppo strato di controllo differenziazione ASC
In questo articolo
Riepilogo
Questo protocollo si concentra sulla utilizzando la capacità intrinseca delle cellule staminali a prendere spunto dalla loro matrice extracellulare che circonda ed essere indotte a differenziarsi in fenotipi multipli. Questo manoscritto metodi estende la nostra descrizione e caratterizzazione di un modello utilizzando un idrogel doppo strato, costituito da PEG-fibrina e collagene, contemporaneamente alla co-differenziare derivate da tessuto adiposo cellule staminali 1.
Abstract
Polimeri naturali nel corso degli anni hanno acquisito maggiore importanza a causa della loro biocompatibilità di accoglienza e la capacità di interagire con le cellule in vitro e in vivo. Un'area di ricerca che promette nel campo della medicina rigenerativa è l'uso combinatorio di biomateriali innovativi e cellule staminali. Una strategia fondamentale nel campo dell'ingegneria dei tessuti è l'uso di tridimensionale ponteggio (ad esempio, decellularizzato matrice extracellulare, idrogel, micro / nano particelle) per dirigere la funzione delle cellule. Questa tecnologia si è evoluta dalla scoperta che le cellule hanno bisogno di un substrato su cui si può aderire, proliferare, ed esprimono il loro fenotipo differenziato cellulare e la funzione 2-3. Più recentemente, è stato anche determinato che le cellule non solo utilizzare questi substrati per adesione, ma anche interagire e prende spunto dal substrato di matrice (ad esempio, matrice extracellulare, ECM) 4. Pertanto, le cellule e ponteggi una connessione reciproca cheserve a controllare lo sviluppo dei tessuti, l'organizzazione e la funzione finale. Derivate da tessuto adiposo cellule staminali (CSA) sono mesenchimale, non-ematopoietiche cellule staminali presenti nel tessuto adiposo, che può esibire multi-lineage differenziazione e servire come fonte immediatamente disponibile di cellule (cioè pre-endoteli vascolari e periciti). La nostra ipotesi è che derivate da tessuto adiposo cellule staminali possono essere dirette verso differenti fenotipi contemporaneamente semplicemente co-coltura in matrici doppo strato 1. Il nostro laboratorio è focalizzata sulla guarigione della ferita cutanea. A questo scopo, abbiamo creato un'unica matrice composita dai biomateriali naturali, fibrina, collagene, e chitosano che possono mimare le caratteristiche e le funzioni di un dermo-specifico ambiente guarigione della ferita ECM.
Protocollo
1. Isolamento derivate da tessuto adiposo cellule staminali (CSA) 1, 5
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Isolare adiposo perirenale e epididimale di ratto e lavare con soluzione salina sterile tamponata di Hank (HBSS) contenente 1% siero bovino fetale (FBS) 5 come precedentemente descritto. Questo studio è stato condotto nel rispetto della legge sulla protezione degli animali, l'applicazione dei regolamenti benessere degli animali e in conformità con i principi della guida per la cura e l'uso di animali da laboratorio.
- Tritare il tessuto e trasferire 1-2 g in 25 ml di HBSS contenente 1% FBS in una provetta da 50 ml e centrifugare a 500 g per 8 minuti a temperatura ambiente.
- Raccogliere il fluttuante strato di tessuto adiposo e trasferimento 125-mL beuta e trattare con 25 ml di collagenasi di tipo II (200 U / mL) in HBSS per 45 min a 37 ° C in un agitatore orbitale (125 rpm).
- Rimuovere con cautela la frazione liquida (sotto olio e strato adiposo) da parte dell'uso lasciare equilibrare e filtrarli in modo sequenziale attraverso un 100 - filtro a maglia di nylon micron - micron e 70. Centrifugare il filtrato a 500 g per 10 min a temperatura ambiente, aspirare il surnatante, il pellet e lavate due volte con 25 ml di HBSS.
- Risospendere il pellet di cellule in 50 mL di mezzo di crescita (RS MesenPRO medio basale) supplementato con supplemento MesenPRO crescita RS, antibiotico-antimicotico (100 U / mL di penicillina G, 100 pg / mL di streptomicina solfato, e 0,25 ug / ml di amfotericina B), e 2 mM di L-glutammina e cellule pipetta in due palloni T75 (25 ml / beuta).
- La cultura il ASC in un 5% di CO 2-incubatore umidificato a 37 ° C (passaggio 2-4 ASC sono utilizzati per tutti gli esperimenti).
2. Preparazione Chitosan Microsfere (CSM)
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- CSM sono preparati da un acqua-in-olio processo di emulsionamento con una tecnica coacervazione ionico usando la nostra precedente protocollo 5. Emulsionare una soluzione acquosa di chitosano (6 mL del 3% w / v chitosano in 0,5 M di acido acetico) in 100 ml di una miscela fase olio costituito da olio di soia, n-ottanolo (1:2 v / v) e 5 % sorbitan-monooleato (Span 80) emulsionante, usando testa (1700 rpm) e agitazione magnetica (1000 rpm) simultaneamente in direzioni opposte. Questo metodo di duplice assicura la miscelazione che micelle formate presto prima reticolazione avviene può rimanere in soluzione e non a depositarsi sul fondo. Inoltre, l'agitazione magnetica bar aiuti in de-aggregazione chitosano durante la formazione delle micelle e rigidization.
- Agitare la miscela agitata continuamente per circa 1 ora fino uno stabile acqua-in-olio è ottenuto. Iniziare croce ionico collega con l'aggiunta di 1,5 ml di 1% w / v di idrossido di potassio in n-ottanolo ogni 15 min per 4 h (24 mL totale)
- Dopo completamento della reazione di reticolazione, lentamente decantare la fase olio della miscela contenente CSM e aggiungere immediatamente il 100 mL di acetone, la soluzione diventa torbida, a causa del residuo di petrolio. Dopo 5 minuti, decantare, aggiungere un ulteriore 100 mL di acetone e incubare una notte a temperatura ambiente. Il giorno successivo, re-lavare le sfere con acetone per cinque minuti. Dopo aver eseguito questi seriale lava la soluzione deve essere trasformato chiaro, se non ripetere il lavaggio finché l'olio viene rimosso e la soluzione di acetone è chiara.
- Asciugare le sfere recuperate in un essiccatore a vuoto e analizzare senza ulteriore trasformazione. È possibile determinare la dimensione particellare in media CSM, area superficiale per milligrammo, e il volume unitario cubico utilizzando un analizzatore di dimensione delle particelle.
- Per gli esperimenti successivi, lavare le CSM tre volte con acqua sterile per eliminare i sali residui e sterilizzare lavando tutta la notte con 5 mL di etanolo assoluto.
3. Determinazioneil numero di gruppi amminici liberi in CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Determinare il numero di gruppi amminici liberi presenti nel CSM dopo cross linking ionico utilizzando il benzensolfonico trinitro (TNBS) dosaggio di acido Bubnis e Ofner 6. Incubare 5 mg di microsfere con 1 mL di soluzione 0,5% in TNBS un 50-mL tubo di vetro per 4 ore a 40 ° C e idrolizzare con l'aggiunta di 3 ml di HCl 6N a 60 ° C per 2 h.
- Raffreddare i campioni a temperatura ambiente ed estrarre i TNBS libere aggiungendo 5 ml di acqua deionizzata e 10 ml di etere etilico.
- Riscaldare un 5-mL aliquota della fase acquosa a 40 ° C in un bagno d'acqua per 15 minuti per evaporare qualsiasi etere residuo, raffreddare a temperatura ambiente, e diluire con 15 ml di acqua.
- Misurare l'assorbanza a 345 nm con uno spettrofotometro con la soluzione di TNBS senza chitosano come vuoto e il chitosano utilizzato per CSM priparazione per determinare il numero totale di gruppi amminici. Stimare il numero di gruppi amminici liberi del CSM rispetto al chitosano.
4. Caricamento in ASC CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Equilibrare 5 mg di CSM sterilizzati dalla sezione 2.5 in HBSS sterili durante la notte e aggiungere ad un 8 - micron dimensione dei pori della membrana inserto cultura piastra (24 pozzetti).
- Dopo aver risolto i CSM sulla membrana, aspirare accuratamente le HBSS e aggiungere 300 ml di terreno di crescita all'interno dell'inserto e 700 microlitri di terreni di crescita verso l'esterno dell'inserto.
- ASC Risospendere alla concentrazione adeguata (1 × 10 4 a 4 × 10 4) in 200 microlitri di terreno di crescita e di semi sopra il CSM all'interno dell'inserto piastra di coltura. Il volume finale del mezzo all'interno dell'inserto coltura, dopo la semina, è 500 pl.
- Incubmangiato la testa di serie ASC sul CSM per 24 ore in un 5% di CO 2 incubatore umidificato a 37 ° C.
5. Determinazione della percentuale di caricamento ASC e la vitalità cellulare in CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Dopo l'incubazione, la pipetta ASC-caricato CSM in uno sterile 1,5 mL provetta da microcentrifuga senza disturbare le cellule che sono migrate nella membrana di inserimento.
- Rimuovere il mezzo residuo e aggiungere 250 microlitri di terreno di crescita fresco al tubo.
- Per ogni provetta, aggiungere 25 ul di MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazolio bromuro] soluzione (5 mg / mL) e incubare per 4 ore in una CO 2 5% umidificata incubatore a 37 ° C.
- Dopo l'incubazione, rimuovere il supporto, si aggiungano 250 microlitri di dimetilsolfossido e miscelare l'impasto per 2-5 min per solubilizzare il complesso formazan.
- Centrifugare il CSM a 2700 gper 5 min, pipetta il surnatante e determinare la sua assorbanza a lunghezza d'onda di 570 nm e 630 nm usando un lettore di piastra normale, secondo le specifiche del costruttore MTT.
- Determinare il numero di cellule associato con i CSM relativi ai valori ottenuti da definiti numeri ASC coltura di sviluppare una curva standard.
6. Preparazione e caratterizzazione di ASC-CSM embedded in PEG-gel di fibrina
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Polietilene glicole (PEG) fibrina (PEG-fibrina) idrogel preparati Suggs et al 7 sciogliendo la succinimidil polietilenglicole glutarato modificato (PEG; 3400 Da). Utilizzando 4 mL di soluzione salina tamponata Tris (TBS, pH 7,8) e filtro sterilizzare con un filtro di 0,22 micron, poco prima dell'inizio dell'esperimento. PEG disciolto è efficace solo in questa applicazione per le prime 3-4 ore.
- Mescolare 500 μ l di brodo fibrinogeno (40 mg / mL in TBS, pH 7,8) e 250μl di azioni PEG in una cultura e di una piastra da 6 pozzetti ed incubare per 20 minuti in un 5% di CO 2 incubatore umidificato a 37 ° C. Questa miscela costituisce un rapporto molare di concentrazione di 1:10, SG-PEG-SG: fibrinogeno.
- Prendete 250 microlitri della ASC-CSM ad una concentrazione di 5 mg di CSM, (≈ 2 × 10 4 celle) e mescolare con la soluzione di fibrinogeno pegilato.
- Immediatamente aggiungere 1 ml di trombina stock (25U/mL) e rapidamente triturare una o due volte con la pipetta. Dopo la miscelazione la trombina con il PEG-fibrinogeno, immediatamente posizionare la cellula-gel miscela a 12-pozzetti e incubate in 5% CO 2 incubatore umidificato a 37 ° C per 10 min per permettere gelificazione completa. Poiché il tempo di gelificazione è veloce, non cercare di tenere la soluzione di gel all'interno del puntale per più di 5 secondi. Il fibrinogeno è scisso PEGylated da trombina e forma un idrogel PEGylated fibrina. Come tale, thprodotto gel e finale viene chiamato PEG-fibrina.
- Lavare le PEG-fibrina gel due volte con HBSS e incubare con alfa terreno minimo essenziale (α-MEM) supplementato con 10% FBS in un 5% CO 2 incubatore umidificato a 37 ° C.
- Osservare la migrazione di cellule CSM in gel su un periodo di 11 giorni usando tecniche standard di microscopia ottica.
7. Preparazione e caratterizzazione di ASC-CSM incorporato in gel di collagene
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Mix ASC-CSM (5 mg contenente ≈ 2 × 10 4 cellule) con collagene di tipo 1 (7,5 mg / mL) estratto da tendini coda di ratto secondo il metodo di Bornstein 8 e fibrillano dopo aver regolato il pH a 6,8 con NaOH 2N.
- Aggiungere il fibrillato collagene-ASC-CSM miscela a 12 pozzetti ed incubare per 30 minuti in un 5% di CO 2 umidostatocato incubatore a 37 ° C.
- Dopo completa fibrillazione, incubare le collagene-ASC-CSM gel fino a 11 giorni in 5% CO 2 incubatore umidificato a 37 ° C.
- Osservare la migrazione di cellule CSM in gel su un periodo di 11 giorni usando tecniche di microscopia standard.
8. Sviluppo di PEG doppo strato di fibrina-(ASC-CSM)-collagene Costrutti Gel
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Per sviluppare il bistrato costrutto, preparare sia il collagene e PEG-fibrina gel come descritto sopra, con lievi modifiche. In breve, per studiare le proprietà migratorie e co-induzione di una singola fonte di cellule staminali utilizzando due bioscaffolds, "sandwich" la ASC-CSM tra il collagene e le PEG-fibrina impalcature utilizzando un processo in quattro fasi: 1) Carico ASC sul CSM, 2) gettato gel fibrillato strato di collagene e le ASC-CSM perline Attraverso il Collagen gel, 3) fuso PEG-fibrina gel sulla ASC-CSM-gel di collagene e consentire gel di solidificare, e 4) aggiungere medio bene e inserire studiare le cellule in vitro o rimuovere da inserto per applicazioni in vivo (vedi Figura 1 ).
- Preparare una 1-mL collagene di tipo 1 (7,5 mg / mL), preparato come descritto sopra in 7,1, senza aggiungere ASC-CSM alla miscela. Posizionare la miscela in un 6-ben inserto di coltura (8-um dimensione dei pori) e incubare per 30 min in un 5% CO 2 incubatore umidificato a 37 ° C.
- Dopo aver completato fibrillazione, strato sopra il collagene superficie 5 mg di ASC-CSM (10, 000 cellule / mg) sospeso in terreni di coltura (200 pl). Dopo le microsfere si sono insediati nel gel, preparare il PEG-gel di fibrina come descritto nella sezione 6.0, senza l'aggiunta di ASC-CSM alla miscela, e lo strato del pegilato fibrinogeno / trombina soluzione nel corso degli ASC-CSM-strati di collagene. Nel preparare il PEG-fibrina gel, utilizzare 250 pl di mezzo di coltura cellulare in luogo di tegli 250 pl di mezzo contenente le cellule.
- Una volta completato, i costrutti incubare per 30 min in un 5% di CO 2 incubatore umidificato per ottenere completa gelificazione prima di alimentare il costrutto con mezzo di coltura.
- Dopo completa gelificazione, posto 1 mL di terreno nella camera superiore sul costrutto e 3 mL di terreno nella camera inferiore.
9. Fare Solutions archivio
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Cloruro di azioni di calcio (40 mm): Utilizzare solo CaCl 2 .2 H 2 O. Sciogliere 588,4 mg di CaCl 2 .2 H 2 O con 100 ml di acqua deionizzata. Sterilizzare utilizzando un filtro di 0,22-um.
- Polietilenglicole: PEG è altamente reattivo con ossigeno e può essere ossidato quando esposto all'aria ambiente. Come tale, PEG deve essere conservata in azoto (N 2) atmosfera. Accurately pesare 32 mg in uno da 2 ml provetta da centrifuga (assicuratevi di eliminare i tubi con N 2 prima dell'uso) e conservare a -80 ° C fino al momento dell'uso. Sciogliere 32 mg di PEG in 4 mL di soluzione di TBS prima dell'uso.
Le seguenti soluzioni devono essere effettuate fresco prima di ogni esperimento. - TBS soluzione: (pH 7,75-7,77 a 25 ° C, pH a 25 ° C è molto critico). Per preparare 15 ml di soluzione di TBS, accuratamente sciogliere una compressa tampone in sterilizzata con filtro acqua deionizzata e regolare il pH desiderato. Non conservare la soluzione stock-prepararla fresca ogni volta.
- Fibrinogeno soluzione: (40 mg / ml). Sciogliere polvere fibrinogeno in TBS per rendere la concentrazione di fibrinogeno 40 mg / ml. Sciogliere per tutta la notte con un agitatore magnetico a 4 ° C. È facile per sciogliere l'intera quantità di 1-g con la quantità richiesta di TBS. Il giorno seguente, rimuovere il fibrinogeno da 4 ° C (di solito torbido) e consentonoper riscaldare in un bagno di acqua fino a una soluzione omogenea. Infine, filtrare sterilizzare il fibrinogeno utilizzando un filtro da 0,45 micron.
- Trombina soluzione (25 unità / ml): Per rendere la soluzione di trombina, pesare la quantità richiesta e sciogliere con il preparato 40 mM CaCl 2 .2 H 2 O. E 'sempre una buona pratica di utilizzare la fiala intera della trombina per fare il brodo. Esempio: Sciogliere una bottiglia di 5 kU trombina con 200 mM di CaCl 2 .2 H 2 O, aliquotare e conservare a -20 ° C.
10. Risultati rappresentativi
L'obiettivo generale della tecnica qui presentata è quello di dimostrare il potenziale di matrice simultanea-driven differenziazione delle ASC nel CSM fenotipi multipli usando come veicolo di consegna. Dimostriamo una strategia in vitro per fornire cellule staminali dal CSM in un doppo strato di collagene-PEG-fibrina patibolo. Caratterizzazione di ASC integrato all'interno di questo reveale scaffoldd che ASC-caricati CSM può essere "sandwich" tra uno strato di collagene e PEG-fibrina simultaneamente e differenzialmente prendono spunto da entrambi gli ambienti extracellulari a crescere in loro nuove condizioni. Per prima cosa ha caratterizzato la possibilità per il sistema modello per mantenere la vitalità delle cellule e le capacità migratorie. Collagene sostenuto la capacità di ASCs di mantenere la loro "staminalità", come hanno dimostrato la loro espressione di Stro-1 e la loro morfologia simile fibroblasti (Figura 2D e 2F). Al contrario, PEG-fibrina indotto le ASC a differenziarsi verso un fenotipo vascolare, come è dimostrato dalla loro morfologia simile a tubo struttura, la loro cellule endoteliali-specifica espressione del fattore di von Willebrand (2E Figura e 2G), e periciti-specifica di espressione NG2 e crescita derivato dalle piastrine recettore beta fattore (PDGFRβ) (dati non mostrati). Inoltre, questi fenotipi osservati si sono verificati all'inizio di cultura e sono stati mantenuti nell'arco di 11 giorni, come è demonstrated in Figura 3.
Tabelle e figure
Vantaggi di doppio strato Construct:
- La sola scaffold senza cellule in grado di eseguire come impalcatura bioattiva.
- PEG-fibrina può indurre le cellule staminali per differenziare senza aggiunta di fattori di crescita.
- Il collagene può aiutare a mantenere il fenotipo delle cellule staminali del CSA.
- Un costrutto doppio strato può essere utilizzato come substrato attivo per altri tipi di cellule a proliferare e migrare (ad esempio, cellule endoteliali, fibroblasti, cheratinociti, cellule muscolari lisce, periciti).
- Può essere usato con tessuto duro-scaffold ingegneria come l'osso hydroxyaptite o demineralizzata per rigenerare tessuti duri e molli.
- Può essere utilizzato per sviluppare un multistrato, diverse ingegneria tessutale costrutto (come dermo-vascolare, vascolare-epiteliale, dermo-ipodermico-vascolari, ecc.)
- Si utilizza una singola cella sorgente di sviluppare simultaneamentecompartimenti pluricellulari.
- Ha il potenziale per l'integrazione con il tessuto ospite, poiché è di origine naturale.
- CSM all'interno del costrutto gel fornisce una piattaforma per le cellule di migrare dal.
- Il chitosano, usato per preparare CSM, è un noto attivo chemo-attrattore.
- Il concetto generale applicato in questo protocollo di "matrix-driven differenziazione delle cellule staminali" può essere applicato ad altri tipi di cellule staminali. Tuttavia, ulteriori indagini è garantito per determinare la fattibilità della matrice-driven differenziazione. Il gel doppo strato impalcatura può agire come un serbatoio per fornire le cellule in modo continuo e controllato.
- Dopo la ricostruzione, i gel possono comunque essere separati in singoli componenti.
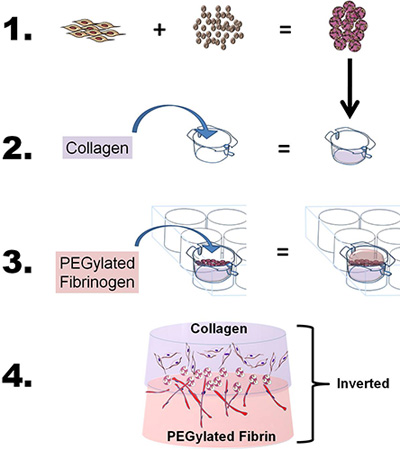
Figura 1. Schema raffigurante l'obiettivo globale e il processo della tecnica. 1) derivate da tessuto adiposo cellule staminali (CSA) sono loaded su chitosano microsfere. 2) collagene viene quindi versata in un 6-ben inserto, il pH regolato a fibrillare il collagene, e l'inserto collocato in una camera ben 6-piastra. Le ASC-caricati sfere CSM sono poi stratificate sopra il collagene. 3) Il fibrinogeno PEGylated viene quindi versata sopra il collagene (ASC-CSM) e gelificato con l'aggiunta di trombina. 4) Il costrutto bistrato finale può quindi essere rimosso dal inserto cultura e utilizzati in vitro o in vivo di analisi.
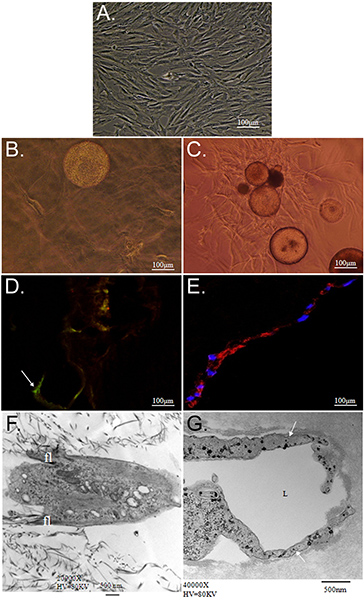
Caratterizzazione Figura 2. Di ASC coltura entro collagene e PEG-fibrina matrici 3D. A) a contrasto di fase microfotografia di isolato ASC diversi passaggi e mantenuto utilizzando di routine 2-dimensionali tecniche di coltura cellulare. Microfotografie B, D, F e raffigurano ASC-CSM coltivate all'interno di un 3-dimensionale gel di collagene e che C, E, G e spettacolo ASC-CSM coltivate all'interno di un 3-dimensionale PEG-gel di fibrina, sia al giorno 12. In B e C), ASC sono mostrati migrazione lontano dalla sfera CSM in entrambi i tipi di ponteggio. ASC sembrano avere un appiattita, come morfologia-mandrino in collagene (B), pur mantenendo la loro espressione del marcatore di cellule staminali Stro-1 (D; freccia). Quando coltivate in PEG-fibrina ASC presentano più strutture tubolari e sono indotti ad esprimere tali marcatori di cellule vascolari come fattore di von Willebrand (E). Microscopia elettronica a trasmissione illustra la morfologia tipica dimostrata da ASC all'interno di ogni ponteggio. ASC in gel di collagene sembrano avere minore filopodia (fl) che si estende dal corpo della cellula (F), mentre ASC tipicamente formato luminale (etichetta L) strutture (G; freccia).
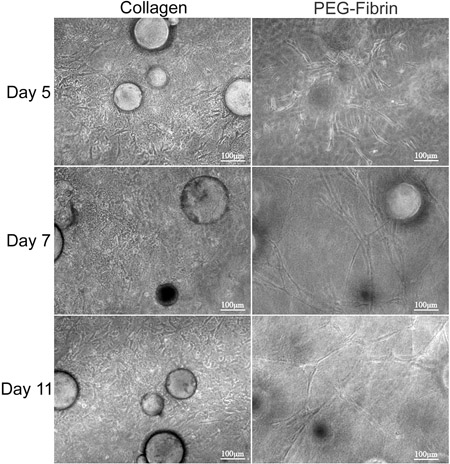
Figura 3. L'analisi morfologica di ASC-CSM tra i doppi strati di collagene e di PEG-gel di fibrina. ASC-CSM stati "sandwich" tra collagene e PEG-gel di fibrina e mantenute in coltura per 11 giorni. La sinistra column rappresenta ASCs migrazione e proliferazione all'interno della matrice di collagene e sembrano assumere un mandrino simile morfologia. La colonna di destra raffigura ASCs migrano lontano dai CSM e tubo formatore strutture simili in tutto il PEG-gel di fibrina.
Discussione
ASC sono ben noti per la loro facilità di isolamento e la capacità di differenziare verso vari tipi di cellule. Con le tecniche descritte in questa manoscritto, siamo in grado di sfruttare la plasticità del ASCs esponendo le cellule a biomatrices contemporaneamente. Come le cellule migrano lontano dalla loro base CSM e inserire il proprio ambiente circostante extracellulare, le cellule prendono spunto dal patibolo e può mantenere "staminalità" (collagene) o essere indotte a differenziarsi verso tipi di ce...
Divulgazioni
Nessun conflitto di interessi finanziari esistono.
Disclaimers
I pareri o le affermazioni contenute nel presente documento sono le opinioni personali degli autori e non devono essere interpretate come ufficiale o che riflette le opinioni del Dipartimento della Difesa o il Governo degli Stati Uniti. Gli autori sono dipendenti del governo degli Stati Uniti, e questo lavoro è stato preparato come parte delle loro funzioni ufficiali. Tutto il lavoro è stato sostenuto dalla US Army Medical Research e Materiel Command. Questo studio è stato condotto nell'ambito di un protocollo esaminato e approvato dalla US Army Medical Research e Materiel Command Institutional Review Board e in conformità con il protocollo approvato.
Riconoscimenti
SN è stato sostenuto da una borsa post-dottorato dal Initiative Tissue Engineering Pittsburgh. DOZ è supportata da una sovvenzione concessa dalla Fondazione di Ginevra.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / apparecchiatura | Azienda | Numero di catalogo | Comments |
| Hanks soluzione salina bilanciata (HBSS) | Gibco | 14175 | Consumabili |
| Siero fetale bovino | Hyclone | SH30071.03 | Consumabili |
| Collagenasi di tipo II | Sigma-Aldrich | C6685 | Consumabili |
| 70-micron Nylon Mesh Filter | BD Biosciences | 352350 | Consumabili |
| 100-um Nylon Mesh Filter | BD Biosciences | 352360 | Consumabili |
| MesenPRO crescita media del sistema | Invitrogen | 12746-012 | Consumabili |
| L-Glutammina | Gibco | 25030 | Consumabili |
| CaCl 2 .2 H 2 O | Sigma | C8106 | Consumabili |
| T75 Tissue Culture Flask | BD Biosciences | 137787 | Consumabili |
| Chitosan | Sigma-Aldrich | 448869 | Consumabili |
| Acido acetico | Sigma-Aldrich | 320099 | Consumabili |
| N-ottanolo | Acros Organics | 150630025 | Consumabili |
| Sorbitan-mono-oleato | Sigma-Aldrich | S6760 | Consumabili |
| Idrossido di potassio | Sigma-Aldrich | P1767 | Consumabili |
| Acetone | Fisher Scientific | L-4859 | Consumabili |
| Etanolo | Sigma-Aldrich | 270741 | Consumabili |
| Trinitro benzensolfonico Acid | Sigma-Aldrich | P2297 | Consumabili |
| Acido cloridrico | Sigma-Aldrich | 320331 | Consumabili |
| Etere etilico | Sigma-Aldrich | 472-484 | Consumabili |
| 8-micron di tessuto coltura in piastra Inserti | BD Biosciences | 353097 | Consumabili |
| Microcentrifuga da 1,5 ml Tubes | Pescatore | 05-408-129 | Consumabili |
| MTT reagente | Invitrogen | M6494 | Consumabili |
| Dimetilsolfossido | Sigma-Aldrich | D8779 | Consumabili |
| Qtracker cellulare Labeling Kit (QTracker 655) | Sonde molecolari | Q2502PMP | Consumabili |
| Collagene di tipo 1 | Travigen | 3447-020-01 | Consumabili |
| Di sodio idrossido | Sigma-Aldrich | S8045 | Consumabili |
| 12-Well piastre di coltura dei tessuti | BD Biosciences | 353043 | Consumabili |
| Fibrinogeno | Sigma | F3879 | Consumabili |
| Trombina | Sigma | T6884 | Consumabili |
| Derivata Benztriazole di polietilene | Sunbio | DE-034GS | Consumabili |
| Tris Buffer Tablet (pH 7,6) | Sigma | T5030 | Consumabili |
| Centrifuga | Eppendorf | 5417R | Equipment |
| Orbital Shaker | New Brunswick Scienctific | C24 | Attrezzatura |
| Incubatore umidificato con Air-5% CO 2 | Thermo Scientific | Modello 370 | Attrezzatura |
| Agitatore | IKA | Visc6000 | Attrezzatura |
| Agitatore magnetico | Corning | PC-210 | Attrezzatura |
| Vacuum Essiccatore | - | - | Attrezzatura |
| Particle Size Analyzer | Malvern | STP2000 Spraytec | Attrezzatura |
| Water Bath | Fisher Scientific | Isotemp210 | Attrezzatura |
| Spettrofotometro | Beckman | Beckman Coulter Spettrofotometro DU 800UV/Visible | Attrezzatura |
| Vortice | Diagger | 3030a | Attrezzatura |
| Microplate Reader | Molecular Devices | Spectramax M2 | Attrezzatura |
| Luce / microscopio a fluorescenza | Olimpo | IX71 | Attrezzatura |
| Microscopio confocale | Olimpo | FV-500 microscopio confocale a scansione laser | Attrezzatura |
| Microscopio Elettronico a Scansione | Carl Zeiss MicroImaging | Leo 435 VP | Attrezzatura |
| Microscopio elettronico a trasmissione | JEOL | JEOL 1230 | Attrezzatura |
Riferimenti
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon