需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
骨转移模型
摘要
经常用来研究癌症骨转移动物模型。在这个协议中,我们将介绍两种常见的方法接种肿瘤骨转移研究,并简要介绍了一些用来监测和量化这些模型的分析。
摘要
骨转移是一种常见的恶性肿瘤,包括乳腺癌,前列腺癌和肺癌的发生。一旦成立于骨,肿瘤有显着的发病率和死亡率1。因此,是一种显着的需要理解在骨的肿瘤的建立,生长和活性的分子机制控制。 体内模型中,已经建立了几个研究这些事件,每个人都有特定的优点和局限性。最常用的模型利用心内接种肿瘤细胞直接进入动脉血液供应的无胸腺(裸)BalbC小鼠。此过程可以应用到许多不同类型的肿瘤(包括PC-3前列腺癌,肺癌,和小鼠乳腺脂肪垫肿瘤),然而,在这最后,我们将重点对乳腺癌模型,MDA-MB-231。在这个模型中,我们利用骨高度选择性的克隆,最初来自曼迪博士的研究小组在圣安东尼奥2,即H转GFP的表达和克隆我们的第3组。克隆是骨转移的变体,具有高的osteotropism率和很少转移到肺,肝,肾上腺。虽然心内注射是最常见的用于研究的骨转移,在某些情况下intratibial 4或乳腺脂肪垫注射是比较合适的。腔内注射时使用的人类肿瘤细胞的目标监测的后期阶段的转移,特别是逮捕骨,生存,增殖,并建立发展成癌性骨骼疾病的肿瘤,癌细胞的能力。 intratibial注射如果侧重于肿瘤后,已转移到骨,这大致既定转移性骨病相关的癌症细胞和骨的关系进行。这些模型概括都不在转移过程中的早期步骤之前栓塞和入境进入血液循环的肿瘤细胞。如果要监控从原发部位的骨原发肿瘤的生长或转移,乳腺脂肪垫接种通常是首选;然而,极少数肿瘤细胞株将一如既往地转移到骨骼,从主站点,与4T1的骨优惠克隆的,一个小鼠乳腺癌,除5,6。
这手稿细节接种程序,并强调在接种后分析的关键步骤。具体来说,它包括细胞培养,心内和intratibial接种的肿瘤细胞接种程序,以及通过X-射线,荧光和组织形态计量学分析的简要信息,关于每周监测。
研究方案
1。池的维护
- 许多骨转移亚克隆MDA-MB-231的存在有变骨的定植和生长的倾向。对于我们的实验中,我们使用来自GFP标记的MDA-MB-231 UTHSCA 2开发克隆。这种特殊的子克隆在大约3周接种后,将形成明显的溶骨性病变,在第4周与牺牲。
- 维持细胞在DMEM中含有10%FBS和0.1毫克/毫升青霉素-链霉素,在37℃下,在5-8%CO 2 7。
- 传代细胞在80-90%汇合,并重新在1:10稀释板(这取决于细胞的类型和尺寸的印版。对于MDA-MB-231细胞中的T-75,这是约6×10 5),这是大约每72小时。
- MDA-MB-231细胞保持一般成纤维细胞的外观与众多伪。任何舍入指示过度拥挤或其它不希望的应力,并应避免,因为这可能影响体内转移潜力 。
- 理想的情况下,电池应维持在文化,只是简单地在接种前(小于1周的实验,直到你有足够多的细胞),和一个新的小瓶应解冻,如果四舍五入或细胞的生长率的变化发生。
2。细胞制备
- Trypsinize 80-90%汇合的细胞用0.15%胰蛋白酶/ EDTA(稀释0.5%Gibco公司,在PBS中的胰蛋白酶EDTA 1:2)。该浓度允许快速脱离(<2分钟),并降低的细胞聚集。
- 立即除去细胞从板与10毫升冰冷的DMEM含10%FBS,吸移管到15毫升锥形管,在200×g离心5分钟离心。
- 重悬沉淀在50ml的锥形管中在25毫升冰冷的PBS(无钙和镁)和计数。
- 离心重新沉淀,并在每毫升(腔内)的10 6个细胞,或在250000 cells/10微升(骨肿瘤引起的)在冰冷的PBS重悬。温度TURE PBS中重要的是在注射后的细胞和随后的栓塞,以防止结块。将细胞悬浮液应保持在冰上,同时执行注射液和将是可行的,并保持30分钟,未结块。虽然确切的数量会有所不同,从研究者到所需的板研究者,我们一般使用8-10小鼠的T-75。
3。腔内接种
- 4-6周龄雌性(Foxn核/ - :哈伦)小鼠用于这些实验中,虽然其他的免疫妥协小鼠(RAG1 - / - ,RAG2 - / - ,SCID的XID,等)也可以是与人类肿瘤细胞的实验中使用。
- 裸鼠,应喂给Teklad 2920x饮食5-10天注射前降低死亡率从注射过程中,减少背景荧光成像程序(自食苜蓿免费)。
- 如果使用小鼠以外的其他女/女,消除头发剃或使用奈尔(根据我们的经验奈尔效果更好)上腹部AREA开始前的程序。
- 麻醉小鼠用异氟醚蒸发器(2.5%异:2-3升/分钟O 2)或其它优选的麻醉(根据我们的经验,异氟醚是最好的用于心内接种的耐受性)的隔室。
- 一个鼠标移动在一个不锈钢通风罩的麻醉机鼻锥的时间。
- 每个鼠标放置在其背部,胸部朝上。
- 洗胸部有10%的聚维酮/碘棉签/用70%的乙醇溶液中,然后,重复2次。
- 马克鼠标的胸部注射液(用消毒过的标记或标记稍微向一侧,以保持注射部位的无菌)。我们使用标记位置的胸骨切迹和剑突过程顶部的中间,稍微左胸骨(解剖)。绘制一个小的气泡的空气进入注射器创建300微升28克½胰岛素注射器柱塞和弯液面之间的空间(重要的看到心脏的脉冲),和吸取100μl的细胞。
- 保持直立的针。按住鼠标用另一只手拉紧皮肤,插入针。
- 成功插入左心室,导致一个明显的亮红色的脉搏,血液的注射器。在这个深度,小心地压下活塞的注射器(100微升量),没有显着运动的针,以避免穿刺入胸腔内的心脏或溢出细胞。
- 细胞被注射后,小幅拉涨柱塞创建少量的负压力,以减少入胸腔酣畅淋漓的细胞。
- 直接拉针的胸部,而在拆卸过程中,它可以衬里的心撕裂,引起出血,一定要避免倾斜针。
- 轻轻推压胸部注射部位,以减少出血。
- 删除鼠标从鼻锥体,并继续施加压力约1分钟的光。
- 移动鼠标到加热垫,直到完全CONscious。
- 如果鼠标开始转动或抽动恢复后,可能的原因是栓塞。小鼠腹膜内注射80〜120毫克/公斤的氯胺酮,同时降低血管阻力,增加血流量和心输出量。这应该可以帮助的鼠标通过血块。发生此问题后,它是最好的改变的细胞制剂,因为它表明,细胞聚集。我们改变细胞制剂后约8只小鼠,或30分钟。
4。骨肿瘤引起的
- 注入鼠标Buprenex(0.1毫克/千克)或类似的经批准的镇痛药之前立即程序。
- 使用异氟醚麻醉鼠标,然后移动到鼻锥和维持麻醉。
- 用10%聚乙烯吡咯烷酮/碘清洁双腿拭子/溶液中,然后用乙醇,重复2次。脱毛腿(奈尔或类似产品)在清洁之前,如果皮毛存在。
- 轻轻抓住外踝,内踝,胫骨和下半部用食指和日UMB,然后弯曲腿(屈曲和横向转动的组合,使得膝盖是可视且可访问的。
- 用70%的乙醇湿润皮肤,提高知名度的基础髌韧带,这应该是作为一个独特的,厚厚的,白线可见。在牢牢把握,并进入前髁间面积在胫骨上方的腿的踝/鼠标插入28克½针髌骨下,通过中间的髌韧带。
- 当插入到胫骨针,引导生长板,通过仔细稳定的,坚定的压力,轻微的钻探行动。
- 穿透胫骨生长板后,中针会遇到明显阻力较小。
- 使用温和的,横向移动的针,以确保针在胫骨生长板通过。运动将是有限的,如果针在胫骨内适当的位置。
- 慢慢地压低柱塞注射10微升的细胞液。应该觉得在这一点上几乎没有阻力。
- 斯洛伐克WLY提取针。
- 按照同样的步骤,进行到下一个腿注入10μl的PBS。
- 从麻醉中拔下鼠标,并继续加热垫,直到恢复。
- 在接下来的24小时监控的老鼠注入额外Buprenex每12小时,如果的动物继续呈现紧张迹象的。
5。成像时间课程
- 萤光素酶的成像:在适用的情况下,荧光素酶的成像后的肿瘤细胞接种(虽然大多数骨转移模型中,检测到接近14天)在第7天开始,应利用。的小鼠的腹腔内注射150 mg / kg的荧光素,麻醉,和成像8分钟后,注射使用IVIS设备8。
- GFP成像:通常情况下表达GFP的肿瘤开始被探测到10-14天左右intratibial注射和16-21腔内实验使用Maestro成像设备(CRI)9。简单地说,老鼠是用异氟烷麻醉(3%),并保持在麻醉下在Maestro卡成像室通过鼻锥体。对于我们的绿色荧光蛋白表达细胞,我们用蓝色的过滤器集(498 excitation/515发射绿色荧光蛋白),在500毫秒暴露在10纳米。
- faxitron(透视):X-射线被开始每周7至14天之间。病变在21天的腔内模型将显示在一个星期前在的intratibial注射3。我们的体外和体内的放射线照相数据获取使用Faxitron LX-60在35千伏为8秒的曝光。
- 其他影像学检查:影像学技术将完全根据具体的研究。除了 上述方法外,3D微型计算机断层扫描(μCT),微正电子发射断层扫描(μPET),和其他方式10,11活的动物成像的基础上提供有价值的信息。
6。鼠标牺牲
- 每个模型都有一个稍微不同的时间过程。 MDA-MB-231个细胞的小鼠的恶病质,或截瘫之间21和35天,一般28天左右(IT小鼠注射21〜28天之间)。
- 一旦几个小鼠的病变,开始突破骨皮质,成为截瘫患者,或失去的体重在10-20%之间,牺牲所有的小鼠在研究中使用氯胺酮/甲苯噻嗪过量颈椎脱位(或其他IACUC批准的方法)。
- 取出骨头需要进一步研究,并存储在缓存4%福尔马林。
- 胸部肿瘤的小鼠是错过了注射的标志,并应被排除在研究之外。
7。 体外分析
- μCT:在70%乙醇中的扫描允许的结构和组织学的参数相同的骨试样上测量。
- 轮廓和分析根据个别实验设计和可用的设备10。我们的数据获得,与一个SCANCO的μCT40使用12μM分辨率的。
- Histomorphometry:使用首选的组织方法和工艺标本染色,苏木素/伊红7
8。代表性的成果
心腔内或intratibial接种的肿瘤细胞( 图1)之后的小鼠每周监测由放射摄影术和荧光(或发光)。病变通常变得显而易见周2和3之间通过X-射线,而它们可以是可见的荧光和发光早在第2周,这取决于模型( 图2)上。病变是可见的作为暗在骨孔,并随时间( 图3)中变得更加明显。病变进行定量的MetaMorph分析X光片和荧光定量使用Maestro(CRI)的图像采集和分析软件。病变开始生长,小鼠经常成为恶病质的。牺牲时,老鼠已经失去了其初始体重在10-20%之间。的条件的小鼠可以迅速改变,并且必须在白天多次监视。 3-4周的小鼠开始拖动一个或两个后肢和牺牲整个研究。图片之前采取牺牲。过量麻醉后,取血,骨代谢标志物或其他因素来衡量。鼠标和骨头切除后颈椎脱位,皮肤被剥夺体外成像( 图3),这将使肿瘤灶的可视化至少7天前体内成像技术和清洁。一次成像完成的骨头被放置在有标签的磁带和存储在福尔马林固定和进一步的组织处理或μCT分析。组织形态计量学的样品上进行,以指示后的肿瘤负担和BV / TVμCT进行量化骨破坏的量( 图4)上的胫骨。
机构/ 4260/4260fig1.jpg"/>
图1。注射妥善安置。腹侧X光片的图(A)中示出在第 4肋间进入左心室心内接种针妥善安置的成年小鼠胸廓。解剖标志的胸骨上(见白色)与水平虚线所示。在老鼠的皮肤胸骨切迹和剑突过程作为地标,并且针插入稍左胸骨。腹侧radiographical图(B)的成年小鼠示出针的正确放置的腿之间的髁在胫骨近端,对齐。从横向的角度来看,胫骨粗隆和深骺板针的尖端放在背后。理想的位置注射的白色圆圈所示。

图2。约的时间过程中,骨转移模型。进展NCER引起的骨质疾病与X射线和GFP +的肿瘤荧光图像体内注射骨肿瘤引起的(A)和心内注射(B)。
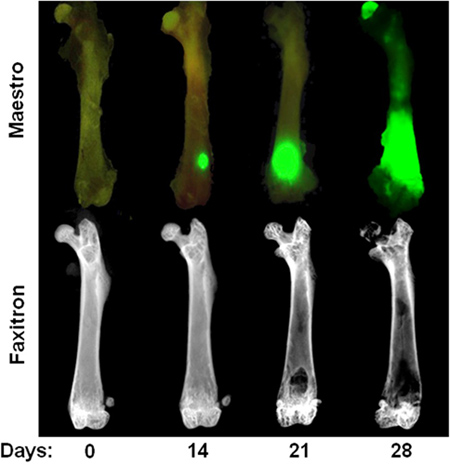
图3。心内MDA-MB-231型顶行: 体外 GFP荧光图像显示在0天,14日,21日和28日腔内注射后,MDA-MB-231的时间过程 。需要注意的是在第14天的肿瘤病灶是唯一可见的软组织切除后, 在体外 。下排: 体外放射图像相同的股骨,说明溶骨性病变。请注意,骨质破坏通常是不可见的,直到3周后,心脏注射。
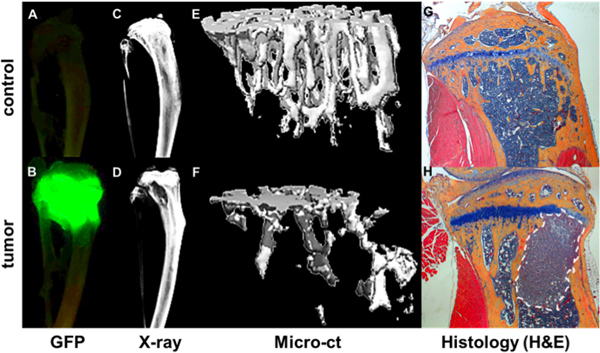
图4。量化骨转移的进展。GFP +肿瘤可视化大师成像体外蒂维AE的非荷瘤小鼠(A)和MDA-MB-231的亚克隆(B)的GFP表达的心腔内注射4周后的小鼠。肿瘤病灶与者Faxitron(D)所示的骨破坏的地区比较(C)无肿瘤的骨。微型电脑测量骨结构和矿物数据呈现为一个健康的骨骼(E)(F)骨质破坏的区域显示为空洞面积和荷瘤骨的三维图像。进一步的骨和肿瘤的细节被认为是在相应的H&E染色的组织切片(G及H)。
讨论
骨肿瘤引起的疾病的研究依赖于几种动物模型,其中最常用的两种心内和intratibial的接种。在许多情况下,研究转移到骨,心内是最好的选择,但是,它并不能代表整个转移过程,为了实现这一目标,因此,乳腺脂肪垫或其他原位注射,最好应使用。肿瘤细胞不容易在大多数研究中使用人类细胞从原发部位转移,如果是的话,他们主要转移到肺部。一些菌株的4T1细胞转移到骨5,6,但病变体...
披露声明
没有利益冲突的声明。
致谢
作者承认以下资金来源:P01CA040035(FE / JAS)和VA职业发展奖(JAS)。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | |
| MDA-MB-231人乳腺癌细胞 | 本来ATCC内部的克隆和选择 | ||
| DMEM | GIBCO | 11885 | |
| PBS | 敏达公司 | 21-040-CV | |
| FBS | 阿特拉斯生物 | F-0050a | |
| 胰蛋白酶 | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| 大师 | 国际广播电台 | ||
| μCT扫描仪 | SCANCO | ||
| 裸鼠 | 哈伦 | 狐女 - / - | |
| 胰岛素注射器(300微升,28.5克) | Becton Dickinson公司 | 309300 | |
| IVIS | 卡尺 | ||
| 辐照啮齿动物的饮食 | Teklad | 2920x |
参考文献
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. . Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。