Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los modelos de metástasis en los huesos
En este artículo
Resumen
Los modelos animales se utilizan con frecuencia para estudiar la metástasis del cáncer de hueso. En este protocolo vamos a describir dos métodos comunes de la inoculación del tumor para los estudios de metástasis óseas y describir brevemente algunos de los análisis utilizados para supervisar y cuantificar estos modelos.
Resumen
Las metástasis óseas son una ocurrencia común en neoplasias varios como el de mama, próstata y pulmón. Una vez establecido en el hueso, los tumores son responsables de una significativa morbilidad y mortalidad 1. Por lo tanto, hay una necesidad significativa para comprender los mecanismos moleculares que controlan el establecimiento, el crecimiento y la actividad de los tumores en el hueso. Varios modelos in vivo se han establecido para estudiar estos eventos y cada uno tiene ventajas y limitaciones específicas. El modelo más comúnmente usado utiliza intracardíaca inoculación de las células tumorales directamente en el suministro de sangre arterial de atímicos (nude) ratones BalbC. Este procedimiento se puede aplicar a muchos tipos de tumores diferentes (incluyendo PC-3 de cáncer de próstata, carcinoma de pulmón, y tumores mamarios de ratón almohadilla de grasa), sin embargo, en este manuscrito nos centraremos en el modelo de cáncer de mama, MDA-MB-231. En este modelo se utiliza un clon altamente ósea selectiva, derivada originalmente en el grupo del Dr. Mundy en San Antonio 2, que hcomo ya sido transfectadas para la expresión de GFP y re-clonado por nuestro grupo 3. Este clon es una variante metastásica ósea con una alta tasa de metástasis y osteotropism muy poco a pulmón, hígado, o de las glándulas suprarrenales. Mientras que las inyecciones intracardiacas son los más utilizados para estudios de metástasis ósea 2, en ciertos casos, las inyecciones de grasa intratibial 4 o almohadilla mamaria son más apropiados. Inyecciones intracardíacas se realizan típicamente utilizando las células tumorales humanas con el objetivo de controlar las etapas posteriores de la metástasis, específicamente la capacidad de las células cancerosas a la detención en hueso, sobrevivir, proliferar, y establecer tumores que se desarrollan en la enfermedad ósea inducida por el cáncer. Intratibial inyecciones se realizan si se centra en la relación de las células cancerosas y el hueso después de un tumor ha hecho metástasis a hueso, que se correlaciona aproximadamente con la enfermedad establecida ósea metastásica. Ninguno de estos modelos recapitula los primeros pasos en el proceso metastásico antes de la embolia y la entradade las células tumorales en la circulación. Si la vigilancia del crecimiento del tumor primario o la metástasis desde el sitio primario para hueso, entonces mamarias inoculaciones capa de grasa son generalmente preferido, sin embargo, muy pocas líneas tumorales de células consistentemente metástasis en hueso desde el sitio primario, con 4T1 hueso preferenciales clones, una mamario de ratón carcinoma, siendo la excepción 5,6.
Este manuscrito detalles procedimientos de inoculación y las medidas que los fundamentales en los análisis post inoculación. Específicamente, incluye el cultivo celular, los procedimientos de inoculación de células tumorales para inoculaciones intracardiacos y intratibial, así como una breve información acerca de la vigilancia semanal por rayos X, fluorescencia y análisis histomorfométricos.
Protocolo
1. Mantenimiento Celular
- Muchos subclones óseas metastásicas de MDA-MB-231 existen que tienen propensión variable para la colonización y el crecimiento óseo. Para nuestros experimentos usamos un clon derivado de la GFP-etiquetados MDA-MB-231 desarrollado en UTHSCA 2. Este sub-clon formarán visibles lesiones óseas osteolíticas en aproximadamente 3 semanas después de la inoculación, con sacrificio a las 4 semanas.
- Mantener las células en DMEM que contenía FBS al 10% y 0,1 mg / ml de penicilina estreptomicina a 37 ° C en 5-8% CO 2 7.
- Células pasaje en 80-90% de confluencia y re-placa en una dilución 1:10 (esto varía dependiendo del tipo celular y la placa de tamaño. Para MDA-MB-231 células en un T-75 es aproximadamente 6x10 5), los cuales es de aproximadamente cada 72 horas.
- MDA-MB-231 células mantienen una apariencia generalmente fibroblástica con pseudópodos numerosos. Cualquier redondeo es indicativo de estrés indeseable hacinamiento o de otro tipo, y se debe evitar ya que estepuede afectar el potencial metastásico in vivo.
- Idealmente, las células deben mantenerse en cultivo sólo brevemente antes de la inoculación (se recomienda menos de 1 semana o hasta que haya suficientes células para el experimento), y un nuevo vial debe ser descongelado si redondeo o los cambios en la tasa de crecimiento celular se producen.
2. Preparación de células
- Tripsinizar las células en 80-90% de confluencia con 0,15% de tripsina / EDTA (Gibco diluir 0,5% de tripsina EDTA 1:2 en PBS). Esta concentración permite desprendimiento rápido (<2 min) y reduce la aglutinación de las células.
- Inmediatamente eliminar las células de la placa con 10 ml de helado de DMEM que contenía FBS al 10%, de la pipeta en tubo de 15 ml cónico y se centrifuga a 200 xg durante 5 min.
- Resuspender el sedimento en un tubo cónico de 50 ml en 25 ml de PBS enfriado en hielo (sin Ca y Mg) y contar.
- Centrifugar para volver a pellet y se resuspenden en 10 6 células por ml (intracardíaca) o en 250.000 células/10 l (intratibial) en PBS enfriado en hielo. La temperatura de PBS es importante para evitar la aglutinación de las células y la embolia posterior después de la inyección. La suspensión de células debe permanecer en hielo mientras se realiza inyecciones y será viable y siguen sin ser agrupadas para 30 min. Aunque el número exacto de placas requerida variará de un investigador a investigador, generalmente usamos 1 T-75 para entre 8-10 ratones.
3. Inoculación intracardíaco
- 4-6 semanas de edad hembra (Foxn nu-/ -: Harlan) ratones se utilizan para estos experimentos, aunque otros ratones inmunocomprometidos (RAG1-/ -, RAG2-/ -, SCID, XID, y etc) puede ser también utilizado con humanos experimentos celulares de cáncer.
- Los ratones desnudos deberían ser alimentados con la dieta Teklad día 2920x 5-10 antes de la inyección para disminuir la mortalidad por el procedimiento de inyección, y reducir la fluorescencia de fondo en los procedimientos de imagen (ya que la comida es gratis alfalfa).
- Si se utilizan otros ratones de nu / nu, eliminar el vello por el afeitado o el uso de Nair (en nuestra experiencia Nair funciona mejor) en ventral abdominal area antes de comenzar el procedimiento.
- Anestesie ratón en una cámara de aislamiento usando un vaporizador de isoflurano (2,5% Iso: 2-3 L / min de O 2) o anestesia otro preferido (en nuestra experiencia isoflurano es el mejor tolerado por inoculaciones intracardíacas).
- Mover un ratón a la vez para el cono de la nariz de la máquina de anestesia dentro de una campana de acero inoxidable ventilado.
- Coloque cada ratón en su parte posterior con el pecho hacia arriba.
- Lavar el tórax con un 10% de povidona / yodo torunda / solución seguido de 70% de etanol, repetir 2 veces.
- Pecho marca ratón para inyección (usando un marcador estéril o marcado ligeramente a un lado para mantener el sitio de inyección estéril). Utilizamos una ubicación a medio camino entre la marca y la horquilla esternal superior del proceso xifoides, y se marchó ligeramente (anatómica) del esternón. Dibujar una pequeña burbuja de aire en la jeringa para crear un espacio entre el émbolo y el menisco (importante para ver pulso cardíaco) de un 300 l 28 g ½ jeringa de insulina, yelaborar 100 l de células.
- Mantenga la aguja en posición vertical. Mientras mantiene tensa la piel de ratón con la otra mano, inserte la aguja.
- La inserción exitosa en el ventrículo cardiaco izquierdo debería resultar en un pulso distinto color rojo brillante de la sangre en la jeringa. A esta profundidad, cuidadosamente presione el émbolo de la jeringa (100 l de volumen), sin movimiento significativo de la aguja para evitar la perforación del corazón o de las células que se derraman en la cavidad torácica.
- Después las células se inyectan, tire hacia arriba ligeramente el émbolo para crear una pequeña cantidad de presión negativa para reducir el goteo de las células en la cavidad torácica.
- Tire aguja directamente de pecho mientras asegurándose de evitar la inclinación de la aguja durante la extracción, lo que puede desgarrar el revestimiento del corazón y causar sangrado.
- Aplique una leve presión en el pecho sobre el sitio de inyección para reducir el sangrado.
- Retire del ratón en el cono de la nariz y se seguirá aplicando una ligera presión durante 1 min.
- Mueve el ratón para almohadilla caliente hasta que esté completamente conconsciente.
- Si el ratón comienza a girar o retorcerse después de la recuperación, la causa probable es una embolia. Inyectar ratón intraperitonealmente con 80-120 mg / kg de ketamina para aumentar el flujo sanguíneo y el gasto cardíaco, mientras que la disminución de la resistencia vascular. Esto debería ayudar a pasar el ratón por el coágulo. Después de producirse esto, lo mejor es cambiar preparaciones de células, ya que indica que las células se peguen. Cambiamos preparaciones de células después de aproximadamente 8 ratones, o 30 min.
4. Intratibial
- Inyectar ratón con Buprenex (0,1 mg / kg) o analgésica similar aprobado inmediatamente antes del procedimiento.
- Anestesie ratón utilizando isoflurano, a continuación, pasar a morro y mantener la anestesia.
- Limpiar las dos piernas con 10% de povidona / yodo torunda / solución, seguido por etanol, repetir 2 veces. Depilarse las piernas (con Nair o producto similar) antes de la limpieza si está presente pieles.
- Pellizque suavemente maléolo lateral, maléolo medial, y la mitad inferior de la tibia con el dedo índice y thumb, entonces la pierna curva (combinación de flexión y rotación lateral, de tal manera que la rodilla es visible y accesible.
- Mojar la piel con 70% de EtOH para aumentar la visibilidad de ligamento rotuliano subyacente, que debería ser visible como una distinta, línea gruesa, blanco. Mientras sujetando firmemente el tobillo / pata de inserción del ratón 28 g ½ aguja debajo de la rótula, a través de la mitad del ligamento rotuliano, y en la zona intercondilar anterior en la parte superior de la tibia.
- Cuando se inserta la aguja en la tibia, guíe con cuidado a través de la placa de crecimiento con una presión constante y firme de la acción de taladrado ligero.
- Después de la penetración de la placa de crecimiento de la tibia, la aguja se encuentra resistencia marcadamente inferior.
- Use un movimiento suave, lateral de la aguja para asegurar la aguja está en la tibia y a través de la placa de crecimiento. El movimiento será limitado si la aguja está en el lugar que le corresponde dentro de la tibia.
- Presione lentamente el émbolo para inyectar 10 l de solución de células. Poca o ninguna resistencia se debe sentir en este momento.
- SloWLY extraer la aguja.
- Siguiendo el mismo procedimiento, proceder a la siguiente etapa de inyectar 10 l de PBS.
- Retire ratón de la anestesia y seguir almohadilla eléctrica hasta que se recupere.
- Monitorear los ratones en los próximos 24 horas y se inyecta con Buprenex adicional cada 12 horas si los animales continúan mostrando signos de sufrimiento.
5. Proyección de imagen Lapso de tiempo
- Radiología luciferasa: Donde formación de imágenes aplicable, luciferasa se deben utilizar a partir de 7 días después de la inoculación de las células tumorales (aunque en la mayoría de los modelos de metástasis ósea, detectable más cerca de día 14). Ratón se inyecta por vía intraperitoneal con 150 mg / kg luciferina, anestesiado, y la imagen 8 min después de la inyección utilizando IVIS equipo 8.
- GFP imagen: Típicamente GFP-expresando tumores empiezan a ser detectables alrededor de 10-14 días para las inyecciones intratibial y 16-21 para los experimentos intracardíacos utilizando equipos de imágenes Maestro (CRI) 9. Brevemente, los ratones se anestesian con isoflurano (3%) Y se mantuvieron bajo anestesia a través de un cono de nariz en la cámara de formación de imágenes Maestro. Para nuestros expresan eGFP de células se utiliza el conjunto de filtros azul (498 excitation/515 emisión para eGFP) a 500 ms exposición en pasos de 10 nm.
- Faxitron (rayos X): Las radiografías se toman semanalmente comenzando entre el día 7 y 14 años. Las lesiones será visible en el modelo intracardíaca en 21 días y una semana antes en la intratibial 3 inyecciones. Nuestros datos radiográficos para ex vivo e in vivo se adquirió usando un Faxitron LX-60 a 35 kV durante 8 segundos de exposición.
- Otras imágenes: modalidades de imagen se basa totalmente en la investigación específica. Además de los métodos anteriores, las imágenes de animales vivos en 3D basado en micro-tomografía computarizada (μCT), micro-tomografía por emisión de positrones (μPET), y otras modalidades de 10,11 puede proporcionar información valiosa.
6. Ratón Sacrificio
- Cada modelo tiene una duración ligeramente diferente. Con MDA-MB-231 ratones células generalmente se vuelven caquéctico o parapléjico entre 21 y 35 días y por lo general en torno al día 28 (IT ratones inyectados entre 21-28 días).
- Una vez que varios ratones desarrollan lesiones que empiezan a romper el hueso cortical, convertido en parapléjico, o pierden entre el 10-20% del peso corporal, sacrifica todos los ratones en estudio con ketamina / xilazina sobredosis con dislocación cervical (u otro método aprobado IACUC).
- Quite los huesos necesarios para su estudio y almacén en buffer formalina al 4%.
- Los ratones con tumores de pecho son un signo de una inyección perdido y deben ser excluidos del estudio.
7. Ex Vivo Analysis
- μCT: exploración en 70% EtOH permite parámetros estructurales e histológica a medir en la muestra de hueso mismo.
- Contorno y analizar de acuerdo al diseño experimental individuo y el equipo disponible 10. Nuestros datos se obtuvieron con un μCT Scanco 40 usando 12 mM resolución.
- Histomorphometry: Las muestras preferidas proceso utilizando métodos histológicos y se tiñen con hematoxilina / eosina 7
8. Los resultados representativos
Después de la inoculación intracardiaco o intratibial de las células tumorales (Figura 1) los ratones se controlaron semanalmente por radiografía y la fluorescencia (o luminiscencia). Las lesiones normalmente harán evidentes por rayos X entre semana 2 y 3, mientras que puede ser visible por fluorescencia y luminiscencia tan temprano como 2 semanas, dependiendo del modelo (Figura 2). Las lesiones son visibles como agujeros oscuros en el hueso, y ser más pronunciado con el tiempo (Figura 3). Las lesiones se cuantificarán mediante análisis Metamorph de las radiografías y de fluorescencia se cuantificó mediante Maestro (CRI) de imágenes software de adquisición y análisis. Como las lesiones comienzan a crecer, los ratones con frecuencia se convierten caquéctico. El sacrificio es necesario cuando los ratones perdieron entre un 10-20% de su peso corporal inicial. La condición de la ratones pueden cambiar rápidamente y se debe supervisar varias veces durante el día. Entre 3-4 semanas los ratones comenzaron a arrastrar uno o ambos miembros posteriores y todo el estudio fue sacrificado. Las imágenes fueron tomadas antes de su sacrificio. Después de sobredosis de anestesia, se recogió sangre para medir los marcadores de recambio óseo o de otros factores. Después de la dislocación cervical, la piel se separó del ratón y huesos extirpados y limpiado para ex vivo de imágenes (Figura 3), que permitirá la visualización de focos tumorales al menos 7 días antes que en las técnicas de imagen in vivo. Una vez que los huesos se terminó de imágenes se colocaron en casetes etiquetados y almacenados en formalina para la fijación y el procesamiento histológico o análisis μCT. Histomorfometría se realizó sobre las muestras para indicar la carga tumoral y BV / TV después de μCT se realizó en una tibia para cuantificar la cantidad de destrucción ósea (Figura 4).
/ 4260/4260fig1.jpg "/>
Figura 1. La colocación correcta de la inyección. Vista ventral radiográfica (A) de tórax ratón adulto que muestra la colocación correcta de la aguja en el espacio intercostal y 4 en el ventrículo izquierdo para la inoculación intracardíaca. Puntos de referencia anatómicos se muestran con líneas punteadas horizontales sobre el esternón (perfiladas en blanco). En la piel del ratón de la muesca esternal y apéndice xifoides servir como puntos de referencia, y se inserta la aguja ligeramente a la izquierda del esternón. Vista radiográfica ventral (B) de la pierna de ratón adulto que muestra la colocación correcta de la aguja en la tibia proximal, alineado entre los cóndilos. Desde una perspectiva lateral de la punta de la aguja se coloca detrás de la tuberosidad tibial y la profundidad de la placa epifisaria. La ubicación es ideal para la inyección se muestra por el círculo blanco.

Figura 2. Evolución temporal de los modelos de metástasis óseas. Progresión de cancer inducida por enfermedad de los huesos se muestra con rayos X y GFP + imágenes fluorescentes de los tumores in vivo de intratibial inyecciones (A) y intracardiaco inyecciones (B).
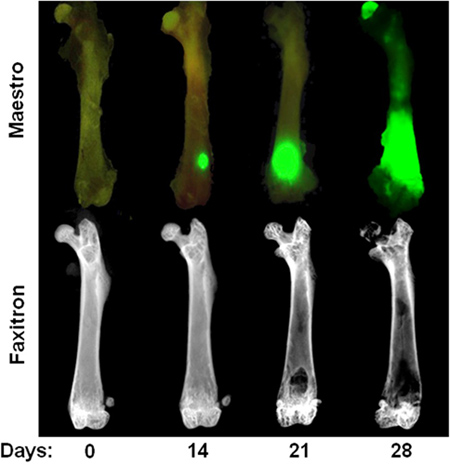
Figura 3. Curso temporal de intracardiaco MDA-MB-231 modelo Fila superior:. Imagen ex vivo que muestra la fluorescencia de GFP en el día 0, 14, 21, y 28 después de la inyección intracardíaca de MDA-MB-231. Tenga en cuenta que los focos tumorales en el día 14 sólo son visibles en ex vivo después de la eliminación de tejido blando. Fila inferior: imágenes radiográficas ex vivo de los fémures mismos que ilustran las lesiones óseas osteolíticas. Tenga en cuenta que la destrucción ósea no suele ser visible hasta 3 semanas después de la inyección cardíaca.
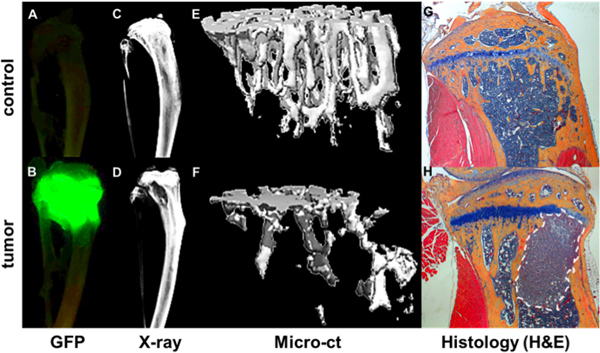
Figura 4. La cuantificación de la progresión metastásica ósea. GFP + tumor como se visualiza por el Maestro de imágenes ex vivo de tibiae de un ratón que no portaban tumores (A) y un ratón de 4 semanas después de la inyección intracardíaca de un expresan GFP MDA-MB-231 subclón (B). Focos tumorales se correlacionan con áreas de destrucción ósea, como se muestra por Faxitron (D) en comparación con un hueso sin tumor (C). Datos hueso estructural y mineral de mediciones microCT se representan como imágenes en 3D de un hueso sano (E) y un hueso con el tumor (F) donde las áreas de destrucción ósea se muestran como área de vacío. Mayor detalle hueso y se observa un tumor en H & E correspondientes cortes histológicos teñidos (G & H).
Discusión
Los estudios de la enfermedad ósea inducida por tumor se basan en diversos modelos animales de los cuales los dos más comúnmente utilizados son inoculaciones intracardíacas y intratibial. En muchos casos intracardíaca es la mejor opción para el estudio de la metástasis ósea, sin embargo, no representa el proceso metastásico completo, y la almohadilla de grasa mamaria por lo tanto, u otras inyecciones ortotópicos idealmente debe ser utilizado para ese fin. Las células tumorales no metastatizan fácilmente desd...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores agradecen las siguientes fuentes de financiamiento: P01CA040035 (FE / JAS) y el Premio VA Desarrollo Profesional (JAS).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| MDA-MB-231 células humanas de cáncer de mama | Originalmente ATCC-Internamente clonado y selecciona | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040 CV- | |
| FBS | Atlas Biológica | F-0050a | |
| Tripsina | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Maestro | CRi | ||
| μCT escáner | Scanco | ||
| Ratones atímicos | Harlan | Fox nu - / - | |
| Jeringas de Insulina (300 l, 28,5 g) | Becton Dickinson | 309300 | |
| IVIS | Caliper | ||
| Dieta de roedores irradiado | Teklad | 2920x |
Referencias
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. . Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados