É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelos de metástase óssea
Neste Artigo
Resumo
Os modelos animais são freqüentemente utilizada para estudar metástase de câncer de osso. Neste protocolo, iremos descrever dois métodos comuns de inoculação do tumor para estudos de metástase óssea e descrever brevemente algumas das análises utilizadas para monitorar e quantificar esses modelos.
Resumo
As metástases ósseas são uma ocorrência comum em determinadas neoplasias, incluindo da mama, da próstata e do pulmão. Uma vez estabelecido no osso, os tumores são responsáveis por significativa morbidade e mortalidade 1. Assim, existe uma necessidade significativa para compreender os mecanismos moleculares que controlam o estabelecimento, crescimento e actividade de tumores no osso. Vários modelos in vivo foram criados para estudar esses eventos e cada um tem vantagens e limitações específicas. O modelo mais comumente utilizado utiliza inoculação intracardíaca de células tumorais diretamente para o fornecimento de sangue arterial do atímicos (nude) ratos BalbC. Este procedimento pode ser aplicado a muitos tipos diferentes de tumores (incluindo o cancro da próstata PC-3, carcinoma de pulmão, e tumores mamários de rato almofada de gordura), no entanto, neste manuscrito iremos focar sobre o modelo de cancro da mama, MDA-MB-231. Neste modelo utilizamos um clone altamente osso seletivo, derivado originalmente no grupo do Dr. Mundy, em San Antonio 2, que hcomo já foi transfectadas para a expressão da GFP e re-clonados por nosso grupo 3. Este clone é uma variante óssea metastática com uma elevada taxa de metástases osteotropism e muito pouco para o fígado, pulmão, glândulas supra-renais ou. Enquanto injeções intracardíacas são mais comumente usados para estudos de metástase óssea 2, em certos casos intratibial 4 ou mamária injeções de gordura abdominal são mais adequadas. Injecções intracardíacas são tipicamente realizadas ao usar células tumorais humanas com o objectivo de monitorizar as fases posteriores de metástase, especialmente a capacidade de células cancerígenas para prender no osso, sobreviver, proliferam, e estabelecer os tumores que se desenvolvem em cancro induzido por doença óssea. Intratibial injecções são realizadas se aborda a relação de células cancerosas e de ossos depois de um tumor tenha metastizado para o osso, o que se correlaciona aproximadamente com a doença óssea metastática estabelecida. Nenhum desses modelos recapitula os primeiros passos no processo de metástase antes de embolia e entradade células de tumor para a circulação. Se monitorizar o crescimento do tumor primário ou metástase de um local primário para o osso, em seguida mamárias inoculações almofada de gordura são geralmente preferido, no entanto, muito poucas linhas de células tumorais, de forma consistente metastizar para o osso a partir do sítio primário, com 4T1 osso preferenciais clones, um rato mamária carcinoma, sendo a excepção 5,6.
Detalhes Este manuscrito de inoculação procedimentos e etapas principais destaques em análises após a inoculação. Especificamente, ele inclui a cultura de células, os procedimentos de inoculação de células tumorais para inoculações intracardíacos e intratibial, bem como uma breve informação sobre a monitorização semanal por raio-x, de fluorescência e análise histomorfométrica.
Protocolo
1. Manutenção de células
- Subclones osso muitos metastáticos de 231-MDA-MB existem que têm propensão variável para a colonização e crescimento ósseo. Para os nossos ensaios, usamos um clone derivado da GFP-tagged MDA-MB-231 desenvolvido no UTHSCA 2. Este em particular do sub-clone irá formar visíveis lesões ósseas osteolíticas em cerca de 3 semanas após a inoculação, com sacrifício de 4 semanas.
- Manter as células em DMEM contendo 10% de FBS e 0,1 mg / ml de penicilina-estreptomicina a 37 ° C em 5-8% de CO 2 7.
- Células de passagem na confluência de 80-90% e re-placa, a uma diluição 1:10 (isto varia dependendo do tipo de célula e da placa de tamanho. Por MDA-MB-231 células de uma T-75 é de aproximadamente 6x10 5), os quais é de aproximadamente 72 h cada.
- MDA-MB-231 células de manter uma aparência geralmente fibroblástica com pseudopodia numerosos. Qualquer arredondamento é indicativo de aglomeração ou de outra tensão indesejável e deve ser evitado uma vez que estapode afetar o potencial metastático in vivo.
- Idealmente, as células devem ser mantidas em cultura apenas brevemente antes da inoculação (recomendamos menos de uma semana ou até que tenha células suficientes para a experiência), e um novo frasco deve ser descongelado se o arredondamento ou alterações na taxa de crescimento celular ocorre.
2. Preparação de células
- Tripsinizar as células em confluência de 80-90% com 0,15% de tripsina / EDTA (Gibco diluir 0,5% de tripsina EDTA 1:2 em PBS). Esta concentração permite desprendimento rápido (<2 min) e reduz a aglomeração das células.
- Imediatamente remover as células da placa com 10 ml de gelo-frio DMEM contendo 10% de FBS, pipeta no tubo de 15 ml e centrifugar a 200 xg durante 5 min.
- Ressuspender o granulado em um tubo cónico de 50 ml em 25 ml de PBS gelado (sem Ca e Mg) e contar.
- Centrifugar novamente a pelota, e ressuspender em 10 6 células por ml (intracardíaca) ou menos 250.000 células/10 ul (intratibial) em PBS gelado. A têmperatura de PBS é importante para prevenir a aglutinação de células e embolia subsequente após a injecção. A suspensão de células devem permanecer em gelo durante a execução de injecções e serão viáveis e permanecem não-agregada, durante 30 min. Embora o número exato de placas necessárias variam de investigador para investigador, geralmente usamos uma T-75 para entre 8-10 ratos.
3. A inoculação intracardíaca
- 4-6 semanas de idade do sexo feminino (Foxn nu-/ -: Harlan) os ratos são usados para estas experiências, embora outros ratinhos imunocomprometidos (RAG1-/ -, RAG2-/ -, SCID, XID, e etc) podem também ser utilizado em experiências de células cancerosas humanas.
- Os ratos sem pêlo devem ser alimentados com dieta 2920x Teklad dias 5-10 antes da injecção para diminuir a mortalidade a partir do procedimento de injecção, e reduzir a fluorescência de fundo nos procedimentos de imagiologia (uma vez que o alimento é alfafa livre).
- Se usar outros ratos do que nu / nu, depilação, barba ou usando Nair (no nosso Nair experiência funciona melhor) no ar ventral abdominaleA antes de iniciar procedimento.
- Anestesiar mouse em uma câmara de isolamento usando um vaporizador isoflurano (2,5% Iso: 2-3 L / min O 2) ou anestesia preferido outro (em nossa experiência isoflurano é o melhor tolerada para as inoculações intracardíacos).
- Mover um rato de cada vez para o cone do nariz da máquina de anestesia dentro de uma capa de aço inoxidável ventilado.
- Posicione cada rato em suas costas com o peito virado para cima.
- Lava-se a caixa com uma zaragatoa de 10% de povidona / iodo / solução seguido de etanol a 70%, repetindo duas vezes.
- Peito Mark rato por injecção (através de um marcador estéril ou marcação ligeiramente para o lado para manter o local da injecção estéril). Nós usamos um meio do caminho entre o local marca fúrcula e superior do processo xifóide, e um pouco para a esquerda (anatômica) do esterno. Desenhar uma pequena bolha de ar para dentro da seringa para criar espaço entre o êmbolo e o menisco (importante para ver pulsação cardíaca) de 300 ul de 28 g ½ seringa de insulina, eelaborar 100 ul de células.
- Mantenha a agulha na posição vertical. Enquanto mantém a pele do rato tenso com a outra mão, inserir a agulha.
- Inserção bem sucedida no ventrículo cardíaco esquerdo deve resultar em um impulso luminoso vermelho distinto de sangue na seringa. Nessa profundidade, cuidadosamente deprimir êmbolo da seringa (100 ul de volume), sem movimento significativo da agulha para evitar a perfuração do coração ou células que derramam na cavidade torácica.
- Depois as células são injectadas, puxe ligeiramente o êmbolo para criar uma pequena quantidade de pressão negativa para reduzir o gotejamento de células para dentro da cavidade torácica.
- Puxar a agulha directamente do tórax, enquanto tendo a certeza de evitar a inclinação da agulha durante a remoção, que pode rasgar o revestimento do coração e provocar sangramento.
- Aplique uma leve pressão no peito o local de injecção para reduzir o sangramento.
- Remover do rato a partir do cone de nariz e continuar a aplicar uma ligeira pressão durante cerca de 1 min.
- Mova o mouse para almofada de aquecimento até que esteja totalmente conconsciente.
- Se o mouse começa a girar ou contorcer após a recuperação, a causa provável é uma embolia. Injectar rato intraperitonealmente com 80-120 mg / kg de cetamina a aumentar o fluxo de sangue e o débito cardíaco, enquanto diminui a resistência vascular. Isso deve ajudar a passar o mouse o coágulo. Depois de isto ocorrer, o melhor é mudar preparações de células, uma vez que indica que as células estão a aglutinação. Mudamos preparações de células após cerca de 8 ratinhos, ou 30 min.
4. Intratibial
- Injectar rato com Buprenex (0,1 mg / kg) ou analgésica semelhante aprovado imediatamente antes do procedimento.
- Anestesiar mouse usando isoflurano, em seguida, passar para cone do nariz e manter a anestesia.
- Limpar ambas as pernas com 10% de povidona / iodo zaragatoa / solução, seguida por etanol, repetindo duas vezes. Depilar as pernas (com Nair ou produto similar) antes da limpeza de pele se presente.
- Gentilmente segure maléolo lateral, maléolo medial, e na metade inferior da tíbia com o indicador e thumb, em seguida, a perna curva (combinação de flexão e rotação lateral, de tal modo que o joelho é visível e acessível.
- Humedecer a pele com EtOH a 70% para aumentar a visibilidade do ligamento patelar subjacente, que deve ser visível como uma distinta, linha branca e espessa. Enquanto segurando firmemente tornozelo / pé de inserção do mouse 28g ½ agulha sob patela, no meio do ligamento patelar, e na área intercondilar anterior em cima de tíbia.
- Ao inserir a agulha na tíbia, guiar com cuidado através da placa de crescimento usando a pressão constante, firme, com ação de perfuração leve.
- Após a penetração da placa de crescimento da tíbia, a agulha irá encontrar resistência marcadamente menos.
- Usar um movimento suave e lateral da agulha para assegurar a agulha se encontra na tíbia e através da placa de crescimento. Movimento será limitado se agulha está no lugar certo dentro de tíbia.
- Lentamente deprimir o êmbolo para injectar 10 jil de solução de células. Pouca ou nenhuma resistência deve ser sentida neste ponto.
- Slowly extrair agulha.
- Seguindo o mesmo procedimento, proceder à próxima etapa de injectar 10 jil de PBS.
- Retire do mouse de anestesia e continuar a almofada de aquecimento até a recuperação.
- Monitorar os ratos sobre o hr 24 próximo e injetar com Buprenex adicional a cada hora 12 se os animais continuam a mostrar sinais de sofrimento.
5. Imagem no Tempo
- Imagem de luciferase: Onde imaging, aplicável luciferase deve ser utilizada a partir de 7 dias pós-inoculação de células de tumor (embora na maioria dos modelos de metástases ósseas, detectável mais próximo de 14 dias). Rato é injectado por via intraperitoneal com 150 mg / kg de luciferina, anestesiados, e fotografada 8 min após a injecção utilizando equipamento IVIS 8.
- GFP imagem: Normalmente GFP-expressando os tumores começam a ser detectáveis por volta do dia 10-14 para 16-21 injeções intratibial e para experimentos intracardíacos usando Maestro equipamentos de imagem (CRI) 9. Resumidamente, os ratos são anestesiados com isoflurano (3%) E mantidos sob anestesia através de um cone de nariz na câmara de imagem Maestro. Para os nossos eGFP expressam células que usam o conjunto de filtro azul (498 excitation/515 emissão para eGFP) a 500 ms exposição em passos de 10 nm.
- Faxitron (X-ray): Raios-X são tomadas semanalmente a partir entre os dias 7 a 14. Lesões serão visíveis no modelo intracardíaca no dia 21 e uma semana antes da injecção intratibial 3. Nossos dados radiográficos em ex vivo e in vivo foram adquiridos utilizando um Faxitron LX-60 a 35 kV, durante 8 segundos de exposição.
- Imagem Outros: modalidades de imagem será inteiramente baseada na investigação específica. Além dos métodos acima descritos, a imagem com base no animal vivo 3D micro-tomografia computadorizada (μCT), micro-positron tomografia de emissão (μPET), e outras modalidades 10,11 pode fornecer informação valiosa.
6. Sacrifício do mouse
- Cada modelo tem um curso de tempo ligeiramente diferente. Com MDA-MB-231 ratos células geralmente tornam-se caquéticos ou paraplégico entre 21 e 35 dias e geralmente em torno de 28 dias (TI injetaram em ratos entre 21-28 dias).
- Uma vez que vários ratos desenvolvem lesões que começam a romper o osso cortical, tornar-se paraplégico, ou perder entre 10-20% do peso corporal, sacrificar todos os camundongos no estudo usando cetamina / xilazina overdose com luxação cervical (ou método IACUC outro aprovado).
- Retirar os ossos necessários para posterior estudo e armazenar em formalina a 4% tamponada.
- Camundongos com tumores no peito são um sinal de uma injeção de falta e devem ser excluídos do estudo.
7. Análise Ex Vivo
- μCT: digitalização em EtOH 70% permite parâmetros estruturais e histológicas a ser medido na amostra mesmo osso.
- Contorno e analisar de acordo com o delineamento experimental individual e equipamento disponível 10. Nossos dados foi obtida com um μCT Scanco 40 usando 12 uM resolução.
- Histomorphometry: espécimes processo usando preferenciais métodos histológicos e manchar com Hematoxilina / Eosina 7
8. Resultados representativos
Após inoculação intracardíaca ou intratibial de células tumorais (Figura 1) os ratinhos foram monitorizados semanalmente por radiografia e fluorescência (ou luminescência). Lesões normalmente tornar-se aparente por raios-X entre 2 e 3 semanas, enquanto que eles podem ser visíveis por fluorescência e luminescência logo na semana 2, dependendo do modelo (Figura 2). As lesões são visíveis como buracos escuros no osso, e tornar-se mais pronunciada com o tempo (Figura 3). As lesões foram quantificados utilizando Metamorph análise de radiografias e fluorescência foi quantificada através de Maestro aquisição de imagem (CRI) e software de análise. Como as lesões começam a crescer, freqüentemente se tornam ratos caquéticos. Sacrifício é necessária quando os ratos perderam entre 10-20% do seu peso corporal inicial. A condição do ratos podem alterar-se rapidamente e deve ser monitorada várias vezes durante o dia. Entre as semanas 3-4 ratos começaram a arrastar uma ou ambas as patas traseiras e todo o estudo foi sacrificado. Imagens foram tiradas antes do sacrifício. Após overdose de anestesia, foi coletado sangue para medir marcadores de remodelação óssea, ou outros fatores. Após deslocamento cervical, a pele foi separada do rato e os ossos excisados e limpos para imagiologia ex vivo (Figura 3), que irá permitir a visualização de focos de tumor, pelo menos, 7 dias mais cedo do que nas técnicas de imagem in vivo. Uma vez que os ossos da imagem foram preenchidos foram colocados em cassetes rotulados e armazenados em formalina para fixação e processamento adicional ou análise histológica μCT. Histomorfometria foi realizada nas amostras para indicar a carga do tumor e BV / TV após μCT foi realizada em uma tíbia para quantificar a quantidade de destruição óssea (Figura 4).
/ 4260/4260fig1.jpg "/>
Figura 1. A colocação apropriada de injecção. Vista radiográfico Ventral (A) do tórax do rato adulto mostrando a colocação apropriada da agulha no 4 º espaço intercostal e para dentro do ventrículo esquerdo para a inoculação intracardíaca. Marcos anatômicos são mostrados com linhas tracejadas horizontais sobre o esterno (destacado em branco). Na pele do rato do manúbrio e processo xifóide servir como pontos de referência, e que a agulha é inserida ligeiramente à esquerda do esterno. Vista radiográfico ventral (B) da perna do rato adulto mostrando a colocação apropriada da agulha na tíbia proximal, alinhados entre os côndilos. A partir de uma perspectiva lateral, a ponta da agulha é colocada atrás da tuberosidade tibial e profunda para a placa epifisária. Localização ideal para a injeção é mostrado pelo círculo branco.

Figura 2. Curso de tempo de modelos de metástases ósseas. Progressão de cancer induzida por doença óssea mostrado com raios-x e GFP + imagens fluorescentes dos tumores in vivo a partir de intratibial injecções (A) e as injecções intracardíacas (B).
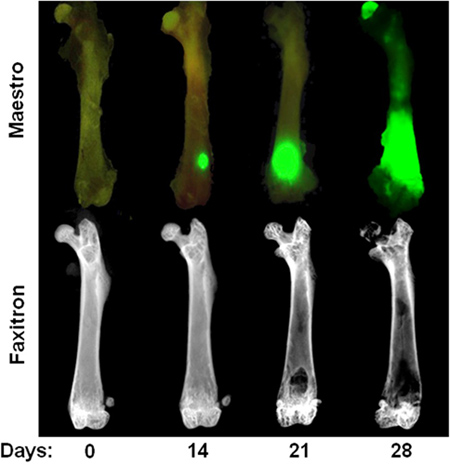
Figura 3. Curso de tempo da intracardíaca MDA-MB-231 modelo Fileira superior:. Imagem ex vivo mostrando fluorescência GFP no dia 0, 14, 21, e 28 após a injecção intracardíaca de 231-MDA-MB. Note-se que os focos de tumor no dia 14 só são visíveis em ex vivo após a remoção do tecido mole. Na fila de baixo: imagens radiográficas ex vivo dos fêmures mesmos ilustram lesões ósseas osteolíticas. Note-se que a destruição do osso não é normalmente visível até 3 semanas após a injecção cardíaca.
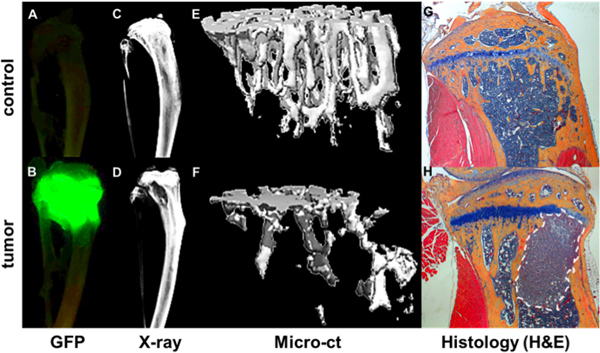
Figura 4. Quantificação do osso metastático progressão GFP. Tumor + como visualizado por Maestro imagiologia ex vivo de tibiae de um rato rolamento não-tumor (A) e de um ratinho de 4 semanas após a injecção intracardíaca de uma GFP expressando MDA-MB-231 subclone (B). Focos tumorais correlacionam-se com as áreas de destruição óssea, como mostrado por Faxitron (D) em relação um osso sem tumor (C). Dados estruturais e osso mineral a partir de medições microCT é processado como imagens 3D de um osso saudável (E) e um rolamento de osso tumor (F) em que as áreas de destruição óssea, são mostrados como espaço vazio. Detalhe do osso e tumores ainda é observada em correspondentes H & E manchados cortes histológicos (G & H).
Discussão
Estudos de induzida por tumor, doença óssea dependem de vários modelos animais dos quais os dois mais utilizados são inoculações intracardíacos e intratibial. Em muitos casos, intracardíaca é a melhor opção para estudar a metástase óssea, no entanto, não representa o processo completo metastático, e, portanto, almofada de gordura mamária ou outras injecções ortotópicos devem, idealmente, ser utilizada para esse fim. As células tumorais não metastatizam prontamente a partir do sítio primário, na ma...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores reconhecem as seguintes fontes de financiamento: P01CA040035 (FE / JAS) e Prêmio de Desenvolvimento VA Carreira (JAS).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| MDA-MB-231 células de cancro da mama humano | Originalmente ATCC-Internamente clonado e selecionado | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040-CV | |
| FBS | Atlas Biológica | F-0050a | |
| Tripsina | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Maestro | CRi | ||
| μCT do scanner | Scanco | ||
| Ratinhos nus atímicos | Harlan | Fox nu - / - | |
| As seringas de insulina (300 ul, 28,5 g) | Becton Dickinson | 309300 | |
| IVIS | Compasso de calibre | ||
| Dieta Roedor irradiado | Teklad | 2920x |
Referências
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. . Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados