È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modelli di metastasi ossee
In questo articolo
Riepilogo
I modelli animali sono spesso utilizzati per studiare metastasi alle ossa. In questo protocollo si descrivono due metodi comuni di inoculo del tumore per gli studi di metastasi ossee e descrivere brevemente alcune delle analisi utilizzati per monitorare e quantificare questi modelli.
Abstract
Le metastasi ossee sono un evento comune in tumori maligni, tra cui mammella, della prostata e del polmone. Una volta stabilito in osso, i tumori sono responsabili di morbilità e mortalità significative 1. Quindi, vi è una grande necessità di comprendere i meccanismi molecolari che controllano la crescita, creazione e l'attività di tumori in osso. Diversi modelli in vivo sono stati istituiti per studiare questi eventi e ognuno ha vantaggi e limiti specifici. Il modello più comunemente usato utilizza inoculazione intracardiaca delle cellule tumorali direttamente nella fornitura di sangue arterioso atimici (nudo) topi BalbC. Questo procedimento può essere applicato a molti diversi tipi di tumore (inclusi PC-3 cancro alla prostata, carcinoma del polmone, e topo tumori mammari cuscinetto di grasso), tuttavia, in questo manoscritto ci concentreremo sul modello di cancro al seno, MDA-MB-231. In questo modello ci avvaliamo di un clone molto osso-selettivo, originariamente derivato nel gruppo Dr. Mundy a San Antonio 2, che hda allora è stato transfettate per l'espressione GFP e ri-clonato dal nostro gruppo 3. Questo clone è una variante osseo metastatico con un alto tasso di osteotropism e metastasi poco da polmone, fegato, o ghiandole surrenali. Mentre iniezioni intracardiaci sono più comunemente utilizzati per gli studi di metastasi ossee 2, in alcuni casi, intratibial 4 o mammaria iniezioni di cuscinetto adiposo sono più appropriati. Iniezioni intracardiaci sono tipicamente eseguite utilizzando cellule tumorali umane con l'obiettivo di monitorare le fasi successive di metastasi, in particolare la capacità delle cellule tumorali di arrestare in osso, sopravvivere, proliferare, e stabilire tumori che si sviluppano in tumore-indotta malattia ossea. Intratibial iniezioni vengono eseguite se concentrandosi sul rapporto delle cellule tumorali e ossee dopo un tumore ha metastatizzato alle ossa, che è correlato o meno una costante malattia metastatica ossea. Nessuno di questi modelli ricapitola primi passi nel processo metastatico prima di embolia e l'ingressodi cellule tumorali nella circolazione. Se monitorare la crescita del tumore primario o metastasi dal sito primario alle ossa, poi mammarie vaccinazioni cuscinetto adiposo sono in genere preferito, tuttavia, pochissimi linee cellulari tumorali in modo coerente metastasi alle ossa dal sito primario, con 4T1 osso preferenziali cloni, un mouse mammaria carcinoma, essendo l'eccezione 5,6.
Questa procedura dettagli inoculazione manoscritti e le fasi principali evidenzia nelle analisi post-inoculazione. In particolare, include colture cellulari, cellule tumorali procedure di inoculazione di vaccini intracardiaci e intratibial, così come brevi informazioni riguardo monitoraggio settimanale di raggi X, fluorescenza e analisi istomorfometrici.
Protocollo
1. Cella di manutenzione
- Subcloni ossa molti metastatici di MDA-MB-231 esistono che hanno propensione variabile per la colonizzazione e la crescita ossea. Per i nostri esperimenti usiamo un clone derivato dal GFP-etichettato MDA-MB-231 sviluppato UTHSCA 2. Questo particolare sub-clone formerà visibili lesioni osteolitiche a circa 3 dopo inoculazione settimane, con sacrificio a 4 settimane.
- Mantenere le cellule in DMEM contenente 10% FBS e 0,1 mg / ml di penicillina-streptomicina a 37 ° C nel 5-8% CO 2 7.
- Cellule passaggio a 80-90% di confluenza e ri-piastra ad una diluizione 1:10 (questo varia a seconda del tipo di cellula e la piastra di dimensioni. Per MDA-MB-231 cellule in un T-75 è di circa 6x10 5), che è circa ogni 72 ore.
- MDA-MB-231 cellule di mantenere un aspetto generalmente fibroblastica con numerosi pseudopodi. Ogni arrotondamento è indicativo di sovraffollamento o altre sollecitazioni indesiderabili, e dovrebbe essere evitata poiché questopossono influenzare il potenziale metastatico in vivo.
- Idealmente, le celle devono essere mantenute in coltura solo brevemente prima dell'inoculazione (si consiglia di meno di 1 sett o fino a quando si dispone di celle sufficiente per l'esperimento), e un nuovo flaconcino devono essere scongelati se arrotondamento o modifiche del tasso di crescita delle cellule si verificano.
2. Preparazione cellulare
- Tripsinizzare le cellule a 80-90% di confluenza con 0,15% di tripsina / EDTA (diluire 0,5% Gibco tripsina EDTA 1:2 in PBS). Questa concentrazione permette il distacco rapido (<2 min) e riduce aggregazione delle cellule.
- Immediatamente rimuovere le cellule dalla piastra con 10 ml ghiacciata DMEM contenente 10% FBS, pipetta in 15 ml tubo conico e centrifugare a 200 xg per 5 min.
- Risospendere il pellet in una provetta da 50 ml in 25 ml di PBS ghiacciato (senza Ca e Mg) e contare.
- Centrifugare nuovamente pellet e risospendere a 10 6 cellule per ml (intracardiaco) o in 250.000 cells/10 pl (intratibial) in PBS ghiacciato. La temperatura di PBS è importante per evitare grumi di cellule ed embolia successiva dopo l'iniezione. La sospensione cellulare dovrebbe rimanere in ghiaccio durante l'esecuzione di iniezioni e sarà vitale e rimangono non-aggregata per 30 min. Mentre il numero esatto di tavole che sono necessarie varia da ricercatore a ricercatore, generalmente usiamo 1 T-75 per 8-10 topi.
3. Inoculazione intracardiaca
- 4-6 femmina settimana fa (Foxn nu-/ -: Harlan) topi sono usati per questi esperimenti, sebbene altri topi immunodeficienti (RAG1-/ -, RAG2-/ -, SCID, XID, e così via) possono anche essere usati negli esperimenti di cellule umane di cancro.
- I topi nudi devono essere alimentati Teklad giorni di dieta 2920x 5-10 prima dell'iniezione per ridurre la mortalità per la procedura di iniezione, e ridurre la fluorescenza di fondo nelle procedure di imaging (in quanto il cibo è gratuito erba medica).
- In caso di utilizzo di altri topi nu / nu, rimuovere i capelli con la rasatura o con Nair (nel nostro Nair esperienza funziona meglio) sulla ventrale addominale area prima di iniziare procedura.
- Anestetizzare mouse in una camera di isolamento utilizzando un vaporizzatore isoflurano (2,5% Iso: 2-3 L / min O 2) o di altra anestesia preferito (nella nostra esperienza isoflurano è la migliore tollerata per vaccinazioni intracardiaci).
- Muovere un mouse alla volta per il cono della macchina per anestesia all'interno di una cappa in acciaio inox ventilato.
- Posizionare ogni mouse sulla schiena con petto rivolto verso l'alto.
- Lavare il petto con un 10% di povidone / iodio tampone / soluzione seguito da etanolo al 70%, ripetere 2 volte.
- Torace Mark mouse per iniezione (con un pennarello sterile o marcatura leggermente di lato per mantenere il sito di iniezione sterile). Usiamo una posizione a metà strada tra il marchio sternale ed ultimo piano di processo xifoideo, e un po 'a sinistra (anatomica) dello sterno. Disegnare una piccola bolla d'aria nella siringa per creare spazio tra il pistone e il menisco (importante per vedere impulso cardiaco) di un pl 300 28 g ½ siringa da insulina, eelaborare 100 pl di cellule.
- Tenere l'ago in posizione verticale. Mentre si tiene la pelle tesa del mouse con l'altra mano, inserire l'ago.
- Inserimento di successo nel ventricolo sinistro cardiaco dovrebbe sfociare in un distinto impulso luminoso rosso del sangue nella siringa. A questa profondità, con attenzione abbassare stantuffo della siringa (100 microlitri di volume), senza movimento significativo dell'ago per evitare la puntura del cuore o le celle che si rovesciano nella cavità toracica.
- Dopo cellule vengono iniettate, sollevare leggermente il pistone per creare una piccola quantità di pressione negativa per ridurre gocciolamento di cellule nella cavità toracica.
- Estrarre l'ago direttamente dal petto pur essendo sicuri di evitare di inclinare l'ago durante la rimozione, che può strappare il rivestimento del cuore e causare sanguinamento.
- Applicare una leggera pressione al petto sul sito di iniezione per ridurre il sanguinamento.
- Rimuovere il mouse dal cono naso e continuano ad esercitare una leggera pressione per circa 1 min.
- Muovi il mouse per rilievo di riscaldamento fino a completo concosciente.
- Se il mouse inizia a girare o contrarsi dopo il recupero, la causa più probabile è un embolia. Iniettare topo intraperitonally con 80-120 mg / kg di ketamina per aumentare il flusso sanguigno e la gittata cardiaca, diminuendo la resistenza vascolare. Questo dovrebbe aiutare il mouse passare il coagulo. Quando questo si verifica, è meglio cambiare preparazioni di cellule, in quanto indica che le cellule sono grumi. Cambiamo preparazioni di cellule dopo circa 8 topi, o 30 min.
4. Intratibial
- Iniettare mouse con Buprenex (0,1 mg / kg) o simili analgesico approvato immediatamente prima procedura.
- Anestetizzare il mouse utilizzando isoflurano, poi passare a cono e mantenere l'anestesia.
- Pulire entrambe le gambe con il 10% di povidone / iodio tampone / soluzione, seguito da etanolo, ripetendo 2 volte. Gambe depilate (con Nair o prodotto analogo) prima della pulizia se presente pelliccia.
- Afferrare con delicatezza malleolo laterale, malleolo mediale, e la metà inferiore della tibia e con l'indice °UMB, quindi gamba curva (combinazione di flessione e rotazione laterale, in modo tale che il ginocchio è visibile e accessibile.
- Inumidire la pelle con il 70% EtOH per aumentare la visibilità del sottostante legamento patellare, che dovrebbe essere visibile come una distinta, spesso, linea bianca. Mentre impugnando saldamente caviglia / gamba di inserto del mouse 28g ½ ago sotto rotula, attraverso il centro del legamento rotuleo, e nella zona intercondiloidea anteriore nella parte superiore della tibia.
- Quando si inserisce l'ago nella tibia, guidare con attenzione attraverso la piastra con una crescita costante, pressione costante con l'azione di perforazione leggero.
- Dopo la penetrazione di cartilagine di accrescimento tibiale, l'ago incontrerà una resistenza nettamente inferiore.
- Utilizzare un dolce, movimento laterale dell'ago per garantire ago si trova nella tibia e attraverso la cartilagine di accrescimento. Il movimento è limitato, se l'ago è in posizione corretta all'interno della tibia.
- Premere lentamente lo stantuffo per iniettare 10 ml di soluzione cellulare. Poca o nessuna resistenza deve essere sentito a questo punto.
- Slowly estrarre l'ago.
- Seguendo la stessa procedura, passare al successivo tratto di iniettare 10 ml di PBS.
- Rimuovere il mouse dall'anestesia e continuare a rilievo di riscaldamento fino al recupero.
- Monitorare i topi per i prossimi 24 ore e iniettare con Buprenex aggiuntiva ogni 12 ore se gli animali continuano a mostrare segni di sofferenza.
5. Imaging tempo
- Imaging Luciferase: Se del caso, l'imaging luciferasi dovrebbe essere utilizzato a partire a 7 giorni dopo l'inoculazione delle cellule tumorali (anche se nella maggior parte dei modelli metastasi ossee, rilevabile più vicino al giorno 14). Mouse viene iniettata per via intraperitoneale con 150 mg / kg luciferina, anestetizzati, e ripreso 8 min dopo l'iniezione utilizzando attrezzature IVIS 8.
- GFP immagini: in genere i tumori che esprimono GFP-cominciano ad essere rilevabili intorno al giorno 10-14 per preparazioni iniettabili intratibial e 16-21 per gli esperimenti che utilizzano intracardiaci Maestro immagini oggetto (CRI) 9. In breve, i topi vengono anestetizzati con isoflurano (3%) E mantenuti sotto anestesia mediante un cono nella camera Maestro imaging. Per i nostri eGFP-cellule che esprimono usiamo un set di filtro blu (498 excitation/515 emissione per eGFP) a 500 ms di esposizione a passi di 10 nm.
- Faxitron (X-ray): I raggi X sono presi a settimana a partire tra il giorno 7 a 14. Le lesioni saranno visibili nel modello intracardiaca al giorno 21 e una settimana prima del intratibial iniezioni 3. I nostri dati radiografici per ex vivo e in vivo è stato acquisito con un Faxitron LX-60 a 35 kV per 8 secondi di esposizione.
- Altre immagini: modalità di imaging sarà interamente basato sulla ricerca specifica. Oltre ai metodi di cui sopra, l'imaging animale vivo sulla base di 3D micro-tomografia computerizzata (μCT), micro-tomografia ad emissione di positroni (μPET), e altre modalità 10,11 in grado di fornire preziose informazioni.
6. Mouse Sacrificio
- Ogni modello ha un decorso leggermente diverso. Con MDA-MB-231 topi cellule di solito diventano cachettico o paraplegico tra 21 e 35 giorni e solitamente intorno 28 ° giorno (IT iniettato nei topi tra 21-28 giorni).
- Una volta che i topi più sviluppare lesioni che iniziano a rompere l'osso corticale, diventato paraplegico, o si perde tra il 10-20% del peso corporeo, sacrificare tutti i topi in studio con ketamina / xilazina sovradosaggio con dislocazione cervicale (o altro metodo IACUC approvato).
- Togliere le ossa necessari per ulteriori studi e conservare in formalina tamponata al 4%.
- I topi con tumori del torace sono il segno di una iniezione di mancato e dovrebbero essere esclusi dallo studio.
7. Ex Vivo Analisi
- μCT: scansione in 70% EtOH consente ai parametri strutturali e istologici da misurare sul provino stesso osso.
- Contour e analizzare secondo singolo disegno sperimentale e le attrezzature disponibili 10. I nostri dati sono stati ottenuti con un μCT Scanco 40 con risoluzione di 12 uM.
- Histomorphometry: i campioni di processo con metodi istologici preferite e colorare con ematossilina / eosina 7
8. Risultati rappresentativi
Seguito di inoculazione intracardiaca o intratibial di cellule tumorali (Figura 1) topi sono monitorati settimanalmente dalla radiografia e fluorescenza (o luminescenza). Lesioni normalmente risulteranno da x-ray settimana tra 2 e 3, mentre possono essere visibili da fluorescenza e luminescenza già alla settimana 2, a seconda del modello (Figura 2). Le lesioni sono visibili come fori scuri nell'osso, e diventano più pronunciati con il tempo (Figura 3). Le lesioni sono stati quantificati utilizzando l'analisi Metamorph delle radiografie e la fluorescenza è stata quantificata utilizzando Maestro (CRI) di acquisizione immagini e software di analisi. Per quanto le lesioni cominciano a crescere, i topi diventano spesso cachettico. Il sacrificio è richiesto quando i topi hanno perso tra il 10-20% del loro peso corporeo iniziale. La condizione del topi possono cambiare rapidamente e deve essere monitorato più volte durante la giornata. Tra 3-4 settimane i topi cominciarono a trascinare uno o entrambi gli arti posteriori e l'intero studio è stato sacrificato. Le immagini sono state prese prima del sacrificio. Dopo l'overdose di anestesia, il sangue è stato raccolto per misurare i marcatori del turnover osseo o da altri fattori. Dopo dislocazione cervicale, la pelle è stata spogliata dal mouse e ossa asportato e pulito per ex vivo imaging (Figura 3) che permette la visualizzazione di foci tumorali almeno 7 giorni di anticipo rispetto a tecniche di imaging in vivo. Una volta che le ossa di imaging è stato completato sono stati posti in cassette etichettati e conservati in formalina per la fissazione e l'ulteriore elaborazione o analisi istologica μCT. Istomorfometria stata effettuata su campioni per indicare il carico tumorale e BV / TV dopo μCT è stata eseguita su una tibia di quantificare la quantità di distruzione ossea (Figura 4).
/ 4260/4260fig1.jpg "/>
Figura 1. Corretto posizionamento di iniezione. Ventrale vista radiografico (A) del torace topo adulto mostrando corretto posizionamento dell'ago nello spazio intercostale 4 ° e nel ventricolo sinistro per inoculazione intracardiaca. Punti di riferimento anatomici sono rappresentati con linee orizzontali tratteggiate sullo sterno (evidenziato in bianco). Sulla pelle del topo e del sternale processo xifoideo servono come punti di riferimento, e l'ago viene inserito leggermente a sinistra dello sterno. Vista radiografico ventrale (B) della gamba topo adulto mostrando corretto posizionamento dell'ago nella tibia prossimale, allineati tra i condili. Da un punto di vista laterale la punta dell'ago è posto dietro la tuberosità tibiale e profondo alla piastra epifisaria. Posizione ideale per l'iniezione è dimostrato dal cerchio bianco.

Figura 2. Naturalmente il tempo di modelli di metastasi ossee. Progressione di cancer indotta da malattia ossea mostrato con i raggi X e la GFP + immagini fluorescenti dei tumori in vivo da intratibial iniezioni (A) e intracardiaca iniezioni (B).
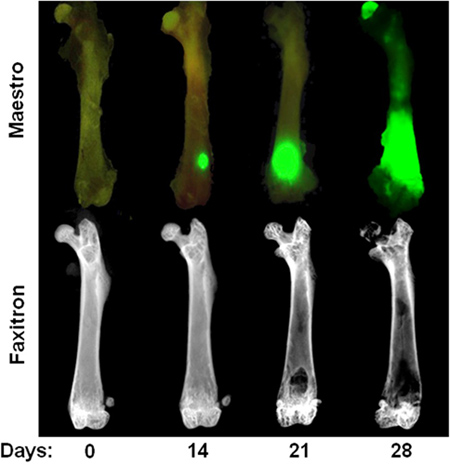
Figura 3. Naturalmente il tempo di intracardiaca MDA-MB-231 modello Top Row:. Immagine ex vivo che mostra fluorescenza GFP, al giorno 0, 14, 21, e 28 dopo l'iniezione intracardiaca di MDA-MB-231. Notare che focolai tumorali al giorno 14 sono visibili solo in ex vivo dopo la rimozione del tessuto molle. Riga in basso: le immagini radiografiche ex vivo dei femori stessi illustrano lesioni ossee osteolitiche. Si noti che la distruzione ossea di solito non è visibile fino a 3 settimane dopo l'iniezione cardiaco.
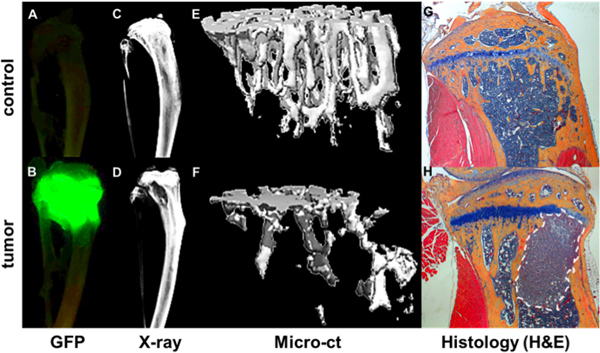
Figura 4. Quantificazione della progressione metastatica ossea. GFP + tumore come visualizzato dal Maestro immagini ex vivo di Tibiae di un non-tumore topo cuscinetto (A) e un mouse 4 settimane dopo l'iniezione intracardiaca di una GFP esprimere MDA-MB-231 subclone (B). Foci tumorali correlate con aree di distruzione ossea come mostrato da Faxitron (D) contro un osso senza tumore (C). Dati strutturali e minerale osseo di misurazioni microCT viene reso come immagini 3d di un osso sano (E) e un osso cuscinetto tumore (F) in cui aree di distruzione ossea sono mostrati come zona vuoto. Ulteriori dettagli delle ossa e del tumore è visto in corrispondenti H & E sezioni colorate istologiche (G & H).
Discussione
Studi di tumore-indotta malattia ossea contare su diversi modelli animali di cui i due più comunemente utilizzati sono inoculazioni intracardiaci e intratibial. In molti casi intracardiaca è l'opzione migliore per lo studio di metastasi alle ossa, tuttavia, non rappresenta l'intero processo metastatico e quindi cuscinetto adiposo mammario o altre iniezioni ortotopici dovrebbero idealmente essere utilizzati verso quella fine. Le cellule tumorali non metastatizzare rapidamente dal sito primario nella maggior par...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori riconoscono le seguenti fonti di finanziamento: P01CA040035 (FE / JAS) e VA Career Development Award (JAS).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| MDA-MB-231 cellule umane di cancro al seno | Originariamente ATCC-Internamente clonato e selezionato | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040-CV | |
| FBS | Atlas biologica | F-0050a | |
| Tripsina | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Maestro | CRi | ||
| μCT scanner | Scanco | ||
| Topi nudi atimici | Harlan | Fox nu - / - | |
| Siringhe da insulina (300 ml, 28,5 g) | Becton Dickinson | 309300 | |
| IVIS | Pinza | ||
| Roditori dieta irradiata | Teklad | 2920x |
Riferimenti
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. . Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon