Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèles de métastases osseuses
Dans cet article
Résumé
Les modèles animaux sont fréquemment utilisés pour étudier la métastase du cancer de l'os. Dans ce protocole, nous allons décrire deux méthodes courantes de inoculation de la tumeur pour les études de métastases osseuses et décrire brièvement quelques-unes des analyses utilisés pour surveiller et quantifier ces modèles.
Résumé
Les métastases osseuses sont un phénomène fréquent dans les tumeurs malignes, y compris plusieurs seins, la prostate et du poumon. Une fois mis en place dans les os, les tumeurs sont responsables d'une morbidité et une mortalité importantes 1. Ainsi, il existe un besoin important de comprendre les mécanismes moléculaires qui contrôlent l'établissement, la croissance et l'activité des tumeurs dans les os. Plusieurs modèles in vivo ont été mis en place pour étudier ces événements et chacun présente des avantages et des limitations spécifiques. Le modèle le plus couramment utilisé utilise inoculation intracardiaque de cellules tumorales directement dans l'approvisionnement en sang artériel de athymiques (nude) BalbC souris. Cette procédure peut être appliquée à de nombreux types de tumeurs différentes (y compris les PC-3 cancer de la prostate, cancer du poumon et les tumeurs mammaires de souris coussinet adipeux), mais dans ce manuscrit, nous nous concentrerons sur le modèle du cancer du sein MDA-MB-231. Dans ce modèle, nous utilisons un clone fortement os sélective, à l'origine dérivé dans le groupe du Dr Mundy à San Antonio 2, que hque depuis été transfectées pour l'expression de la GFP et re-cloné par notre groupe 3. Ce clone est une variante osseuse métastatique avec un taux élevé de métastases ostéotropisme et très peu de poumon, du foie ou des glandes surrénales. Alors que les injections intracardiaques sont les plus couramment utilisés pour les études de métastases osseuses 2, dans certains cas intratibial 4 ou mammaire injections coussinet adipeux sont plus appropriées. Injections intracardiaques sont généralement effectuées lors de l'utilisation des cellules tumorales humaines dans le but de surveiller stades de métastases, en particulier la capacité des cellules cancéreuses à l'arrestation de l'os, de survivre, proliférer et établir des tumeurs qui se développent dans la maladie osseuse induite par le cancer. Intratibial injections sont effectuées si la focalisation sur la relation entre les cellules cancéreuses et les os, après une tumeur a métastasé aux os, ce qui correspond à peu près à la maladie osseuse métastatique établi. Aucun de ces modèles récapitule les premières étapes du processus métastatique avant l'embolie et l'entréedes cellules tumorales dans la circulation. Si surveiller la croissance des tumeurs primaires ou de métastases à partir du site principal de l'os, puis mammaires inoculations coussinet adipeux sont généralement préféré, mais très peu de lignées cellulaires tumorales de manière constante métastaser à l'os à partir du site primaire, avec 4T1 os préférentiels clones, un mammaire de la souris carcinome, l'exception étant 5,6.
Ces procédures manuscrits inoculation détails et les étapes clés dans l'analyse met en évidence après l'inoculation. Plus précisément, il comprend la culture de cellules, tumorales procédures d'inoculation de cellules pour des inoculations intracardiaques et intratibial, ainsi que de brèves informations concernant le suivi hebdomadaire par rayons X, fluorescence et analyses histomorphométriques.
Protocole
1. Entretien cellule
- Beaucoup de sous-clones osseuse métastatique de cellules MDA-MB-231 existent qui ont la propension variable pour la colonisation et la croissance osseuse. Pour nos expériences, nous utilisons un clone dérivé de la GFP-étiqueté MDA-MB-231 développé à UTHSCA 2. Ce sous-clone former des lésions osseuses ostéolytiques visibles à environ 3 post-inoculation semaines, avec sacrifice à 4 semaines.
- Maintenir les cellules dans du DMEM contenant 10% de FBS et 0,1 mg / ml de pénicilline-streptomycine à 37 ° C dans 5-8% de CO 2 7.
- Le passage des cellules à confluence de 80-90% et re-plaque à une dilution de 1:10 (cela varie en fonction du type cellulaire et la plaque de taille. Par MDA-MB-231 cellules dans un T-75 est d'environ 6x10 cet 5), qui est à peu près tous les 72 heures.
- MDA-MB-231 cellules maintenir une apparence généralement fibroblastique avec pseudopodes nombreux. Toute l'arrondissement est indicative de stress indésirable surpeuplement ou autre, et doit être évitée car ellepeut affecter le potentiel métastatique in vivo.
- Idéalement, les cellules doivent être maintenues en culture que brièvement avant l'inoculation (nous vous recommandons de moins de 1 semaine ou jusqu'à ce que vous avez suffisamment de cellules pour l'expérience), et un nouveau flacon doit être décongelée si l'arrondissement ou des changements de taux de croissance cellulaire se produire.
2. Préparation des cellules
- Trypsiniser cellules à confluence de 80-90% avec 0,15% de trypsine / EDTA (Gibco diluer 0,5% de trypsine EDTA 1:2 dans du PBS). Cette concentration permet de détachement rapide (<2 min) et de réduire l'agglutination des cellules.
- Immédiatement éliminer les cellules de la plaque avec 10 ml glacée DMEM contenant 10% de FBS, une pipette dans 15 ml tube conique et centrifuger à 200 xg pendant 5 min.
- Resuspendre le culot dans un tube conique de 50 ml dans 25 ml PBS glacé (sans Ca et Mg) et à compter.
- Centrifuger à nouveau à granulés, et remettre en suspension à 10 6 cellules par ml (intracardiaque) ou à 250.000 cellules/10 ul (intratibial) dans du PBS glacé. La températureture de PBS est important pour empêcher l'agglutination des cellules et une embolie suite après l'injection. La suspension cellulaire doit rester sur la glace tout en effectuant des injections et sera viable et restent non agglomérées pendant 30 min. Bien que le nombre exact de plaques requis variera d'un enquêteur à l'enquêteur, on utilise généralement 1 T-75 pour les souris entre 8-10.
3. L'inoculation intracardiaque
- 6.4 féminine semaine vieux (Foxn nu-/ -: Harlan) souris sont utilisées pour ces expériences, bien que d'autres souris immunodéprimées (RAG1-/ -, RAG2-/ -, SCID, XID, et etc) peuvent également être utilisé avec l'homme des expériences de cellules cancéreuses.
- Les souris nues doivent être nourris au jour Teklad régime 2920x 5-10 avant l'injection pour réduire la mortalité de la procédure d'injection, et de réduire la fluorescence de fond dans les procédures d'imagerie (puisque la nourriture est la luzerne gratuit).
- Si vous utilisez d'autres souris de nu / nu, enlever les poils par le rasage ou l'utilisation de Nair (dans notre expérience Nair fonctionne mieux) sur abdominale area avant de commencer la procédure.
- Anesthésier la souris dans une chambre d'isolement à l'aide d'un vaporisateur d'isoflurane (2,5% Iso: 2-3 L / min O 2) ou autre anesthésie préféré (dans notre expérience isoflurane est le mieux toléré pour les inoculations intra-cardiaques).
- Déplacer une souris à la fois à la pointe avant de l'appareil d'anesthésie à l'intérieur d'une hotte ventilée en acier inoxydable.
- Placez chaque souris sur son dos avec la poitrine vers le haut.
- Laver la poitrine avec un 10% povidone / iode tampon / solution suivie d'éthanol à 70%, en répétant 2 fois.
- Mark souris poitrine pour injection (en utilisant un marqueur stérile ou le marquage légèrement sur le côté pour garder le site d'injection stérile). Nous utilisons un emplacement à mi-chemin entre la marque et la fourchette sternale supérieure du processus xiphoïde, et légèrement à gauche (anatomique) du sternum. Dessiner une petite bulle d'air dans la seringue pour créer un espace entre le piston et le ménisque (important pour voir pulsation cardiaque) de 300 ul de 28 g ½ seringue à insuline, etétablir 100 ul de cellules.
- Gardez l'aiguille verticale. Tout en tenant la peau tendue de la souris avec l'autre main, introduire l'aiguille.
- Insertion réussie dans le ventricule cardiaque gauche devrait se traduire par une impulsion distincte rouge vif du sang dans la seringue. A cette profondeur, soigneusement appuyer piston de la seringue (volume de 100 pl), sans mouvement significatif de l'aiguille pour éviter de percer le coeur ou les cellules déversant dans la cavité thoracique.
- Après que les cellules sont injectées, tirez légèrement sur le piston pour créer une petite quantité de pression négative pour réduire l'égouttement des cellules dans la cavité thoracique.
- Tirer l'aiguille directement de la poitrine tout en étant sûr d'éviter inclinaison de l'aiguille lors de l'enlèvement, qui peut déchirer la paroi interne du cœur et causer des saignements.
- Appliquez une légère pression sur la poitrine sur le site d'injection pour réduire le saignement.
- Enlevez la souris de l'ogive et de continuer à appliquer une légère pression pendant environ 1 min.
- Déplacez la souris pour coussin chauffant jusqu'à ce que complètement conconsciente.
- Si la souris commence à tourner ou à se contracter après la guérison, la cause probable est une embolie. Injecter souris intraperitoneale avec 80-120 mg / kg de kétamine pour augmenter le débit sanguin et le débit cardiaque tout en diminuant la résistance vasculaire. Cela devrait aider à passer la souris le caillot. Lorsque cela se produit, il est préférable de changer les préparations cellulaires, car il indique que les cellules sont agglutination. Nous changeons de préparations de cellules après environ 8 souris, ou 30 min.
4. Intratibial
- Injecter la souris avec Buprenex (0,1 mg / kg) ou similaire analgésique approuvées immédiatement avant l'intervention.
- Anesthésier la souris en utilisant l'isoflurane, puis passer à cône de nez et maintenir une anesthésie.
- Nettoyer les deux jambes avec povidone 10% / iode tampon / solution, puis de l'éthanol, de répéter 2 fois. Jambes épiler (avec Nair ou produit similaire) avant de les nettoyer le cas échéant fourrure.
- Saisir délicatement la malléole externe, malléole interne, et la moitié inférieure du tibia avec l'index et le eUMB, puis la jambe coude (combinaison de flexion et de rotation latérale, de telle sorte que le genou est visible et accessible.
- Mouiller avec de l'EtOH 70% d'accroître la visibilité du sous-jacent ligament rotulien, qui doit être visible en tant que distinct, épaisse ligne blanche. Tout en saisissant fermement la cheville / pied d'insert souris 28g ½ aiguille sous la rotule, par l'intermédiaire du ligament rotulien, et dans la zone intercondylienne en haut antérieure du tibia.
- Lors de l'insertion d'aiguilles dans le tibia, guider attentivement à travers la plaque de croissance en utilisant une pression constante et ferme avec une légère action de forage.
- Lors de la pénétration de la plaque de croissance du tibia, l'aiguille se heurter à une résistance nettement moins.
- Utilisez un léger mouvement latéral de l'aiguille afin d'assurer l'aiguille est dans le tibia et à travers la plaque de croissance. Mouvement sera limité si l'aiguille est en place au sein du tibia.
- Enfoncez lentement le piston pour injecter 10 ul de solution cellulaire. Peu ou pas de résistance doit se faire sentir à ce point.
- Slowly extraire l'aiguille.
- Selon la même procédure, passez à l'étape suivante pour injecter 10 ul de PBS.
- Enlevez la souris de l'anesthésie et de garder le coussin chauffant jusqu'à récupéré.
- Surveiller les souris au cours de la prochaine 24 heures et injecter Buprenex supplémentaire toutes les 12 heures si les animaux continuent à montrer des signes de détresse.
5. Cours de temps d'imagerie
- Imagerie luciférase: Le cas échéant, l'imagerie luciférase devraient être utilisés à partir de 7 jours après l'inoculation cellulaire post-tumorale (bien que dans la plupart des modèles de métastases osseuses, détectables près de 14 jours). Souris est injecté par voie intrapéritonéale de 150 mg / kg luciférine, anesthésié, et imagée 8 min après l'injection à l'aide IVIS équipement 8.
- GFP imagerie: En règle générale exprimant la GFP tumeurs commencent à être détectable autour du jour 10-14 pour injections intratibial et 16-21 pour les expériences utilisant intracardiaques Maestro équipement d'imagerie (CRi) 9. En bref, les souris sont anesthésiés à l'isoflurane (3%) Et maintenu sous anesthésie à travers un cône de nez dans la chambre Maestro imagerie. Pour nos cellules exprimant eGFP nous utilisons l'ensemble filtre bleu (498 excitation/515 émission pour eGFP) à 500 ms exposition par pas de 10 nm.
- Faxitron (rayons X): les rayons X sont prises hebdomadaires de départ entre 7 à 14 jours. Les lésions sont visibles dans le modèle intracardiaque au jour 21 et une semaine plus tôt dans le intratibial injections 3. Nos données radiographiques ex vivo et in vivo ont été acquises avec un Faxitron LX-60 à 35 kV pendant 8 secondes d'exposition.
- Imagerie Autre: modalités d'imagerie sera entièrement basé sur la recherche spécifique. En plus des méthodes ci-dessus, l'imagerie des animaux vivants 3D basé sur la micro-tomographie assistée par ordinateur (μCT), tomographie par émission de micro-positons (μPET), et d'autres modalités 10,11 peuvent fournir des informations précieuses.
6. Sacrifice de la souris
- Chaque modèle dispose d'un cours à temps légèrement différent. Avec MDA-MB-2Souris 31 cellules deviennent habituellement cachectiques ou paraplégique entre 21 et 35 jours et habituellement environ 28 jours (IT injecté des souris entre 21-28 jours).
- Une fois que plusieurs souris développent des lésions qui commencent à percer l'os cortical, devenu paraplégique, ou perdre entre 10-20% du poids corporel, sacrifiez toutes les souris dans l'étude utilisant la kétamine / xylazine surdosage à la dislocation cervicale (ou autre méthode approuvée IACUC).
- Enlever les os pour poursuivre des études et de stocker dans un tampon formol à 4%.
- Souris présentant des tumeurs thoraciques sont le signe d'une injection oubliée et devraient être exclus de l'étude.
7. Analyse ex vivo
- μCT: balayage dans EtOH 70% permet de paramètres structurels et histologique à mesurer sur l'échantillon un même os.
- Contour et analyser en fonction de la conception expérimentale individuelle et de l'équipement disponible 10. Nos données ont été obtenues avec un μCT Scanco 40 en utilisant une résolution de 12 uM.
- Histomorphometry: spécimens de processus utilisant les méthodes préférées histologiques et colorer avec hématoxyline / éosine 7
8. Les résultats représentatifs
Après inoculation intracardiaque ou intratibial des cellules tumorales (figure 1) souris sont suivis chaque semaine par la radiographie et la fluorescence (ou luminescence). Les lésions se manifestent normalement par x-ray entre la semaine 2 et 3, alors qu'elles peuvent être visibles par fluorescence et la luminescence dès la semaine 2, selon le modèle (Figure 2). Les lésions sont visibles comme des trous noirs dans l'os, et s'accentuer avec le temps (figure 3). Les lésions ont été quantifiées en utilisant une analyse Metamorph des radiographies et la fluorescence a été quantifiée avec une carte Maestro (CRi) d'imagerie logiciel d'acquisition et d'analyse. Comme les lésions commencent à se développer, les souris deviennent souvent cachectiques. Le sacrifice est nécessaire lorsque les souris ont perdu entre 10-20% de leur poids initial. L'état de l' souris peuvent changer rapidement et doivent être surveillés à plusieurs reprises pendant la journée. Entre 3-4 semaines souris ont commencé à faire glisser un ou les deux membres postérieurs et toute l'étude a été sacrifié. Les images ont été prises avant le sacrifice. Après une surdose d'anesthésie, le sang a été recueilli pour mesurer les marqueurs du remodelage osseux ou d'autres facteurs. Après la dislocation cervicale, la peau a été retirée de la souris et en os excisés et nettoyé pour l'imagerie ex vivo (figure 3) qui permettra la visualisation des foyers tumoraux au moins 7 jours plus tôt que dans les techniques d'imagerie in vivo. Une fois que l'imagerie des os a été dûment remplis ont été placés dans des cassettes étiquetés et entreposés dans du formol pour la fixation et le traitement ultérieur histologique ou l'analyse μCT. Histomorphométrie a été effectuée sur les échantillons pour indiquer la charge tumorale et BV / TV après μCT a été réalisée sur un tibia de quantifier l'ampleur de la destruction osseuse (figure 4).
/ 4260/4260fig1.jpg "/>
Figure 1. Mise en place correcte de l'injection. Ventrale vue radiographique (A) du thorax de la souris adulte montrant un placement correct de l'aiguille dans l'espace intercostal et 4 ème dans le ventricule gauche pour l'inoculation intracardiaque. Les repères anatomiques sont représentés avec des lignes horizontales en pointillés sur le sternum (contour blanc). Sur la peau de la souris la fourchette sternale et le processus xiphoïde servir de points de repère, et l'aiguille est insérée légèrement à gauche du sternum. Vue radiographique ventrale (B) de la jambe de la souris adulte présentant un placement correct de l'aiguille dans le tibia proximal, alignées entre les condyles. Du point de vue latéral de la pointe de l'aiguille est placé derrière la tubérosité tibiale et profonde à la plaque épiphysaire. Situation idéale pour injection est représenté par un cercle blanc.

Figure 2. Évolution dans le temps des modèles de métastases osseuses. Progression du CAmaladie osseuse induite par ncer montré avec les rayons X et la GFP + images de fluorescence des tumeurs in vivo à partir intratibial injections (A) et intracardiaque injections (B).
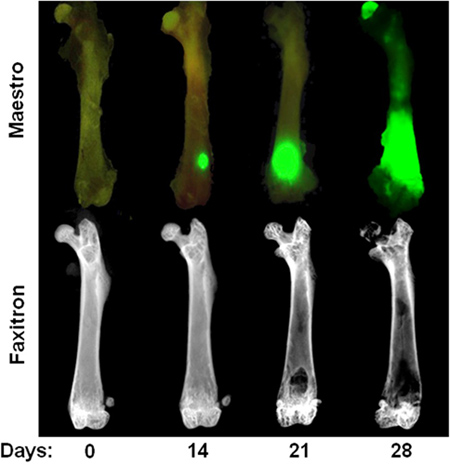
Figure 3. Évolution dans le temps des intracardiaque MDA-MB-231 modèle Rangée du haut:. L'image ex vivo montrant fluorescence de la GFP au jour 0, 14, 21, et 28 jours après l'injection intracardiaque de cellules MDA-MB-231. Notez que foyers tumoraux à 14 jours ne sont visibles qu'en ex vivo après le retrait des tissus mous. Rangée du bas: les images radiographiques ex vivo des fémurs mêmes illustrant des lésions osseuses ostéolytiques. Notez que la destruction osseuse n'est généralement pas visible jusqu'à 3 semaines après l'injection cardiaque.
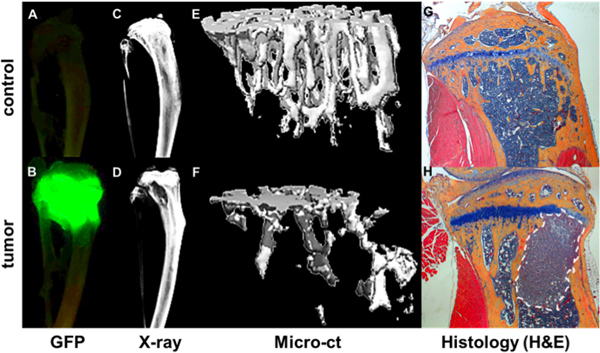
Figure 4. Quantification de l'os progression. Métastatique GFP + tumeur visualisée par imagerie ex vivo Maestro de tibiae de souris portant pas de tumeur (A) et une souris 4 semaines après l'injection intracardiaque d'une GFP exprimant MDA-MB-231 clone (B). Foyers tumoraux en corrélation avec les zones de destruction osseuse, comme indiqué par Faxitron (D) par rapport un os sans tumeur (C). Les données de structure osseuse et minéral à partir des mesures microCT est rendu sous la forme d'images en 3D d'un os sain (e) et un palier tumeur osseuse (F), où les zones de destruction osseuse sont présentés comme zone de vide. De plus amples informations os et tumeur est vu en H & E correspondant coupes histologiques colorées (G et H).
Discussion
Les études sur les maladies osseuses d'origine tumorale s'appuyer sur plusieurs modèles animaux dont les deux les plus couramment utilisés sont les inoculations intracardiaques et intratibial. Dans de nombreux cas intracardiaque est la meilleure option pour l'étude des métastases osseuses, mais il ne représente pas l'ensemble du processus métastatique, et donc du coussinet adipeux mammaire ou autres injections orthotopiques devraient idéalement être utilisés à cette fin. Les cellules tumorales...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs remercient les sources de financement suivantes: P01CA040035 (FE / JAS) et VA Prix le développement de carrière (JAS).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| MDA-MB-231 cellules humaines de cancer du sein | A l'origine ATCC-cloné interne et sélectionné | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040 CV- | |
| FBS | Atlas biologique | F-0050A | |
| Trypsine | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Maestro | CRi | ||
| μCT scanner | Scanco | ||
| Des souris nues athymiques | Harlan | Fox nu - / - | |
| Seringues à insuline (300 ul, 28,5 g) | Becton Dickinson | 309300 | |
| IVIS | Pied à coulisse | ||
| Diet rongeurs irradié | Teklad | 2920x |
Références
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. . Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon