Method Article
的视觉检测,以监测T6SS介导的细菌竞争
摘要
我们描述了定性检测,监测细菌介导的竞争铜绿假单胞菌类型的VI分泌系统(T6SS)的。分析依赖的生存/杀死大肠杆菌靶细胞背着 lacZ的记者。这种技术是可调的,以评估杀菌/抑菌活性精通T6SS的微生物。
摘要
Ⅵ型分泌的系统(T6SSs)是分子纳米机器允许革兰阴性菌,运输和注入的蛋白质,用于广泛的各种靶细胞1,2。该T6SS是组成13核心部件,并显示与尾管的噬菌体3的结构上的相似之处。噬菌体使用的球管和删余的移动设备以穿透的目标细菌细胞信封并注入DNA。它提出,T6SS创建一个特定的路径中的细菌细胞信封驱动效应器和毒素的表面是一个倒置的噬菌体的移动设备。这一过程可以采取进一步的T6SS装置可以穿孔与其他细胞的细菌接触,从而注入到这些目标的效应。尾管和穿刺装置部分的T6SS作出与赛和VgrG蛋白中,分别为4,5。
通过s已被证明的多功能性的T6SS各种细菌病原体tudies使用。的的霍乱弧菌 T6SS可以重塑真核宿主细胞骨架的注入“进化”VgrG的一个C-末端的肌动蛋白交联域6,7。另一个明显的例子是最近使用绿脓杆菌能够瞄准并杀死细菌在一个T6SS依赖性,从 而推动建立细菌微生物在特定的细分市场,有竞争力的环境8,9,10记录。
在后者的情况下,三个T6SS分泌蛋白,即TSE1,TSE2及TSE3,已被确定为在目标细菌( 图1)喷射的毒素。的供体细胞是从这些效应的有害影响的保护,通过抗毒素机制,介导由Tsi1 Tsi2和Tsi3免疫蛋白8,9,10。这种抗菌活性可以被监控当T6SS,精通细菌的共培养在S固体表面,在与其他细菌物种或与T6SS惰性细菌属同一物种的8,11,12,13的竞争。
现有的数据强调了数值方法的细菌竞争法,包括费时CFU计数,它在很大程度上依赖于抗生素制造商。在的情况下的抗生素的耐药菌株,如P.铜绿假单胞菌 ,这些方法可以是不合适的。此外,约200种不同的超过100个细菌基因组的14 T6SS位点的识别,方便的筛选工具,是非常可取的。我们开发了一种检测是容易使用的,并要求标准实验室材料和试剂。该方法提供了一种快速和定性的技术来监测T6SS依赖性杀菌/抑菌活性通过使用记者菌株作为食饵(在这种情况下, 大肠杆菌 DH5α)允许一个互补的 lacZ基因。总体而言,此方法的grap嗝的T6SS相关的表型琼脂平板上,并允许快速识别。这个试验性的协议可适于考虑到特定的条件,例如生长培养基,温度或时间的接触的其他菌株或细菌物种。
研究方案
1。细菌菌株和文化
- 工程师变换(使用标准的氯化钙处理或电)15 E.大肠杆菌受体细胞(猎物,P)与允许的 lacZ基因( 表1)中的a-互补的质粒的大肠杆菌 DH5α细胞。板的Luria-Bertani琼脂平板上的转化细胞(LBA,1.5%琼脂),含有5 - 溴-4 - 氯 - 吲哚基-β-D-吡喃半乳糖苷(X-gal的),在40毫克/毫升的最终浓度和合适的抗生素。孵育在37°C过夜,第二天早上选择蓝色的转化(见第1.3节)。
- 成长的铜绿假单胞菌 ,T6SS活性的供体细胞(D +)或T6SS的惰性(D-),(表1)上的LBA过夜,在37℃下在给出的例子在这里我们使用的是P.铜绿假单胞菌可再生能源技术的应变拥有一个组成活性H1-T6SS 16和一个等位基因突变的的H1-T6SS的基因簇( 表1)的删除。
- 第二天,准备通宵充气烧瓶液体培养接种明亮的蓝色克隆之间的E. §1.1中描述的大肠杆菌转化体(P),从板,在5毫升的胰蛋白酶大豆肉汤(TSB)辅以适当的抗生素。在搅拌下成长,在37°C。 §1.2中描述的从板的单菌落(D +)和(D - ),继续进行同样。
2。竞争法
- LBA板准备第二天的实验。确保这些板块干燥(附近的本生灯,或在层流柜)。准备一个“检测输入”板(A输入)的菌株(D +),(D - ),和(P )。准备“法输出”(A-输出)的菌株板(D - + P)和(D + + P)。划分和标记板。
- 过夜后生长(见第1.3节),测量输入细菌培养(D - ,D +和P)的光密度(OD 600nm的),并计算所需要的体积,得到细胞密度相当于1个单位的每个菌株OD 600nm为。每个“输入”细胞培养物(D - ,D +和P)的最初收集在一个无菌1.5毫升Eppendorf管中。
- 以13,000 rpm离心细菌样品在室温下的1分钟期间,并弃去上清液。
- 重悬的粒料的 D - ,(D)+,和 P的文化,在100μl新鲜TSB通过轻轻移液接种10毫升的各对应作为一个单一的点上的“A-输入”板(§2.1)中制备的相应的应变。
- 接种“A-输出板(§2.1编制)。更精确地,轻轻混匀,30微升(D +)与30微升(P)和30微升的(D - )用30毫升(P)的两个单独的Eppendorf管中(注意,所使用的培养是在§2.4中描述的那些) 。接种20μl的混合物(D)+(/ P)和(D - / P),“输出”的板作为单独的点上。允许斑点附近的一个本生灯干燥并放置一段适当的时间,在此期间,杀死细菌正在发生的板在37℃的培养箱中。在的情况下的 P 铜绿假单胞菌 ,有效的杀死细菌培养5小时后观察比较T6SS积极与T6SS缺陷株。
3。定性观察的t他杀死细菌
- 准备的LBA板含有40微克/毫升X-gal的用于读出的测定。板将被称为“读数输入”或“R-输入”发现分离出的细菌或“读出输出”或“R-输出”发现混合细菌培养,这样读出的查杀性能。这些板块也需要得到适当的干燥。除以板在它的后面的四个相等的部分,这些部件和注释0,10 -1,10 -2,10 -3,指定的细菌培养物的稀释液的琼脂平板上发现(见第3.3节)。的稀释将允许在同一个地方的蓝/白菌比半定量评价。
- 收集的无菌环的单个细菌斑点从“A-输入板(见§2.4)和”输出“板(见§2.5),重悬在不同的1.5 mL的Eppendorf管中含有1毫升TSB每个点。将在30分钟到离心振动筛块重悬有效地细菌。
- 准备了一系列的5倍的3个Eppendorf管含900微升TSB的,每个重悬点至10倍系列稀释到10 -3继续进行。请一定要更换吸头和涡5秒之间每个稀释步骤。
- 继续LBA板干燥最摊薄未稀释的悬浮液中含40μg/ ml的X-gal的准备§3.3细菌稀释,使得这些“R-输入”车牌为“A检举输入点“的”R-输出“为”A-输出点“( 图2)的板。涡简要每个管中,然后再进行检举保持均匀的菌悬液。的可重复性的结果,在一个象限中的点20μl,以一式三份( 图2)。你的盘子的相对干燥,在这个阶段是很重要的,因为点需要保持单独分离板,而不是向对方滑行。
的竞争测定甲量化也可以在此阶段的实验。之后的步骤3.3中,100微升稀释10 -3 LBA板含有40微克/毫升X-gal的传播。对于重复性的结果,从“A-输出”板电镀一式三份的每一个点。将稀释板中,在37℃培养箱中培养过夜(相应于孵育16小时)。继续的蓝色菌落计数(P细胞仍然活着)。典型的竞争5小时后,得到的结果如图3所示。 - 发布的无菌区域内板开(无盖),以允许过量的液体的吸收,各点内。
- 板放置在37℃培养箱中过夜。在此温育时间,杀害仍然发生在混合(D + / P)的时间这两个菌株仍处于接触。
- 拍摄一张照片或扫描您的输出分析的板( 图2)。点仍然在很大程度上蓝色表明,E.菌没有被杀死的P.铜绿假单胞菌 。这是E.大肠杆菌混合与T6SS缺陷P.铜绿假单胞菌菌株(D-)(图2中 ,板在右下角)。
结果
典型结果示于图1,表1中描述的菌株和试剂。在该图中所示的板的被扫描后,孵育过夜。 “读数输入”板示出了在该测定中使用的菌株的连续稀释图案。正如预期的那样, 大肠杆菌大肠杆菌猎物点(P)过度表达的 lacZ基因,用X-gal培养基上出现蓝色的,而捐助者P.铜绿假单胞菌菌株(D +,T6SS有源)和(D - ,T6SS无效)保持白色。 “读出输出板之间的搭配的猎物和T6SS积极应变(D / P)已被发现,显示的蓝色消失的猎物,从而表明它已被杀害。这表明捐助,outcompete的猎物的能力。持久性的蓝色的(D - / P)板演示,一个无效T6SS供体不能杀蓝色的猎物。
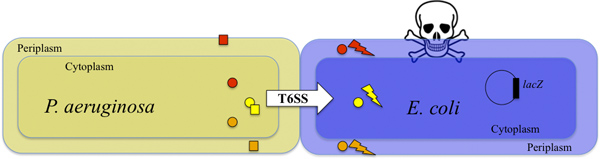
图1。杀害E.大肠杆菌的T6SS精通P.铜绿假单胞菌。P. 铜绿假单胞菌注射到E.毒素大肠杆菌在T6SS依赖性靶细胞(白色箭头所示)。两种毒素TSE1和TSE3(橙色和红色圆圈)被注入到E.大肠杆菌周质和降解肽聚糖9。 (黄圈)TSE2毒素注射到E.大肠杆菌细胞质,并有抑菌活性8,10。共同作用的毒素杀死目标细胞(闪光的闪电和头骨)。可以通过监测所产生的β-半乳糖苷酶的活性(也可参见图2)检测到的靶细胞的生存。P.一eruginosa是受保护的的免疫力的蛋白质Tsi1,Tsi2和Tsi3(橙色,黄色和红色的正方形),分别8,9,10拮抗活性的毒素。
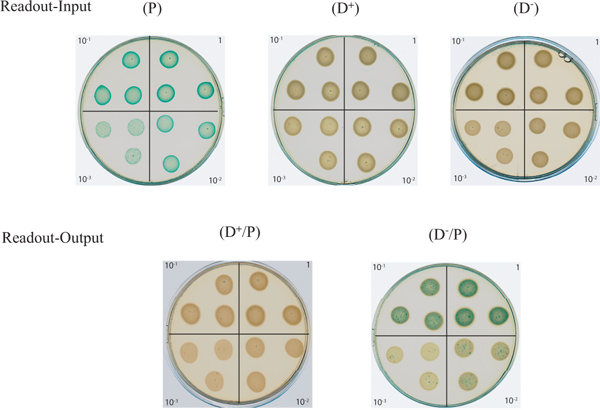
图2。琼脂平板测定监视T6SS依赖杀死细菌,在该图中所示的上半部分的“读出输入”板组成的系列稀释的 D - ,D +和 P输入单元格。 P输入细胞是蓝色由于到α-互补的 lacZ基因,并由此产生了β-半乳糖苷酶酶切的X-gal。中下部所示的“读出输出”的板组成的系列稀释的细菌混合之间的活性(D + / P) 或无效(D - / P),T6SS捐助P.铜绿假单胞菌菌株与E.大肠杆菌的猎物。 点击此处查看大图 。
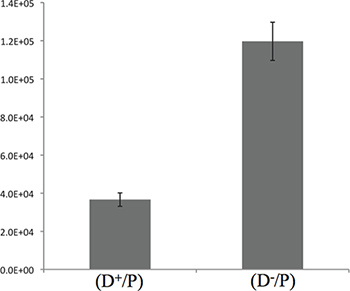
图3。 E.杀害的量化大肠杆菌的P.铜绿假单胞菌 5小时后孵化。图介绍了CFU计数E.大肠杆菌中描述的步骤3.4。这里给出的结果显示的T6SS +和该T6SS菌株的3倍的差异,这表明大部分的杀灭发生在最初的5个小时的接触。
讨论
在这篇文章中介绍的方法,可以用肉眼观察的T6SS介导的杀菌/抑菌活性。的琼脂板的表面上进行测定。先前已表明,T6SS依赖杀灭试验进行混合细菌液体培养的效率不高,可能是因为缺乏稳定的两种细菌之间的联系8。相信该T6SS是一种机制类似于使用噬菌体注入DNA导入靶细胞的17中的一项操作。在液体培养中,管样结构的T6SS可能更容易地打破,细菌间的接触可以被丢失,和毒素不能有效地传递。
孵育时间,最初5个小时的接触,我们描述的供体菌和猎物之间有足够的观察杀死细菌之间P.绿脓杆菌和大肠杆菌大肠杆菌 ,如在图3中示出。然而,这是可取的调整通过执行中的动力学为了优化的实验条件下的培养时间。
由于这种方法是基于色彩技术,输出的结果可能会受到影响的供体菌的色素沉着。例如,在的情况下的 P 铜绿假单胞菌 ,某些菌株产生高水平的着色颜料,如绿脓素和pyoverdine,这可能会干扰化验读数,使得从猎物的区别相对困难。其他的显色的β-半乳糖苷酶的底物,如-半乳糖苷酶的品红或红色-半乳糖苷酶,可用于代替的X-gal的( 表1)。
竞争法可以利用的其他报告基因的读出。例如,也进行了类似的试验,使用绿色荧光蛋白标记的猎物12。
我们的分析,而不能定量,提供了一个很好的指示的T6SS活动,因为它是基于生存或杀害记者的猎物。该技术存在的优点是容易和方便地评价从任何细菌物种的杀菌/抑菌活性T6SSs。到目前为止,的T6SS活性已经显示出对革兰氏阴性菌和革兰氏阳性细菌的T6SS敏感没有明确的例子已报道12。这是交不亲和的文化,以测试不同的细菌种类也很明显, 如生长温度,氧,特定的媒体是要考虑的。
我们的分析也可用于评估的T6SS组件是绝对必要的,因为即使痕迹的分泌毒素足以杀死的猎物。即使是活动能力弱的T6SS就可以清楚地检测到我们的试验相比,标准的程序测试T6SS依赖分泌培养上清液和免疫印迹分析。然而,仍然需要一个适当的集落形成单位(CFU)计数准确定量本T6SS活动。
披露声明
我们什么都没有透露。
致谢
这项工作是由威康信托基金会资助WT091939MA。阿兰·Filloux是由英国皇家学会的支持。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂/材料名称 | 公司 | 目录编号 | 评论 |
| 铜绿假单胞菌 PAKΔ 可再生能源技术 (D +) (积极T6SS) | 实验室菌株 | 文献16中描述的 | |
| 铜绿假单胞菌 PAKΔ 可再生能源技术ΔH1-T6SS(D - )(未激活T6SS) | 本研究 | 文献18中描述的步骤后,通过等位基因交换的的H1-T6SS群集(包围基因PA0070 PA0095)已被删除。与下面的一组引物为:向上片段的引物产生的mutator片段: 5'-ATGGTCAACGACATGGAGCTGGAG-3',和 5'CGAGGCCGATCAGGCCTTCAGAACTGA-3'。向下片段引物: 5'-TCAGGCCTTCAGAACTGAAGCGGCGCA-3', 5'-GGTGGCGTTCAACAGTTCCATGTC-3' | |
| 大肠杆菌 DH5α | Invitrogen公司 | 18258-012 | F-φ80, 紫胶 ZΔM15Δ( 拉丁美洲和加勒比ZYA-ARG F)U169 REC A1 年底 A1 HSD R17(R K - M K +)PHO一个支持 E44λ 氏 -1 GYR A96 相对 A1 |
| 的pBluescript II SK(+) | 安捷伦 | 212205 | 该载体表达的α肽的β-半乳糖苷酶的用于α-互补。 |
| X-gal的 | Invitrogen公司 | 15520-018 | 在40微克/毫升 |
| 卢里亚Bertani琼脂 | 默克化学品 | 1.10283.0500 | |
| 酪蛋白大豆肉汤(TSB) | Oxoid公司 | CM109 | |
| 涡流振动筛天才3 | IKA | 3340000 | |
| 扫描器 | 爱普生 | V700 | |
| 分光光度计 | WPA Biowave | CO8000密度计 | |
| 洋红色 - 半乳糖苷酶 | Bioworld | 30350001-1(715241) | |
| 红加仑 | 研究有机物 | 1364C | |
表1菌株,质粒,材料和使用的试剂。 |
参考文献
- Filloux, A., et al. The bacterial type VI secretion machine: yet another player for protein transport across membranes. Microbiology. 154 (6), 1570 (2008).
- Cascales, E., Cambillau, C. Structural biology of type VI secretion systems. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 367 (1592), 1102 (2012).
- Leiman, P. G., et al. Morphogenesis of the T4 tail and tail fibers. Virol. J. 7, 355 (2010).
- Ballister, E. R., et al. In vitro self-assembly of tailorable nanotubes from a simple protein building block. Proc. Natl. Acad. Sci. U.S.A. 105 (10), 3733 (2008).
- Leiman, P. G., et al. Type VI secretion apparatus and phage tail-associated protein complexes share a common evolutionary origin. Proc. Natl. Acad. Sci. U.S.A. 106 (11), 4154 (2009).
- Pukatzki, S., et al. Type VI secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin. Proc. Natl. Acad. Sci. U.S.A. 104 (39), 15508 (2007).
- Ma, A. T., et al. Translocation of a Vibrio cholerae type VI secretion effector requires bacterial endocytosis by host cells. Cell Host Microbe. 5 (3), 234 (2009).
- Hood, R. D., et al. A type VI secretion system of Pseudomonas aeruginosa targets a toxin to bacteria. Cell Host Microbe. 7 (1), 25 (2010).
- Russell, A. B., et al. Type VI secretion delivers bacteriolytic effectors to target cells. Nature. 475 (7356), 343 (2011).
- Li, M., et al. Structural basis for type VI secretion effector recognition by a cognate immunity protein. PLoS Pathog. 8 (4), e1002613 (2012).
- Zheng, J., et al. Genetic analysis of anti-amoebae and anti-bacterial activities of the type VI secretion system in Vibrio cholerae. PLoS One. 6 (8), (2011).
- Schwarz, S., et al. Burkholderia type VI secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathog. 6 (8), e23876 (2010).
- Murdoch, S. L., et al. The opportunistic pathogen Serratia marcescens utilizes type VI secretion to target bacterial competitors. J. Bacteriol. 193 (21), 6057 (2011).
- Boyer, F., et al. Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?. BMC Genomics. 10, 104 (2009).
- Maniatis, T., et al. . Molecular cloning: A Laboratory Manual. , (1982).
- Mougous, J. D., et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science. 312 (5779), 1526 (2006).
- Records, A. R., et al. The type VI secretion system: a multipurpose delivery system with a phage-like machinery. Mol. Plant Microbe Interact. 24 (7), 751 (2011).
- Hachani, A., et al. Type VI secretion system in Pseudomonas aeruginosa: secretion and multimerization of VgrG proteins. J. Biol. Chem. 286 (14), 12317 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。