Method Article
Un ensayo visual para monitorear T6SS mediada por la competencia bacteriana
En este artículo
Resumen
Se describe un ensayo cualitativo para supervisar la competencia bacteriana mediada por el Pseudomonas aeruginosa Tipo VI secreción del sistema (T6SS). El ensayo se basa en la supervivencia / muerte de células de Escherichia coli que llevan un objetivo LacZ-Reportero. Esta técnica es ajustable para evaluar la actividad bactericida / bacteriostasis de T6SS que dominan los microorganismos.
Resumen
Sistemas de secreción de tipo VI (T6SSs) son nanomáquinas moleculares que permiten bacterias Gram-negativas para transportar e inyectar proteínas en una amplia variedad de células diana 1,2. El T6SS está integrado por 13 componentes principales y muestra similitudes estructurales con el tubo de cola de bacteriófagos 3. El fago se utiliza un tubo y un dispositivo de punción para penetrar la envoltura celular de las bacterias diana e inyectar ADN. Se propone que la T6SS es un dispositivo de bacteriófago invertida crear una ruta específica en la envoltura celular bacteriana para conducir efectores y toxinas a la superficie. El proceso podría continuarse y el dispositivo T6SS podría perforar otras células con la que la bacteria está en contacto, con lo que la inyección de los efectores en estos objetivos. El tubo de cola y partes de punción del dispositivo de las T6SS se hacen con Hcp y proteínas VgrG, respectivamente, 4,5.
La versatilidad de la T6SS se ha demostrado a través de sos estudios con diversos patógenos bacterianos. Los T6SS Vibrio cholerae puede remodelar el citoesqueleto de las células huésped eucariotas mediante la inyección de un "evolucionado" VgrG llevando una actina C-terminal de dominio de reticulación 6,7. Otro ejemplo notable se documentó recientemente usando Pseudomonas aeruginosa, que es capaz de atacar y matar a las bacterias de una manera T6SS-dependiente, por lo tanto, promover el establecimiento de bacterias en nichos microbianos específicos y el entorno competitivo 8,9,10.
En este último caso, tres T6SS proteínas secretadas, a saber Tse1, Tse2 y TSE3 han sido identificados como las toxinas inyectadas en las bacterias diana (Figura 1). La célula donante está protegida de los efectos perjudiciales de estos efectores a través de un mecanismo de anti-toxina, mediada por las proteínas de la inmunidad Tsi1, Tsi2 y Tsi3 8,9,10. Esta actividad antimicrobiana se puede controlar cuando T6SS que dominan las bacterias son co-cultivadas en sOlid superficies en competencia con otras especies bacterianas o con T6SS-inactivos bacterias de la misma especie 8,11,12,13.
Los datos disponibles hincapié en un método numérico para el ensayo de competición bacteriana, incluyendo el conteo de CFU mucho tiempo y que depende en gran medida de los fabricantes de antibióticos. En el caso de cepas resistentes a antibióticos tales como P. aeruginosa, estos métodos pueden ser inapropiado. Además, con la identificación de unos 200 loci diferentes T6SS en más de 100 genomas de bacterias 14, una herramienta de cribado conveniente es altamente deseable. Hemos desarrollado un ensayo que es fácil de utilizar y necesita material de laboratorio estándar y los reactivos. El método ofrece una técnica rápida y cualitativa para monitorizar la actividad bactericida dependiente de T6SS / bacteriostasis mediante el uso de una cepa reportero como una presa (en este caso Escherichia coli DH5a) permitiendo una complementación del gen lacZ. En general, este método es grapHIC y permite la identificación rápida de T6SS fenotipos relacionados sobre placas de agar. Este protocolo experimental se puede adaptar a otras cepas o especies bacterianas, teniendo en cuenta las condiciones específicas, tales como medios de crecimiento, la temperatura o el tiempo de contacto.
Protocolo
1. Cepas bacterianas y Culturas
- Un ingeniero de Escherichia coli célula receptora (Prey, P) mediante la transformación (utilizando el estándar de CaCl2 tratamiento o electroporación) 15 E. coli DH5a células con un plásmido que permite la complementación de una-el gen lacZ (Tabla 1). Placa de las células transformadas en placas de agar Luria-Bertani (LBA, 1,5% de agar) que contenía 5-bromo-4-cloro-indolil-β-D-galactopiranósido (X-gal) a 40 mg / ml de concentración final y adecuada de antibióticos. Incubar a 37 ° C durante la noche y la mañana siguiente seleccionar los transformantes azules (véase § 1,3).
- Cultivar las células de Pseudomonas aeruginosa que son donantes T6SS-activo (D +) o inactivo T6SS-(D-) (Tabla 1) durante la noche en LBA a 37 ° C. En el ejemplo presentado aquí se utilizó una P. RETS aeruginosa cepa que poseeun H1-T6SS constitutivamente activa 16 y un mutante isogénica con una deleción del grupo de genes H1-T6SS (Tabla 1).
- El día siguiente, preparar un cultivo líquido durante la noche en un matraz de aireado por inoculación de un clon azul brillante entre la E. transformantes coli (P) de la placa descrita en § 1,1, en 5 ml de caldo de soja tríptico (TSB) suplementado con el antibiótico apropiado. Crecer con agitación a 37 ° C. Proceder igualmente con una única colonia de (D +) y de (D -) de la placa descrita en § 1,2.
2. Concurso de Ensayo
- Preparar placas de LBA para el experimento al día siguiente. Asegúrese de que estas placas se secan adecuadamente (ya sea cerca del quemador Bunsen o en el gabinete de flujo laminar). Preparar un "Ensayo de entrada" (A-Input) placa para las cepas (D +), (D -), y (P ). Preparar un "Ensayo de salida" (A-salida) placa para las cepas (D - + P) y (D + + P). Dividir y marcar las placas en consecuencia.
- Después de una noche de crecimiento (véase el § 1,3), medir la densidad óptica (OD 600 nm) del cultivo bacteriano de entrada (D -, D + y P) y calcular el volumen necesario para obtener una densidad equivalente a 1 unidad celular OD 600 nm de cada cepa . Cada "entrada" de cultivo celular (D -, D + y P) inicialmente se recoge en un tubos estériles Eppendorf de 1,5 ml.
- Centrifugar las muestras de bacterias a 13.000 rpm durante 1 min a temperatura ambiente y descartar el sobrenadante.
- Resuspender los pellets de la D -, D + culturas, y P, en 100 l de TSB fresco por pipeteo suave y inocular 10 ml de cada correspondiente presión de un solo punto en el "A-entrada" placa (preparado en el § 2.1).
- Inocular el "A-output" placa (preparado en el § 2.1). Más precisamente, mezclar suavemente 30 l de (D +) con 30 l (P) y 30 l de (D -) con 30 ml (P) separados en dos tubos Eppendorf (nota que los cultivos utilizados son los descritos en § 2,4) . Inocular 20 l de las mezclas (D + / P) y (D - / P) como puntos individuales en la "A-salida" placa. Deje secar las proximidades de un mechero de Bunsen y coloque la placa en una incubadora a 37 ° C durante un período adecuado de tiempo durante el cual la destrucción bacteriana está teniendo lugar. En el caso de P. aeruginosa, una eficiente destrucción bacteriana se observa después de 5 horas de incubación cuando se compara una T6SS activos con una cepa deficiente T6SS.
3. Observación cualitativa de tél Killing bacteriana
- Preparar placas de LBA que contenían 40 ug / ml de X-gal para la lectura del ensayo. Las placas se llamará "Lectura de entrada" o "R-entrada" para detectar bacterias aisladas o "Salida de Lectura" o "R-salida" para detectar cultivos mixtos de bacterias y por lo tanto leer el desempeño matando. Estas placas también deben ser bien seca. Divida el plato en cuatro partes iguales en la espalda y anotar estas partes 0, 10 -1, 10 -2 y -3 10, la designación de las diluciones del cultivo bacteriano de detectar en las placas de agar (véase § 3.3). La dilución permitirá una evaluación semi-cuantitativa de la relación azul / blanco de las bacterias en el mismo lugar.
- Recoger con un asa estéril las manchas bacterianas individuales de la "A input-" la placa (ver § 2.4) y "A-output" placa (ver § 2.5) y resuspender cada lugar en distintos tubos Eppendorf de 1,5 ml que contienen 1 ml de TSB. Coloque en un bloque de Eppendorf agitador durante 30 minutos para volver a suspender de manera eficiente elbacterias.
- Preparar una serie de 5 veces 3 tubos Eppendorf que contiene 900 l de TSB y seguir por cada punto resuspendido a diez veces diluciones seriadas hasta 10 -3. Asegúrese de cambiar las puntas de pipeta y vórtice 5 segundos entre cada paso de dilución.
- Proceder a la localización de sus diluciones bacterianas preparadas en el § 3,3 en bien secos placas de LBA que contenían 40 ug / ml de X-gal por empezando por la más diluida a la suspensión diluida, por lo que estos la "entrada de R-" placas para el "A de insumos y los "puntos de salida" R "para las" placas de salida A-"puntos (Figura 2). Vórtice brevemente cada tubo antes de proceder a la localización para mantener una suspensión bacteriana homogénea. Para la reproducibilidad de los resultados, punto 20 l en triplicado dentro de un cuadrante (Figura 2). La sequedad relativa de la placa es importante en esta etapa ya que las manchas deben permanecer separados individualmente en el plato y no se deslizan el uno hacia el otro.
Una cuantificación del ensayo de competición también es posible en esta fase del experimento. Tras la etapa de 3,3, se extendió 100 l de la dilución 10 -3 en placas de LBA que contenían 40 ug / ml de X-gal. Para la reproducibilidad de los resultados, proceder a un recubrimiento por triplicado para cada punto de la "A-output" plato. Colocar las placas de dilución en una incubadora ° C durante la noche (correspondiente a 16 horas de incubación) 37. Proceder al recuento de las colonias azules (las células que quedaban vivos P). Los resultados típicos obtenidos después de 5 horas de competencia se muestran en la Figura 3. - Dejar la placa abierta (sin tapa) dentro de una zona estéril para permitir la absorción del líquido en exceso dentro de cada mancha.
- Colocar la placa en una incubadora a 37 ° C durante la noche. Durante este tiempo de incubación, la matanza todavía se producen en la mezcla (D + / P) puesto que ambas cepas están todavía en contacto.
- Tome una fotografíao escanear sus placas para el análisis de la producción (Figura 2). Cuando las manchas permanecen en gran parte azul indica que E. coli no ha sido asesinado por P. aeruginosa. Este es el caso cuando E. coli se mezcla con un p-T6SS defectuoso Aeruginosa cepa (D-) (figura 2, la placa en la parte inferior derecha).
Resultados
Los resultados típicos se muestran en la Figura 1 con las cepas y reactivos descritos en la Tabla 1. Las placas que se muestran en esta figura se escanea después de una incubación durante la noche. La "entrada" Lectura-placas muestran un patrón de dilución en serie para las cepas utilizadas en este ensayo. Como era de esperar, la E. coli presa puntos (P) que sobreexpresan el gen lacZ aparecen azules en medios suplementados con X-gal, mientras que el P. donante aeruginosa cepas (D +, T6SS activo) y (D -, T6SS inactivo) sigue siendo blanco. Los "resultados" Lectura-placas en que se haya la mezcla entre la presa y una cepa T6SS activo (D + / P) ¿Ha encontrado demostrar la desaparición de la presa azul indicando así que ha sido asesinado. Esto demuestra la capacidad del donante para competir directamente con la presa. La persistencia del color azul en la (D - / P) Placa demuestra la incapacidad de un donante T6SS inactivo para matar a la presa azul.
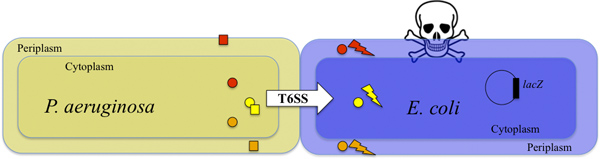
Figura 1. Asesinato de E. coli por T6SS-competente P. aeruginosa. P. aeruginosa inyecta toxinas en la E. coli células diana de una manera dependiente de T6SS (mostrada por la flecha blanca). Dos toxinas Tse1 y TSE3 (naranja y círculos rojos) se inyectan en la E. coli periplasma y degradar el peptidoglicano 9. La toxina Tse2 (círculo amarillo) se inyecta en la E. coli citoplasma y tiene una actividad bacteriostática 8,10. La acción combinada de las toxinas mata a las células diana (relámpago y el cráneo). La supervivencia de las células diana puede ser detectada mediante la supervisión de la actividad de la β-galactosidasa producida (véase también la Figura 2). P. uneruginosa está protegido contra la actividad de las toxinas por las proteínas de la inmunidad Tsi1, Tsi2 y Tsi3 (naranja, cuadrados amarillo y rojo, respectivamente) 8,9,10.
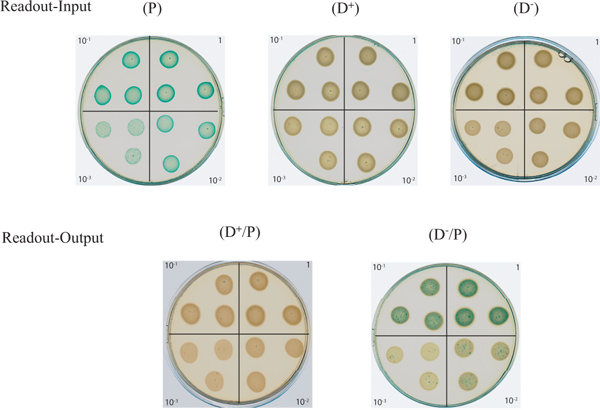
Figura 2. Ensayo en placa de agar para supervisar T6SS dependiente de muerte bacteriana En esta figura se muestran en la parte superior de la "entrada" Lectura-planchas compuestas de las diluciones en serie de la D -., D +, y células de entrada P. Las celdas de entrada P son de color azul debido a la α-complementación del gen lacZ y por lo tanto produce β-galactosidasa que escinde X-gal. En la parte inferior se muestra la "salida" Lectura-cajas placas de diluciones en serie de la mezcla bacteriana entre un activo (D + / P) , o una forma inactiva (D - / P), T6SS donante P. aeruginosa cepa con la E. coli presa. Haga clic aquí para ampliar la cifra .
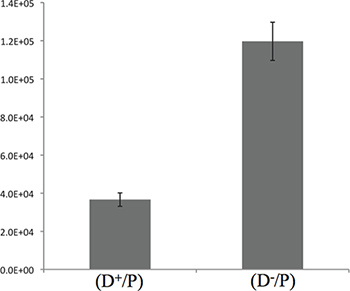
Figura 3. La cuantificación de la muerte de E. coli por P. aeruginosa después de 5 horas de incubación. El gráfico presenta el recuento de CFU de E. coli se describe en el paso 3,4. Los resultados aquí presentados muestran una diferencia de 3 veces entre el T6SS + y las cepas T6SS-, lo que sugiere que la mayoría de la matanza se lleva a cabo durante las 5 horas iniciales de contacto.
Discusión
El método presentado en este artículo permite la observación visual de T6SS actividad bactericida mediada / bacteriostasis. El ensayo se realiza en la superficie de una placa de agar. Se ha demostrado previamente que T6SS dependiente de ensayo de destrucción realiza con cultivo mixto líquido bacteriano no es eficiente, probablemente debido a la falta de contacto constante entre las dos bacterias 8. El T6SS se cree que funcionan con un mecanismo similar al utilizado por los bacteriófagos para inyectar ADN en células diana 17. En la cultura líquida, la estructura tubular de la T6SS pueden romper con más facilidad, entre otras-bacterial contacto se pueden perder, y las toxinas no se entregan de manera eficiente.
En términos de tiempos de incubación, las 5 horas iniciales de contacto que describimos entre la cepa donante y la presa son suficientes para observar la destrucción bacteriana entre P. aeruginosa y E. coli, como se ilustra en la figura 3 . Sin embargo, es conveniente ajustar el tiempo de incubación mediante la realización de una cinética con el fin de optimizar las condiciones experimentales.
Dado que este método es una técnica basada en el color, los resultados de salida puede verse comprometida por la pigmentación de la cepa donante. Por ejemplo, en el caso de P. aeruginosa, algunas cepas producen altos niveles de pigmentos coloreados tales como piocianina y pyoverdine, que pueden interferir con la lectura del ensayo, haciendo que la distinción de la presa relativamente difícil. Otros cromógenos galactosidasa β-sustratos, tales como el magenta-gal o el rojo-gal, se puede utilizar en lugar de la X-gal (Tabla 1).
El ensayo de competición se puede hacer uso de otros genes indicadores para la lectura. Por ejemplo, ensayo similar también se ha realizado mediante el uso de proteína verde fluorescente marcada con presas 12.
Nuestro ensayo, mientras que no cuantitativa, da una buena indicaciónde la actividad T6SS ya que se basa en la supervivencia o la muerte de una presa reportero. Esta técnica presenta la ventaja de ser fácil y conveniente para evaluar la actividad bactericida / bacteriostasis de T6SSs de cualquier especie bacteriana. Hasta ahora, la actividad de la T6SS se ha demostrado contra bacterias Gram-negativas y no hay ningún ejemplo claro de T6SS sensibles a bacterias Gram-positivas se ha informado todavía 12. También es obvio que la incompatibilidad en la cultura de las diferentes especies bacterianas a prueba (por ejemplo la temperatura de crecimiento, la oxigenación, los medios de comunicación específicos) es para ser considerada.
Nuestro ensayo también se puede utilizar para evaluar cuál de los componentes T6SS son absolutamente esenciales ya que incluso trazas de una toxina secretada podría ser suficiente para matar a la presa. Incluso débil actividad de los T6SS entonces podría claramente ser detectado por nuestro ensayo en comparación con el procedimiento estándar de ensayo T6SS dependiente de la secreción utilizando blot sobrenadante de cultivo y occidentalanálisis. Sin embargo, una adecuada unidad formadora de colonias (CFU) recuento todavía se requiere para la cuantificación exacta de esta actividad T6SS.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Wellcome Trust subvención WT091939MA. Alain Filloux con el apoyo de la Royal Society.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / material | Empresa | Número de catálogo | Comentarios |
| P. aeruginosa PAKΔ TER (D +) (T6SS activos) | Laboratorio de tensión | Descrito en la Referencia 16 | |
| P. aeruginosa PAKΔ RETS Δ H1-T6SS (D -) (T6SS inactivos) | Este estudio | El clúster H1-T6SS (que comprende los genes PA0070 a PA0095) ha sido borrado por intercambio alélico siguiendo el procedimiento descrito en la Referencia 18. El fragmento mutador fue generado con el siguiente conjunto de cebadores: Los cebadores fragmento Subir: 5'-ATGGTCAACGACATGGAGCTGGAG-3 ', y 5'CGAGGCCGATCAGGCCTTCAGAACTGA-3 '. Los primers de fragmentos de Down: 5'-TCAGGCCTTCAGAACTGAAGCGGCGCA-3 ', 5'-GGTGGCGTTCAACAGTTCCATGTC-3 ' | |
| E. coli DH5a | Invitrogen | 18258-012 | F-φ80 lac ZΔM15 Δ (lac ZYA-arg F) U169 rec A1 A1 final hsd R17 (r k -, m k +) pho A sup E44-thi λ -1 gyr A96 rel A1 |
| pBluescript II SK (+) | Agilent | 212205 | Este vector expresa el péptido α de β-galactosidasa utilizado para α-complementación. |
| X-gal | Invitrogen | 15520-018 | Utilizar en 40 ug / ml |
| Agar Luria Bertani | Merck-químicos | 1.10283.0500 | |
| TSB (caseína de soja caldo) | Oxoid | CM109 | |
| Vortex agitador Genius 3 | IKA | 3340000 | |
| Escáner | Epson | V700 | |
| Espectrofotómetro | WPA Biowave | CO8000 celular densímetro | |
| Magenta-gal | Bioworld | 30350001-1 (715241) | |
| Red-gal | Research Organics | 1364c | |
Tabla 1. Strain, material de plásmido, y el reactivo usado. |
Referencias
- Filloux, A., et al. The bacterial type VI secretion machine: yet another player for protein transport across membranes. Microbiology. 154 (6), 1570 (2008).
- Cascales, E., Cambillau, C. Structural biology of type VI secretion systems. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 367 (1592), 1102 (2012).
- Leiman, P. G., et al. Morphogenesis of the T4 tail and tail fibers. Virol. J. 7, 355 (2010).
- Ballister, E. R., et al. In vitro self-assembly of tailorable nanotubes from a simple protein building block. Proc. Natl. Acad. Sci. U.S.A. 105 (10), 3733 (2008).
- Leiman, P. G., et al. Type VI secretion apparatus and phage tail-associated protein complexes share a common evolutionary origin. Proc. Natl. Acad. Sci. U.S.A. 106 (11), 4154 (2009).
- Pukatzki, S., et al. Type VI secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin. Proc. Natl. Acad. Sci. U.S.A. 104 (39), 15508 (2007).
- Ma, A. T., et al. Translocation of a Vibrio cholerae type VI secretion effector requires bacterial endocytosis by host cells. Cell Host Microbe. 5 (3), 234 (2009).
- Hood, R. D., et al. A type VI secretion system of Pseudomonas aeruginosa targets a toxin to bacteria. Cell Host Microbe. 7 (1), 25 (2010).
- Russell, A. B., et al. Type VI secretion delivers bacteriolytic effectors to target cells. Nature. 475 (7356), 343 (2011).
- Li, M., et al. Structural basis for type VI secretion effector recognition by a cognate immunity protein. PLoS Pathog. 8 (4), e1002613 (2012).
- Zheng, J., et al. Genetic analysis of anti-amoebae and anti-bacterial activities of the type VI secretion system in Vibrio cholerae. PLoS One. 6 (8), (2011).
- Schwarz, S., et al. Burkholderia type VI secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathog. 6 (8), e23876 (2010).
- Murdoch, S. L., et al. The opportunistic pathogen Serratia marcescens utilizes type VI secretion to target bacterial competitors. J. Bacteriol. 193 (21), 6057 (2011).
- Boyer, F., et al. Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?. BMC Genomics. 10, 104 (2009).
- Maniatis, T., et al. . Molecular cloning: A Laboratory Manual. , (1982).
- Mougous, J. D., et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science. 312 (5779), 1526 (2006).
- Records, A. R., et al. The type VI secretion system: a multipurpose delivery system with a phage-like machinery. Mol. Plant Microbe Interact. 24 (7), 751 (2011).
- Hachani, A., et al. Type VI secretion system in Pseudomonas aeruginosa: secretion and multimerization of VgrG proteins. J. Biol. Chem. 286 (14), 12317 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados