Method Article
通过电穿孔内在和生物分子荧光观察生活中的微生物
摘要
Studies of biomolecules in vivo are crucial for understanding molecular function in a biological context. Here we describe a novel method allowing the internalization of fluorescent biomolecules, such as DNA or proteins, into living microorganisms. Analysis of in vivo data recorded by fluorescence microscopy is also presented and discussed.
摘要
The ability to study biomolecules in vivo is crucial for understanding their function in a biological context. One powerful approach involves fusing molecules of interest to fluorescent proteins such as GFP to study their expression, localization and function. However, GFP and its derivatives are significantly larger and less photostable than organic fluorophores generally used for in vitro experiments, and this can limit the scope of investigation.
We recently introduced a straightforward, versatile and high-throughput method based on electroporation, allowing the internalization of biomolecules labeled with organic fluorophores into living microorganisms. Here we describe how to use electroporation to internalize labeled DNA fragments or proteins into Escherichia coli and Saccharomyces cerevisiæ, how to quantify the number of internalized molecules using fluorescence microscopy, and how to quantify the viability of electroporated cells. Data can be acquired at the single-cell or single-molecule level using fluorescence or FRET. The possibility of internalizing non-labeled molecules that trigger a physiological observable response in vivo is also presented. Finally, strategies of optimization of the protocol for specific biological systems are discussed.
引言
活细胞内最荧光研究依赖于蛋白质融合荧光蛋白(FPS),如GFP 1。这些荧光标记允许参与诸如基因表达或膜转运2-7过程的蛋白的拷贝数,扩散图案或定位的研究。的FP提供高特异性标记,易于实施,并提供大量库存的各种光物理和化学性质1变种。然而,有机荧光团保持头等选择用于体外实验,由于其更大的光稳定性(高达100倍的FP相比更稳定的)8,9,小尺寸(高达100倍体积小于FPS)和易于分子内标签(主要是通过使用半胱氨酸残基)。所有这些因素都对单分子荧光特别重要和FRET研究10。
几个内部方法COMBIN荷兰国际集团有机标签和体内检测的优点已被引入,在过去的十年;然而,这样的方法或者采用相对较大的多肽的标签( 例如 ,TMP,卤素,或20kDa的SNAP标签)11-14,需要使用的非天然氨基酸15,或限于大的,单膜的真核细胞( 如 ,刮加载,加载注射器,注射),16-19。
这个协议描述了一种新颖的,简单的和高通量的内化方法,夫妻的有机荧光团的优点与体内观察。为了开发这种技术,我们适于通常用于以加载微生物,如大肠杆菌转化细胞与质粒DNA 20,21电穿孔过程大肠杆菌或S.酵母与有机生物分子标记。该协议包括4个简单的步骤:细胞培养与生物分子标记,电穿孔,细胞恢复和细胞洗涤以除去非内化的生物分子。这里,我们提出这个电协议,以及在细胞成像和数据分析过程,以研究细胞系和单分子荧光和FRET信号。
电穿孔依赖于横跨一个低离子强度的细胞悬浮液排出的高电压电场形成瞬态膜孔,通过该生物分子可进入细胞中( 图1)20,21。正如改造的细菌或酵母质粒DNA,细胞具有电穿孔,以确保其electrocompetency事先做好准备。此过程中,由几个洗涤步骤用的水,增加了膜的通透性和降低的细胞溶液的离子强度,以避免产生电弧的电穿孔杯中。在这个协议中,细胞可如下所述制备(参见协议:1.1),或从商业提供商购买秒。
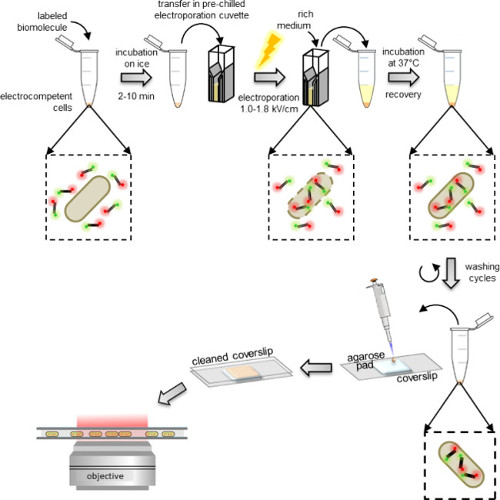
图1:该内化协议的示意图从左至右:加标记的生物分子的几微升至电感受态细胞(双标记的DNA片段和细菌在这个例子中)的等分试样;孵育1至10分钟,在冰上并转移到预冷的电穿孔杯中;电穿孔,然后后立即加入0.5-1毫升丰富的培养基中的细胞;孵育在37℃下(或由生物体所要求的温度,例如 29℃,酵母),让细胞恢复;执行5洗涤步骤,以除去任何过量的未内化的标记的分子;重悬在100-200微升的PBS缓冲液和吸液管将10μl在琼脂糖垫的最终的沉淀;盖上盖玻片清洗和图像上的荧光显微镜的垫(在宽视场模式或HILO模式)。
电感受态细胞孵育只电穿孔前的标记的生物分子,其可以使用在大多数生化实验室发现标准electroporators来执行。立即电穿孔后,将细胞温育在加富培养基使洗涤前的恢复( 图1)。非内在生物分子标记多余首先由洗涤含有相当高浓度的盐和一些清洁剂的缓冲删除(参见PROTOCOL:3.3)。盐的存在破坏了,否则可能会粘在外膜非内在标记的生物分子形成的非特异性静电相互作用。同样地,洗涤剂中的洗涤缓冲液的存在下破坏非特定疏水相互作用。
而DNA的内化是直接( 图2),注意事项需要内在使用电穿孔标记的蛋白质时要采取。首先,有机标记的蛋白质的储备样品仍然可能包含游离的染料的一小部分。游离的染料分子比蛋白质小很多,因此可能被优先内在化。以确保所观察到的内在荧光分子的绝大多数对应于感兴趣的蛋白质,初始蛋白质样品应含有少于〜2%无染料( 图5)22。非内化标记的蛋白质的过量也可以粘到电穿孔后的细胞外膜;这种现象是蛋白特异性和需要被检查为每个新的蛋白质。我们提出了几个选项,允许拆除非内在的蛋白质从细胞装样品(见PROTOCOL:3.3.3)。
最后,将细胞重悬浮于小体积的磷酸盐缓冲液中,吸移到琼脂糖垫,允许在荧光显微镜的成像。固定在琼脂糖垫是SIMPLe和成像细胞在盖玻片不损害其完整性的有效方式。垫应包含一个低荧光培养基。
细胞成像可以进行无论是在广角,全内反射荧光(TIRF)或使用HILO(高度倾斜和层压光学片)显微镜。在希洛构造中,激光束更深地穿入样品比在TIRF,但不照亮整个样本作为宽视场,从而允许更大的信噪比23。根据所使用的激光功率和时间分辨率,内化的生物分子进行计数(使用逐步-漂白分析, 图3),局部的,或跟踪24-28。用FRET对荧光团的双标记的构建物的内化允许FRET两者中的单细胞或单分子的水平( 图6)的定量。
不同的参数可被改变取决于期望的输出,并研究了生物系统。第一,每个细胞的内化材料的量可以通过改变标记的生物分子的加入到细胞之前电穿孔( 图2)的浓度来调节。电场强度也将影响两个装载效率和细胞活力;如预期的,而装载效率增加而增加电场强度,电穿孔的细胞的生存力降低( 图4A)。这两个参数可以通过记录的加载的百分比和电穿孔后分裂的细胞进行定量。这再加上荧光成像的可行性实验也验证了观察内在生物分子在活细胞中,并允许连续观察了好几代( 图4B)。
总之,这个协议允许荧光标记的DNA和蛋白质分子的内化入大肠杆菌或S.酵母 26。标有有机荧光团的单个分子可被跟踪以高时空分辨率的时间尺度一个数量级超过的FP。最后,这种方法是用宽视场,TIRF和共焦检测,以及脉冲激发方案,诸如ALEX(交流激光激发28,29)相兼容。
研究方案
1.细胞制备
- 实验室制造的电感受细菌的制备
- 制备来自感兴趣的大肠杆菌菌株的单个菌落5-10毫升过夜预培养物中的低荧光介质,例如M9或EZ富定义中。
- 当天上午,接种新版400毫升培养与隔夜预培养,使OD 600nm的起价为0.02。添加到400毫升低荧光培养基2.5ml的1M 硫酸镁和2.5ml的1M MgCl 2的。
- 生长于37℃和250rpm下,直到OD 600nm处达到0.4〜0.6。
- 通过冷却在冰水浴中培养10-15分钟停止生长。
注:从现在起,开展的所有步骤在4°C(冰)。 - 离心培养15分钟1000×克。弃上清,悬浮于250毫升冷冻和无菌的细胞沉淀蒸馏水H 2 O.
- 重复离心和再悬浮步骤吨WICE,减少水的体积至100ml,然后50毫升
- 离心培养10分钟1000×克。弃上清,重悬细胞沉淀在25毫升冷冻和无菌蒸馏水H 2 O + 10%甘油。
- 重复离心和再悬浮步骤三次,10%的甘油溶液的体积减少至10ml,加入5ml,最后以500微升。
- 分装细胞的20微升每,闪冻在液氮中,并存储等分在-80℃下。
- 商业电感受细菌细胞
- 稀释市售细胞等份1:1用无菌冷冻蒸馏水。使20微升等份,并储存在-80℃。
- 准备电感受酵母
注:电感受S.酵母细胞电穿孔的每个实验之前制备并不能储存在-80℃作为为E.大肠杆菌 。- 要启动,接种50毫升YPD培养基与感兴趣的需要的菌株的单菌落。
- 孵育在30℃和250rpm下,直到OD 600nm处达到0.6〜0.8。
- 离心细胞,在1000×g离心5分钟,在4℃下。
- 悬浮颗粒在25毫升冷冻和无菌蒸馏水H 2 O.
- 重复洗涤步骤两次重悬在25毫升水中,并在1M。在2ml山梨糖醇的冷冻溶液重悬浮两次
- 将细胞重悬于250微升1M山梨醇,分裂细胞向50μl的等分试样。
2.琼脂糖垫的制备
- 以除去背景荧光发色粒子,烧盖玻片在一个炉中于500℃进行1小时。 "清洁烧"盖玻片可以在室温下以铝箔覆盖保存数周。
注:其他常见的清洗方法,例如等离子体清洗或食人鱼溶液可能被使用,只要背景清洗幻灯片的荧光仍准空。 - 制备的低荧光琼脂糖溶液在微波炉中在2%琼脂糖熔化 - 蒸馏水溶液(70℃)。立即加入500μl明确2%琼脂糖溶液500微升2倍低荧光培养基中,轻轻混匀。
- 前冷却下来并变硬,迅速吸取这琼脂糖 - 为了形成大致2厘米直径和几毫米的高度垫在显微镜盖玻片(否1.5厚度)培养基溶液。避免气泡,如果需要用枪头弹出他们。
- 压平垫与第二个"烧"盖玻片(否1.5厚度,参见图1)。
注:本上盖玻片有助于形成一个平面均匀垫和灰尘,烘干保护细胞的同时正在准备。基本培养基,如M9或富媒体如EZ丰富的定义中已经过测试,其低荧光。
3. Electroporat离子
- 孵化
- 加起来5微升存储在低盐缓冲液(<50毫盐)至感受态细胞(20微升细菌或50μl的酵母)的单一等份标记的分子和在冰上孵育10分钟。
附注:储备溶液的荧光标记的分子的浓度,从而增加在电穿孔之前直接与装载效率相关的细胞标记的分子的量(图3,与讨论)。如某些蛋白质与低盐条件不太相容,在存储缓冲器中的盐浓度可能增加,但加入到细胞中前电穿孔标记的分子的量,然后需要被降低。 - 转移细胞和标记的生物分子的混合物到预冷冻的电穿孔杯中(0.1和0.2厘米间距为细菌和酵母,分别)。轻轻拍打在板凳上的比色皿,以从溶液中取出任何潜在的泡沫。
- 把CU维特入电穿孔和施加高电压电脉冲到该溶液中(0.9至1.8千伏/厘米,见讨论关于选择电压更多细节)。这种脉冲形式的瞬态毛孔中的细胞膜,允许标记的生物分子扩散进入细胞。
- 检查在电穿孔仪显示的时间常数是4至6毫秒之间。较低的时间常数通常是由于过高的盐浓度和/或气泡在反应杯的存在,并且将导致非常低的或无负载的细胞。
- 加起来5微升存储在低盐缓冲液(<50毫盐)至感受态细胞(20微升细菌或50μl的酵母)的单一等份标记的分子和在冰上孵育10分钟。
- 恢复
- 立即电穿孔后,加入500μl丰富培养基如SOC,EZ富定义培养基,YPD或任何富培养基与细胞的。
- 孵育的样品在37℃下的细菌和29℃,酵母为2至10分钟。为生存力的测量,在用户想要以评估细胞生长和电穿孔后分割的百分比,使用较长的恢复时间(长达1小时),为瓦特E中的第一次细胞分裂前,看到这样的滞后时间。
- 洗涤步骤
- 洗细胞通过停转的细胞进行1分钟,在3300×g离心,4℃,以去除任何非内化的生物分子。弃上清,悬浮细胞在500微升PBS。
注意:对于每个样品,制备细胞培养用标记的生物分子的相同量,但不电穿孔并洗涤完全相同的方式作为主样品的阴性对照。 - 重复上述步骤3次。
- 在蛋白质内化的情况下,优化了洗涤过程取决于所感兴趣的标记的蛋白质的性质和行为。下面的步骤是示例的可能的优化:
- 使用PBS中含有100mM NaCl和0.005%的Triton X100以除去非内化的蛋白质可能粘到外层细胞膜22执行第一洗涤3次,<SUP> 26。
- 过滤该电穿孔的细胞与嵌合1.5ml微量离心管内通过吸取的电穿孔细胞进入过滤0.22微米孔径的过滤器。降速3分钟,在800×g离心并4℃。丢弃的流量通过。加入500μl新的PBS在细胞上,再次旋转它们像以前那样重复这些步骤一次22。
- 在第一个洗涤循环中添加少量的蛋白酶K(10毫微克在500μlPBS中),以允许任何非内化蛋白的消化。
- 使用PBS中含有100mM NaCl和0.005%的Triton X100以除去非内化的蛋白质可能粘到外层细胞膜22执行第一洗涤3次,<SUP> 26。
- 降速的细胞在3300×g离心1分钟,4℃。弃上清,悬浮细胞在150微升PBS。
- 通过除去上层盖玻片并通过液滴铺展10微升细胞悬浮液滴涂在琼脂糖垫加载的细胞溶液。更换一个未使用的清洁烧盖玻片(否1.5厚度,搭配显微镜物镜规范)对T他顶垫,然后按轻轻地在幻灯片上。
- 通过存储垫在一个不透明的箱子,同时成像不同的样品保护电穿孔细胞的光。
- 洗细胞通过停转的细胞进行1分钟,在3300×g离心,4℃,以去除任何非内化的生物分子。弃上清,悬浮细胞在500微升PBS。
4.显微镜数据采集
注意:在活体微生物的单细胞和单分子荧光显微镜可以在任何适当的荧光显微镜来进行(定制或商业)。
- 设置
- 广角或HILO照明
- 图像样本与任何的TIRF /单分子显微镜。
注意:作为一个例子,我们在实验室中使用定制倒置显微镜用的TIRF的设置。从532纳米和637纳米二极管激光器的光束被组合并聚焦到物镜的后焦面之前准直。从样品的荧光通过相同的物镜收集,使用长通和陷波滤波器从激发光分开,并分割成重使用分色镜D和绿色通道。两个通道被成像到电子倍增电荷耦合器件(EM-CCD)照相机的芯片的单独的两部分。影片使用的是动态模式记录下来。白色光图像是使用白色灯和安装在显微镜的照明源的冷凝器获得。 - 对于一般的单分子观察,设置显微镜TIRF或HILO 23的照明模式(见讨论关于TIRF详细信息与 HILO成像)。上设置一个TIRF显微镜的HILO模式,稍微降低激发光的入射角转移焦点比盖玻片表面稍高(图像中的细胞内部,而不是在与盖玻片接触其下的膜,参见4.5.4 )。
- 对于细胞级分析,长的单分子跟踪实验或逐步漂白分析,在显微镜的照明模式设定为宽视野模式ensuri纳克的连续观察整个细胞体积的,因此,所有的内化标记的分子。
- 图像样本与任何的TIRF /单分子显微镜。
- 通常情况下,围绕0.5-3毫瓦利用激发功率(〜50-400瓦/厘米2)。
注:较低的激光功率要实现长寿命的荧光观察和跟踪(超过1分钟),同时可能需要更高的时空分辨率和逐步漂白分析更高的激光功率有用。 - 使用的曝光时间从15毫秒跟踪实验,以100毫秒的更一般的观察和强度量化。注:其他的帧速率和模式可以使用,例如频闪照明,特别是用于研究快速扩散物质30。
- 在TIRF显微镜,记录在电子倍增CCD(EMCCD)相机的荧光信道造成〜100纳米/像素的像素长度的倍率。该TIRF设置是描述更详细的参考26。
- 广角或HILO照明
- 数据采集
- 关闭或阻挡激光照射直至实验开始。切换EMCCD相机增益关闭,以防止损坏照相机由于过度曝光。
- 放置琼脂糖垫夹心倒置显微镜舞台上,与小区覆盖的侧朝下,以便使该小区附近的目标。将重点放在细胞在透射光显微镜模式28。记录的观点下的白色光成像的每个细胞的图像,以找到小区切断白光前轮廓。
- 保护从实验室的环境光的样品。
- 对于HILO励磁方式,通过照射样本接近盖玻片表面的仅部分调整激发光束至各最大信噪比的角度。
- 为了实现HILO照明,将激光束聚焦成一个100×NA 1.4物镜28(较高nume的后焦平面rical孔如1.45或1.49顷也是合适的)。通过移动聚焦透镜垂直于梁,焦点移动远离目标中心,从而使光束离开物镜具有角度。
- 调整以最大化信噪比,细胞内荧光强度与细胞外的背景信号的透镜位置。
- 打开相机增益和对激光切换前开始数据采集。
- 同时记录数据前或记录荧光数据后获得的每个FOV的白光图像;这有助于识别在荧光通道小区边界。
- 对于可行性评估
- 使用低荧光丰富培养基在琼脂糖垫,以允许细胞电穿孔后生长。
- 平衡显微镜的最佳温度为所研究的微生物(37℃, 大肠杆菌 ,29℃的酿酒酵母)配有一个客观的加热器系统。
- 记录两个白光和荧光图像,每隔30分钟,并确保在整个数据记录期间保持对视图完全相同字段。 ≈1小时的滞后通常是观察前细胞开始分裂。
- 计数每个细胞内化的生物分子的数量
- 设置激光功率到高值(2-3毫瓦)和长暴露时间(100毫秒)。
- 设置为以照亮整个小区广角模式的照明。
- 纪录电影,在步骤4.2中所述,确保录制完成的荧光漂白后附加的帧(50-100帧)。
5.数据分析
- 一般分析
- 录制的图像和电影,无论是在白光和荧光激发,使用成像软件,进行分析,如免费软件ImageJ的。
- 在ImageJ的,打开文件记录在显微镜(TIF格式)的图像或电影>打开>您的文件位置。
- 定性在电脑屏幕上比较荧光强度,确保所有的荧光图像在图像显示相同的亮度和对比度设置>调整>亮度/对比度。手动调节或自动设置所选图像,按"设置"按钮,然后选择"传播到所有其他图像"选项。
- 设置的信息提取类型:分析>设置测量,并选择(至少)"区域","标准差","最小和最大灰度值"和"平均灰度值"。
- 比较细胞荧光强度,选择面积S使用ImageJ的写意选择按钮的兴趣,并提取细胞强度的分析>测量。结果表中包含的测量值和可以保存和/或复制到其他软件。所述"平均数"值对应于每个像素中所选择的区域中的平均强度并能细胞之间或细胞与背景之间直接进行比较。
- 在一个电穿孔的细胞样品,细胞被认为是装载如果每像素的平均强度比每阴性对照的象素加3倍标准偏差(AV(Ⅰ 装载单元 )>平均(Ⅰ-EP)+平均强度较大3 * STDDEV(I-EP))。
- 建立假色的荧光叠加图像和动画,以评估样品的质量和负载。
- 在ImageJ的,叠加图像等的白色光图像和在图像>颜色对应于相同的FOV的荧光图像>合并信道。选择为每个图像(C4(灰色)的白光,C1(红),用于红色通道,C2(绿色为绿色通道...等)。
- 检查上,该荧光被位于小区边界内的叠加图像(白色光图像),并且背景荧光低,均质的(小区边界之外没有亮点)。
- 在分析了大量的细胞,检查定性对应于负样本的图像类似于空细胞图像,并显示低得多的强度比电穿孔的细胞。
- 对于可行性实验,手工清点分裂,非分裂,但明显完好无损(相同)和损坏的(死)细胞的增长来看随着时间的推移相同的字段(参见4.2.6)的百分比。
- 为了收集足够的统计数据评估至少200个细胞,每个样品(电,阴性对照,空白单元格)的可行性。
- 录制的图像和电影,无论是在白光和荧光激发,使用成像软件,进行分析,如免费软件ImageJ的。
- 基于细胞的分析
- 通过逐步漂白分析计算每个细胞内化生物分子的数量
- 段细胞selecti纳克的使用ImageJ的写意选择按钮感兴趣的区域,绘制精确周围细胞(相当于细胞膜)的形状。
- 提取细胞的强度随着时间的推移在图像>栈>情节Z轴档案。将所得图表示每像素的平均强度为小区边界相对于产生该特定小区中的漂白曲线每个影片帧中的区域。它包含了电池的强度达到了一个较低的渐近线(背景荧光)的初始指数下降。的测量值,并且可以通过点击"保存"或"复制"被保存和/或复制到其他软件。
- 复制并粘贴漂白值转换为电子表格列(我生 )。
- 通过平均在过去的50至100帧(下渐近线)获得我的原始值漂白(我自动 )后计算每个像素剩余的平均自发荧光。
- Subtract每像素的平均自发荧光漂白从最初的漂白曲线细胞后,剩下的我漂白 = I 生-我的汽车。
- 使用基线减去漂白timetraces(Ⅰ 漂白 与帧)表示由于单荧光团26的漂白小于10量化步骤来评价的平均步长(酉荧光强度)。
- 由单一荧光强度除以初始基线减去细胞强度(I 漂白在t = 0)评估每个细胞的内化的分子数。
- 单细胞的FRET效率
- 测量在这两个供体和受体发射通道每像素的平均强度的细胞(在供体激发),并为每个信道的小区边界内,在5.1.1.4解释。
- 测量平均像素强度在每个声道背景annel从滑动的空白区域。
- 减去从每个像素的平均强度这个背景强度。使用这些扣除背景的荧光强度来计算FRET每个单元通过计算各捐助国激发扣除背景的受体强度除以总(受体+供体)除以扣除背景的强度:我接受或 /( 接受或我+ I 供体 )
- 通过逐步漂白分析计算每个细胞内化生物分子的数量
- 单分子分析
- 单分子跟踪和扩散分析
注意:该协议用 于跟踪扩散在活细胞中的荧光分子,并评价它们的表观扩散系数已经描述26,28。- 简要地说,由一个二维椭圆高斯拟合单荧光团中的每帧的图像。链接本地化分子轨道,如果他们出现在连续帧中的5-7个像素(0.48-0.67微米)的窗口。使用MEMOR1帧参数y占荧光团因闪烁或错过了本地化的瞬间消失。
- 体内smFRET分析
- 手动识别本地化分子在细胞内的电影由经历电影中的ImageJ并确定在FRET(受体)通道不动(或相当不动)的分子。
- 中提取对应于不动的分子的受体和供体通道的强度,使用ImageJ的"椭圆形"选择按钮选择每个通道中的分子周围的区域(围绕每个单个荧光团圆,使用~3像素半径)和提取分子强度的分析>测量。结果表中包含的测量值,并且可以被保存和/或复制到其他软件。
- 从相同尺寸的滑动以上分析的所有帧的空白面积的圆计算出的平均像素强度每信道的背景值。
- 使用供体和受体通道(在供体激发)的荧光扣除背景的荧光值和FRET时间痕迹,如在单细胞FRET情况(见5.2.1.7)。
注:自动化和强大的分析和算法的引用,26-28,31已被描述。
- 单分子跟踪和扩散分析
结果
样品制备
的不同步骤的协议的表示为图1中的原理图。作为一个例子,我们表示的细菌用双标记(供体和受体染料)的DNA片段的加载。用于DNA内在化的代表性结果示于图2中 。对于每个电穿孔样品,为空的细胞和非电穿孔的细胞的数据也记录( 图2)。 "空单元格"对应于电感受态细胞培养既不用荧光生物分子,也没有电;其在荧光通道强度反映相同的实验条件(激光功率,时间分辨率,温度等)下自发荧光水平。 "非电穿孔的细胞"(也称为-EP, 即减去EP)对应的阴性对照,其中电感受态细胞已孵育与荧光biomolecULES而不是电。这些非电穿孔的细胞应该具有相似于空细胞的自体荧光和比加载,电穿孔的细胞显示的荧光强度显著低的荧光水平。这证实了去除可能粘附在外层细胞膜的任何非内在标记的生物分子。
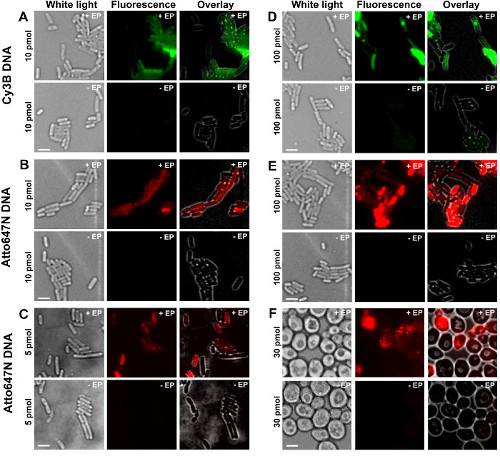
图2:为双链DNA(AE)的内化在细菌中标记不同的荧光团在不同浓度和酵母(F)的代表性结果从左至右:白光,荧光和叠加的图像。 - / + EP表示没有孵化/有电。标尺:3微米。 A. CY3B双链DNA,10皮摩尔,E.大肠杆菌 。 B. ATTO647N双链DNA,10皮摩尔,E.大肠杆菌 。 C. Alexa647双链DNA,5皮摩尔,大肠杆菌。 D. CY3B双链DNA,100pmol的,大肠杆菌。 E. ATTO647N DSDNA,100皮摩尔,E.大肠杆菌 。 F. ATTO647N双链DNA,30皮摩尔,酵母。这个数字已经被修改的参考26。 请点击此处查看该图的放大版本。
计数每个细胞内化的生物分子的数量
该过程以估计示于图3和补充电影2每使用漂白分析细胞内在标记的生物分子的数量,与用不同浓度的标记的DNA而得到的代表性结果。小区负载效率随孵育标记的DNA的初始量,从而允许用户调每个细胞标记的分子的数量从一个"单分子"电平(<10,补充电影2B)向一个"合奏"水平(> 10 ,补充电影2A)。估计装细胞百分率的健壮的方式为tO数量电穿孔的细胞显示非电穿孔的细胞的平均细胞密度加3倍它们的标准偏差( 即 ,AV(Ⅰ-EP)+ 3 * STDDEV(Ⅰ-EP),其中平均=平均以上的小区的强度的数量, I =每个像素的强度,标准。开发。=标准偏差和-EP =非电穿孔),为如图3所示。
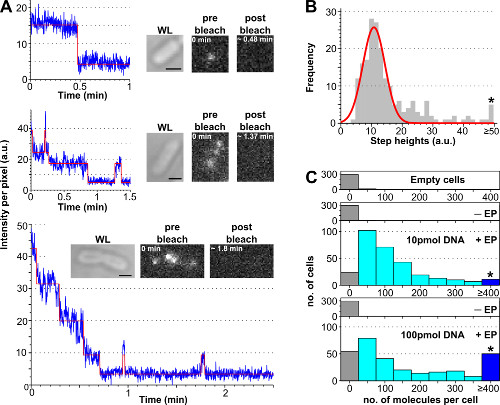
图3:计数用漂白分析内化分子的数量(A)的单细胞光漂白分析。荧光强度timetraces例子(蓝色:原始数据;红色:适合;插图:WL和装载ATTO647N标记的双链DNA和前漂白后的大肠杆菌荧光图像)。上图:单步漂白事件。中东:含±3的分子显示出漂白细胞和闪烁。底部:细胞含有对应于至少10分子> 10个步骤(B)中 ,从一个自动化的步骤拟合算法从含小于6区分的步骤57细胞直方图的单步高度强度。单高斯拟合集中在11±3 AU,对应于每秒8100光子的单一荧光强度。星号标记的bin收集以上或每个细胞内化分子与电不同数量ATTO647N双链DNA,除初始荧光强度由单一的荧光强度计算后,等于50金(C)直方图所有的台阶高度。从上到下:空细胞( 即不孵育荧光分子,而不是电穿孔),非电穿孔(但孵育荧光分子,命名-EP),以及电穿孔的细胞孵育10和100皮摩尔的dsDNA(名为+ EP)。空和非电穿孔细胞对应以自体荧光,而电穿孔细胞表现出内在的分子的广泛分布,在100皮摩尔比例较高的高负荷细胞(≥4分子,看到星号标记斌)。内化效率(细胞与智力的分数。>是指非-EP样品+ 3×标准。开发。)为10和100皮摩尔的样品分别为94%和90%。平均每个细胞内化分子数:121±106分子10皮摩尔双链DNA,和176±187分子100皮摩尔双链DNA。设置:100毫秒的曝光,宽视场照明。比例尺:1微米。这个数字已经被修改的参考26。 请点击此处查看该图的放大版本。
小区负荷和生存能力
除了改变标记的生物分子的量添加到细胞中前,电穿孔,所述用户可以调整内化分子的量通过电穿孔期间选择不同的场强( 图4,补充电影1)。更高的场强导致更大的内化效率,但会导致细胞活力略有下降。对于蛋白质内化,使用的过滤步骤可以帮助去除未内化的标记的蛋白质(见3.3.3.1.1)。在这种情况下,细胞过滤确保观察到的荧光蛋白质被细菌胞质内确实内化;我们注意到,不过,过滤也对细胞活力产生负面影响(有关详细信息,请参阅REF 22)。
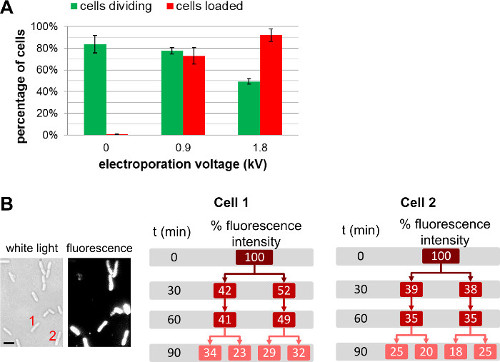
图4:在小区负载和生存能力电电压的影响(A)柱状图代表的电磁场强度的负荷effic的影响。iency(红色条)和细胞(绿色条)的可行性。后在37℃下在琼脂糖垫1小时84±8%,非电穿孔的细胞(0千伏/厘米)隔膜。在相同条件下,78±3%,并电穿孔在0.9千伏/厘米和1.8千伏/厘米的细胞的49±3%1小时后,分别划分。用于装载效率,73±8%的细胞被装载在0.9千伏/厘米,而细胞的92±6%,在1.8千伏/厘米的被加载。误差条表示由三个独立的测量值计算的标准偏差;对于每个样品,每个重复多于200个细胞进行分析。整体装载效率随着电电压的细胞生存力的轻微损害。(B)的基于细胞的荧光测量几代表明整体荧光强度二者的子细胞之间平分。小区1和2指的是在t = 0的比例在白色光图像(左)的细胞数和荧光图像酒吧:1微米)。这个数字已经被修改的参考26。
蛋白质内化
蛋白质内部代表性的结果在图5A&B。特别重要的是要尽可能多的剩余的游离(未反应)的染料从蛋白质样品尽可能在电穿孔之前除去。在图5A和B中,CY3B标记Klenow片段样品(CY3B-KF,其中KF是大肠杆菌 DNA聚合酶I的Klenow片段,66 kDa的)仅含有1%游离染料的例子;整体细胞装载这种染料的贡献是可忽略不计。与非电穿孔的细胞都兴趣(孵育标记的蛋白质的同量)的电穿孔样品的比较,以及电穿孔与游离染料的等量细胞构成两个所需的控制,以确保所观察到的荧光分子确实是内化标记的蛋白质。
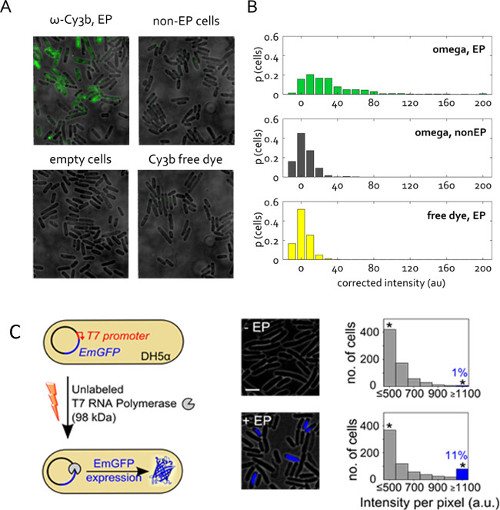
图5:在活细菌蛋白质内部(A)的观点代表荧光覆盖领域。细胞的电穿孔在1.4千伏电压,用50皮摩尔的RNA聚合酶ω从仅含有1%游离CY3B染料的蛋白质原液亚基。非电穿孔(非-EP)和空细胞被定义为先前。游离的染料被内化在相同浓度的RNA聚合酶ω电穿孔样品中。成像在宽视场模式下,532-nm激发在1毫瓦,50毫秒的曝光。(B)中分布未校正细胞平均强度的样品(A)中,在总细胞数的比例给出。每个样品400多个细胞进行分割。这个数字已经被修改的参考22。unla的(C)内部化贝莱德T7 RNA聚合酶(T7 RNA聚合酶,98 kDa的)转换成电感受DH5α携带PRSET-EmGFP质粒编码翡翠绿色荧光蛋白(EmGFP)根据一个T7启动子的控制。左图:示意图化验。中东:荧光叠加。右:直方图的基于细胞的荧光强度为无电穿孔样品(顶部)和细胞培养和电穿孔用T7 RNA聚合酶(底部);电穿孔的细胞约11%表现出较高的荧光强度(细胞智力的分数。>的意思+非-EP样的3倍标准。开发。)表示EmGFP的表达。星号表示垃圾箱收集大于或等于1100太子港比例尺所有的强度:3微米。这个数字已经被修改的参考26。
图5C展示蛋白质电穿孔的另一种应用。在这里,电穿孔蛋白是未标记的,但它的内在触发可观察到的荧光反应。本实验验证的预SENCE并在细胞质电穿孔蛋白的功能性。未标记的T7 RNA聚合酶(98 kDa的)被内化为E.大肠杆菌 DH5α菌株含有T7启动子26的控制下,用于荧光蛋白EmGFP质粒编码。作为基因T7 RNA聚合酶不存在在DH5α,在我们的实验EmGFP表达需要官能T7 RNA聚合酶通过电穿孔( 图5C)导入细胞。在电穿孔之后用1皮摩尔的T7 RNA聚合酶,该细胞的> 11%(蓝色条, 图5C)显示出荧光高于阴性对照组(温育用T7 RNA聚合酶的相同量,但不电穿孔)。这个结果规定,通过电穿孔内化的T7 RNA聚合酶分子的比例保持其在体内的完整性,并可以在细胞的细胞质执行其预期的功能。
体内 FRET在单分子和单细胞水平
最后,双标记的物种中活细菌的内化和分析示于图6和补充电影3.如荧光蛋白融合物是不理想的用于体内 smFRET研究中,使用电来提供双标记的生物分子到活细胞的能力是1该方法的大的资产。 图6A呈现的单细胞FRET细菌装载有不同的FRET的DNA标准(使用CY3B和Atto647N荧光团作为供体-受体FRET对)的分析。细胞被电穿孔用20皮摩尔的0.17,0.48的三个短双标记的dsDNA的FRET标准与表观的FRET效率(E *),和0.86 体外 (先前确定26)。所有的DNA进入细胞中有效( 图6A,左侧)和各单电池E *分布的主峰与体外结果吻合( 图6A,右)。在中程和高的FRET的样品,细胞群具有较低ΔE*比预期被观察到,可能是由于受体漂白和光物理不活动,可变小区负载的组合(因此,可变信噪比)和DNA降解。
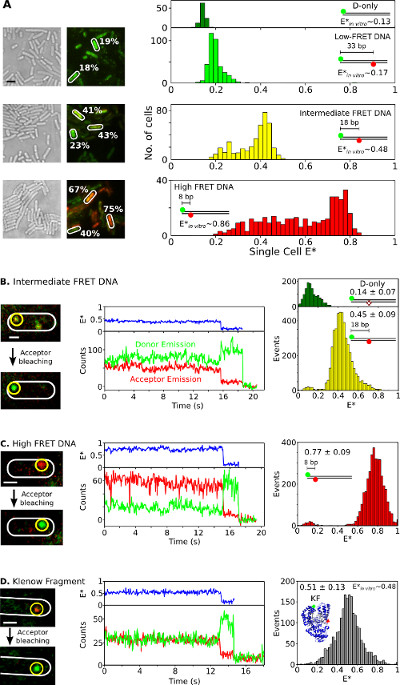
图6:单细胞和单分子代表结果FRET活细菌乐团和smFRET研究单一细菌的观察(A)分析细胞装有20皮摩尔每三个DNA FRET标准,具有低(约0.17),中间体(〜0.48)和高(〜0.86)的FRET(如使用体外单分子测量测得;参见REF 26)。左:白色的光,绿/红(FRET)的荧光叠加图像(比例尺:3微米)。从不同细胞的FRET值的例子来表示(白色)。操纵 HT(从上到下):未修正的基于细胞的FRET(E *)直方图施主只(深绿),低(浅绿色),中级(黄色),和高(红色)FRET的DNA标准(B-D)的 在体内 smFRET。细胞加载0.25皮摩尔中间-FRET的DNA(图B),0.25皮摩尔高的FRET的DNA(图C),和5皮摩尔双重标记的KF·(图D)。左栏:单帧之前和受体漂白后的绿/红色荧光叠加。中间一栏:对应于黄色圆圈分子时间的痕迹。 ,FRET的效率,供体的发射强度,以及受主发光强度显示为蓝色,绿色和红色分别。右列:施主仅分子(绿色)和供体 - 受体分子(黄色,红色和灰色)从每个样品20个时间痕迹的FRET直方图。标尺:3微米的A,1微米的B-D。这个数字已经被修改的参考26。208fig6large.jpg"目标="_空白">点击此处查看该图的放大版本。
为DNA或蛋白质样品,低量(0.25皮摩尔)的中程和高FRET DNA标准( 图6B,C)或5皮摩尔的双标KF(Alexa647 / CY3B荧光作为FRET对,图体内观察smFRET 6D)被电到E.大肠杆菌 。这种浓度导致许多细胞装载有几个(N = 1-10)标记的分子,允许直接定位,跟踪和监测FRET单分子。一些分子扩散自由,而另一些会出现静止或缓慢扩散(补充电影3)。固定的双重标记的生物分子( 图6,中间)持续1至30秒,并显示smFRET的标志Timetraces:在供体和受体荧光经受体漂白反相关的变化(例如,叔〜16秒; 图6B中 ,中间),其次是单-步骤施主漂白(例如,叔〜19秒; 图6B)。从这样timetraces( 图6,右图)结果的平均值,该值是在良好的协议与已发表的体外研究26,31,32产生的FRET分布。这些结果建立的内在的DNA和蛋白质定量smFRET研究的能力,并建议蛋白质(由T7 RNA聚合酶内化实验的支持)对电和内保持其完整性和结构。
补充电影1:细胞活力左:白色光图像。右:荧光图像。动画GIF动画显示细菌装有10皮摩尔Atto647标记的DNA的电穿孔(1.8千伏/厘米)后的划分。荧光的总体表观减少是由于标记的DNA的经细胞分裂的稀释和还部分向其中在每个发生光漂白测量。
补充电影2:基于Cell的漂白研究A.。一个重仓细胞(含> 100 Atto647N标记的DNA分子)的有代表性的例子。左上角,兴趣(红色矩形)的小区的白光图像。右上方,加载细胞呈现在几分钟内其荧光衰减的电影。底,时间感兴趣的细胞的总荧光强度衰减的痕迹。有机荧光团可表现出光致漂白的寿命2个数量比的FP更高量级的(在此,〜41秒为Atto647N)。 B.代表装载有小于10标记的分子(在这种情况下,3)的细胞的例子。顶部,相同面板A.底部,示出的单步的漂白和/或闪烁对应于单一的有机荧光团关注单元的总荧光强度的时间跟踪。这些步骤的平均高度对应于单分子整体强度(此处〜12 AU)用来估算每个细胞内化分子的初始数量。在连续的红色激光激发电影在300μW功率和每帧100毫秒。
补充电影3:I N 体内单分子FRET顶:将细胞装载有0.25皮摩尔高的FRET的DNA(如在图6C)以每帧50毫秒的下nTIRF照明连续监视使用1毫瓦绿色(532纳米)的激光。每个帧是一个绿色/红色(FRET)的荧光每个通道的叠加。扩散和不动的红色(完整)和绿色(单活性标记)的DNA分子,可以观察到。下图:对应于黄色圆圈分子时间跟踪。 ,FRET的效率,供体的发射强度,以及受主发光强度显示为蓝色,绿色和红色分别。抗相关受体漂白事件(红色到绿色转换)相应于单分子的FRET签字。
讨论
许多参数可以细胞电穿孔和数据采集取决于感兴趣的生物系统和实验(细胞级或单分子分析)的确切性质上期间被改变。例如,电穿孔DNA导入细菌时,标记的双链DNA片段的0.25至5皮摩尔导致低的内化效率,允许直接单分子检测( 即 ,无需事先漂白)。上述5pmol的双链DNA,细胞往往是重仓,制度更适合于单细胞分析。所有标记的DNA也应该预先凝胶纯化以除去游离的染料的任何痕迹从DNA储备液(未反应的荧光团)。此外,随着DNA降解,特别是用于smFRET实验的潜在问题,可以通过使用的DNA与非天然核酸,或者该核酸外切酶保护可访问的末端如发夹环基序处理。
另一个adjustabl在电穿孔e参数是电穿孔期间所施加的场强。低场强(约1千伏/厘米)将导致相应的单分子研究低负载效率。更高的场强(高达1.8千伏/厘米)将增加装载效率;但是,没有电穿孔后的场强和细胞活力之间的逆相关(参见图4)。作为参考,用于细菌和酵母电穿孔正常磁场强度为〜1.5千伏/厘米。的时间常数,表示此衰减的长度,是一种方便的参数遵循,因为时间常数滴只要任何电弧现象发生在比色皿。在正常设定时,时间常数应大于4毫秒;较低的值会导致低装载效率甚至无负载受损细胞。最electroporators提供其他自由度(如"脉冲截断"或"脉冲状"),它可以既修饰以调小区负载和活力。我们应用此方法,以细菌和酵母,但是类似的程序也应当允许标记的生物分子到哺乳动物细胞的内化使用适当的电穿孔仪的设置,因为它们的膜实际上是较不复杂(单脂双层),并且由于电穿孔已经被用于此类细胞21。
当内化标记的蛋白,所有的自由染料需要从所述标记蛋白原液现有电穿孔除去。游离的染料分子,由于它们的小的尺寸,可以优先内化在感兴趣的蛋白质,并且难以在数据分析期间区分(尽管他们预期更快扩散)。作为指导,对于有机标记的蛋白的样品,以适合于电穿孔,剩余的游离的染料量应低于2%,22(用SDS-PAGE的荧光扫描检测)。这个过程是特别重要的,一些分子可能会坚持到电细菌或酵母的外膜。在这方面,所述阴性对照样品应显示每个细胞的荧光强度比电穿孔的细胞显然较低,最好低至空细胞(细胞尚未孵育任何荧光标记的生物分子,也没有电穿孔的, 图2)的自发荧光水平。
与双链DNA,标记的蛋白质的内化效率是与加入到前电穿孔的细胞的生物分子的量。然而,其他参数,例如大小和电荷,起到内在化的作用。小蛋白表现出高的内化效率,而较大的蛋白质(高达98 kDa的)可以被成功内化,但以较低的效率( 图5)26。所述isolelectric点的蛋白质,与细胞的膜电位的相互作用和其他物理化学参数也电过程中的影响力小区负载。这样一来,用户需要优化的实验为自己的系统,知道标记的蛋白(> 50μM)的高初始浓度将给予成功加载的最好机会。电穿孔还提供了一个新的工具,扰乱,并通过引入蛋白质和其他生物分子进入细胞(无论是标注或未标注)分析细胞功能。 T7 RNA聚合酶的实验( 图5C)本实验,我们可以引入的生物分子,可以在体内使用电改变的基因表达的这样的例子。
当执行单分子荧光实验,TIR照明通常比其他照明模式的青睐,因为它提供了在一个薄截面盖玻片表面(〜100nm)的上述最佳信噪比通过激发仅荧光团。但是成像标记的生物分子扩散里面活的微生物可能再叠纸更深照度(高达0.8微米的大肠杆菌 )。更深照明希洛模式实现的,同时保持高信噪比。另一方面,宽视场成像是特别重要的用于分步漂白分析,在用户通过漂白具有高的激光功率的整个加载细胞和除以初始细胞荧光强度所产生的单一强度估计内化分子的数目由一个单一的分子(单光漂白工序中, 图3)。还需要宽视场成像为长期分子跟踪,以便感兴趣的分子扩散进行本地化,即使它们的轨迹覆盖整个细胞体积。
在这个协议中,我们提出了如何电穿孔,一个标准技术生物学家和生物化学用于递送核酸的细胞中,构成用于输送荧光的生物分子在各种细胞类型的简单方法。日是新颖的,高通量的技术提供了一个独特的工具来观察标记的分子在其天然环境中。在标记有荧光团覆盖一个宽的波长范围内加成的生物分子,电穿孔可以提供分子修饰与许多化学基团,如非天然核苷酸和氨基酸,金属螯合剂,交联剂,和笼蔽基。如果感兴趣的生物系统不是必不可少的细胞发育,对靶蛋白的编码基因也被删除(或击倒),确保内部后观察到的蛋白代表了所有胞内蛋白池(或大多数) 。从本质上说,电穿孔可以"移植" 在体外的生物缀合物的灵活性入活细胞,因此,有利于在努力合成生物学,系统生物学和体内单分子检测。
披露声明
The authors have nothing to disclose.
致谢
We thank Stephan Uphoff for discussions.
R.C. was supported by Linacre College, Oxford University. A.P. was supported by the German Academic Exchange Service (DAAD), the German National Academic Foundation and EPSRC. M.S. was supported by the Wellcome Trust. A.N.K. was supported by a UK BBSRC grant (BB/H01795X/1), and a European Research Council Starter grant (261227).
材料
| Name | Company | Catalog Number | Comments |
| ElectroMax DH5-alpha Comptent cells | Invitrogen | 11319-019 | or any other commercial or lab-mage electrocompetant bacteria or yeast. |
| EZ Rich Defined Madia | Teknova | M2105 | low fluorescence rich media |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | or any classical electroporator for microorganism transformation |
| Certified Molecular Biology agarose | Biorad | 161-3100 | low fluorescence agarose for agarose pad |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1h |
| Single-molecule fluorescence microscope | Home-built | described in REFs | |
| Localization software | Custom-written, available online | MATLAB and C++ software package that can be adapted for localization analysis. | |
| Tracking software | Available online | MATLAB implementation by Blair and Dufresne. |
参考文献
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Leake, M. C., et al. Stoichiometry and turnover in single, functioning membrane protein complexes. Nature. 443, 355-358 (2006).
- Taniguchi, Y., Kawakami, M. Application of HaloTag protein to covalent immobilization of recombinant proteins for single molecule force spectroscopy. Langmuir. 26, 10433-10436 (2010).
- Xie, X. S., Choi, P. J., Li, G. W., Lee, N. K., Lia, G. Single-molecule approach to molecular biology in living bacterial cells. Annual review of biophysics. 37, 417-444 (2008).
- Lee, J. H., et al. Highly multiplexed subcellular RNA sequencing in situ. Science. 343, 1360-1363 (2014).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Sauer, M. Localization microscopy coming of age: from concepts to biological impact. J Cell Sci. 126, 3505-3513 (2013).
- Dempsey, G. T., Vaughan, J. C., Hao Chen, K., Zhuang, X. Evaluation of fluorophores for optimal performance in localizationbased super-resolution imaging. Nat Meth. 8, 1027-1041 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Meth. 2, 905-909 (2005).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nat. Methods. 9, 480-482 (2012).
- Jaitin, D. A., et al. Massively Parallel Single-Cell RNA-Seq for Marker-Free Decomposition of Tissues into Cell Types. Science. 343, 776-779 (2014).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biol. 14, R124 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat. Methods. 7, 717-719 (2010).
- Zhang, Z., et al. A new strategy for the site-specific modification of proteins in vivo. Biochemistry. 42, 6735-6746 (2003).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. J Cell Biol. 98, 1556-1564 (1984).
- Clarke, M. S., McNeil, P. L. Syringe loading introduces macromolecules into living mammalian cell cytosol. J Cell Sci. 102, 533-541 (1992).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nat. Methods. 7, 203-205 (2010).
- Taylor, L. S. Electromagnetic syringe. IEEE Trans. Biomed. Eng. 25, 303-304 (1978).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16, 6127-6145 (1988).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Sustarsic, M., et al. Optimized delivery of fluorescently labeled proteins in live bacteria using electroporation. Histochem Cell Biol. , (2014).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5, 159-161 (2008).
- Sinha, A., et al. A cascade of DNA-binding proteins for sexual commitment and development in Plasmodium. Nature. 000, 1-5 (2014).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc Natl Acad Sci U S A. 108, E365-E373 (2011).
- Crawford, R., et al. Long-lived intracellular single-molecule fluorescence using electroporated molecules. Biophys J. 105, 2439-2450 (2013).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc Natl Acad Sci U S A. 110, 8063-8068 (2013).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing Protein-DNA Interactions in Live Bacterial Cells Using Photoactivated Single-molecule Tracking. J Vis Exp. , (2014).
- Hohlbein, J., Gryte, K., Heilemann, M., Kapanidis, A. N. Surfing on a new wave of single-molecule fluorescence methods. Phys Biol. 7, 031001 (2010).
- Xie, X. S., Yu, J., Yang, W. Y. Perspective - Living cells as test tubes. Science. 312, 228-230 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proc Natl Acad Sci U S A. 107, 715-720 (2010).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature communications. 4, 2131 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。