Method Article
Elektroporasyon yoluyla Yaşam Mikroorganizmalar içinde içselleştirilmesi ve Floresan biyomoleküllerin Gözlem
Bu Makalede
Özet
Studies of biomolecules in vivo are crucial for understanding molecular function in a biological context. Here we describe a novel method allowing the internalization of fluorescent biomolecules, such as DNA or proteins, into living microorganisms. Analysis of in vivo data recorded by fluorescence microscopy is also presented and discussed.
Özet
The ability to study biomolecules in vivo is crucial for understanding their function in a biological context. One powerful approach involves fusing molecules of interest to fluorescent proteins such as GFP to study their expression, localization and function. However, GFP and its derivatives are significantly larger and less photostable than organic fluorophores generally used for in vitro experiments, and this can limit the scope of investigation.
We recently introduced a straightforward, versatile and high-throughput method based on electroporation, allowing the internalization of biomolecules labeled with organic fluorophores into living microorganisms. Here we describe how to use electroporation to internalize labeled DNA fragments or proteins into Escherichia coli and Saccharomyces cerevisiæ, how to quantify the number of internalized molecules using fluorescence microscopy, and how to quantify the viability of electroporated cells. Data can be acquired at the single-cell or single-molecule level using fluorescence or FRET. The possibility of internalizing non-labeled molecules that trigger a physiological observable response in vivo is also presented. Finally, strategies of optimization of the protocol for specific biological systems are discussed.
Giriş
Canlı hücrelerin içinde çoğu floresan çalışmaları gibi GFP 1 gibi floresan proteinleri (FP), protein füzyonları bağlıdır. Bu floresan etiketler, gen ekspresyonu ya da zar taşıma 2-7 gibi süreçlerde rol oynamaktadır proteinlerin kopya sayısı, difüzyon desen veya lokalizasyon çalışmaları sağlar. FP yüksek etiketleme özgüllük, kolay uygulanmasını teklif, ve çeşitli fotofiziksel ve kimyasal özellikleri 1 çeşitlerinin büyük bir envanter vardır. Bununla birlikte, organik flüoroforlar da daha fazla foto-nedeniyle, in vitro deneyler için birincil seçim kalır (kadar FP daha stabil 100 kat) 8,9, küçük boyutlu (en küçük FP daha hacmi 100 kat kadar) ve molekül içi etiketleme kolaylığı (esas olarak sistein artıklarının kullanımı yoluyla). Tüm bu faktörler tek-molekül floresan için özellikle önemlidir ve FRET 10 inceler.
Çeşitli içselleştirme yöntemleri combinOrganik etiketleme ve in vivo tespiti avantaj ing son on yıl içinde kullanılmaya başlanmıştır; Bununla birlikte, bu yöntem, doğal olmayan amino asitler 15 kullanılmasını gerektirmektedir, ya da örneğin, (büyük, tek-zar ökaryotik hücreler ile sınırlıdır, göreceli olarak büyük polipeptitlere etiketler (örneğin, TMP, halo, ya da 20 kDa'lık SNAP etiketleri) 11-14 kullanmak ya da. , yükleme, şırınga yükleme, mikroenjeksiyon) 16-19 kazımak.
Bu protokol, in vivo gözlem ile çiftler organik florofor avantajları yeni, basit ve yüksek verimli içselleştirme yöntemi tarif etmektedir. Bu tekniğin geliştirilmesi için, genel olarak, örneğin E.Coli gibi mikroorganizmalar yüklemek için plazmid DNA 20,21 ile hücrelerini dönüştürmek için kullanılan elektroporasyon prosedürü adapte E. coli veya S. organik etiketli biyomoleküllerle cerevisiae. protokol 4 basit adımlardan oluşur: hücrelerinin inkübasyon etiketli biyomoleküllerle,elektroporasyon, hücre kurtarma ve hücre yıkama olmayan içselleştirilmiş biyomoleküllerin kaldırmak için. Burada, bu elektroporasyon protokolü, hem de hücre bazlı ve tek molekül floresan çalışma ve sinyalleri FRET hücre görüntüleme ve veri analizi işlemleri sunmaktadır.
Elektroporasyon biyomoleküllerin (Şekil 1) 20,21 hücreleri girebileceği geçici zar gözenekleri oluşturmak için düşük iyonik güçlü bir hücre süspansiyonu üzerinde bir yüksek gerilim elektrik alanı boşaltma dayanır. Sadece plazmid DNA ile bakteri transformasyonu veya maya gibi, hücreler electrocompetency sağlamak için elektroporasyon önce hazırlanmalıdır gerekir. Bu işlem, su ile birkaç yıkama aşamasından oluşan zar geçirgenliğini artırır ve elektroporasyon küveti içinde bir kavisi önlemek için hücre çözeltisinin iyonik mukavemeti azaltır. Bu protokol, hücrelerin (protokol bakınız: 1.1), aşağıda tarif edildiği gibi hazırlanabilir ya da ticari sağlayıcıdan satıns.
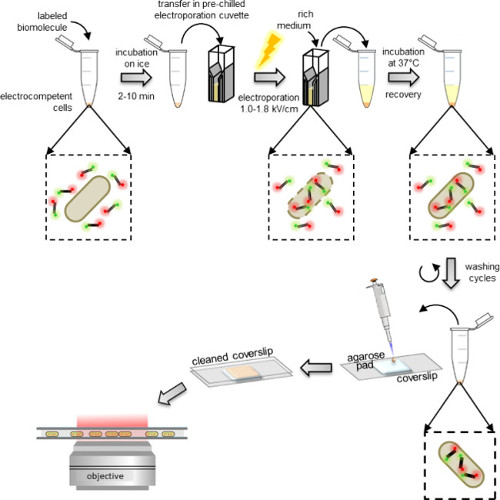
Şekil 1: içselleştirme protokolünün şematik temsili Soldan sağa:. Elektro-güçlü hücreler (çift-etiketli DNA fragmanları ve bu örnekte bakteri) kana etiketli biyomoleküllerin birkaç mikrolitre ekleyin; buz üzerinde 1 ila 10 dakika inkübe edilir ve önceden soğutulmuş elektroporasyon küvetine transfer; electroporate ve daha sonra hemen sonra hücrelere 0.5-1 ml zengin orta ekleyin; Hücreler dinlendirin 37 ° C (veya organizma için gerekli sıcaklık, örneğin, maya için 29 ° C) inkübe; herhangi bir aşırı olmayan içselleştirilmiş etiketli molekülleri kaldırmak için 5 yıkama adımları gerçekleştirin; PBS tamponu ve pipet bir agaroz ped 10 ul 100-200 ul nihai pelet tekrar süspansiyon; (geniş alan modu veya HILO modunda) bir floresan mikroskop üzerinde bir temizlenmiş lamel ve görüntü ile pedi kapağı.
Elektro hücreleri en biyokimya laboratuarlarda bulunan standart electroporators kullanılarak yapılabilir sadece elektroporasyon önce etiketlenmiş biyomoleküller ile inkübe edilir. Hemen Elektroporasyondan sonra, hücreler, yıkama önce iyileşme (Şekil 1) sağlayan bir zengin ortam içinde inkübe edilir. olmayan içsel etiketli biyomoleküllerin fazlalığı ilk olarak bir tuz, oldukça yüksek konsantrasyonda ve bir deterjan ihtiva eden bir tampon içinde yıkanarak uzaklaştırılır (3.3 protokolü). tuz varlığı, aksi takdirde dış zar üzerinde yapışabilir olmayan içselleştirilmiş etiketli biyomoleküllerin tarafından oluşturulan non-spesifik elektrostatik etkileşimleri bozar. Benzer bir şekilde, yıkama tampon maddesi içinde deterjan varlığı spesifik olmayan hidrofobik etkileşimler bozar.
DNA içselleştirilmesi (Şekil 2) basit iken, önlemler elektroporasyon kullanılarak etiketli proteinleri içselleştirilmesi zaman alınması gereken. İlk olarak, organik işaretlenmiş proteinin hazır numune hala serbest boyanın küçük bir yüzdesini içerebilir. Serbest kalan boya molekülleri protein göre çok daha küçük ve bu nedenle tercihli olarak içselleştirilebilir olabilir. Gözlenen içsel floresan moleküllerin büyük çoğunluğu ilgilenilen proteinin uygun olduğundan emin olmak için, ilk protein örneği az 2 ila en fazla% serbest boya (Şekil 5) 22 içermesi gerekir. olmayan içselleştirilmiş etiketli proteinlerin aşırı ayrıca elektroporasyon sonra dış hücre zarı sopa; Bu olgu, protein-spesifik ve her yeni protein için kontrol edilmesi gerekmektedir. Biz (: 3.3.3 PROTOKOL bakınız) Yüklenen hücre örneği olmayan içselleştirilmiş proteinlerin kaldırılmasını sağlayacak çeşitli seçenekler önermek.
Son olarak, hücreler, fosfat tamponu, küçük bir hacim içinde tekrar süspanse edilir ve flüoresanlı bir mikroskop üzerine görüntüleme sağlayan bir agaroz ped üzerine damlatıldı. Agaroz pedleri İmmobilizasyonu bir simplE ve bütünlüğünü zarar vermeden bir lamel hücreleri görüntülenmesi etkili yolu. ped düşük floresan kültür ortamı ihtiva etmelidir.
Hücre görüntüleme ya Widefield içinde, toplam iç yansıma floresan (TIRF) veya Hilo kullanarak (Yüksek Eğimli ve Lamine Optik Levha) mikroskopi yapılabilir. HILO yapılandırmada, lazer ışını, daha büyük bir sinyal-gürültü oranı 23 sağlayan, geniş açılı gibi, örneğin tamamına yanmaz henüz TIRF daha numunenin içine derin nüfuz eder. Kullanılan lazer gücü ve zaman çözünürlüğüne bağlı olarak, içselleştirilmiş biomoleküller, (Şekil 3 kademeli-photobleaching analizi kullanılarak) sayılır lokalize veya 24-28 izlenebilir. Flüoroforların bir FRET çifti ile iki kez işaretlenmiş yapıların içselleştirme tek bir hücre ya da tek-molekül seviyesinde (Şekil 6), FRET iki ölçümü sağlar.
Farklı parametreler değiştirilebiliristenen çıktı ve çalışılan bir biyolojik sisteme bağlı olarak değişebilir. İlk olarak, hücre başına içsel malzeme miktarı Hücreler, steril elektroporasyon (Şekil 2) eklenmiştir etiketli biyomoleküllerin konsantrasyonunun değiştirilmesiyle ayarlanabilir. Elektroporasyon alan şiddeti de yükleme verimliliği ve hücre canlılığı hem etkileyecektir; Beklendiği gibi, artan kuvvet alanı ile birlikte yükleme verimliliği artar ise, elektroporate edilmiş hücrelerde yaşayabilirliği (Şekil 4A) azalır. Her iki parametre de yüklenen yüzdesini kayıt ve elektroporasyon sonra hücrelerin bölünmesiyle hesaplanabilir. Floresan görüntüleme ile birleştiğinde bu canlılığı tahlil de canlı hücrelerde içselleştirilmiş biyomoleküllerin gözlem doğrular ve birkaç kuşak (Şekil 4B) üzerinde sürekli gözlem sağlar.
Özet olarak, bu protokol fosforla etiketlenmiş DNA ve protein moleküllerinin içselleşmesini içine sağlarE. coli veya S. cerevisiae'de 26. Organik fluorophores etiketli Bireysel moleküller büyüklükte bir sipariş daha uzun hekimleri daha zaman çizelgesi için yüksek uzaysal çözünürlüğü ile izlenebilir. Son olarak, bu yöntem, geniş açılı, TIRF ve konfokal tespiti, hem de bu tür ALEX (lazer uyarma 28,29 sırayla değişen) ve darbeli uyarma yapısı ile uyumlu değildir.
Protokol
1. Hücre hazırlanması
- Laboratuvar yapımı elektro bakteri hazırlanması
- Orta Tanımlanan bu M9 veya EZ Rich gibi bir düşük floresan ortamı ilgi konusu E. coli suşunun bir tek koloniden bir 5-10 ml, gece boyunca ön kültüre hazırlayın.
- Sabah, OD 600 0.02 başlar nm böyle bir gecede ön kültür ile yeni bir 400 ml'lik kültür aşılamak. 1 M MgSO 4, 2.5 ml 1 M MgCl2, 2.5 ml orta düşük floresan 400 ml ekle.
- 37 ° C'de büyümeye ve 0,4-0,6 ulaşır mil OD 600 kadar 250 rpm.
- 10-15 dakika boyunca bir buz-su banyosu içinde kültür soğutma büyümeyi durdurur.
Şu andan itibaren, (buz üzerinde) 4 ° C'de tüm adımları gerçekleştirin: Not. - X g 1000 kültür 15 dakika santrifüj. Süpernatantı atın ve H 2 O distile soğutulmuş ve steril 250 ml hücre pelletini
- Santrifüj tekrarlayın ve yeniden süspansiyon t adımlarıAkil, daha sonra 50 ml, 100 ml su hacmi azaltarak ve.
- X g 1000 kültür 10 dakika santrifüj. Süpernatant atılır ve 25 ml soğutulmuş ve steril damıtılmış H2O +% 10 gliserol hücre pelletini.
- Tekrar santrifüj ve yeniden süspansiyon, 10 ml, 5 ml ve son olarak 500 ul% 10 gliserol çözeltisi hacmi küçülür üç kez yineleyin.
- -80 ° C'de, sıvı azotun ve depoda 20 ul, her biri flaş dondurma alikolar içinde hücreleri alikosu.
- Ticari elektro bakteri hücreleri
- Ticari bir hücre kısım 1 seyreltin: 1 steril soğutulmuş damıtılmış su ile. -80 ° C'de 20 ul alikotları ve mağaza olun.
- Elektrokompetan maya hazırlama
Not: Elektro S. cerevisiae hücreleri, her elektroporasyon deneyinde önce hazırlanır ve E gibi -80 ° C'de muhafaza edilemez coli.- Başlatmak için, 5 aşılamakIstenen özel soyun tek bir koloni ile 0 mi YPD ortamı.
- 30 ° C ve 0,6-0,8 ulaşır mil OD 600 kadar 250 rpm'de inkübe edin.
- 4 ° C'de 5 dakika boyunca 1000 x g'de santrifüje hücreleri.
- 'H 2 O damıtılmış soğutulmuş ve steril 25 ml pelletini
- Iki kez 25 ml su tekrar süspansiyon haline getirerek ve 1 M de sorbitol soğutulmuş bir çözeltisine, 2 ml iki kez yeniden süspanse edilmesi yıkama adımları tekrarlayın
- 1 M sorbitol 250 ul hücrelerin tekrar ve 50 ul kısma hücreleri bölmek.
2. Agaroz pad hazırlık
- Arka plan flüoresan partikülleri çıkarmak için, 1 saat için 500 ° C'da bir fırın içinde bir lamel yakmak. Lamelleri, alüminyum folyo kaplı, oda sıcaklığında hafta saklanabilir "Temiz yandı".
Not: plazma temizleme veya pirana çözeltisi gibi diğer yaygın temizleme yöntemleri arka sürece kullanılabilecektemizlenmiş slaytlar floresan yarı-boş kalır. - Bir mikrodalga fırın, bir% 2 agaroz eritilerek düşük floresan agaroz çözeltisi hazırlayın - distile su çözeltisi (70 ° C). Hemen 2X düşük floresan kültür ortamı 500 ul net% 2 agaroz çözeltisi 500 ul ekleyin ve hafifçe karıştırın.
- Aşağı ve sertleşmesine soğuduktan önce derhal bu agaroz pipet - bir mikroskop lameli (Resim 1,5 kalınlık) üzerinde orta çözelti yaklaşık 2 cm çapında ve birkaç milimetre yüksekliğinde bir parça oluşturmak için gereklidir. Kabarcıklar kaçının ve gerekirse bir pipet uçları ile pop.
- İkinci "yanmış" lamel ile ped düzleştirmek (No 1.5 kalınlığı, bakınız Şekil 1).
Not: Bu üst lamel düz homojen ped oluşturmak ve hücreleri hazırlandı edilirken toz ve kurutmadan korunmasına yardımcı olur. Böyle M9 veya EZ Zengin Tanımlı Orta gibi zengin ortamı gibi minimal, orta, düşük floresan için test edilmiştir.
3. Electroporatiyon
- Kuluçka
- Kompetan hücreler (20 ul bakteri ya da 50 ul maya) tek bir kana düşük tuzlu tampon (<50 mM tuzu) saklanan işaretli moleküllerin 5 ul kadar ilave edin ve buz üzerinde 10 dakika inkübe edilir.
Not: stok çözeltileri floresan işaretli moleküllerin konsantrasyonu ve dolayısıyla elektroporasyon önce doğrudan yükleme verimliliği ile ilişkili olan bir hücreye ilave edilen işaretli moleküllerin miktarı (Şekil 3 ve Tartışma). Bazı proteinlerin düşük tuz koşulu ile daha az uyumlu olarak, depolama tamponu içinde tuz konsantrasyonu arttırılabilir ama hücrelerin önceden elektroporasyon ilave işaretli moleküllerin miktarı daha sonra bir düşüş olması gerekir. - (Sırasıyla, bakteri ve maya için, 0.1 ve 0.2 cm arayla) önceden soğutulmuş elektroporasyon küvetine hücreleri ve etiketli biyomoleküllerin karışımı aktarın. Yavaşça çözümün herhangi bir potansiyel kabarcıklarını çıkarmak için bankta küveti dokunun.
- Cu yerleştirinelektroporatörü içine vette ve çözüm için yüksek voltajlı elektrik darbe uygulamak (0,9-1,8 kV / cm, voltaj seçme hakkında daha fazla bilgi için bkz Tartışma). Bu tür bir darbe etiketli biyomoleküllerin hücrelerin içine yayılmasını sağlayarak, hücre membran geçici gözenekler oluşturur.
- Elektroporatörü görüntülenen zaman sabiti 4 ila 6 ms arasında olduğunu kontrol edin. Alt zaman sabitleri genellikle çok yüksek bir tuz konsantrasyonu ve / veya küvet içinde kabarcıklar varlığına bağlı olan ve çok düşük ya da hücrelerin herhangi bir yükleme yol açacaktır.
- Kompetan hücreler (20 ul bakteri ya da 50 ul maya) tek bir kana düşük tuzlu tampon (<50 mM tuzu) saklanan işaretli moleküllerin 5 ul kadar ilave edin ve buz üzerinde 10 dakika inkübe edilir.
- Kurtarma
- Hemen elektroporasyon sonra, örneğin SOC, EZ Zengin Tanımlı Orta, YPD'de veya hücrelere herhangi bir zengin ortam olarak zengin orta 500 ul ekleyin.
- Bakteriler için, 37 ° C 'de örnek ve 2-10 dakika boyunca, maya için 29 ° C inkübe edin. Kullanıcı büyüyen ve elektroporasyon sonra bölünen hücrelerin yüzdesini değerlendirmek isteyen canlılık ölçümleri için, w gibi uzun bir iyileşme süresi (1 saate kadar) kullanıne ilk hücre bölünmesi öncesinde böyle bir gecikme sürelerini gözlemlemek.
- Yıkama adımları
- 3300 x g'de, 4 ° C'de 1 dakika boyunca hücrelerin aşağı iplik olmayan içsel biyomoleküllerin kaldırmak için hücreler yıkanır. Süpernatantı atın ve 500 ul PBS hücrelerin tekrar süspansiyon.
Not: her bir numune için, işaretlenmiş biyomoleküllerin aynı miktarda suretiyle inkübe elektropore ve ana örnek olarak aynı şekilde yıkandı olmayan hücrelerin bir negatif kontrol hazırlar. - Önceki adımları 3 kez tekrarlayın.
- Protein içselleştirme durumunda, ilgi konusu işaretlenmiş proteinin özellikleri ve davranışa bağlı olarak yıkama işlemini optimize eder. Aşağıdaki adımlar olası optimizasyonlar örnektir:
- dış hücre zan 22 yapışabilir olmayan içsel proteinleri uzaklaştırmak için, 100 mM NaCI ve% 0.005 Triton X100 içeren kullanarak ilk 3 yıkama çevrimi gerçekleştirinsup> 26.
- Filtre elektroporasyona hücreleri pipetleme 1.5 ml mikrosantrifüj tüpü içine yerleştirilmiş bir 0.22 mikron gözenek çapı filtre ile Elektroporasyona tabi tutulan hücreler filtre. 800 xg'de 3 dakika ve 4 ° C aşağı doğru döndürün. Flow-through atın. Hücreleri üzerinde 500 ul Yeni PBS ekleyin ve daha önce olduğu gibi bir kez daha onları dönmeye ve 22 kez bu adımları yineleyin.
- Olmayan içsel protein sindirimini izin vermek için birinci yıkama çevrimi sırasında proteaz K küçük bir miktar (500 ul PBS içinde 10 ng) ekleyin.
- dış hücre zan 22 yapışabilir olmayan içsel proteinleri uzaklaştırmak için, 100 mM NaCI ve% 0.005 Triton X100 içeren kullanarak ilk 3 yıkama çevrimi gerçekleştirinsup> 26.
- 3300 xg'de 1 dakika ve 4 ° C hücreleri aşağı Spin. Süpernatantı atın ve PBS 150 ul hücreleri tekrar süspansiyon.
- Üst lamel kaldırarak ve damlacık yoluyla hücre süspansiyonu damlacık 10 ul yayarak agaroz pad üzerinde yüklü hücre çözümü yaymak. Kullanılmayan bir temiz yandı lamel (No 1.5 kalınlığı, mikroskop objektif özellikleri eşleşen) t Değiştirçok nazikçe slaytta ped ve basının o üst.
- Farklı örnekleri görüntüleme sırasında opak kutusuna yastıkları saklayarak ışıktan electroporated hücreleri koruyun.
- 3300 x g'de, 4 ° C'de 1 dakika boyunca hücrelerin aşağı iplik olmayan içsel biyomoleküllerin kaldırmak için hücreler yıkanır. Süpernatantı atın ve 500 ul PBS hücrelerin tekrar süspansiyon.
4. Mikroskop veri toplama
Not: yaşayan mikroorganizmalar Tek hücreli ve tek-molekül floresan mikroskopi herhangi bir uygun floresan mikroskop yapılabilir (özel-yerleşik veya ticari).
- Ayarlar
- Geniş alanlı veya HILO aydınlatma
- Herhangi bir TIRF / tek-molekül mikroskop ile görüntü örnekleri.
Not: Örnek olarak, biz bir TIRF set-up ile laboratuarda özel bir ters mikroskop kullanmak. Bir 532-nm ve 637 nm diyot lazer gelen kirişler kombine ve objektif arka odak düzlemi üzerine odaklanarak önce collimated edilir. Numuneden Floresan uzun pas ve çentik filtresi kullanılarak ikaz ışığı ayrılmış, aynı amaca aracılığıyla toplanan ve yeniden ayrılmıştırBir dikroik ayna kullanarak d ve yeşil kanalları. iki kanal bir elektron çarparak charge-coupled cihaz (EM CCD) kamera çipinin ayrı yarısı üzerine görüntülü. Videolar kinetik modunu kullanarak kaydedilir. Beyaz ışık ve görüntüler, bir beyaz ışık lambası ve bir aydınlatma kaynağı olarak mikroskop bağlı olan bir soğutucu vasıtasıyla elde edilir. - Genel tek-molekül gözlem için, TIRF veya Hilo 23 mikroskop aydınlatma modu (HILO görüntüleme karşı TIRF hakkında daha fazla bilgi için bkz Tartışma) ayarlayın. Yerine lamel ile temas alt zarının daha iç hücre, bakınız 4.5.4 Bir TIRF mikroskop bir HILO modunu ayarlamak için, lamel yüzeyinden biraz daha yüksek odak (görüntü kaydırmak için hafifçe uyarma ışık geliş açısını azaltmak ).
- Hücre düzeyinde analizi için, uzun tek-molekül deneyler veya adım adım photobleaching analizi izleme, bir widefield modu ensuri için mikroskop aydınlatma modunu ayarlayınBütün hücre hacmi sürekli gözlem ng ve bu nedenle tüm içselleştirilmiş etiketli moleküllerin.
- Herhangi bir TIRF / tek-molekül mikroskop ile görüntü örnekleri.
- Tipik olarak, 0.5-3 mW civarında kullanım uyarma güçler (~ 50-400 W / cm 2).
Not: Alt lazer güçler, uzun ömürlü floresan gözlem ve yüksek lazer güçler daha yüksek uzaysal çözünürlüğü veya kademeli photobleaching analizi için gerekli olabilir iken (1 dakika) üzerinden izleme ulaşmak için yararlıdır. - 15 ms daha genel gözlem ve yoğunluk ölçümü için 100 ms deneyler izlemek için değişen pozlama süreleri kullanın. Not: Diğer kare hızları ve şekilleri özellikle hızlı difüzyon türler 30 eğitim için, stroboskopik aydınlatma gibi kullanılabilir.
- TIRF mikroskopta, ~ 100 nm / piksel piksel uzunluğunda elde edilen büyütülmüş bir elektron-çarparak CCD (EMCCD) kamera floresan kanalı kaydedin. TIRF kurulum referans 26 daha fazla ayrıntı tarif olduğunu.
- Geniş alanlı veya HILO aydınlatma
- Veri toplama
- Kapatın veya deney başlangıcına kadar lazer aydınlatma engellemek. Nedeniyle aşırı maruz kalma için kameraya zarar görmesini önlemek için kapalı EMCCD kamera kazancı Anahtarı.
- Hedefe yakın hücreyi getirmek için, baş aşağı mikroskop sahnede, aşağı bakacak şekilde hücre kaplı tarafı agaroz ped sandviç yerleştirin. Iletilen ışık mikroskobu modunda 28 hücreleri üzerinde odağı ayarlayın. Hücreyi bulmak için beyaz ışık görüntüleme görüntüsü altında her hücrenin bir görüntü kaydetmek beyaz ışık kapatmadan önce özetliyor.
- Laboratuar ortam ışığı numuneyi koruyun.
- HILO uyarma modu için, lamel yüzeyine yakın tek örnek bölümü aydınlatılarak her biri, maksimum sinyal-gürültü oranı uyarım ışın açısını ayarlamak.
- HILO aydınlatma elde etmek için, 100x NA 1.4 objektif 28 (yüksek NUME arka odak düzlemi içine lazer ışını odakörneğin 1.45 veya 1.49 olarak rical aralıklı) de uygundur. Kiriş bir açı ile objektif çıkar ve böylece kiriş dik odaklama lensi kaydırarak, odak objektif merkezi dışında hareket eder.
- Dışı arka plan sinyali karşı sinyal-gürültü oranı, hücre içi floresan yoğunluğu en üst düzeye çıkarmak amacıyla mercek konumunu ayarlayın.
- Kamera kazancı Anahtarı ve lazer açmadan önce veri toplama başlar.
- Veri kaydederken, önce veya floresan verileri kaydettikten sonra her FOV bir beyaz ışık görüntü elde; Bu floresan kanalları hücre sınırlarını belirlemeye yardımcı olur.
- Canlılık tahmini için
- Hücreler elektroporasyon sonra büyümeye izin agaroz pad düşük-floresan zengin ortamı kullanın.
- Çalışılan mikroorganizma (37 ° C, E. coli, 29 ° C'de, S. cerevisiae için en uygun sıcaklığa mikroskop dengeye) Objektif ısıtıcı sistemi ile.
- Kayıt hem beyaz ışık ve floresan görüntüleri her 30 dakikada bir, tüm veri kaydı sırasında görüş aynı alanda kalması emin. Hücreler bölmek başlamadan önce ≈1 saat bir gecikme genellikle görülmektedir.
- Hücre başına içselleştirilmiş biyomoleküllerin sayısını sayma
- Yüksek değerler (2-3 mW) ve uzun pozlama süresi (100 ms) için lazer gücünü ayarlayın.
- Tüm hücre aydınlatmak amacıyla modunu Widefield için aydınlatma ayarlayın.
- Gibi rekor filmler floresan photobleaching tamamlanmasından sonra ek kareler (50-100 kare) kaydetmek için emin adım 4.2 tarif.
5. Veri analizi
- Genel analizi
- Böyle özgür yazılım ImageJ gibi bir görüntüleme yazılımı kullanarak beyaz ışık ve floresan uyarımları hem kaydedilmiş görüntüleri ve filmleri, analiz.
- ImageJ, Dosya mikroskop (TIF formatında) kaydedilmiş görüntüleri veya filmleri> Aç> Sizin dosya konumunu açın.
- Niteliksel bir bilgisayar ekranında floresan yoğunlukları karşılaştırmak için,> Tüm floresan görüntüleri Image aynı parlaklık ve kontrast ayarları ile görüntülenir emin olun> Parlaklık / Kontrast ayarlayın. Seçilen bir görüntü için elle veya otomatik olarak ayarları yapın düğmesine basın "Set" ve "diğer tüm görüntülere yaymak" seçeneğini seçin.
- "Min & max gri değer" ve "gri değeri ortalama" Analyze> Set Ölçümler ve (en azından) "Alan", "Standart sapma" seçin: ayıklamak için bilgi türünü ayarlayın.
- > Ölçü, hücre floresan yoğunluklarının karşılaştırılması alan s ImageJ Freehand seçim düğmesini kullanarak ilgi seçin ve hücre yoğunlukları Çözümle ayıklamak için. Ortaya çıkan tablo, ölçüm değerleri içerir vekaydedilir ve / veya diğer yazılım kopyalanabilir. "Mean" değer seçilen alanda piksel başına ortalama yoğunluğuna karşılık doğrudan hücreler arasında veya bir hücre ve arka plan arasında mukayese edilebilir.
- Bir Electroporated hücre örneği olarak, bir hücre piksel başına ortalama yoğunluğu negatif kontrol piksel artı 3 kat standart sapma (Av (ı hücre yüklenen)> Av (I -EP) + başına ortalama yoğunluğu büyükse yüklenen sayılır 3 * StandartSapma (I -EP)).
- Numunelerin kalitesi ve yükleme değerlendirmek amacıyla sahte renkli floresan bindirme görüntüleri ve filmleri oluşturun.
- ImageJ, bu tür beyaz ışık görüntü ve Görüntü> Renkler aynı FOV karşılık floresan görüntü olarak bindirme görüntüler> kanallar Birleştirme. Beyaz ışık için her görüntü (C4 (gri bir renk) seçin, C1 kırmızı kanal için (kırmızı), C2 (yeşil kanal ... vb yeşil.).
- KontrolBindirme floresan hücre sınırları içinde yer almaktadır görüntünün (beyaz ışık görüntü) ve arka plan floresan, düşük ve homojen (hücre sınırları dışında hiç parlak noktalar) üzerinde.
- Hücrelerin çok sayıda analiz etmeden önce, boş hücre görüntülere benzer olumsuz numune karşılık nitelik görüntüleri vardır kontrol ve Electroporated hücrelerden çok daha düşük yoğunluklar görüntüler.
- Canlılık deneyleri için, elle (4.2.6 bakınız) zamanla büyüyen aynı görüş alanında olmayan bölünmesini ama (özdeş) gözle görülür sağlam ve hasarlı (ölü) hücrelerin bölünmesi yüzdelerini saymak.
- Yeterli istatistik toplamak amacıyla numune (elektropore, negatif kontrol ve boş hücreler) başına en az 200 hücre canlılığı değerlendirmek.
- Böyle özgür yazılım ImageJ gibi bir görüntüleme yazılımı kullanarak beyaz ışık ve floresan uyarımları hem kaydedilmiş görüntüleri ve filmleri, analiz.
- Hücre-tabanlı analiz
- Adım adım photobleaching analizi ile hücre başına içselleştirilmiş biyomoleküllerin sayısını sayma
- Selecti göre ayır hücreleriImageJ Freehand seçim düğmesini kullanarak ilgi alanı ng ve hassas hücre (zarını hücre eşdeğer) çevreleyen bir şekil çizmek.
- Görüntü> Yıgıt> Arsa Z-ekseni Profili zamanla hücre yoğunlukları ayıklayın. Elde edilen grafik belirli hücre için bir photobleaching eğrisi sonuçlanan her film çerçevesi karşı hücre sınırları içinde bölge için piksel başına ortalama yoğunluğunu temsil eder. Daha düşük Asimptota (arka plan floresan) ulaşan hücre yoğunluğunun başlangıç üstel azalma içerir. Ölçüm değerleri ve "Kaydet" veya "kopyala" üzerine tıklayarak kaydedilir ve / veya diğer yazılım kopyalanabilir.
- Bir elektronik tablo sütunu içine kopyalayın ve ağartma değerlerini yapıştırın (çiğ).
- Son 50-100 kare (düşük asymptote) için elde edilen çiğ değerlerinin ortalaması alınarak (I auto) photobleaching sonra kalan piksel başına ortalama otofloresans hesaplayın.
- Sİlk ışıkla ağartma eğriden o hücre için photobleaching sonra kalan piksel başına ortalama otofloresans ubtract: Ben ağartma = çiğ - Ben otomatik.
- Kullan bazal-çıkarılır (ben kare karşı bleaching) timetraces photobleaching nedeniyle tek floroforla 26 ağartma ortalama adım boyutu (üniter fluorofor yoğunluğu) değerlendirmek için en az 10 kuantize adımları gösteren.
- Üniter fluorofor yoğunluğu başlangıçtaki esas çizgi-çıkartılır hücre yoğunluğunu (I t = 0 zamanında ağartılması) bölünmesi ile hücre başına içsel moleküllerinin sayısını değerlendirmek.
- Tek hücreli FRET verimliliği
- (Donör uyarma üzerine) hem donör ve alıcı emisyon kanallarında piksel başına ortalama hücre yoğunluğunu ölçmek ve her kanal için hücre sınırları içinde 5.1.1.4 açıklamak gibi.
- Her ch arka planda için ortalama piksel yoğunluğunu ölçmekslayt boş alan frekanslarını.
- Piksel başına ortalama yoğunluğu bu arka plan yoğunluğunu çıkartın. Donör uyarma üzerine toplam (alıcı + donör) tarafından bölünmüş arka plan çıkarılır alıcı yoğunluğu arka plan çıkarılır yoğunluğu hesaplayarak, her hücre için FRET hesaplamak için bu arka plan çıkarılır floresan yoğunlukları kullanın: (Ben + Ben bağış kabul) / alıcı
- Adım adım photobleaching analizi ile hücre başına içselleştirilmiş biyomoleküllerin sayısını sayma
- Tek-molekül analizi
- Tek moleküllü izleme ve difüzyon analizi
Not: canlı hücrelerde floresan moleküller difüzyon ve görünen yayılma katsayısı değerlendirmek için izleme için protokol 28 26 tarif edilmiştir.- Kısaca, bir 2D eliptik Gauss tarafından her karede tek fluorophores görüntüleri uyacak. Onlar 5-7 piksel (0,48-0,67 mm) bir pencere içinde ardışık çerçeve ortaya eğer bağlantı parçaya molekülleri lokalize. Bir Memor kullanın1 çerçevenin y parametresi nedeniyle yanıp veya cevapsız lokalizasyonu bir floroforun geçici kaybolması için hesap.
- In vivo smFRET analizinde
- Manuel ImageJ bir film geçerek filmleri lokalize molekülleri iç hücreleri belirlemek ve FRET (alıcı) kanal hareketsiz (ya da oldukça hareketsiz) molekülleri tespit.
- Hareketsiz bir moleküle karşılık gelen alıcı ve verici kanal yoğunluklarını ayıklamak için, (bir ~3-piksel yarıçapı kullanarak, her bir florofor etrafında daire) ImageJ "Oval" seçim düğmesini kullanarak her kanalda molekülün etrafında alanı seçin ve > molekül yoğunlukları Çözümle Tedbir ayıklayın. Ortaya çıkan tablo, ölçüm değerlerini içerir ve kaydedilir ve / veya diğer yazılım kopyalanabilir.
- Incelenen tüm karelerin üzerine slayt boş bir alanı aynı büyüklükte bir daire ortalama piksel yoğunluğu gelen kanal başına arka plan değerlerini hesaplayın.
- Tek hücrede olduğu gibi, floresan (donör uyarma üzerine) donör ve alıcı kanalları arka plan çıkarılır floresan değerlerini kullanın ve zaman izlerini FRET (5.2.1.7 bakınız) davayı FRET.
Not: Otomatik ve sağlam analiz ve algoritmalar Kaynaklar, 26-28, 31 tarif edilmiştir.
- Tek moleküllü izleme ve difüzyon analizi
Sonuçlar
Örnek hazırlanması
protokol farklı adımlar, Şekil 1 'de şema olarak sunulmaktadır. Bir örnek olarak, çift etiketli (donör ve alıcı boyalar), DNA fragmanları ile bakteri yükleme temsil etmektedir. DNA internalizasyonundan Örnek sonuçlar Şekil 2'de gösterilmektedir. Her bir elektroporasyona numune için, boş hücreler olmayan elektroporate edilmiş hücrelerde için veriler (bakınız Şekil 2) kaydedildi. "Boş hücreler" ne floresan biyomoleküllerin ne elektropore ile kuluçkaya hücreleri elektrouyumlu karşılık; floresan kanalda kendi yoğunluğu aynı deneysel koşullar (lazer gücü, zaman çözünürlüğü, sıcaklık, vb) kapsamında otofloresans seviyesini yansıtır. "Non-Elektroporasyona tabi tutulan hücreler" (diğer bir deyişle -EP, yani, eksi AP) hücreler, floresan biomolec ile inkübe edilmiştir elektrouyumlu olan bir negatif kontrol tekabültim ama elektropore değil. Bu non-Elektroporasyona hücreler boş hücrelerin otofloresansı benzer ve yüklü, Electroporated hücreler tarafından görüntülenen floresan yoğunluğu önemli ölçüde daha düşük bir floresan seviyesi göstermelidir. Bu dış hücre zarına yapışmış olabilecek herhangi olmayan içselleştirilmiş etiketli biyomoleküllerin kaldırılmasını onaylar.
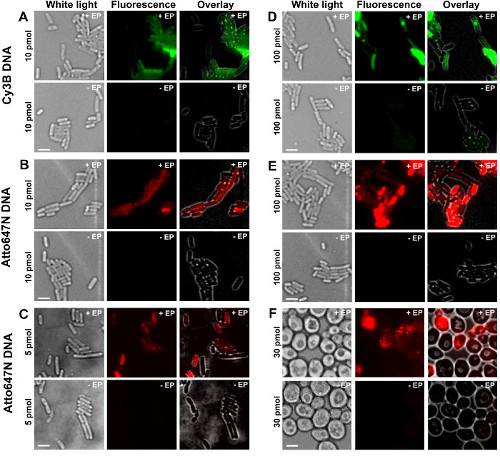
Şekil 2: bakteri farklı konsantrasyonlarda farklı floroforlar ile etiketlenmiş dsDNA'nın içselleştirme (AE) ve maya (F) için Temsilcisi sonuçları sağa Sola:. Beyaz ışık, floresan ve bindirme görüntüler. - / + EP elektroporasyon ile / olmadan inkübasyon gösterir. Ölçek çubukları: 3 mikron. C. Cy3B dsDNA, 10 pmol E. coli. B. ATTO647N dsDNA, 10 pmol E. coli. C Alexa647 dsDNA, 5 pmol E.coli. D. Cy3B dsDNA, 100 pmol, E.coli. E. ATTO647N dsDNA, 100 pmol E. coli. F. ATTO647N dsDNA, 30 pmol Maya. Bu rakam referans 26 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Hücre başına içselleştirilmiş biyomoleküllerin sayısını sayma
işlem, birbirine Etiketli DNA farklı konsantrasyonları ile elde edilen temsili sonuçlar, Şekil 3 ve Yardımcı film 2 içinde sunulmaktadır ışıkla ağartma analizi kullanılarak hücre başına içsel etiketli biyomoleküllerin sayısını tahmin etmek. Hücre yükleme verimliliği kuluçkaya etiketli DNA başlangıç miktarı artar, bir "tek-molekül" seviyede (<10, Ek Film 2B) bir "topluluk" seviyesine (> 10 den ayarlamak için kullanıcıya hücre başına etiketli moleküllerin sayısını izin , Ek Film 2A). Yüklenen hücrelerin yüzdesini tahmin bir sağlam yol to, olmayan Electroporated hücrelerin ortalama hücre yoğunluğu artı 3 kat standart sapma (yani, Av (I-EP) + 3 * StdDev (I-EP) Av = ortalamanın üzerinde bir hücre yoğunluğu görüntüleme Electroporated hücrelerin sayısını I = piksel şiddeti, std. Dev. = standart sapma ve -EP = olmayan elektroporasyona), Şekil 3'te gösterildiği gibi.
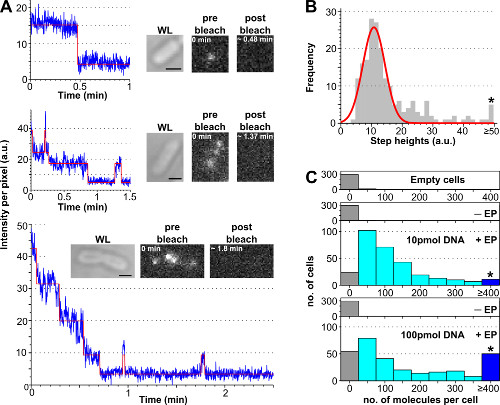
Şekil 3:. Photobleaching analizi kullanılarak içselleştirilmiş moleküllerin sayısını sayma (A) Tek hücreli analizi photobleaching. Floresan yoğunluğu timetraces örnekleri (mavi: ham veri; kırmızı: fit; ekler: WL öncesi ve beyazlatma sonrası ATTO647N-etiketli dsDNA'ya yüklü E. coli floresan görüntüleri). En: Tek adım beyazlatma olay. Orta: ağartma gösteren ± 3 molekülleri ihtiva eden hücreve yanıp sönen. Alt: En az 10 moleküllere tekabül> 10 adım içeren hücre az 6 ayırt adımlar içeren 57 hücrelerinden otomatik adım uydurma algoritması tek adım yüksekliği yoğunluklarının (B) Histogram.. Tek-Gauss uyum saniyede 8100 fotonların bir üniter fluorofor yoğunluğu karşılık, 11 ± 3 au merkezli edilir. yıldız üstünde veya üniter fluorofor yoğunluğu ile ilk floresan yoğunluğu bölünmesi sonra hesaplanan ATTO647N dsDNA'nın farklı miktarlarda ile electroporated hücre başına içselleştirilmiş moleküllerin eşit 50 au (C) Histogram tüm basamak yükseklikleri toplama bin işaretler. Alt en: boş hücreler (örneğin, floresan moleküller ile inkübe değildir ve elektroporasyona olan) non-elektroporasyona (ancak floresan moleküller, adı -EP ile inkübe) ve elektroporasyonlu hücreler, 10 ve 100 pmol (EP + adlandırılır) dsDNA inkübe edildi. Boş ve olmayan electroporated hücreleri karşılıkotofloresansı için, elektroporasyona ise hücreler (≥ 4 molekülleri yıldız işaretli bin bakınız), 100 pmol de yüksek yüklü hücrelerin daha yüksek bir oranda içsel bir molekül, geniş bir dağılım göstermektedir. Içselleştirme verimi 10 ve 100 pmol numuneler için (Int hücrelerin oranı. + 3x std. Dev. Sigara -EP numunenin ortalama>) sırasıyla% 94 ve% 90 idi. 10 pmol dsDNA için 121 ± 106 molekülleri ve 100 pmol dsDNA için 176 ± 187 moleküller: Hücre başına içselleştirilmiş moleküllerin sayısını ortalama. Ayarlar: 100 ms pozlama, geniş açılı aydınlatma. Ölçek çubukları: 1 mikron. Bu rakam referans 26 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Hücre yükleme ve canlılığı
Etiketli biyomoleküllerin miktarının değiştirilmesi ek olarak önce elektroporasyon hücrelere ilave,Kullanıcı elektroporasyon sırasında (Şekil 4, Ek Film 1) farklı alan güçlerini seçerek ayar içselleştirilmiş moleküllerin miktarını yapabilirsiniz. Yüksek alan kuvvetleri daha içselleştirilmesi verimlilikleri yol, ancak hücre canlılığı hafif azalmaya yol. Protein içselleştirilmesi için, bir filtrasyon adım kullanımı olmayan içselleştirilmiş etiketli proteinleri (3.3.3.1.1 bakınız) giderilmesine yardımcı olabilir. Bu gibi durumlarda, hücre filtrasyon gözlenen floresan proteinleri gerçekten bakteriyel sitoplazma içinde içsel sağlar; Biz (Daha fazla bilgi için, REF 22) Ancak, bu filtrasyon de hücre canlılığı üzerine olumsuz etkisi vardır, unutmayın.
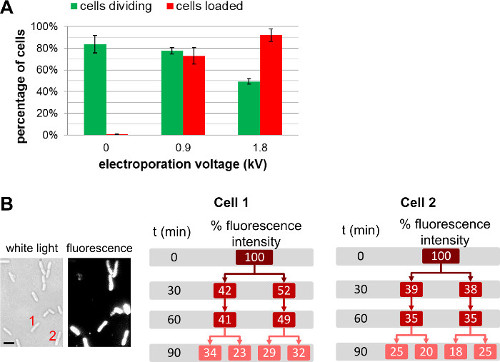
Şekil 4: Hücre yükleme ve canlılığı üzerine elektroporasyon gerilim Etkisi (A) yükleme effic üzerinde elektroporasyon alan gücü etkisini temsil eden Çubuk grafik.iency (kırmızı çubuklar) ve hücrelerin (yeşil çubuklar) canlılığı. 37 ° C'de bir agaroz yastığı 1 saat sonra olmayan elektroporasyona hücre (0 kV / cm) bölme 84 ±% 8. Aynı koşullar altında, 78 ±% 3 ve 0.9 kV / sm ve 1.8 kV / cm elektroporate edilmiş hücrelerde 49 ±% 3, sırasıyla 1 saat sonra bölün. Hücrelerin 92 ± 6% 1.8 kV / cm yüklenir yüklenirken verimi için, hücreler 73 ±% 8, 0.9 kV / cm yüklenir. Hata çubukları üç bağımsız ölçümlerinden hesaplanan standart sapmayı temsil eder; 200'ün hücreler her bir numune ve her tekrar için analiz edilmiştir. Birkaç nesil boyunca hücre canlılığı hafif zararına elektroporasyon gerilimi ile genel yükleme verimi artar. (B) Hücre bazlı floresan ölçümleri genel floresan yoğunluğu hem kızı hücreleri arasında eşit olarak paylaşılır olduğunu göstermektedir. Hücre 1 ve 2 t = 0 Ölçeğinde (solda) beyaz ışık görüntüdeki hücre sayısı ve floresan görüntü anlamına gelirBar: 1 mikron). Bu şekil, başvuru 26 modifiye edilmiştir.
Protein içselleştirme
Protein içselleştirilmesi için Temsilcisi sonuçları Şekil 5A & B vardır. Mümkün önce elektroporasyon gibi protein örnek geri kalan serbest (tepkimeye girmemiş) boya kadar çıkarmak için özellikle önemlidir. Şekiller 5A ve B, Cy3b etiketli Klenow Fragment örnek (KF, E. coli DNA polimeraz I Klenow fragmanı olduğu Cy3b-KF, 66 kDa), sadece% 1 serbest boyasını içeren örnekler ise; genel hücre yükleme gibi boya katkısı ihmal edilebilir. Serbest boya eşdeğer bir miktarı ile elektropore (etiketli protein aynı miktarı ile kuluçkalanmıştır) olmayan elektroporate edilmiş hücrelerde hem de ilgi elektroporasyona numune karşılaştırma olarak hücreler gözlenen floresan moleküller sağlamak için gerekli olan iki kontrolleri teşkilgerçekten etiketli proteinleri içselleştirilir.
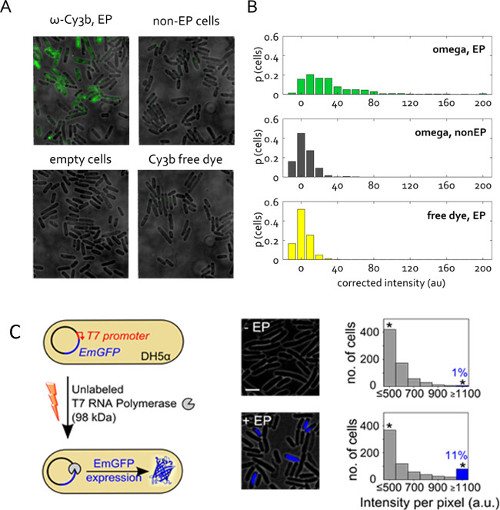
Şekil 5: canlı bakteri protein içselleştirilmesi (A) görüş Temsilcisi floresan bindirme alanı.. Hücreler sadece% 1 bedava Cy3b boyası içeren bir protein stok çözeltisinden 50 pmol rnap ω alt birimi ile 1.4 kV geriliminde elektropore. Sigara Elektroporasyona (non -EP) ve boş hücreler, daha önce olduğu gibi tanımlanır. Serbest kalan boya rnap ω Electroporated örnekteki gibi aynı konsantrasyonda internalize edildi. 1 mW, (A) numuneleri için düzeltilmemiş hücre ortalama yoğunlukları 50 ms maruz kalma. (B), dağıtım de geniş alan modu, 532 nm uyarım Imaging, toplam hücre sayımı oranı verilmiştir. Numune başına 400'den fazla hücre dilimli edildi. Bu rakam referans 22 modifiye edilmiştir. Unla (C) içselleştirilmesibir T7 promoterinin kontrolü altında, pRSET-EmGFP plazmid kodlayan zümrüt GFP (EmGFP) taşıyan elektro DH5a içine Beled T7 RNA polimeraz (T7 rnap, 98 kDa) sahiptir. Sol: tahlil şematik. Orta: floresan bindirme. Sağ: kuluçkalanmıştır ve T7 rnap (alt) ile elektroporasyona olmayan elektroporasyona örnek (üst) ve hücreleri için hücre bazlı floresan yoğunluklarının histogram; Electroporated hücrelerin yaklaşık% 11 yüksek floresan yoğunluğu göstermektedir (Int hücrelerin fraksiyonu.> + ortalama 3x Std. Dev. dışı -EP numunesinin) EmGFP ifadesini göstermektedir. 3 um: yıldız üzerinde veya eşit 1,100 au Ölçek çubuğu tüm yoğunlukları toplama kutuları gösterir. Bu şekil, başvuru 26 modifiye edilmiştir.
Şekil 5C proteini elektroporasyon başka bir uygulama sunuyor. Burada, Electroporated protein etiketsiz, ama onun içselleştirilmesi gözlemlenebilir floresan yanıtı tetikler. Bu deney öncesi doğrularSense ve hücre sitoplazması içinde elektro proteinlerin işlevleri. Etiketsiz T7 RNA polimeraz (98 kDa) E. içine içselleştirilmiş edildi bir T7 promotörü 26 kontrolü altında floresan protein EmGFP için bir plazmid kodlayan ihtiva eden E. coli suşu DH5a. T7 RNA polimeraz için gen DH5a içinde mevcut olduğu gibi, deneylerde EmGFP sentezleme fonksiyonel T7 RNA polimerazı, elektroporasyon (Şekil 5C) ile hücrelere dahil olmasını gerektirir. 1 umol T7 rnap hücrelerin>% 11 ile elektroporasyon tarafta (mavi bar, Şekil 5C), negatif kontrol daha yüksek flüoresans sergilemiştir (T7 rnap aynı miktarı ile inkübe ancak elektroporasyona yok). Bu sonuç, elektroporasyon tarafından içselleştirilmiş T7 rnap moleküllerinin bir kısmının in vivo kendi bütünlüğünü korumak ve hücre sitoplazmasında amaçlanan işlevlerini gerçekleştirebilirsiniz kurar.
In vivo tek molekülün de FRETve tek hücre seviyeleri
Son olarak, canlı bakteri çift etiketli türlerin içselleştirme ve analiz 3. Adı floresan protein füzyonları, in vivo smFRET çalışmalar için ideal değildir, Şekil 6 ve ek film sunulmuştur, elektroporasyon kullanılarak canlı hücreler içine iki kez işaretlenmiş biyomoleküllerin iletme kabiliyeti biridir Bu yöntemin büyük varlıkların. Şekil 6A tek hücreli (donör-alıcı FRET çifti olarak Cy3B ve Atto647N fluorophores kullanarak) farklı FRET DNA standartları ile yüklenen bakterilerin analizi FRET sunuyor. Hücreler 0.17, 0.48 görünen FRET verimliliği ile üç kısa çift etiketli dsDNA FRET standartlarının 20 pmol (E *) ile electroporated edilir ve 0.86 in vitro (daha önce 26 belirlenir). Tüm DNA'lar (Şekil 6A, sol) ve her tek hücreli E * dağılımının ana zirve verimli hücrelerine girmek (in vitro sonuçları ile de Şekil 6A kabul, Sağ). Orta ve yüksek FRET örneklerde, düşük bunun nedeni, muhtemelen alıcı ağartma ve Fotofiziksel hareketsizlik, değişken hücre yükleme kombinasyonuna gözlenir beklenenden daha E * (bu nedenle, değişken bir sinyal-gürültü oranı) ve DNA bozulmasıyla hücre popülasyonları .
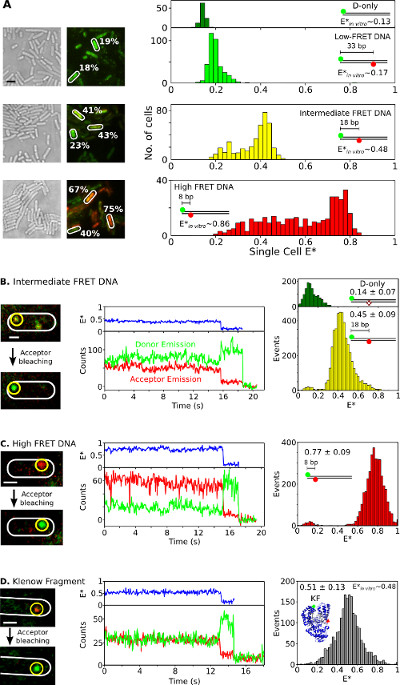
Şekil 6,.:., Tek hücre ve tek molekül için Örnek sonuçlar Topluluğu ve smFRET çalışmalar tek bakteri yaşayan bakteri içinde gözlem FRET düşük sergileyen her biri üç DNA FRET standartlarının 20 pmol yüklü hücrelerin (A) Analizi (~ 0.17) ara madde (~ 0,48) ve yüksek (~ 0.86), FRET (in vitro tek molekül ölçümleri kullanılarak ölçüldüğünde REF 26). Sol: beyaz ışık ve yeşil / kırmızı (FRET) floresan bindirme görüntüleri (Ölçek çubuğu: 3 mikron). Farklı hücrelerden FRET değerlerin örnekleri (beyaz) gösterilir. Teçhizat (yukarıdan aşağıya) ht:. düzeltilmemiş hücre tabanlı FRET (E *) DNA standartlarını FRET donör sadece (koyu yeşil), düşük (açık yeşil), ara (sarı), ve yüksek (kırmızı) için histogramlar (B-D) in vivo smFRET içinde. Hücreler 0.25 pmol orta FRET DNA (panel B), 0.25 pmol yüksek FRET DNA (panel C) ile yüklenir, ve 5 pmol KF (panel D), çift etiketli. Sol sütun: öncesi ve alıcı photobleaching sonra tek bir kare yeşil / kırmızı floresan bindirme. Orta sütun: sarı daire içinde molekülün karşılık gelen zaman izleri. FRET verimliliği, donör emisyon yoğunlukları ve alıcı emisyon yoğunlukları sırasıyla, mavi, yeşil, kırmızı ve görüntülenir. Sağ kolon: donör sadece moleküller (yeşil) ve her bir numune için 20 kez izlerinden (sarı, kırmızı ve gri) donör-alıcı molekülleri FRET histogramlar. Ölçek çubukları: A 3 um, B-D-1 um. Bu şekil, başvuru 26 modifiye edilmiştir.208fig6large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
DNA ya da protein, orta ve yüksek-FRET DNA standartları örnekleri, düşük miktarlarda (0.25 umol) (Şekil 6B, C) ya da, FRET çifti çift etiketli KF (Alexa647 / Cy3B fluorophores 5 pmol Şekil için in vivo olarak smFRET gözlemlemek 6D) E. elektroporasyona tabi olan coli. Bu konsantrasyonlar izleme ve tek moleküllerin izlenmesi FRET, doğrudan yerelleştirme izin birkaç (n = 1-10) etiketli molekülleri ile yüklenen birçok hücrelere yol açtı. Diğerleri hareketsiz görünür veya yavaş (Ek Film 3) yaygın ise bazı moleküller, serbestçe yayılır. 1-30 saniye sürer ve smFRET ayırt edici göstermektedir hareketsizleştirilmiş çift etiketli biyomoleküllerin (Şekil 6, ortada) Timetraces: Örneğin alıcı ağartma üzerine donör ve akseptör floresansta anticorrelated değişimleri (t ~ 16 saniye; Şekil 6B, orta ), tek ardından(örneğin, t +; 19 saniye; Şekil 6B), aşama verici ağartma. Bu tür timetraces (Şekil 6, sağ) in vitro çalışmalar, 26,31,32 yayınlanan ile mükemmel bir uyum içinde olan, bir ortalama değer sonuç elde FRET dağılımlar. Bu sonuçlar içselleştirilmiş DNA'lar ve proteinler üzerinde kantitatif smFRET çalışmaları için yeteneği kurmak, ve (T7 rnap içselleştirilmesi deneyleri tarafından desteklenen) proteinleri elektroporasyon ve içselleştirilmesi üzerine kendi bütünlüğünü ve yapısını korumak öneririz.
Ek Film 1:. Hücre canlılığı Sol: Beyaz ışık görüntüleri. Sağ: floresan görüntüler. Hareketli GIF 10 pmol Atto647 işaretlenmiş DNA ile yüklü bakteri elektroporasyon (1.8 kV / cm) sonra ayrımı gösteren animasyonlu. floresan genel belirgin düşüş kısmen her sırasında meydana photobleaching da hücre bölünmesi üzerine etiketli DNA seyreltme nedeniyle ve birölçümü.
Ek Film 2: Hücre bazlı photobleaching çalışmaları A.. (> 100 Atto647N etiketli DNA moleküllerini ihtiva eden) bir ağır yüklü hücre Örnek örneği. En sol, faiz (kırmızı dikdörtgen) bir hücrenin beyaz ışık görüntüsü. En doğru, birkaç dakika içinde kendi floresan çürümesine gösteren yüklenen hücrelerin film. Ilgi hücrenin genel floresan yoğunluğu çürüme Bottom, zaman iz. Organik flüoroforlar yaşam süreleri FP daha yüksek büyüklükte 2 sipariş (burada ~ Atto647N 41 sn), ışıkla ağartma sergileyebilir. En az 10 işaretli moleküllerin (bu durumda 3) ile yüklü bir hücre B. Örnek örneği. Paneli A. Bottom, tek aşamalı ağartma gösteren ve / veya tek organik floroforlar karşılık gelen yanıp sönen ilgi hücrenin genel floresan yoğunluğu zaman izi ile aynı Üst,. Bu adımların ortalama yüksekliği ~ burada (tek-molekül üniter yoğunluğuna karşılık12 au) hücre başına içselleştirilmiş moleküllerin ilk sayısını tahmin etmek için kullanılmıştır. 300 uW güçte sürekli kırmızı lazer uyarma altında Filmler ve kare başına 100 ms.
Ek Film 3:. Ben n tek-molekül FRET En vivo: Hücreler sürekli nTIRF aydınlatma altında kare başına 50 ms izlenir 0.25 pmol (Şekil 6C gibi) yüksek FRET DNA 1 mW yeşil (532 nm) lazer kullanarak yüklü. Her kare, her kanalda bir yeşil / kırmızı (FRET) floresan bindirme olduğunu. Difüzyon ve hareketsiz kırmızı (bozulmamış) ve yeşil (tek aktif etiket) DNA molekülleri görülebilir. Alt: sarı daire içinde molekül gelen Zaman iz. FRET verimliliği, donör emisyon yoğunlukları ve alıcı emisyon yoğunlukları sırasıyla, mavi, yeşil, kırmızı ve görüntülenir. Anti-ilişkili alıcı ağartma olayı (kırmızı-yeşil-geçişler için) tek-molekül FRET imzalanmasından karşılık gelir.
Tartışmalar
Çoğu parametre hücre elektroporasyon ve veri toplama ilgi biyolojik sisteme ve deney (hücre düzeyinde ya da tek-molekül analizi) kesin doğasına bağlı olarak sırasında değiştiirlebilir. Bakteri içine DNA elektroporasyon Örneğin, işaretlenmiş dsDNA parçalarının 0,25-5 pmol (daha önce ışıkla ağartma gerek kalmadan örneğin.) Doğrudan tek moleküllü tespitine olanak sağlayan, düşük bir içselleştirme verimliliği sağlanır. 5 pmol dsDNA üzerinde, hücreler ağırlıklı olarak tek bir hücre analizi için bir rejim daha uygun yüklenecek eğilimindedir. Bütün etiketlenmiş DNA'lar aynı zamanda, daha önce jel-saflaştırılmış serbest boyanın izlerini tamamen yok etmek için olması gereken bir DNA stok çözeltisinden (floroforu reaksiyona girmemiş). Ayrıca, özellikle smFRET deneyler için DNA bozulması, potansiyel sorunlar, doğal olmayan nükleik asitler, ya da firkete döngüler gibi eksonükleaz erişilebilir terminallerini koruyan motifli DNA'lar kullanılarak ele alınabilir.
Başka Ayarlanamazelektroporasyon e parametresi elektroporasyon sırasında uygulanan alan gücüdür. Düşük alan gücü (yaklaşık 1 kV / cm), tek bir molekül çalışmalar için uygun olan düşük bir yükleme veriminin düşmesine sebep olacaktır. (1.8 kV / cm kadar) yüksek alan kuvvetleri yükleme verimliliğini artıracak; Bununla birlikte, elektroporasyon sonra kapsama alanı ve hücre canlılığı arasında ters bir ilişki vardır (bakınız Şekil 4). Referans için, bakteri ve mantar için elektroporasyonu için kullanılan normal bir alan kuvveti ~ 1.5 kV / cm'dir. zaman sabiti damla kısa sürede herhangi bir ark fenomen küvet içinde meydana gibi beri bu çürüme uzunluğunu temsil eden zaman sabiti, takip için uygun bir parametredir. Normal ayarlar altında, zaman sabiti 4 ms daha büyük olmalıdır; düşük değerler düşük yükleme verimliliği ve hatta olmayan yüklü hasarlı hücrelerin yol açacaktır. En electroporators iki ayarlamak için değiştirilebilir (örneğin, "darbe kesme" veya "şekli darbe" gibi) serbestlik diğer derecelerde teklifHücre yükleme ve canlılık. Ancak biz benzer prosedürler de, bunların zar (tek lipid iki-tabakalı) gerçekten de daha kolay ve elektroporasyon artık bu tür hücreleri ile kullanıldığından uygun Electroporator ayarlarını kullanarak memeli hücrelerine etiketli biyomoleküllerin içselleşmesini izin vermelidir, hem bakteriler ve maya için, bu yöntemi tatbik 21.
Etiketli proteinlerin içe, tüm serbest boya işaretli protein, stok çözelti, önce elektroporasyon arasından çıkarılması gerekiyor. Ücretsiz boya molekülleri nedeniyle kendi küçük boyutu, ilgi proteinlerin üzerinde tercihen içselleştirilmiş ve (beklenen hızlı difüzyon rağmen) veri analizi sırasında ayırt etmek zordur edilebilir. Organik etiketlenmiş proteinin bir numune için bir rehber, elektroporasyon için uygun olduğu gibi, serbest boya kalan miktarı% 2'nin altında olması gerekir 22 (SDS-PAGE floresan taraması kullanılarak tespit edilir). Bu işlem, özellikle önemlidirBazı moleküller Electroporated bakteri veya maya dış zarlarında sopa olabilir gibi. Bu bağlamda, negatif kontrol örneği (herhangi bir floresan etiketli biyomoleküller ile inkübe de elektroporasyona edilmemiş hücreler, Şekil 2) boş hücre otofloresan seviyesi ideal olarak, düşük elektroporate edilmiş hücrelerde açıkça daha düşük hücre başına floresan yoğunluğu, göstermesi gerekir.
DsDNA gibi, etiketlenmiş proteinlerin içselleştirme verimliliği elektroporasyon önce hücrelere ilave biyomoleküllerin miktarı ile bağlantılıdır. Bununla birlikte, bu boyut ve şarj gibi diğer parametreler, içselleştirme bir rol oynar. Küçük proteinler büyük proteinlerin etmiştir (Şekil 5) 26 (98 kDa kadar) başarılı bir şekilde içselleştirilebilir, ancak daha düşük bir randımanla, yüksek içselleştirme etkinliği düşüktür. protein izoelektrik nokta, hücre zarı ile potansiyel etkileşimler ve diğer fizikokimyasal parametrelerelektroporasyon sırasında etkisi hücre yükleme. Sonuç olarak, kullanıcılar etiketli protein (> 50 mcM) yüksek başlangıç konsantrasyonu başarılı yükleme için en iyi şans vereceğini bilerek, kendi sistemi için deneyler optimize etmek gerekir. Elektroporasyon da perturb ve hücrelerin (ya etiketli veya etiketsiz) içine proteinleri ve diğer biyomoleküllerin getirerek hücresel fonksiyonu analiz için yeni bir araç sunar. Bu, T7 RNA polimeraz deneyleri (Şekil 5C) Bu elektroporasyon kullanılarak in vivo gen ekspresyonunu değiştirmek için bir biyomolekülün neden olabilir bir deney gibi bir örnek.
Tek-molekül floresan deneyler yaparken bu lamel yüzeyi (~ 100 nm) üzerinde ince bir bölüm içinde heyecan verici tek floroforlar en iyi sinyal-gürültü oranı sunuyor gibi, TIR aydınlatma genellikle diğer aydınlatma modları üzerinde tercih edilir. Ancak yaşayan mikroorganizmaların içinde difüzyon görüntüleme etiketlenmiş biomoleküller yeniden olabilirquire derin aydınlatma (yukarı, E. coli için 0.8 um). Yüksek sinyal-gürültü oranı muhafaza ederken daha derin aydınlatma, HILO modunda elde edilir. Diğer taraftan, geniş alan görüntüleme kullanıcının yüksek lazer gücü ile bütün bir yüklü hücre ışıkla ağartma ve üretilen yekpare yoğunluğu ile ilk hücre floresan yoğunluğu bölünerek içsel moleküllerinin sayısını tahmin etmek olan aşamalı bir ışıkla ağartma analizi için özellikle önemlidir tek bir molekül (bir ışıkla ağartma aşamasında, Şekil 3) ile incelenmiştir. Kendi yörüngeleri tüm hücre hacmi kapsayacak bile Widefield görüntüleme da ilgi difüzyon molekülleri lokalize etmek amacıyla uzun vadeli molekülü takibi için gereklidir.
Bu protokol, elektroporasyon, hücrelerdeki nükleik asitlerin sağlanması için biyologlar ve biyokimya için standart bir teknik, farklı hücre tiplerinde floresan biyomoleküllerin verilmesi için basit bir yöntem teşkil ne sunulmuştur. Throman, yüksek verimli tekniği kendi doğal ortamında etiketli molekülleri gözlemlemek için eşsiz bir araç sunuyor. Flüoroforlar dalga boyu geniş bir kaplama ile etiketlenmiş ilaveli biyomoleküllerin olarak, doğal olmayan nükleotid ve amino asitler, metal kenetleme maddeleri, çapraz bağlayıcılar, ve tespit grupları gibi birçok kimyasal gruplar ile tadil edilmiş moleküller sağlamak elektroporasyon. İlgi biyolojik sistem hücre gelişimi için gerekli değilse içselleştirme sonra gözlenen proteinler, hücre içi protein havuzunun tüm (veya en) temsil sağlanması, hedef protein için gen kodlaması da silinebilir (veya sersemleyen) . Özünde, elektroporasyon "nakli" canlı hücrelere in vitro biyokonjugatlarda esneklik ve dolayısıyla sentetik biyoloji, sistem biyolojisi çabaları, ve in vivo tek-molekül tespiti yararlanabilir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We thank Stephan Uphoff for discussions.
R.C. was supported by Linacre College, Oxford University. A.P. was supported by the German Academic Exchange Service (DAAD), the German National Academic Foundation and EPSRC. M.S. was supported by the Wellcome Trust. A.N.K. was supported by a UK BBSRC grant (BB/H01795X/1), and a European Research Council Starter grant (261227).
Malzemeler
| Name | Company | Catalog Number | Comments |
| ElectroMax DH5-alpha Comptent cells | Invitrogen | 11319-019 | or any other commercial or lab-mage electrocompetant bacteria or yeast. |
| EZ Rich Defined Madia | Teknova | M2105 | low fluorescence rich media |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | or any classical electroporator for microorganism transformation |
| Certified Molecular Biology agarose | Biorad | 161-3100 | low fluorescence agarose for agarose pad |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1h |
| Single-molecule fluorescence microscope | Home-built | described in REFs | |
| Localization software | Custom-written, available online | MATLAB and C++ software package that can be adapted for localization analysis. | |
| Tracking software | Available online | MATLAB implementation by Blair and Dufresne. |
Referanslar
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Leake, M. C., et al. Stoichiometry and turnover in single, functioning membrane protein complexes. Nature. 443, 355-358 (2006).
- Taniguchi, Y., Kawakami, M. Application of HaloTag protein to covalent immobilization of recombinant proteins for single molecule force spectroscopy. Langmuir. 26, 10433-10436 (2010).
- Xie, X. S., Choi, P. J., Li, G. W., Lee, N. K., Lia, G. Single-molecule approach to molecular biology in living bacterial cells. Annual review of biophysics. 37, 417-444 (2008).
- Lee, J. H., et al. Highly multiplexed subcellular RNA sequencing in situ. Science. 343, 1360-1363 (2014).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Sauer, M. Localization microscopy coming of age: from concepts to biological impact. J Cell Sci. 126, 3505-3513 (2013).
- Dempsey, G. T., Vaughan, J. C., Hao Chen, K., Zhuang, X. Evaluation of fluorophores for optimal performance in localizationbased super-resolution imaging. Nat Meth. 8, 1027-1041 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Meth. 2, 905-909 (2005).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nat. Methods. 9, 480-482 (2012).
- Jaitin, D. A., et al. Massively Parallel Single-Cell RNA-Seq for Marker-Free Decomposition of Tissues into Cell Types. Science. 343, 776-779 (2014).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biol. 14, R124 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat. Methods. 7, 717-719 (2010).
- Zhang, Z., et al. A new strategy for the site-specific modification of proteins in vivo. Biochemistry. 42, 6735-6746 (2003).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. J Cell Biol. 98, 1556-1564 (1984).
- Clarke, M. S., McNeil, P. L. Syringe loading introduces macromolecules into living mammalian cell cytosol. J Cell Sci. 102, 533-541 (1992).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nat. Methods. 7, 203-205 (2010).
- Taylor, L. S. Electromagnetic syringe. IEEE Trans. Biomed. Eng. 25, 303-304 (1978).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16, 6127-6145 (1988).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Sustarsic, M., et al. Optimized delivery of fluorescently labeled proteins in live bacteria using electroporation. Histochem Cell Biol. , (2014).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5, 159-161 (2008).
- Sinha, A., et al. A cascade of DNA-binding proteins for sexual commitment and development in Plasmodium. Nature. 000, 1-5 (2014).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc Natl Acad Sci U S A. 108, E365-E373 (2011).
- Crawford, R., et al. Long-lived intracellular single-molecule fluorescence using electroporated molecules. Biophys J. 105, 2439-2450 (2013).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc Natl Acad Sci U S A. 110, 8063-8068 (2013).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing Protein-DNA Interactions in Live Bacterial Cells Using Photoactivated Single-molecule Tracking. J Vis Exp. , (2014).
- Hohlbein, J., Gryte, K., Heilemann, M., Kapanidis, A. N. Surfing on a new wave of single-molecule fluorescence methods. Phys Biol. 7, 031001 (2010).
- Xie, X. S., Yu, J., Yang, W. Y. Perspective - Living cells as test tubes. Science. 312, 228-230 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proc Natl Acad Sci U S A. 107, 715-720 (2010).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature communications. 4, 2131 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır