Method Article
הפנמה והתבוננות של פלורסנט מולקולות ביולוגיים במיקרואורגניזמים שחיים דרך Electroporation
In This Article
Summary
Studies of biomolecules in vivo are crucial for understanding molecular function in a biological context. Here we describe a novel method allowing the internalization of fluorescent biomolecules, such as DNA or proteins, into living microorganisms. Analysis of in vivo data recorded by fluorescence microscopy is also presented and discussed.
Abstract
The ability to study biomolecules in vivo is crucial for understanding their function in a biological context. One powerful approach involves fusing molecules of interest to fluorescent proteins such as GFP to study their expression, localization and function. However, GFP and its derivatives are significantly larger and less photostable than organic fluorophores generally used for in vitro experiments, and this can limit the scope of investigation.
We recently introduced a straightforward, versatile and high-throughput method based on electroporation, allowing the internalization of biomolecules labeled with organic fluorophores into living microorganisms. Here we describe how to use electroporation to internalize labeled DNA fragments or proteins into Escherichia coli and Saccharomyces cerevisiæ, how to quantify the number of internalized molecules using fluorescence microscopy, and how to quantify the viability of electroporated cells. Data can be acquired at the single-cell or single-molecule level using fluorescence or FRET. The possibility of internalizing non-labeled molecules that trigger a physiological observable response in vivo is also presented. Finally, strategies of optimization of the protocol for specific biological systems are discussed.
Introduction
רוב מחקרי הקרינה בתוך תאי חיים תלויים בשילובי חלבון עם חלבוני ניאון (fps), כגון GFP 1. תגי ניאון אלה מאפשרים לימודים של עותק מספר, דפוס דיפוזיה או לוקליזציה של חלבונים מעורבים בתהליכים כגון ביטוי גנים או תחבורת קרום 2-7. FPS מציע סגוליות תיוג גבוה, יישום קל, והם זמינים במלאי גדול של גרסאות עם photophysical השונים ותכונות כימיות 1. עם זאת, fluorophores האורגני יישאר בחירת ראש לניסויים במבחנה בשל photostability הגדולה יותר (עד 100 פי יציב יותר מFPS) 8,9 גודל קטן, (עד 100 פי נפח קטן יותר FPS) וקלות תיוג intramolecular (בעיקר באמצעות השימוש בשאריות ציסטאין). כל הגורמים הללו הם חשובים במיוחד לקרינת מולקולה בודדת וסריג לומד 10.
COMBIN שיטות הפנמה כמהing היתרונות של תיוג אורגני ובאיתור vivo הוכנס בעשור האחרון; עם זאת, שיטות כאלה או להעסיק תגי פוליפפטידים גדולים יחסית (תגים למשל, TMP, HALO, או 20 kDa SNAP) 11-14, דורשות השימוש בחומצות אמינו לא טבעיות 15, או מוגבלות לתאים גדולים, חד-קרום האיקריוטים (למשל. , לגרד טעינה, טעינת מזרק, microinjection) 16-19.
פרוטוקול זה מתאר שיטת הפנמת רומן, פשוט ותפוקה גבוהה כי זוגות היתרונות של fluorophores האורגנית עם תצפית in vivo. כדי ששיטה זו, אנו מותאמים הליך electroporation הנפוץ להפוך תאים עם DNA פלסמיד 20,21 כדי לטעון מיקרואורגניזמים, כגון E. coli או S. cerevisiae עם מולקולות ביולוגיות שכותרתו אורגנית. הפרוטוקול כולל 4 צעדים פשוטים: דגירה של תאים עם מולקולות ביולוגיות שכותרתו,electroporation, התאוששות תא, ושטיפת תא כדי להסיר מולקולות ביולוגיות-הפנים שאינם. כאן, אנו מציגים פרוטוקול זה electroporation, כמו גם את תהליכי ההדמיה תא וניתוח נתונים ללמוד הקרינה מבוססת תאים ומולקולה בודדת וסריג אותות.
Electroporation מסתמכת על פריקת שדה חשמלי במתח גבוה על פני השעיה תא כוח יונית נמוכה כדי ליצור נקבוביות קרום חולף דרכו מולקולות ביולוגיות יכולות להיכנס לתאים (איור 1) 20,21. בדיוק כמו עם הפיכתו של חיידקים או פטריות עם פלסמיד דנ"א, תאים צריכים להיות מוכנים לפני electroporation כדי להבטיח electrocompetency. הליך זה, בהיקף של כמה צעדי שטיפה במים, מגדיל את החדירות הממברנה ומוריד את החוזק היוני של פתרון התא, כדי למנוע קשתי בקובט electroporation. בפרוטוקול זה, יכולים להיות מוכן תאים כמפורט להלן (ראה פרוטוקול: 1.1) או שנרכשו מספק מסחרי s.
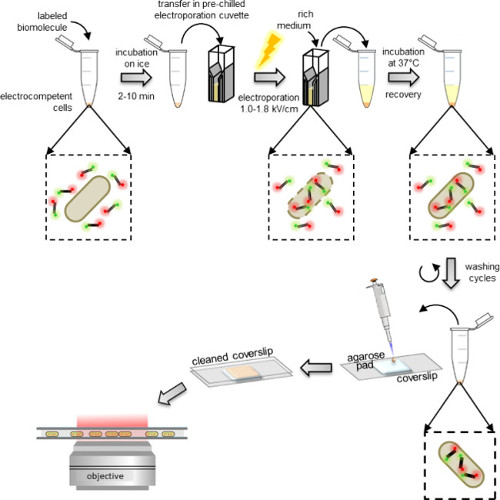
איור 1: ייצוג סכמטי של פרוטוקול ההפנמה משמאל לימין:. להוסיף כמה מיקרוליטר של מולקולות ביולוגיות שכותרת לaliquot של תאי electrocompetent (קטעי דנ"א כפול שכותרתו וחיידקים בדוגמא זו); דגירה 1 עד 10 דקות על קרח ומעביר לקובט electroporation טרום צונן; electroporate ולאחר מכן להוסיף 0.5-1 מיליליטר בינוני עשיר לתאים מייד לאחר; לדגור על 37 ° C (או בטמפרטורה הנדרשת על ידי האורגניזם, למשל, 29 ° C עבור שמרים) כדי לאפשר לתאים להתאושש; לבצע 5 צעדי כביסה כדי להסיר כל שאינן מופנמת-מולקולות עודפות שכותרתו; resuspend את הכדור האחרון ב100-200 μl של חיץ PBS ופיפטה 10 μl על כרית agarose; לכסות את משטח עם coverslip ניקה ותמונה על מיקרוסקופ פלואורסצנטי (במצב רחב שדה או במצב חילו).
התחת = "jove_content"> תאי Electrocompetent מודגרת עם המולקולות הביולוגיות שכותרתו רק לפני electroporation, אשר יכול להתבצע באמצעות תקן electroporators נמצא ברוב המעבדות ביוכימיה. מייד לאחר electroporation, תאים מודגרת במדיום עשיר המאפשר ההתאוששות שלהם לפני הכביסה (איור 1). העודף של אי-הפנימו מולקולות ביולוגיות שכותרתו יוסר ראשון על ידי שטיפה במאגר המכיל ריכוז גבוה למדי של מלח וקצת חומר ניקוי (ראה פרוטוקול: 3.3). הנוכחות של מלח משבשת אינטראקציות אלקטרוסטטיות שאינם ספציפיות שהוקמו על ידי אי-הפנימו מולקולות ביולוגיות שכותרתו שאחרת עשוי להידבק בקרום החיצוני. בדומה לכך, הנוכחות של חומר ניקוי בכביסת החיץ משבשת אינטראקציות הידרופוביות שאינם ספציפיות.
בעוד הפנמת DNA היא פשוטה (איור 2), אמצעי זהירות יש לנקוט כאשר הפנמת חלבונים שכותרתו באמצעות electroporation. ראשית, מניית המדגם של חלבון הנקרא באופן אורגני עשוי עדיין מכיל אחוז קטן של צבע חופשי. מולקולות צבע חינם הן הרבה יותר קטנות מאשר חלבונים ולפיכך יתכן כי הפנימו מועדף. כדי להבטיח כי רובם המכריע של נצפו מולקולות ניאון הפנימו מתאים לחלבון של עניין, מדגם החלבון הראשוני צריך להכיל פחות מ ~ 2% צבע חופשי (איור 5) 22. העודף של אי-הפנימו חלבונים שכותרתו יכול גם להיצמד לקרום התא החיצוני לאחר electroporation; תופעה זו היא חלבון ספציפי וצריכה להיבדק לכל חלבון חדש. אנו מציעים מספר אפשרויות המאפשרות את הסרתם של חלבונים-הפנים שאינם ממדגם התא הטעון (ראה פרוטוקול: 3.3.3).
לבסוף, תאי resuspended בנפח קטן של חיץ פוספט וpipetted על כרית agarose, המאפשרים ההדמיה שלהם במיקרוסקופ פלואורסצנטי. קיבוע על רפידות agarose הוא simplדואר ודרך יעילה של תאי הדמיה על coverslip מבלי לפגוע שלמותם. הכרית צריכה להכיל מדיום תרבות נמוכה הקרינה.
הדמיה תא יכולה להתבצע במיקרוסקופ או בwidefield, סך הקרינה השתקפות פנימית (TIRF) או באמצעות הילו (מאוד משופע וגיליון אופטי רבודה). בתצורה חילו, קרן הלייזר חודרת עמוקה יותר לתוך הדגימה מאשר בTIRF, עדיין לא להאיר את המדגם כולו כלwidefield, המאפשר יחס אות לרעש גדול יותר 23. בהתאם לרזולוצית כוח הלייזר וזמן שימוש, ניתן לספור מולקולות ביולוגיות הפנימו (באמצעות ניתוח photobleaching-שלבים, איור 3), מקומיות, או במעקב 24-28. הפנמה של מבנים שכותרתו כפליים עם זוג סריג של fluorophores מאפשרת כימות של סריג הן בתא בודד או רמות מולקולה בודדת (איור 6).
יכולים להיות מגוונים פרמטרים שוניםבהתאם לפלט הרצוי והמערכת הביולוגית למדה. ראשית, כמות החומר הפנים לכל תא יכולה להיות מכוונת על ידי שינוי הריכוז של מולקולות ביולוגיות שכותרתו נוספה לelectroporation התאים הקודם (איור 2). עוצמת שדה Electroporation תשפיע גם הן את יעילות הטעינה וכדאיויות תא; כצפוי, בזמן שמגביר את יעילות טעינה עם עוצמת שדה גובר, את הכדאיות של תאי electroporated יורדת (איור 4 א). ניתן לכמת את שני פרמטרים על ידי הקלטת אחוז טעון וחלוקת תאים לאחר electroporation. assay כדאיות זה בשילוב עם ההדמיה הקרינה גם מאמת את התצפית של מולקולות ביולוגיות הפנימו בתאים חיים ומאפשר תצפית רציפה במשך כמה דורות (איור 4).
לסיכום, פרוטוקול זה מאפשר ההפנמה של מולקולות דנ"א וחלבון fluorescently שכותרתו לE. coli או S. cerevisiae 26. מולקולות בודדות שכותרתו עם fluorophores האורגני יכולות להיות במעקב עם הרזולוציה spatiotemporal גבוהה ללוחות זמנים בסדר גודל יותר מFPS. לבסוף, שיטה זו תואמת widefield, TIRF וזיהוי confocal, כמו גם תוכניות עירור פעם, כגון ALEX (לסירוגין עירור לייזר 28,29).
Protocol
הכנת 1. תא
- הכנה של חיידקי electrocompetent תוצרת מעבדה
- הכן preculture 5-10 מיליליטר הלילה ממושבה אחת של מתח E.coli של עניין במדיום נמוך הקרינה כגון M9 או EZ עשיר מוגדרים בינוני.
- בבוקר, לחסן תרבות 400 מיליליטר חדש עם preculture הלילה כזה שOD 600 ננומטר מתחיל ב0.02. הוסף ל-400 מיליליטר נמוך הקרינה בינונית 2.5 מיליליטר של 1 M MgSO 4 ו 2.5 מיליליטר של 1 M MgCl 2.
- לגדול ב 37 מעלות צלזיוס ועד 250 סל"ד OD 600 ננומטר מגיע 0.4-0.6.
- לעצור את הצמיחה על ידי מצמרר התרבות באמבט קרח-מים במשך 10-15 דקות.
שים לב: מעתה, לבצע את כל השלבים בC ° 4 (על קרח). - צנטריפוגה דקות תרבות 15 ב 1000 x g. בטל supernatant ו resuspend התא גלולה ב 250 מיליליטר צונן וסטרילי מזוקק H 2 O.
- חזור על צנטריפוגה וresuspension הצעדים twice, ומקטין את נפח מים 100 מ"ל ולאחר מכן 50 מיליליטר.
- צנטריפוגה תרבות 10 דקות ב 1000 x g. בטל supernatant ו resuspend התא גלולה ב 25 מיליליטר H מזוקק המצונן וסטרילי גליצרול 2 O + 10%.
- חזור על צנטריפוגה וresuspension צעדים שלוש פעמים, ומקטין את הנפח של 10% פתרון גליצרול עד 10 מיליליטר, 5 מיליליטר, ולבסוף ל -500 μl.
- Aliquot התאים בaliquots של 20 μl כל, הבזק-הקפאה בחנקן נוזל חנות ב -80 ° C.
- תאי חיידקיים electrocompetent מסחריים
- לדלל aliquot תא מסחרי 1: 1 עם מים מזוקקים צוננים סטרילי. הפוך aliquots 20 μl ולאחסן ב -80 ° C.
- הכנת שמרי electrocompetent
הערה: Electrocompetent S. תאי cerevisiae מוכנים לפני כל ניסוי electroporation ולא ניתן לאחסן ב -80 ° C כלE. coli.- כדי להתחיל, לחסן 5בינוני 0 מיליליטר YPD עם מושבה אחת של המתח הרצוי של עניין.
- לדגור על 30 מעלות צלזיוס ועד 250 סל"ד OD 600 ננומטר מגיע 0.6-0.8.
- תאי צנטריפוגה XG 1000 במשך 5 דקות ב 4 מעלות צלזיוס.
- Resuspend גלולה ב 25 מיליליטר צונן וסטרילי מזוקק H 2 O.
- חזור על שלבי הכביסה resuspending פעמיים ב 25 מיליליטר מים וresuspending פעמיים ב 2 מיליליטר של פתרון מקורר של סורביטול ליום 1 במ '
- Resuspend התאים 250 μl של סורביטול 1 M ולפצל את התאים לתוך 50 aliquots μl.
2. הכנת כרית Agarose
- כדי להסיר חלקיקי ניאון רקע, לשרוף coverslip בתנור על 500 מעלות צלזיוס במשך שעה 1. "נקי שרפה" coverslips יכול להיות מאוחסן במשך שבועות בטמפרטורת חדר מכוסים בנייר אלומיניום.
הערה: שיטות ניקוי נפוץ אחרות כגון ניקוי פלזמה או פתרון פיראניה עשויות לשמש עוד כרקעהקרינה של השקופיות ניקו נשארה מעין-null. - הכן פתרון agarose נמוך הקרינה על ידי התכה בתנור מיקרוגל agarose 2% - פתרון מים מזוקק (70 מעלות צלזיוס). מייד להוסיף 500 μl של 2% פתרון agarose ברור עד 500 μl של מדיום תרבות הקרינה נמוכה 2X ומערבבים בעדינות.
- לפני שהוא מתקרר ומתקשה, מייד פיפטה agarose זה - פתרון בינוני על coverslip מיקרוסקופ (לא 1.5 עובי) על מנת ליצור משטח של בערך 2 קטרי סנטימטר וגובה כמה מילימטרים. למנוע בועות ומכניס אותם עם טיפים פיפטה במידת צורך.
- שטח את הכרית עם coverslip שני "שרפה" (לא עובי 1.5, ראה איור 1).
הערה: coverslip העליון זה עוזר ליצור משטח הומוגני שטוח ולהגן מפני אבק והייבוש בזמן שתאים נמצאים בהכנה. מדיום מינימאלי כגון M9 או בינוני עשיר כגון בינוני מוגדר EZ העשיר נבדק לקרינה הנמוכה שלהם.
3. Electroporatיון
- דגירה
- להוסיף עד 5 μl של מולקולות שכותרתו מאוחסנות במאגר דל מלח (<מלח 50 מ"מ) לaliquot בודד של תאים מוסמכים (חיידקי 20 μl או 50 שמרי μl) ו דגירה 10 דקות על קרח.
הערה: הריכוז של מולקולות שכותרתו fluorescently בפתרונות מניות ובכך את כמות המולקולות שכותרתו נוספו לתא לפני electroporation מתואם ישירות עם יעילות טעינה (איור 3, ודיון). כחלק מהחלבונים הם פחות תואמים למצב מלח נמוך, ריכוז המלח במאגר האחסון עשוי להיות מוגבר אבל הנפח של מולקולות שכותרתו נוספו לelectroporation לפני התאים אז צריך להיות ירידה. - מעביר את התערובת של תאים ומולקולות ביולוגיות שכותרתו לתוך קובט מראש צונן electroporation (ריווח 0.1 ו -0.2 סנטימטר לחיידקים ושמרים, בהתאמה). לטפוח בעדינות את קובט על הספסל כדי להסיר בועות פוטנציאליות מהפתרון.
- הנח את מ"קהקורבט לelectroporator ולהחיל דופק חשמלי במתח גבוה לפתרון (0.9-1.8 סנטימטר / קילו וולט, ראה דיון לפרטים נוספים על בחירת מתח). כגון דופק מהווה נקבוביות חולפת בקרום התא ומאפשר מולקולות ביולוגיות שכותרתו לנטרל לתוך התאים.
- בדוק שקבוע הזמן מוצג בelectroporator הוא בין 4 עד 6 ms. קבועי זמן תחתון הם לעתים קרובות עקב ריכוז גבוה מדי מלח ו / או הנוכחות של בועות בקובט, ויובילו למאוד נמוך או ללא טעינה של התאים.
- להוסיף עד 5 μl של מולקולות שכותרתו מאוחסנות במאגר דל מלח (<מלח 50 מ"מ) לaliquot בודד של תאים מוסמכים (חיידקי 20 μl או 50 שמרי μl) ו דגירה 10 דקות על קרח.
- שחזור
- מייד לאחר electroporation, להוסיף 500 μl של מדיום עשיר כגון SOC, בינוני EZ העשיר מוגדרים, YPD או כל מדיום עשיר לתאים.
- דגירה המדגם ב 37 מעלות צלזיוס במשך חיידקים ו -29 מעלות צלזיוס במשך שמרים ל -2 עד 10 דקות. למדידות כדאיות, שבו המשתמש רוצה להעריך את אחוז תאי גידול וחלוקה לאחר electroporation, משתמש בזמן החלמה ארוך יותר (עד השעה 1) כwדואר לצפות פעמים בפיגור כזה לפני חלוקת התא הראשונה.
- צעדי כביסה
- שוטף את התאים כדי להסיר כל מולקולות ביולוגיות-הפנים שאינן על ידי ספינינג את התאים 1 דקות בXG 3300 ו- 4 מעלות צלזיוס. בטל supernatant וresuspend תאי 500 μl PBS.
הערה: עבור כל דגימה, להכין בקרה שלילית של התאים הודגרו עם אותה הכמות של מולקולות ביולוגיות שכותרתו אבל לא electroporated ורחצו באותו אופן בדיוק כפי המדגם העיקרי. - חזור על השלבים הקודמים 3 פעמים.
- במקרה של הפנמת חלבון, לייעל את הליך הכביסה בהתאם למאפיינים וההתנהגות של החלבון שכותרתו של עניין. השלבים הבאים הם דוגמא לאופטימיזציות אפשריות:
- בצע 3 מחזורי השטיפה הראשונים באמצעות PBS המכיל 100 mM NaCl ו0.005% Triton X100 כדי להסיר חלבונים-הפנים שאינם שעלולה להידבק לקרום התא החיצוני 22, 26.
- סנן את תאי electroporated עם מותקן בתוך צינור 1.5 מיליליטר microcentrifuge ידי pipetting תאי electroporated לתוך מסנן מסנן קוטר נקבובית 0.22 מיקרומטר. ספין למטה במשך 3 דקות ב 800 XG ו -4 ° C. מחק את הזרימה דרך. להוסיף PBS 500 μl חדש על התאים ולסובב אותם שוב כמו קודם ולחזור על שלבים אלה פעם אחת 22.
- להוסיף כמות קטנה של פרוטאז K (10 ng ב 500 μl PBS) במהלך מחזור הכביסה הראשון כדי לאפשר העיכול של כל חלבון-הפנים שאינו.
- בצע 3 מחזורי השטיפה הראשונים באמצעות PBS המכיל 100 mM NaCl ו0.005% Triton X100 כדי להסיר חלבונים-הפנים שאינם שעלולה להידבק לקרום התא החיצוני 22, 26.
- ספין למטה תאי דקה 1 בXG 3300 ו- 4 מעלות צלזיוס. בטל supernatant וresuspend התאים 150 μl של PBS.
- מורחים את פתרון התא הטעון על כרית agarose על ידי הסרת coverslip העליון ומתפשט 10 μl של רביב ההשעיה תא על ידי רביב. החלף coverslip שאינו בשימוש נקי נשרף (לא עובי 1.5, מיקרוסקופ מפרט אובייקטיבי התאמה) על tהוא החלק העליון של הכרית ולחץ בעדינות רבה בשקופית.
- הגן על תאי electroporated מהאור על ידי אחסון הרפידות בתיבה אטומה בזמן ההדמיה מדגמים שונים.
- שוטף את התאים כדי להסיר כל מולקולות ביולוגיות-הפנים שאינן על ידי ספינינג את התאים 1 דקות בXG 3300 ו- 4 מעלות צלזיוס. בטל supernatant וresuspend תאי 500 μl PBS.
רכישת נתונים 4. מיקרוסקופ
הערה: מתא בודד ומיקרוסקופ פלואורסצנטי מולקולה בודדת במיקרואורגניזמים חיים יכולים להתבצע על כל מיקרוסקופ פלואורסצנטי המתאים (או מסחרי בנוי מותאם אישית).
- הגדרות
- תאורת Widefield או הילו
- דגימות תמונה עם כל מיקרוסקופ TIRF / מולקולה בודדת.
הערה: כדוגמא, אנו משתמשים במעבדה מותאמת אישית מיקרוסקופ הפוכה עם סט-אפ TIRF. קורות מ532-ננומטר ודיודת לייזר 637 ננומטר משולבות וcollimated לפני ההתמקדות על מישור המוקד האחורי של המטרה. הקרינה מהמדגם שנאסף באמצעות אותה המטרה, הופרדה מאור העירור באמצעות ארוך לעבור ומסנן חריץ, והתפצלה למחדשערוצי ד וירוקים באמצעות מראה dichroic. שני הערוצים הם צילמו על גבי חצאים נפרדים של השבב של מצלמה מכשיר תשלום מצמידים אלקטרונים הכפלה (EM-CCD). קטעי וידאו שהוקלטו באמצעות המצב קינטית. תמונות אור הלבנות מתקבלות באמצעות מנורת אור לבנה וקבל המחובר למיקרוסקופ כמקור תאורה. - לתצפית מולקולה בודדת כללית, להגדיר את מצב התאורה של מיקרוסקופ כדי TIRF או חילו 23 (ראה דיון לפרטים נוספים על TIRF לעומת הדמיה חילו). כדי להגדיר מצב חילו על מיקרוסקופ TIRF, להקטין מעט את הזווית של שכיחות של אור העירור להסיט את המוקד מעט גבוה יותר מאשר פני השטח coverslip (תמונת התא הפנימי ולא קרום התחתון במגע עם coverslip, ראה 4.5.4 ).
- לניתוח ברמת תא, מולקולה בודדת ארוכה מעקב ניסויים או ניתוח photobleaching צעד חכם, להגדיר את מצב התאורה של מיקרוסקופ כדי ensuri מצב widefieldng התצפית רציפה של כל נפח התא ולכן כל הפנימו מולקולות שכותרתו.
- דגימות תמונה עם כל מיקרוסקופ TIRF / מולקולה בודדת.
- בדרך כלל, כוחות עירור שימוש סביב 0.5-3 mW (~ 50-400 W / 2 סנטימטר).
הערה: סמכויות לייזר תחתונה הן שימושיות כדי להשיג תצפית הקרינה חיים ארוכת ומעקב (מעל 1 דקה) ואילו סמכויות לייזר גבוהות יותר עשויות להידרש לרזולוציה גבוהה יותר spatiotemporal או ניתוח photobleaching בשלבים. - השתמש בזמני חשיפה נעות בין 15 ms למעקב אחר ניסויים ל -100 ms להסתכלות כללית יותר וכימות עוצמה. הערה: שיעורי מסגרת אחרים ומצבים יכולים לשמש כגון תאורת stroboscopic, במיוחד ללימוד מינים מהר לשדר 30.
- במיקרוסקופ TIRF, להקליט ערוץ הקרינה על מצלמת CCD אלקטרונים הכפלה (EMCCD) בהגדלה וכתוצאה מכך אורך פיקסל של ~ 100 nm / פיקסל. התקנת TIRF היא לתאר בפרטים רבים יותר בהתייחסות 26.
- תאורת Widefield או הילו
- רכישת נתונים
- כבה או לחסום את תאורת הלייזר עד לתחילת הניסוי. לעבור רווח המצלמה EMCCD את כדי למנוע נזק למצלמה עקב חשיפת יתר.
- מניחים את כריך כרית agarose הפוך על הבמה מיקרוסקופ, עם הצד מכוסה התא פונה כלפי מטה, על מנת להביא את התא הקרוב למטרה. הגדר את ההתמקדות בתאים במצב מיקרוסקופ אור מועבר 28. להקליט תמונה של כל תא מבט תחת הדמיה אור הלבנה כדי לאתר את התא מתאר לפני כיבוי האור הלבן.
- הגנה על המדגם מן המעבדה אור הסביבה.
- למצב עירור חילו, להתאים את הזווית של קרן העירור לכל יחס אות לרעש מרבי ידי הארה רק החלק מהמדגם הקרוב אל פני השטח coverslip.
- כדי להשיג תאורה חילו, למקד את קרן הלייזר למישור המוקד האחורי של 1.4 (28 Nume מטרת 100x NA גבוה יותרפתחי rical כגון 1.45 או 1.49 מתאימים גם). על ידי הסטת העדשה מתמקדת בניצב לקרן, המוקד עובר לגזרים ממרכז המטרה, כך שהקרן יוצאת אובייקטיבית עם זווית.
- להתאים את מיקום העדשה על מנת למקסם את יחס אות לרעש, עוצמת הקרינה תוך-תאית לעומת אות רקע תאית.
- לעבור רווח המצלמה ולהתחיל רכישת נתונים לפני הפעלת מכשיר הלייזר.
- בעת הקלטת נתונים, לרכוש תמונה לבנה-אור של כל FOV לפני או אחרי הקלטת נתוני הקרינה; זה עוזר לזהות את גבולות תא בערוצי הקרינה.
- להערכת כדאיות
- השתמש בינוני עשירה נמוכה הקרינה בכרית agarose כדי לאפשר לתאים לגדול לאחר electroporation.
- לאזן את המיקרוסקופ לטמפרטורה האופטימלית למיקרואורגניזם למד (37 מעלות צלזיוס במשך E. coli, 29 מעלות צלזיוס במשך cerevisiae ס) עם מערכת חימום אובייקטיבית.
- שיא שני תמונות אור וקרינה הלבנות כל 30 דקות, והקפד להישאר באותו השדה בדיוק מבט במהלך הקלטת נתונים שלמה. פיגור של ≈1 שעה הוא ציין בדרך כלל לפני התאים מתחילים להתחלק.
- לספור את מספר המולקולות הביולוגיים הפנימו לכל תא
- הגדר את כוח הלייזר לערכים גבוהים (2-3 mW) וזמן חשיפה ארוך (100 ms).
- הגדר את התאורה לwidefield מצב כדי להאיר את כל התא.
- שיא סרטים כמתואר בשלב 4.2 והקפד לרשום מסגרות נוספות (50-100 מסגרות) לאחר השלמת photobleaching הקרינה.
ניתוח נתונים 5.
- ניתוח כללי
- לנתח את התמונות שתועדו וסרטים, שניהם בעירורי אור וקרינה לבנים, באמצעות תוכנת הדמיה, כגון ImageJ התוכנה החופשי.
- בImageJ, לפתוח את התמונות או סרטים שהוקלטו במיקרוסקופ (בפורמט TIF) בקובץ> פתח> מיקום הקובץ שלך.
- כדי להשוות איכותי עוצמות הקרינה על מסך מחשב, לוודא שכל תמונות הקרינה מוצגות עם אותן הגדרות הבהירות והניגודיות בתמונה> התאם> הבהירות / ניגודיות. התאם באופן ידני או באופן אוטומטי את ההגדרות עבור תמונה שנבחרה, לחץ על "קבע" כפתור ובחר באפשרות "הפץ לכל תמונות האחרות".
- הגדר את סוג המידע כדי לחלץ: לנתח> מדידות סט, ובחר (לפחות) "אזור", "סטיית תקן", "מינימום וערך מקסימום אפור" ו" Mean ערך אפור ".
- כדי להשוות עוצמות הקרינה סלולארי, בחר את האזור של עניין באמצעות לחצן בחירת Freehand של ImageJ ולחלץ את עוצמות התא לנתח ב> מדוד. השולחן וכתוצאה מכיל את ערכי המדידה וניתן לשמור ו / או להעתיק לתוכנה אחרת. ערך "Mean" תואם את עוצמת לפיקסל הממוצעת באזור שנבחר וניתן להשוות בין תאים או בין תא והרקע.
- במדגם תא electroporated, תא נחשב טעון אם העצמה הממוצעת שלה לכל פיקסל גדולה יותר מהעצמה הממוצעת לכל פיקסל של הביקורת השלילית ועוד 3 פעמים סטיית התקן שלה (אב (אני טעון תא)> אב (אני -EP) + 3 * StdDev (אני -EP)).
- לבנות תמונות כיסוי הקרינה כוזבות בצבע וסרטים על מנת להעריך את האיכות וטעינה של הדגימות.
- בImageJ, תמונות כיסוי כגון תמונת האור הלבנה ותמונת הקרינה המקבילה לאותו FOV בצבעי תמונה>> מיזוג ערוצים. בחר צבע לכל תמונה (C4 (אפור) לאור הלבן, C1 (אדום) למסלול אדום, C2 (ירוק למסלול ירוק ... וכו '.).
- בדוקבתמונת השכבה שהקרינה ממוקמת בתוך גבולות התא (תמונת אור לבנה) ושקרינת הרקע היא נמוכה ואחידה (לא כתמים בהירים מחוץ לגבולות התא).
- לפני ניתוח מספר גדול של תאים, לבדוק איכותי התמונות המתאימות למדגם השליליים דומות לתמונות תא הריקות ולהציג עוצמות נמוכות בהרבה מתאי electroporated.
- בניסויים כדאיות, לספור ידני אחוזי החלוקה, שאינו מפריד אבל בעליל שלם (זהה) ותאים פגומים (מת) מאותו שדה הראייה גדלה לאורך זמן (ראה 4.2.6).
- להעריך את הכדאיות של לפחות 200 תאים לדגימה (שליטת electroporated, שלילית ותאים ריקים) על מנת לאסוף מספיק נתונים סטטיסטיים.
- לנתח את התמונות שתועדו וסרטים, שניהם בעירורי אור וקרינה לבנים, באמצעות תוכנת הדמיה, כגון ImageJ התוכנה החופשי.
- ניתוח מבוסס תאים
- לספור את מספר המולקולות הביולוגיים הפנימו לכל תא על ידי ניתוח photobleaching צעד חכם
- תאי מגזר על ידי selecting השטח של עניין באמצעות לחצן בחירת Freehand של ImageJ ולצייר צורה מקיפה בדיוק תאים (שווה ערך לתא קרום).
- חלץ את עוצמות התא לאורך זמן ב> פרופיל Z ציר עלילת תמונה סטאקס>. הגרף וכתוצאה מכך מייצג את עוצמת לפיקסל הממוצעת לאזור בתוך גבול התא לעומת כל מסגרת סרט וכתוצאה מכך עקום photobleaching שלתא מסוים. הוא מכיל ירידה מעריכית ראשונית של עוצמת התא להגיע לאסימפטוטה נמוכה (הקרינה רקע). ניתן לשמור את הערכים והמדידה ו / או להעתיק לתוכנה אחרת על ידי לחיצה על "שמור" או "העתק".
- העתק והדבק את ערכי הלבנה לעמודה בגיליון אלקטרוני (אני גלם).
- לחשב את autofluorescence הממוצע לכל פיקסל שנותר לאחר photobleaching (אני אוטומטי) על ידי חישוב ממוצע ערכי הגלם השגתי עבור 50-100 המסגרות האחרונות (אסימפטוטה נמוכה יותר).
- Subtract autofluorescence לכל פיקסל הממוצע שנותר לאחר photobleaching לתא שמעקום photobleaching הראשוני: אני הלבנת = אני גלם - אני אוטומטי.
- השתמש photobleaching timetraces (אני הלבנת לעומת מסגרת) מראה פחות מ -10 צעדים בדידים כדי להעריך את הגודל הממוצע צעד (עוצמת fluorophore יחידתי) בשל ההלבנה של fluorophore יחיד 26 מופחת בתחילת מחקר.
- להעריך את מספר המולקולות הפנימו לכל תא על ידי חלוקת עוצמת תא הראשונית מופחת נקודת התחלה (אני הלבנת בזמן t = 0) מעוצמת fluorophore יחידתי.
- יעילות סריג תא בודד
- למדוד את עוצמת הממוצעת תאים לכל פיקסל בשני ערוצי פליטת תורם acceptor (על עירור תורם) ובתוך גבול התא לכל ערוץ כלהסביר ב5.1.1.4.
- למדוד את עוצמת פיקסל הממוצעת עבור הרקע בכל פרקannel מאזור ריק בשקופית.
- לחסר עוצמת רקע זה מהעצמה הממוצעת לכל פיקסל. השתמש בעוצמות הקרינה מופחתת רקע אלה כדי לחשב סריג עבור כל תא על ידי חישוב עוצמת מופחת רקע acceptor מחולקת בסך הכל (acceptor + תורם) העצמה מופחתת רקע על עירור תורם: אני acceptor / (אני acceptor + אני תורם)
- לספור את מספר המולקולות הביולוגיים הפנימו לכל תא על ידי ניתוח photobleaching צעד חכם
- ניתוח מולקולה בודדת
- מעקב מולקולה בודדת וניתוח דיפוזיה
הערה: הפרוטוקול למעקב אחר לשדר מולקולות ניאון בתאים חיים ולהעריך מקדם הדיפוזיה לכאורה תואר 26, 28.- בקצרה, להתאים את התמונות של fluorophores אחת בכל מסגרת על ידי גאוס אליפטי 2D. קישור מקומי מולקולות למסלול אם הם הופיעו במסגרות רצופות בתוך חלון של 5-7 פיקסלים (0.48-.67 מיקרומטר). השתמש memorפרמטר y של 1 מסגרת להסביר את ההיעלמות הזמנית של fluorophore בשל מהבהב או לוקליזציה החמיצה.
- בניתוח smFRET vivo
- באופן ידני לזהות מולקולות בתוך תאים מקומיות מסרטים על ידי עובר סרט בImageJ ולזהות מולקולות נייחות (או די נייחות) בסריג הערוץ (acceptor).
- כדי לחלץ את העוצמות בערוץ acceptor והתורם המתאימים למולקולה נייחת, בחר סביב המולקולה בכל ערוץ האזור באמצעות לחצן הבחירה "הסגלגל" של ImageJ (העיגול מסביב לכל fluorophore היחיד, באמצעות רדיוס ~3-פיקסל) ו לחלץ את עוצמות המולקולה לנתח ב> מדוד. השולחן וכתוצאה מכיל את ערכי מדידה וניתן לשמור ו / או להעתיק לתוכנה אחרת.
- לחשב ערכי רקע לכל ערוץ מעוצמת פיקסל הממוצעת ממעגל באותו הגודל באזור ריק בשקופית על כל המסגרות ניתחו.
- השתמשו ערכי הקרינה מופחת רקע בערוצי תורם acceptor (על עירור תורם) לקרינה וסריג עקבות זמן, כמו בתא הבודד סריג מקרה (ראה 5.2.1.7).
הערה: ניתוח ואלגוריתמים אוטומטיים וחזק תוארו בהערות 26-28, 31.
- מעקב מולקולה בודדת וניתוח דיפוזיה
תוצאות
לדוגמא הכנה
השלבים השונים של הפרוטוקול מוצגים כשרטוטים באיור 1. כדוגמא, אנחנו מייצגים את הטעינה של חיידקים עם כותרתו כפליים (תורם וצבעים acceptor) שברי DNA. תוצאות נציג להפנמת DNA מוצגות באיור 2. עבור כל דגימה electroporated, נתונים לתאים ריקים ותאים שאינם electroporated נרשמו גם (איור 2). "תאים ריקים" מתאים לelectrocompetent תאים לא מודגרות עם מולקולות ביולוגיות ניאון ולא electroporated; עוצמתם בערוץ הניאון משקפת את רמת autofluorescence בתנאים זהים ניסיוניים (כוח הלייזר, רזולוציה זמן, טמפרטורה, וכו '). "תאים-electroporated ללא" (המכונה גם -EP, כלומר, בניכוי EP) מתאים לביקורת שלילית שבו תאי electrocompetent כבר הודגרו עם biomolec הניאוןules אבל לא electroporated. תאים-electroporated אלה שאינם צריכים להפגין רמת הקרינה דומה לautofluorescence של התאים הריקים ונמוכה משמעותי מעוצמת הקרינה המוצגת על ידי תאים טעונים, electroporated. זה מאשר את הסרת כל שאינו הפנימו מולקולות ביולוגיות שכותרתו שיכולה היה דבקו בקרום התא החיצוני.
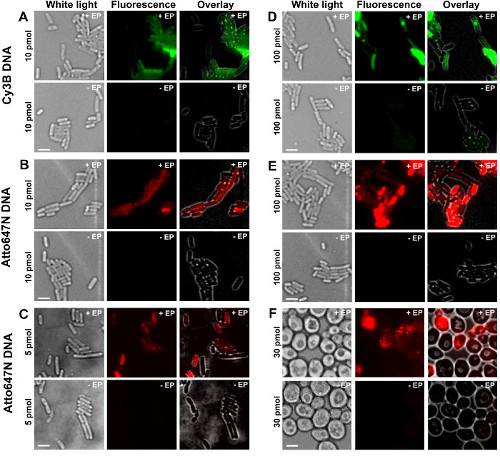
תמונות לבנה-אור, הקרינה וריבוד: איור 2: תוצאות עבור נציג ההפנמה של dsDNA שכותרתו עם fluorophores שונה בריכוזים שונים בחיידקים (AE) ושמרים (F) מימין לשמאל.. - / + EP מציין דגירה ללא / עם electroporation. ברים בקנה מידה: 3 מיקרומטר. א Cy3B dsDNA, 10 pmol, E. coli. B. ATTO647N dsDNA, 10 pmol, E. coli. ג Alexa647 dsDNA, pmol 5, E. coli. ד Cy3B dsDNA, 100 pmol, E. coli. ds ATTO647N E.DNA, 100 pmol, E. coli. פ ATTO647N dsDNA, 30 pmol, שמרים. נתון זה שונה מהתייחסות 26. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לספור את מספר המולקולות הביולוגיים הפנימו לכל תא
ההליך להעריך את מספר הפנימו מולקולות ביולוגיות שכותרתו לתא באמצעות ניתוח photobleaching מוצגת באיור 3 ומשלימים סרט 2, יחד עם תוצאות שהושגו עם נציג ריכוזים שונים של DNA שכותרתו. תא טעינה מגבירה את היעילות עם הסכום הראשוני של מודגרות DNA שכותרתו, המאפשר למשתמש לכוון את מספר המולקולות שכותרתו לכל תא מרמה "מולקולה בודדת" (<10, משלים סרט 2B) לרמה "אנסמבל" (> 10 , 2A סרט נוסף). דרך חזקה של הערכת אחוז התאים טעונים היא to לספור את מספר תאי electroporated בו מוצגות עוצמת תא מעל העצמה הממוצעת התא של תאים-electroporated שאינו בתוספת 3 פעמים סטיית התקן שלהם (כלומר, אב (I-EP) + 3 * StdDev (I-EP) שבו אב = ממוצע, אני = עוצמה לכל פיקסל, Std. Dev. = סטיית תקן ו-EP =-electroporated שאינו) כפי שמוצג באיור 3.
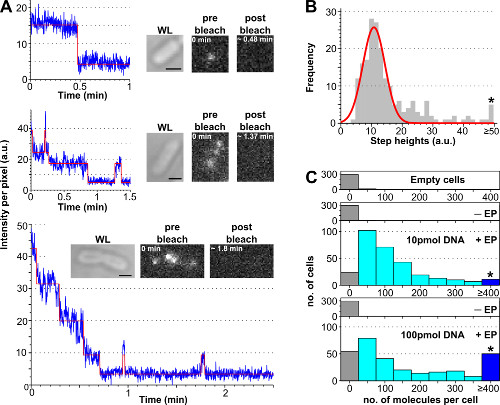
איור 3:. ספירת מספר המולקולות הפנימו באמצעות ניתוח photobleaching () מתא בודד photobleaching ניתוח. דוגמאות לtimetraces עוצמת הקרינה (כחול: נתונים גולמיים; אדום: נכון; ריבועים: WL ותמונות הקרינה של E. coli עמוס dsDNA שכותרת ATTO647N לפני ואחרי הלבנת). למעלה: אירוע הלבנת שלב יחיד. התיכון: תא המכיל ± 3 מולקולות מראים הלבנהומהבהב. תחתון: תא המכיל> 10 צעדים המתאימים לפחות 10 מולקולות היסטוגרמה (B) של עוצמות גובה בשלב יחיד מאלגוריתם צעד-התאמה אוטומטית מ 57 תאים המכילים פחות מ 6 שלבים מובחנים.. כושר Single-גאוס הוא מרוכז ב -11 ± 3 au, מתאים לעוצמת fluorophore אחידה של 8100 פוטונים לשניה. הכוכבית מציינת את סל איסוף כל הגבהים הצעד מעל או 50 au שווה היסטוגרמה (C) של מולקולות הפנימו לכל תא electroporated עם כמויות שונות של ATTO647N dsDNA, חושבו לאחר חלוקת עוצמת הקרינה הראשונית מעוצמת fluorophore יחידתי. מלמעלה למטה: תאים ריקים (כלומר, לא הודגרו עם מולקולות ניאון ולא electroporated), שאינו electroporated (אבל הודגרו עם מולקולות ניאון, -EP בשם), ותאי electroporated הודגרו עם 10 ו -100 pmol dsDNA (שם + EP). תאים ריקים ו- electroporated שאינו מתאיםלautofluorescence, תאים ואילו electroporated להראות הפצה רחבה של מולקולות הפנימו, עם שיעור גבוה יותר של תאים טעונים מאוד ב 100 pmol (≥ 4 מולקולות, לראות את בן-מסומן כוכבית). יעילות הפנמה (חלק יחסי של תאים עם Int.> אומר + 3x Std. Dev. מדגם -EP לא) עבור 10 ו -100 pmol הדגימות הייתה 94% ו -90%, בהתאמה. אומר מספר המולקולות הפנימו לכל תא: 121 ± 106 מולקולות במשך 10 pmol dsDNA, ו± 176 187 מולקולות ב -100 pmol dsDNA. הגדרות: 100 ms חשיפה, תאורת widefield. ברים בקנה מידה: 1 מיקרומטר. נתון זה שונה מהתייחסות 26. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
טעינת תא כדאיות
בנוסף לשינוי בסך של מולקולות ביולוגיות שכותרתו נוספה לתאים לפני electroporation,משתמש יכול לכוון את כמות המולקולות הפנימו ידי בחירת עוצמות שדה שונות במהלך electroporation (איור 4, סרט משלים 1). עוצמת שדה גבוהה יותר יוביל ליעילות הפנמה גדולה יותר, אך יוביל לירידה קלה של כדאיות תא. להפנמת חלבון, השימוש בצעד סינון עשוי לסייע בהסרה לא הפנימו-חלבונים שכותרתו (ראה 3.3.3.1.1). במקרים כאלה, סינון תא מבטיח כי חלבוני ניאון נצפים אכן הפנימו בתוך הציטופלסמה החיידקים; נציין, עם זאת, סינון שיש גם השפעה שלילית על כדאיות תא (לפרטים נוספים, ראה REF 22).
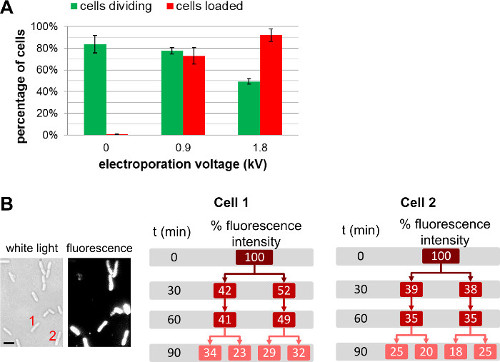
איור 4: השפעה של מתח electroporation על טעינה סלולארי וכדאיות () תרשים בר המייצג את ההשפעה של עוצמת שדה electroporation על effic טעינה.iency (ברים אדומים) ויכולת קיום של התאים (פסים ירוקים). 84 ± 8% מהתאים לא electroporated-הפרד (0 ק ו / סנטימטר) לאחר h 1 על כרית agarose על 37 מעלות צלזיוס. באותם תנאים, 78 ± 3% ו -49 ± 3% מתאי electroporated ב 0.9 kV / סנטימטר ו -1.8 קילו וולט / סנטימטר לחלק בהתאמה לאחר שעה 1. לשימוש יעילות בטעינה, 73 ± 8% מהתאים נטענים על 0.9 kV / סנטימטר, ואילו 92 ± 6% מהתאים נטענים על 1.8 kV / סנטימטר. הברים השגיאה מייצגים סטיית התקן מחושבת משלוש מדידות עצמאיות; יותר מ -200 תאים נותחו עבור כל דגימה וכל חוזר. עליות בסך הכל יעילות טעינה עם מתח electroporation לרעת הקלה של כדאיות תא. (B) מדידות הקרינה מבוססת Cell במשך כמה דורות מראות כי עוצמת הקרינה הכוללת משותפת שווה בשווה בין שני תאי הבת. תא 1 ו -2 מתייחסים למספר התא בתמונה האור הלבנה (משמאל) ותמונת הקרינה בזמן t = 0. Scaleבר: 1 מיקרומטר). נתון זה שונה מהתייחסות 26.
הפנמת חלבון
תוצאות נציג להפנמת חלבון נמצאות בדמויות 5A & B. זה חשוב במיוחד כדי להסיר כמה שיותר הצבע שנותר חופשי (unreacted) ממדגם החלבון כלפני electroporation האפשרי. בדוגמאות באיורים 5A & B, מדגם Klenow קטע שכותרתו Cy3b (Cy3b-KF, שבו KF הוא בר Klenow של E. coli DNA פולימראז אני, 66 KDA) מכיל רק 1% לצבוע חופשי; תרומת צבע כזה לטעינת התא הכוללת היא זניחה. השוואות של מדגם electroporated עניינים עם שני תאים-electroporated שאינם (הודגרו עם אותה הכמות של חלבון שכותרת), כמו גם תאים electroporated עם הכמות שווה של צבע חופשי מהוות שתי בקרות נדרשות כדי להבטיח שמולקולות ניאון נצפואכן הפנימו חלבונים שכותרתו.
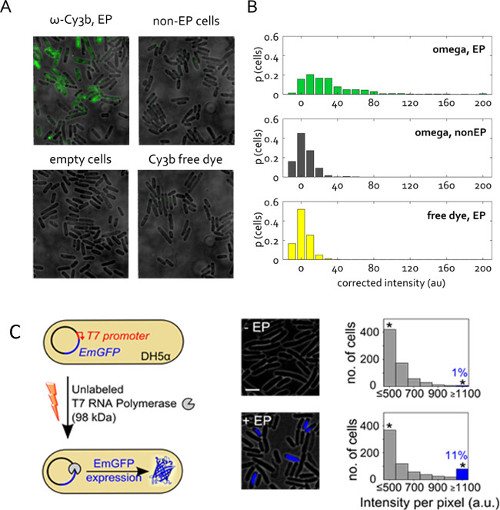
איור 5: הפנמת חלבון בחיידקים חיים שדה שכבת הקרינה נציג של נוף ().. תאי electroporated במתח 1.4 וולט עם מקטע ω 50 pmol RNAP ממניות פתרון חלבון המכיל רק 1% צבע Cy3b חופשי. (-EP לא)-electroporated ללא ותאים ריקים מוגדרים כבעבר. צבע חינם הופנם באותו הריכוז כמו במדגם Electroporated ω RNAP. הדמיה במצב שדה רחב, עירור 532 ננומטר ב 1 mW, חשיפת הפצת 50 ms. (ב) לעוצמות-ממוצע תא לא תוקנו לדגימות ב (א), בהתחשב בשיעור הכולל ספירת התאים. יותר מ -400 תאים לכל מדגם מפולח. נתון זה שונה מהתייחסות 22. (C) הפנמה של unlaפולימראז beled T7 RNA (T7 RNAP, 98 KDA) לDH5α electrocompetent ביצוע GFP pRSET-EmGFP ברקת קידוד פלסמיד (EmGFP) תחת שליטה של אמרגן T7. משמאל: סכמטי של assay. התיכון: כיסוי הקרינה. מימין: היסטוגרמות של עוצמות הקרינה המבוסס על תאים במדגם-electroporated שאינו (למעלה) והתאים הודגרו וelectroporated עם T7 RNAP (למטה); כ -11% מתאי electroporated להראות עוצמת הקרינה גבוהה (חלק יחסי של תאים עם Int.> אומר + 3x Std. Dev. מדגם -EP לא) מצביע על ביטוי של EmGFP. הכוכבית מצביעה פחי איסוף כל העוצמות מעל או בר סולם 1,100 au שווה: 3 מיקרומטר. נתון זה שונה מהתייחסות 26.
איור 5 ג מציג יישום אחר של electroporation חלבון. כאן, חלבון electroporated הוא ללא תווית, אך ההפנמה שלה מעוררת תגובת ניאון נצפית. ניסוי זה מאמת מראשהיגיון ופונקציונליות של חלבוני electroporated בציטופלסמה התא. RNA פולימראז T7 ללא תווית (98 KDA) הופנם לתוך E. DH5α זן coli המכיל קידוד פלסמיד לחלבון פלואורסצנטי EmGFP תחת שליטתו של אמרגן T7 26. כגן לפולימראז T7 RNA נעדר בDH5α, ביטוי EmGFP בניסויים שלנו דורש שRNA פולימראז T7 הפונקציונלי הוא הציג לתוך התאים באמצעות electroporation (איור 5 ג). בעקבות electroporation עם pmol 1 T7 RNAP,> 11% של התאים (פס כחול, איור 5 ג) הציגו הקרינה גבוהה מהביקורת השלילית (הודגרו עם אותה הכמות של T7 RNAP, אבל לא electroporated). תוצאה זו קובעת, כי חלקם של מולקולות T7 RNAP הפנימו ידי electroporation לשמור על שלמותם in vivo והוא יכול לבצע את הפונקציות מיועדות שלהם בציטופלסמה התא.
In vivo סריג במולקולה בודדתורמות תא בודד
לבסוף, ההפנמה והניתוח של מינים שכותרתו כפליים בחיידקי חיים מוצגים באיור 6 וסרט משלים 3. שילובי חלבון כניאון אינם אידיאליים ללימודי smFRET in vivo, היכולת לספק מולקולות ביולוגיות שכותרתו כפליים לתאים חיים באמצעות electroporation היא אחד הנכסים הגדולים של שיטה זו. איור 6 א מציג תא בודד סריג ניתוח של חיידקים עמוסים סטנדרטים שונים סריג DNA (באמצעות Cy3B וfluorophores Atto647N כזוג סריג acceptor התורם). תאי electroporated עם 20 pmol של שלושה תקנים קצרים כפליים שכותרת dsDNA סריג עם יעילות סריג לכאורה (E *) של 0.17, 0.48, 0.86 ובמבחנה (26 נקבעו בעבר). כל DNAs להיכנס לתאים ביעילות (איור 6 א, משמאל) ושיאו העיקרי של כל הפצה * E תא בודד מסכימים גם עם במבחנה התוצאות (איור 6 א, מימין). בדגימות הבינוניות וגבוה סריג, אוכלוסיות תאים עם * נמוכים מהצפוי E הם נצפו, ככל הנראה בשל שילוב של הלבנת acceptor וחוסר פעילות photophysical, טעינת תאים משתנים (ובכך, יחס אות לרעש משתנה) והשפלה DNA .
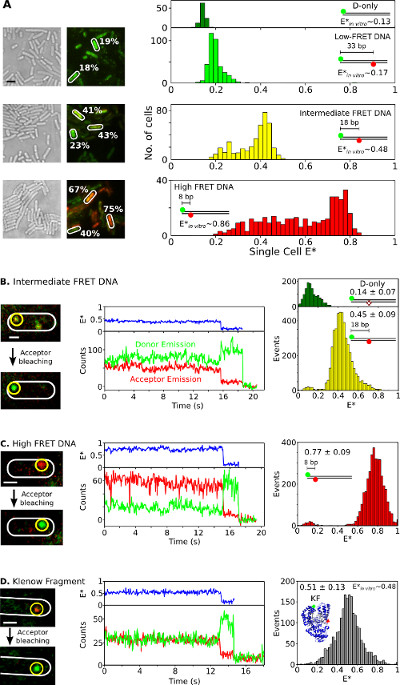
איור 6:.. תוצאות עבור נציג תא בודד ומולקולה בודדת סריג תצפית בחיידקי חיים מחקרי אנסמבל וsmFRET בחיידקים בודדים () ניתוח של תאים עמוסים 20 pmol כל אחת משלושה תקני DNA סריג מציגים נמוך (~ 0.17), ביניים (~ 0.48), וגבוה (~ 0.86) סריג (כפי שנמדד באמצעות מדידות מולקולה בודדת במבחנה, ראה REF 26). משמאל: אור לבן ותמונות ירוקות / אדום כיסוי (סריג) הקרינה (בר סולם: 3 מיקרומטר). דוגמאות לערכי סריג מהתאים שונים מצוינות (לבנים). Rig HT (מלמעלה למטה):. סריג מבוסס תאים שלא תוקן (E *) היסטוגרמות לתורם בלבד (בצבע ירוק כהה), נמוך (אור ירוק), ביניים (צהוב), וגבוה (אדום) סריג הסטנדרטים DNA (B-D) בsmFRET vivo. תאים נטענים עם 0.25 pmol ביניים סריג DNA (לוח ב '), (C פנל) גבוה סריג DNA 0.25 pmol, ו -5 pmol כפליים שכותרת KF (פנל D). עמודה שמאלית: כיסוי ירוק / אדום הקרינה של מסגרת אחת לפני ואחרי photobleaching acceptor. עמודה אמצעית: עקבות זמן המתאימות למולקולה בעיגול הצהוב. יעילות סריג, עוצמות פליטת תורם, ועוצמות פליטת acceptor מוצגות בכחול, ואדום ירוק, בהתאמה. עמודה ימנית: היסטוגרמות סריג של תורם רק מולקולות (ירוקה) ומולקולות acceptor התורם (צהובות, אדומות ואפורות) מ -20 עקבות זמן עבור כל דגימה. ברים בקנה מידה: 3 מיקרומטר ל, מיקרומטר 1 לB-D. נתון זה שונה מהתייחסות 26."Target =" 208fig6large.jpg _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
כדי לצפות בsmFRET in vivo עבור דגימות DNA או חלבון, כמויות נמוכות (0.25 pmol) של תקני ה- DNA בינוניים וגבוה סריג (איור 6, C) או 5 pmol של fluorophores KF (Alexa647 / Cy3B-פעמיים שכותרתו כזוג סריג, איור 6D) הם electroporated לתוך E. coli. ריכוזים כאלה הובילו לתאים רבים עמוסים במולקולות כמה (n = 1-10) שכותרתו, המאפשרים לוקליזציה ישירה, מעקב, וסריג ניטור למולקולות בודדות. מולקולות מסוימות מפוזרות באופן חופשי, ואילו אחרים מופיעים נייחים או לפזר לאט (סרט משלים 3). Timetraces של מולקולות ביולוגיות משותקים כפליים שכותרתו (איור 6, באמצע) שעברה ל1 עד 30 של ולהראות סימני ההיכר של smFRET: שינויי anticorrelated בקרינת תורם acceptor על הלבנת acceptor (למשל, t ~ 16 שניות; איור 6, אמצע ), ואחריו אחדהלבנת -step תורם (לדוגמא, t ~; 19 שניות; איור 6). הפצות סריג שנוצרו מtimetraces כזה (איור 6, מימין) בתוצאת ערך ממוצע שהוא בהסכם מצוין עם שפורסם במחקרי מבחנה 26,31,32. תוצאות אלו להקים את היכולת ללימודי smFRET הכמותית על DNAs וחלבונים הפנים, ומצביעות על כך שחלבונים לשמור על השלמות והמבנה שלהם על electroporation והפנמה (כנתמכת על ידי ניסויי הפנמת RNAP T7).
סרט משלים 1:. כדאיות תא משמאל: תמונות אור לבנה. תמונות הקרינה: נכון. אנימציה GIF אנימציה המציגה את החלוקה לאחר electroporation (1.8 kV / סנטימטר) של חיידקים עמוסים DNA שכותרתו Atto647 10 pmol. הירידה ניכרה הכוללת של הקרינה נובעת מהדילול של ה- DNA שכותרתו על חלוקת תאים וגם באופן חלקי לphotobleaching אשר מתרחש במהלך כלמדידה.
סרט משלים 2: מחקרי photobleaching מבוסס Cell א. דוגמא מייצגת של תא עמוס במיוחד (המכיל> 100 מולקולות DNA שכותרתו Atto647N). שמאלי עליון, תמונת אור לבנה של התא של העניין (מלבן אדום). ימני עליון, סרט של התאים נטענים מראים דעיכת הקרינה שלהם על פני כמה דקות. עקבות תחתונה, זמן של דעיכת עוצמת הקרינה הכוללת של התא של עניין. fluorophores האורגנית יכולה להפגין photobleaching חיים 2 סדרי גודל גבוה יותר מאשר FPS (כאן, ~ 41 שניות לAtto647N). דוגמא נציג B. של תא עמוס פחות מ -10 מולקולות שכותרתו (3 במקרה זה). למעלה, כמו תחתון א הפנל, עקבות של עוצמת הקרינה הכוללת של התא של העניין מראה הלבנת צעד אחד ו / או המהבהב המתאים לfluorophores האורגנית פעם אחת. הגובה הממוצע של צעדים אלה תואם את עוצמת האחידה המולקולה בודדת (כאן ~12 au) המשמש לאמידת המספר הראשוני של מולקולות הפנימו לכל תא. סרטים תחת עירור לייזר אדום הרציף ב 300 כוח μW וכל מסגרת 100 אלפיות שני.
סרט משלים 3: אני n vivo מולקולה בודדת סריג למעלה:. תאים עמוסים 0.25 pmol גבוה סריג DNA (כמו באיור 6 ג) מנוטר באופן רציף בגיל 50 ms לכל מסגרת תחת תאורת nTIRF באמצעות ירוק mW 1 לייזר (532 ננומטר). כל מסגרת היא כיסוי ירוק / אדום הקרינה (סריג) של כל ערוץ. לשדר וניתן לצפות מולקולות DNA אדום נייחת וירוק (ללא שינוי) (תווית פעילה יחידה). עקבות זמן המתאימות למולקולה בעיגול הצהוב: תחתון. יעילות סריג, עוצמות פליטת תורם, ועוצמות פליטת acceptor מוצגות בכחול, ואדום ירוק, בהתאמה. אירוע הלבנת acceptor קורלציה-אנטי (מעברים אדומים-to-ירוק) מתאים לחתימה של סריג מולקולה בודדת.
Discussion
יכולים להיות מגוונים פרמטרים רבים במהלך electroporation התא ורכישת נתונים בהתאם למערכת הביולוגית של עניין ואופייה המדויק של הניסוי (ברמת תא או ניתוח מולקולה בודדת). לדוגמא, כאשר electroporating DNA של חיידקים, 0.25-5 pmol של שברי dsDNA כותרת מוביל ליעילות הפנמה נמוכה, המאפשר זיהוי מולקולה בודדת ישיר (כלומר., ללא צורך בphotobleaching לפני כן). מעל 5 pmol dsDNA, תאים נוטים להיות עמוסים במיוחד, משטר מתאים יותר לניתוח תא בודד. כל DNAs שהכותרת צריך להיות גם בעבר על מנת להסיר כל שמץ של צבע חופשי מטוהר ג'ל (לא הגיב fluorophore) מפתרון מניות DNA. חוץ מזה, בעיות פוטנציאליות עם השפלה DNA, במיוחד עבור ניסויי smFRET, ניתן לטפל באמצעות DNAs עם חומצות טבעיות גרעין, או מוטיבים המגנים על termini exonuclease הנגיש כגון לולאות סיכת ראש.
adjustabl נוסףפרמטר דואר בelectroporation הוא עוצמת השדה מיושמת במהלך electroporation. עוצמת שדה נמוכה (~ ק ו 1 / סנטימטר) יוביל ליעילות טעינה נמוכה מתאימה ללימודי מולקולה בודדת. עוצמת שדה גבוהה יותר (עד 1.8 קילו וולט / סנטימטר) תגביר את יעילות הטעינה; עם זאת, יש מתאם הפוך בין עוצמת שדה וכדאיויות תא לאחר electroporation (ראה איור 4). להתייחסות, עוצמת שדה רגילה המשמשת לחיידקים והשמרים electroporation היא ~ 1.5 kV / סנטימטר. קבוע הזמן, המייצג את האורך של הריקבון הזה, הוא פרמטר נוח למעקב, שכן טיפות קבועות הזמן בהקדם כל תופעה קשתית מתרחשת בקובט. תחת הגדרות רגילות, קבוע הזמן צריך להיות גדולה מ 4 ms; ערכים נמוכים עלולים להוביל ליעילות טעינה נמוכה או תאים שניזוקו אף שאינם טעונים. רוב electroporators מציע תארים אחרים של חופש (כמו "חיתוך דופק" או "דופק צורה") אשר יכול להיות שונה כדי לכוון שניטעינת תא כדאיות. אנחנו מוחלים בשיטה זו לשני החיידקים ושמרים, אולם הליכים דומים צריכים גם לאפשר להפנמה של מולקולות ביולוגיות שכותרתו לתוך תאי יונקים באמצעות הגדרות מתאימות electroporator מאז הקרום שלהם הוא למעשה פחות מורכב (bilayer שומנים יחיד) ומאז electroporation כבר נעשה שימוש בתאים כאלה 21.
כאשר הפנמת חלבונים שכותרתו, כל הצבע החופשי צריך להיות מוסר מelectroporation לפני פתרון מניות חלבון שכותרתו. מולקולות צבע חינם, בשל הגודל הקטן שלהם, יכולות להיות מופנמות באופן מועדף על החלבונים של עניין, וקשה להבחין בניתוח נתונים (למרות דיפוזיה מהירה יותר הצפויה שלהם). כמדריך, למדגם בחלבון הנקרא באופן אורגני להיות מתאים לelectroporation, כמות שנותר לצבוע חופשיים צריכה להיות מתחת ל -2% (שזוהה באמצעות סריקת ניאון של SDS-PAGE) 22. תהליך זה הוא חשוב במיוחד,כחלק ממולקולות עלולות להידבק לקרומים החיצוניים של חיידקים או פטריות electroporated. מבחינה זו, מדגם הביקורת השלילי צריך להציג עוצמת הקרינה לכל תא באופן ברור נמוכה מתאי electroporated, באופן אידיאלי נמוכה כמו רמת autofluorescence של תאים ריקים (תאים שלא היה מודגרות עם כל מולקולות ביולוגיות שכותרתו fluorescently ולא electroporated, איור 2).
כמו בdsDNA, יעילות ההפנמה של חלבונים שכותרתו צמודה לסכום של מולקולות ביולוגיות הוסיפו לתאים לפני electroporation. עם זאת, פרמטרים אחרים, כגון גודל ותשלום, לשחק תפקיד בהפנמה. חלבונים קטנים להפגין יעילות הפנמה גבוהה, ואילו חלבונים גדולים יותר (עד 98 KDA) יכול להיות מופנם בהצלחה אבל עם יעילות נמוכה יותר (איור 5) 26. נקודת isolelectric של החלבון, אינטראקציות אפשריות עם קרום התא ופרמטרים physicochemical אחרים גםטעינת תא השפעה במהלך electroporation. כתוצאה מכך, משתמשים צריכים לייעל את הניסויים למערכת משלהם, בידיעה כי ריכוז ראשוני גבוה של חלבון שכותרת (> 50 מיקרומטר) ייתן את הסיכוי הטוב ביותר לטעינה מוצלחת. Electroporation מציע גם כלי חדש להפריע ולנתח פונקציה סלולרית על ידי החדרת חלבונים ומולקולות ביולוגיות אחרות לתאים (שכותרתו או ללא תווית או). ניסויי RNA פולימראז T7 (איור 5 ג) הווה דוגמא כזו של ניסוי שבו אנחנו יכולים להציג את biomolecule שיכול לשנות ביטוי גני in vivo באמצעות electroporation.
בעת ביצוע ניסויי הקרינה מולקולה בודדת, תאורת TIR בדרך כלל העדיפה על פני מצבי תאורה אחרים כפי שהוא מציע יחס אות לרעש הטוב ביותר על ידי fluorophores רק מרגשת בתוך קטע דק מעל פני השטח coverslip (~ 100 ננומטר). עם זאת מולקולות ביולוגי הדמיה שכותרתו לשדר בתוך מיקרואורגניזמים חיים עשויות מחדשמקהלת תאורה עמוקה יותר (עד 0.8 מיקרומטר לE. coli). תאורה עמוקה מושגת במצב חילו, תוך שמירה על יחס אות לרעש גבוה. מצד השני, הדמיה שדה רחבה היא חשובה במיוחד לניתוח photobleaching צעד חכם, שבו המשתמש הוא לאמוד את מספר המולקולות הופנמו על ידי photobleaching תא טעון כל עם כוח גבוה לייזר וחלוקת עוצמת הקרינה סלולארי הראשונית מעוצמת האחידה מיוצרת על ידי מולקולה בודדת (שלב photobleaching בודד, איור 3). ההדמיה Widefield נדרשה גם למעקב מולקולה ארוך טווח על מנת למקם את המולקולות לשדר עניין גם אם המסלולים שלהם לכסות את כל נפח התא.
בפרוטוקול זה, אנו מציגים כיצד electroporation, טכניקה סטנדרטית לביולוגים וביוכימאים לאספקת חומצות גרעין בתאים, מהווה שיטה פשוטה להעברת מולקולות ביולוגי ניאון בסוגי תאים שונים. ההוא רומן, טכניקת תפוקה גבוהה מציעה כלי ייחודי להתבונן מולקולות שכותרתו בסביבה הטבעית שלהם. במולקולות ביולוגיות בנוסף שכותרתו עם fluorophores מכסה מגוון רחב של אורכי גל, electroporation יכול לספק מולקולות שונה עם קבוצות כימיות רבות, כגון נוקלאוטידים וחומצות אמינו לא טבעיים, chelators מתכת, crosslinkers, וקבוצות כולאות. אם המערכת הביולוגית של עניין היא לא חיונית להתפתחות התאים, הגן המקודד לחלבון המטרה יכול להיות גם שנמחק (או דפק למטה), על מנת להבטיח כי החלבונים נצפו לאחר הפנמה כל (או רוב) של בריכת החלבון תאית מייצגים . בעיקרו של דבר, electroporation יכול "השתלה" הגמישות של במבחנה bioconjugates לתאים חיים, ולכן תועלת מאמצים בביולוגיה סינתטית, ביולוגיה של מערכות, ובגילוי מולקולה בודדת vivo.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Stephan Uphoff for discussions.
R.C. was supported by Linacre College, Oxford University. A.P. was supported by the German Academic Exchange Service (DAAD), the German National Academic Foundation and EPSRC. M.S. was supported by the Wellcome Trust. A.N.K. was supported by a UK BBSRC grant (BB/H01795X/1), and a European Research Council Starter grant (261227).
Materials
| Name | Company | Catalog Number | Comments |
| ElectroMax DH5-alpha Comptent cells | Invitrogen | 11319-019 | or any other commercial or lab-mage electrocompetant bacteria or yeast. |
| EZ Rich Defined Madia | Teknova | M2105 | low fluorescence rich media |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | or any classical electroporator for microorganism transformation |
| Certified Molecular Biology agarose | Biorad | 161-3100 | low fluorescence agarose for agarose pad |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1h |
| Single-molecule fluorescence microscope | Home-built | described in REFs | |
| Localization software | Custom-written, available online | MATLAB and C++ software package that can be adapted for localization analysis. | |
| Tracking software | Available online | MATLAB implementation by Blair and Dufresne. |
References
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Leake, M. C., et al. Stoichiometry and turnover in single, functioning membrane protein complexes. Nature. 443, 355-358 (2006).
- Taniguchi, Y., Kawakami, M. Application of HaloTag protein to covalent immobilization of recombinant proteins for single molecule force spectroscopy. Langmuir. 26, 10433-10436 (2010).
- Xie, X. S., Choi, P. J., Li, G. W., Lee, N. K., Lia, G. Single-molecule approach to molecular biology in living bacterial cells. Annual review of biophysics. 37, 417-444 (2008).
- Lee, J. H., et al. Highly multiplexed subcellular RNA sequencing in situ. Science. 343, 1360-1363 (2014).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Sauer, M. Localization microscopy coming of age: from concepts to biological impact. J Cell Sci. 126, 3505-3513 (2013).
- Dempsey, G. T., Vaughan, J. C., Hao Chen, K., Zhuang, X. Evaluation of fluorophores for optimal performance in localizationbased super-resolution imaging. Nat Meth. 8, 1027-1041 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Meth. 2, 905-909 (2005).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nat. Methods. 9, 480-482 (2012).
- Jaitin, D. A., et al. Massively Parallel Single-Cell RNA-Seq for Marker-Free Decomposition of Tissues into Cell Types. Science. 343, 776-779 (2014).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biol. 14, R124 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat. Methods. 7, 717-719 (2010).
- Zhang, Z., et al. A new strategy for the site-specific modification of proteins in vivo. Biochemistry. 42, 6735-6746 (2003).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. J Cell Biol. 98, 1556-1564 (1984).
- Clarke, M. S., McNeil, P. L. Syringe loading introduces macromolecules into living mammalian cell cytosol. J Cell Sci. 102, 533-541 (1992).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nat. Methods. 7, 203-205 (2010).
- Taylor, L. S. Electromagnetic syringe. IEEE Trans. Biomed. Eng. 25, 303-304 (1978).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16, 6127-6145 (1988).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Sustarsic, M., et al. Optimized delivery of fluorescently labeled proteins in live bacteria using electroporation. Histochem Cell Biol. , (2014).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5, 159-161 (2008).
- Sinha, A., et al. A cascade of DNA-binding proteins for sexual commitment and development in Plasmodium. Nature. 000, 1-5 (2014).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc Natl Acad Sci U S A. 108, E365-E373 (2011).
- Crawford, R., et al. Long-lived intracellular single-molecule fluorescence using electroporated molecules. Biophys J. 105, 2439-2450 (2013).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc Natl Acad Sci U S A. 110, 8063-8068 (2013).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing Protein-DNA Interactions in Live Bacterial Cells Using Photoactivated Single-molecule Tracking. J Vis Exp. , (2014).
- Hohlbein, J., Gryte, K., Heilemann, M., Kapanidis, A. N. Surfing on a new wave of single-molecule fluorescence methods. Phys Biol. 7, 031001 (2010).
- Xie, X. S., Yu, J., Yang, W. Y. Perspective - Living cells as test tubes. Science. 312, 228-230 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proc Natl Acad Sci U S A. 107, 715-720 (2010).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature communications. 4, 2131 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved