Method Article
新一代测序为可操作的突变在固体和液体瘤检测
摘要
This manuscript describes clinical protocols for two next-generation sequencing panels. One panel interrogates hematologic malignancies while the other panel targets genes commonly mutated in solid tumors. Molecular classification of driver mutations in human malignancies offers valuable prognostic and predictive information.
摘要
As our understanding of the driver mutations necessary for initiation and progression of cancers improves, we gain critical information on how specific molecular profiles of a tumor may predict responsiveness to therapeutic agents or provide knowledge about prognosis. At our institution a tumor genotyping program was established as part of routine clinical care, screening both hematologic and solid tumors for a wide spectrum of mutations using two next-generation sequencing (NGS) panels: a custom, 33 gene hematological malignancies panel for use with peripheral blood and bone marrow, and a commercially produced solid tumor panel for use with formalin-fixed paraffin-embedded tissue that targets 47 genes commonly mutated in cancer. Our workflow includes a pathologist review of the biopsy to ensure there is adequate amount of tumor for the assay followed by customized DNA extraction is performed on the specimen. Quality control of the specimen includes steps for quantity, quality and integrity and only after the extracted DNA passes these metrics an amplicon library is generated and sequenced. The resulting data is analyzed through an in-house bioinformatics pipeline and the variants are reviewed and interpreted for pathogenicity. Here we provide a snapshot of the utility of each panel using two clinical cases to provide insight into how a well-designed NGS workflow can contribute to optimizing clinical outcomes.
引言
临床肿瘤学标本下一代测序(NGS),为查明靶向基因变化和预测/预后分子标记的重要性越来越多的科学文献点已经成为过去几年更广泛的应用。多基因分析小组和疾病进展和复发两种上皮1,2和血液系统恶性肿瘤3全外显子组测序研究都凝固了肿瘤异质性的概念,并克隆演变。另外,与竞争技术如聚合酶链反应(PCR)或Sanger测序,NGS可以检测单个测定4中的所有临床相关的癌基因最基因组改变。
该中心最初有两个临床NGS板,自定义面板血液学(血红素-NGS面板)和一个现成的,货架癌症小组FFPE样品(固体NGS面板)推出个性化诊断(见图1)。这些面板覆盖了选择的基因的临床相关的或高利息的区域;不是所有的基因或外显子完全覆盖。扩增子被探针杂交其次是延伸和连接产生的。目标区域使用PCR具有普遍的双索引引物进一步放大,允许多达96个样品进行汇集测序。
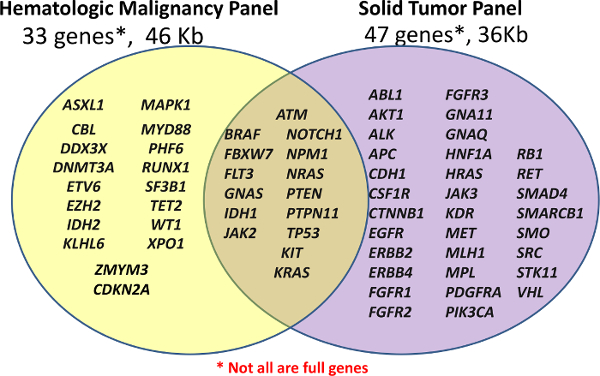
图1:在面板覆盖基因的列表中使用进行文库制备为自定义面板血液学33基因或关闭的,现成的扩增子癌症面板的47个基因(固NGS)(血红素-NGS面板)。不是所有的基因或外显子的覆盖全面,因为有些可能扩增子仅涵盖某些热点。 请点击此处查看该图的放大版本。</ A>
为血红素-NGS面板内容是从多个来源,但围绕在先前描述为证明临床效用5高水平急性髓细胞白血病(AML)突变16个基因中心。固NGS面板与商业报道的体细胞突变的目录癌症(COSMIC)数据库6基于在一般癌症的基因突变目标区域产生的。
几个关键步骤表征整个工作流程,为临床NGS。临床医生订单试验后,病理学家确定以下用于肿瘤百分比和样品体积分析检体的充分性。在我们的机构,我们要求,由于该技术的背景测序错误率("噪声")和目标方法的效率为至少10%的肿瘤。如果组织是足够的检测,基因组DNA提取。然后将该DNA进行多个质量控制(QC)的步骤。如果DNA通过QC,产生和测序的扩增子文库。所得数据通过一个内部的生物信息学流水线进行分析。继生物信息学分析,变种人工审查,并结合之前解释的致病性到临床报告。下面我们描述了两个案例,通过这个严格的流程去,并最终导致临床管理的变化。
案例1 -急性髓系白血病
从病人A A骨髓活检诊断是反洗钱,没有成熟。细胞遗传学研究是对骨髓标本发出并表现出正常的雌性核型。出席者达95%循环爆炸,使外周血标本为血红素NGS面板上的个性化诊断测试发送。
急性髓性白血病(AML)是白血细胞的骨髓谱系的血液系统恶性肿瘤。检测在AML基因突变已成为预后和治疗越来越重要,复发性基因突变公认的发病机制和预后7重要。在NPM1和CEBPA突变与一个有利的预后风险相关,而在FLT3内部串联重复(场ITD)已与一个不太有利的结果8有关。越来越多的证据体支持的AML 9这些和其他突变的致病作用。
案例2 -肺腺癌
从患者B中的左锁骨上肿块活检证实肺腺癌。从福尔马林固定的石蜡包埋(FFPE)淋巴结肿块活检材料用于基因组试验(固NGS面板)被发送作为辊/卷发具有大于50%的肿瘤,以确定一个突变是否存在有针对性的治疗干预。
龙CANC器是在美国癌症相关死亡的主要原因,并分为两种主要类型,非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。非小细胞肺癌,可以进一步定义为腺癌或鳞状细胞癌,基于病变的组织学。肺腺癌是肺癌最常见的亚型,在吸烟者和非吸烟者看到的,是不吸烟者10肺癌最常见的形式。肺腺癌的分子研究已经在多个癌基因11中确定突变。在吸烟者中确定的最常见驾驶员的突变是在KRAS基因和BRAF突变。在非吸烟者中最常见的突变是EGFR突变,以及涉及的基因ALK,RET和ROS1重排。肺肿瘤已与一个在框架的外显子20插入在基因ERBB2(HER2 / neu的)中描述。在何最常见的异常R 2 / neu的是该位点在乳腺癌的扩增为其中靶向治疗是可用的(曲妥单抗:针对HER2 / neu基因的人源化单克隆抗体)。即在2观察HER2 / neu基因外显子20插入-肺4%adenocarcimomas 12已经(分别为那替尼和西罗莫司脂化)13显示,联合治疗HER2 / neu和mTOR抑制剂部分缓解。
研究方案
这个协议包括两个验证实验室开发的测试为固体和液体瘤的基因组分析的显着的步骤,分别。在实验室中进行的试验是根据1988年的临床实验室改进修正案(CLIA)的要求完成。
1.外周血或骨髓DNA提取
- 确定有多少血液或骨髓采取根据表1。
| 采样/ WBC | 量被视为1ml血液 |
| 骨髓 | 250微升 |
| 血WBC 12,000 - 50000 | 1毫升 |
| 血WBC 50,000 - 100000 | 500微升 |
| 血WBC 100,000 - 200000 | 200微升 |
| 血白细胞> 20万 | 100微升 |
| *血WBC <12000取2毫升血液 | |
表1:血/骨髓卷以使用图表由于白细胞计数将从样本变化来样,它是很难指定的血液使用特定的体积。因此,血液用于测定的量必须通过启动测定之前看着白细胞计数(WBC)来确定。虽然是利用较少的血液,它仍应被视为好像其1毫升以来的使用过的血液的体积减少了,因为本小区的数目大于正常值。
- 按照商业上可获得的试剂盒的协议来的基因组DNA分离。
2.从福尔马林固定石蜡包埋(FFPE)组织DNA提取
- 基于肿瘤区域的病理学家对H&E幻灯片盘旋,排队与导向H&E幻灯片未染色的幻灯片,并概述了提取了类似的区域。对于宏观解剖,进程只有一个标本/患者的一次设置幻灯片。
- 加热45℃的加热块上滑动到略微熔化石蜡。仔细刮掉被标记幻灯片上的线内的组织,采用了全新的手术刀要提取每个试样。放置蜡刮出入适当标记的1.5mL管中。要小心,因为刮蜡是非常静电,可能跳出管。
- 加入320微升脱蜡解决方案为每五到六5微米的部分(25 - 30微米计)。例如,如果含有10微米辊/卷曲3段的管将要处理的,然后用320微升,但是如果得到在相同的厚度5个部分,然后使用640微升。
- 涡旋剧烈至少10秒,并执行水溶液在微量uick自旋以去除从侧面和帽并进入溶液中的组织/蜡。孵育在56℃进行3分钟,然后在RT孵育5 - 10分钟。
- 以下对RT温育后,添加180微升的ATL缓冲液中,每320微升脱蜡溶液。使用利用为每个试样新杵的无菌微型杵剁碎的组织十倍。确保没有粘在杵,因为它可以是很粘的组织。涡旋该悬浮液剧烈3秒,然后离心以最大速度为1分钟。
- 添加10微升蛋白酶K的到下澄清相。通过上下吹打,以确保组织被重新悬浮轻轻混匀。不要旋涡。在56℃孵育400振摇过夜 - 500转。
- 第二天早上,检查是否组织被完全溶解(如果较低的解决方案是清楚这已经发生)。如果较低的解决方案是不明确的,则涡流大力以最大速度FO 3秒,并离心的R 1分钟。添加额外的5 - 蛋白酶K的10微升并在56℃孵育另外30 - 60分钟。
- 孵育在90℃下1小时,以帮助扭转甲醛交联。允许样品冷却到室温5 - 10分钟,然后短暂离心每个管巩固液体。
- 转移低明确阶段到一个标记好的1.5 ml管。如果有来自同一患者样品(例如,如果正在使用多个辊的情况下)的多个管,重组的下阶段到一个管中,在这一点上。注:传输少量脱蜡解的不应与纯化过程产生干扰,但是,如果大量的转移的危险。
- 加入2微升RNA酶A的解决方案。涡旋轻轻或反转在微量25倍和快速旋转。孵育在室温下5分钟。
- 加入200μl蛋白沉淀解决方案。如果做一个或两个卷,用200微升。如果做三辊■在一次,然后用400微升。涡大力高速30秒,均匀混合裂解液。在冰上孵育5分钟,或可将样本留在冰上达一个小时。
- 离心在5000 xg离心5分钟。沉淀的蛋白质应该形成一套严密,白色沉淀。倾上清液成标记的1.5mL管中,然后在冰上孵育样品至少3分钟。离心在5000 xg离心3分钟。
- 添加每180微升缓冲液的ATL200μl的2-丙醇(异丙醇)的较早的标记1.5mL管中加入(它可能是需要使用2毫升管)。例如,如果在做三辊加600μl异丙醇。加入1μl糖原为每180微升缓冲ATL较早的加入异丙醇和反转管几次,以混合。
- 小心地从蛋白沉淀踏进异丙醇混合物中加入上清。通过倒转温和地至少50倍混合管。
- 离心机最大SPEED 3分钟。该DNA将作为在管的底部小的白色沉淀可见。
- 倒入或吸掉上清到相应的废液管。保持单独的1.5毫升废物管的情况下,每一个试样粒料自带脱落,所以它不会被丢失或与其他试样的废物混合。漏在纸巾上的管,并确保大部分异丙醇被除去。
- 加入300微升新鲜制备的70%的乙醇。轻轻颠倒管数次清洗沉淀。尽量保证粒料来被撞出,以确保一个更彻底的清洁。
- 离心以最大速度为5分钟。然后小心地除去乙醇。沉淀可能松动,所以倒吸或慢,看沉淀。从管的内部除去过量的乙醇,而不触及沉淀。允许样品在空气中干燥5 - 15分钟,注意不要过度干燥样品。
- 添加的25 - DNA水合溶液微升100到e基于该DNA沉淀的大小和组织的起始量ACH样品。涡管大力和旋转简要的离心。孵育1小时,在65℃下充分再水化的DNA。
3.基因组DNA的质量控制
注意:对于DNA的质量控制(QC)三个独立的步骤。 见表2为什么执行每个QC步骤的进一步解释。
| 仪器 | 结果 | 迹象 | 理想的范围 |
| DropSense96 | A260 / A230 | 化学污染物的标识( 如乙醇) | 1.50 - 2.2 |
| DropSense96 | A260 / A280 | 蛋白质污染物的鉴定 | 1.60 - 2.2 |
| DropSense96 | 浓度 | DNA定量 | > 1纳克/微升 |
| TapeStation | DNA涂片 | DNA完整性的测定( 如 ,降解/提取的DNA片段) | 50%> 1000基点 |
| 量子比特2.0 | 浓度 | 更准确的DNA定量 | > 1纳克/微升 |
表2:DNA QC预期结果所有这些值都考虑到允许运行的样本进行到图书馆准备阶段之前。
- 按照制造商的协议,在荧光计以获得工作浓度样品浓度(ng /微升)运行2微升提取的DNA。
- 运行1 - 2微升各样品上的UV / VIS分光光度计来检查样品的质量(A260 / A230和A260 / A280鼠IOS)根据制造商的说明。
- 对FFPE样品:按照制造商的说明中,微流体凝胶电泳系统上运行1μl的每种样品来评估DNA的降解/分裂。参见图2中的例子。
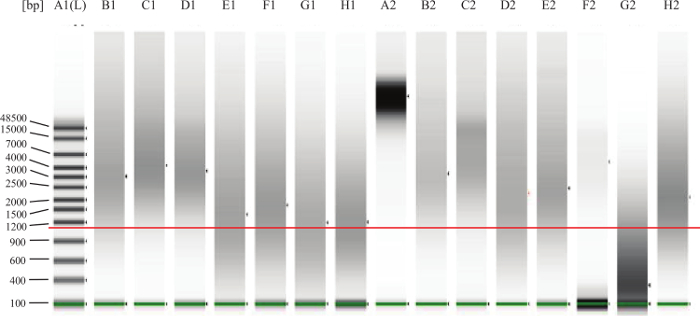
图2:基因组DNA的QC凝胶实施例的绿线在较低频段是指示低标记。添加的,在红线指示约1,000基点。巷A2表示完全完整的DNA,因为人们会从新鲜TIS 起诉 ( 例如 ,外周血或骨髓)期待。泳道B1,C1,D1,B2,C2,E2是良好的,完整的FFPE的DNA的例子。在泳道F 2的DNA看起来是完整的,但是在太低的浓度。在泳道G2中的DNA被降解或片段化,并且不会在测定工作。车道的E1,F1,G1,H1,D2H2代表的DNA,它落在这意味着检测可以工作的"灰色地带",但一些的DNA可能会过于损坏或交联的,因此它不会在试验中表现良好。 请点击此处查看大图版本这个数字。
4.扩增子文库制备
- 绑定寡寡池和杂交分机结扎
- 在预PCR室,加低EDTA TE的必要量,5微升小组的寡糖管( 如固体NGS面板或血红素-NGS面板),以及100 - 250纳克基因组DNA,以在每个相应井半裙边96孔板标记为杂交(HYB)板。
- 加入40微升的Oligo杂交测序试剂1(OHS1)的在HYB板每个样品。轻轻移液器上下至少5 - 6次混合。更改提示每列后避免交叉感染。
- 密封HYB板用粘合剂铝箔和离心机在1000×g离心30秒。
- 孵育在预加热的杂交培养箱HYB板在95℃下1分钟。杂交培养箱的温度设定为40℃。继续只要它需要培养箱降低从95℃至40℃(〜90分钟)温育。注:此逐渐冷却是正确杂交的关键。
- 在过去的15 - 杂交孵育20分钟,预洗过滤板单元(FPU)。在目前的实验中使用仅准备的孔中, 即 ,只使用一个先前打开的过滤器板的新鲜/未使用的孔,但从未重新使用已经使用的井。注意:此应根据在过滤器板的工具包号,在过滤器板的标记,并在该板所用的密封剂是清楚的。
- 使用多通道移液管,添加45微升严格洗涤1(SW1)的每个孔中。
注意:包含甲酰胺。封面与离心机FPU 2250 XG 3分钟,20℃。检查每单井残余液(> 15微升/孔)。 - 如果残留液体存在,旋转FPU 180°,并再次重复该离心机步骤另外3分钟。如果残余液体旋转通过第二次,然后进行下一步骤,如果没有,那么有可能是在过滤器板中的缺陷和当前板将需要更换。
- 使用多通道移液管,添加45微升严格洗涤1(SW1)的每个孔中。
- 一旦杂交培养箱已冷却至40℃,离心板在1000 xg离心至少30秒,在20℃下以收集冷凝。从HYB板各样品的总体积转移到浮点处理单元的相应的预洗涤井的中心。提示更改每列后,避免交叉污染。盖2250 XG FPU的和离心机在20℃下3分钟。
- 2250 xg离心添加45微升SW1和离心机的3分钟在20℃下。重复总共两次洗涤的。 2250 XG 3分钟,再次旋转FPU 180°,离心机完全删除所有的SW1。
- 掩饰的FPU。丢弃所有流过的(含有甲酰胺)到适当的废物容器。重新安装使用不同的MIDI废物收集板的FPU。 2250 xg离心添加45微升通用缓冲液1(UB1)的每个样品井和离心3分钟,在20℃。注意:含有甲酰胺。
- 加入45微升延伸连接混合3(ELM3)在每个样品以及在FPU盘和吸管上下3次混合。注:分机连接反应发生在过滤板膜。
- 密封FPU板用粘合剂铝箔孵育整个FPU组件在预热的37℃培养箱中45分钟。
- 索引和PCR扩增
- 等分指标被用来对应油井在索引放大PL吃(IAP),通过设置在指引板夹具的引物,布置在下面的方式:垂直,具有至H排A对齐的i5底漆管(白色帽,澄清溶液),i7的底漆管(橙帽,黄色溶液)水平,通过12列1使用P10多通道移液器对齐,加入4微升i7的引物(黄色溶液)至IAP的每一行,并添加4微升i5的引物(澄清溶液)到IAP的每一列。
- 在冰或冷却块,加入0.5微升DNA聚合酶1(TDP1)对每个样品25微升PCR预混2(PMM2)的准备PCR主混合物。反转,迅速旋涡,并短暂离心PCR主混合物混合。
- 加入22微升的PCR扩增预混到IAP的每孔吸管上下3次混合。更改井之间的技巧。保持IAP在4℃。
- 在45分钟分机连接反应(步骤4.1.10)后,从孵化器中删除FPU并小心地取出人uminum铝箔封口。与在20℃的盖子和离心机2250 xg离心3分钟覆盖。
- 加入25微升的50mM NaOH中,以每个样品井的FPU。吸管上下至少6倍;保证进来与膜接触的枪头。每列之后更改的提示。在室温下孵育5分钟。
- 转移样品从FPU到IAP洗脱如下:
- 使用P100多通道移液器设置为20微升,吸取该NaOH在FPU板向上和向下的至少6倍。微微翘起的FPU板,保证了板完成愿望。
- 转移从FPU到IAP的相应列20微升。轻轻吸取上下至少6次以彻底将DNA与PCR主混合物结合起来。用粘接膜和离心密封IAP在1000 xg离心1分钟,在20℃。
- 把PCR板进入后-PCR室并加载到板的热循环仪。运行PCR program包括热变性,在95℃步骤3分钟的;接着,30秒,62℃,30秒,72℃60秒95℃25个循环;随后的72℃5分钟的最终延伸;与在10℃的保持精加工。如果未进行到下述PCR完成下一阶段,板可以保持在热循环仪过夜,或者它可以被存储在2至8℃长达两天。
- PCR纯化和基于珠规范化
- 从4℃冰箱和地点在RT下一个阶段之前的至少20分钟除去磁性纯化珠,洗脱缓冲液(EBT),和凝胶电泳试剂。
- 一旦在PCR完成后,离心机在1000×g离心1分钟,在20℃以收集冷凝。转移1μl的每个PCR反应的剥离含有4微升的水稀释样品1/5管/板孔中。移液器上下混合。
- 加入2微升的稀释PCRed样品2微升微凝胶缓冲。密封条/板。摇在1800转,至少30秒,离心机在1000×g离心30秒。依照制造商的协议,在一个微流体凝胶运行混合物,以评估如果库制备,得到一个可接受的库(参见图3)。
- 涡流磁净化珠,直到他们很悬和颜色出现均匀。添加45微升的珠粒各样品。
- 印章清晰胶膜板,并在1800转摇板2分钟。在室温下孵育不摇动10分钟。
- 放置板到一个磁性支架上。一旦上清已清除,小心地取出并弃去上清液。如果任何珠粒无意中吸入到提示,分配所述珠回板,并让在磁铁的板其余2分钟,并确认上清液已经清除。
- 随着对T盘他磁架,加入200微升新鲜制备的80%的乙醇,以每个样品孔。移动板来回几次。孵育在磁性支架30秒的板。小心取出并弃去上清液。重复总共两次洗涤的。
- 通过以1000 xg离心简要离心板压低任何乙醇在管侧,放置所述板放回磁性支架,并且使用一个P10多通道移液器设置为10微升以除去乙醇除去过量的乙醇。允许珠风干5 - 8分钟。
- 使用P100多通道移液器,添加30微升EBT的每个孔中。吸管上下几次,以确保珠脱落管的一侧。印章清晰胶膜板,并在1800转摇板2分钟。
- 在室温下孵育不摇动3分钟。如果有其中的珠未完全再悬浮的样品,轻轻吸取上下重悬珠子。
- 放置板在磁性支架上。使用P100多道移液器,转让20微升上清到一个全新的板块叫做库正常化板(LNP)。转移剩余的约10微升的各个测序文库的一个单独的板块叫做剩余清理后的库板(RCLP)。与最终库准备沿存储该板,因为它可以用来作为储备用于第二测序运行,如果需要的话。如果不继续到下一阶段,LNP和RCLP可以存储在-15至-25℃。
- 大力涡和悬浮图书馆规范化珠1(LNB1)。至关重要的是在管的底部,以完全悬浮LNB1珠粒料。通过将8微升LNB1的每个样品库规范化添加剂1(LNA1)的44微升准备正常化混合。大力涡正常化混合10 - 20秒。
注意:LNA1含有甲酰胺。 - 间歇反演第二正常化驴友涡旋,加入45微升的携号转网的每个样本。印章清晰胶膜板,并在1800转摇板30分钟。这个孵育30分钟为正确的库正常化为大于或小于30分钟的孵育可能影响库表示和群密度是至关重要的。
- 在培养30分钟,解冻试剂盒和HYB缓冲器(HT1)准备测序试剂[注意:这两种含有甲酰胺。此外,获得冰上后面的步骤,并确保合适的1.5毫升离心管中被设置为96℃的热块。
- 当30分钟的混合步骤完成时,将LNP在磁性支架上。一旦上清液已经清除,使用多道移液器小心取出并弃去上清液到适当的废物容器。
- 从磁性底座上卸下LNP洗与图书馆标准化洗1次(LNW1)珠如下:
- 添加45LNW1的微升至每个样品孔。
注意:含有甲酰胺。印章清晰胶膜板,并在1800转摇板5分钟。重复总共两次洗涤的。确保第二次洗涤后删除所有LNW1。
- 添加45LNW1的微升至每个样品孔。
- 从磁性底座上卸下的LNP,并使用多通道移液管,加入30微升0.1N NaOH中的(少于周龄)到每个孔中,以洗脱样品。印章清晰胶膜板,并在1800转摇板5分钟。
- 在5分钟洗脱,添加库正常化保存缓冲液1(LNS1)的30微升每孔的命名的存储板(SGP)新印版被使用。
- 将携号转网对磁立场。一旦上清液已经清零,30微升洗脱转移到LNS1在SGP。更改样本之间的技巧,以避免交叉污染。
- 封用粘接膜和离心该板在1000 xg离心至少30秒。
- 加入51;每个样品l的待测序到的标记汇集扩增子库(PAL)的1.5mL管中。漩涡PAL混合并短暂在微降速。
- 根据正在使用的测序试剂(V2 V3或)加4 - 10微升的PAL至590 - 596微升HT1的。一般来说,加5.8微升PAL的595微升HT1为V2化学和8.5微升PAL 592微升HT1为V3化学。标签此管作为稀释扩增子库(DAL)管。
- 漩涡DAL并简要在微降速。孵育DAL在96℃2分钟。倒置DAL管3倍,并把DAL冰上至少5分钟,而制备用于测序的定序。 5分钟后,将DAL准备好被装载。
- 如果与SGP完成后,密封用粘合剂铝箔膜的板,并与日期和板ID标签它。储存在-15至-25℃下的密封SGP和PAL。

图3:库准备的QC凝胶实施例的绿线在较低频段是指示低标记和超过上带紫线是指示更高标记。一切工作的很好车道H1,A2,B2,C2,E2和G2。库准备没有最佳地工作,为泳道D2,F2和H 2,但结果仍可以获得他们只是可能没有足够的覆盖范围。对于A3,图书馆准备工作几乎没有,最有可能这个DNA样本是不够的检测。下标记上方的下频带是未使用的引物,因为等分试样从PCRed直接采取良好。 NTC的样本应该只有未使用的底漆乐队,而不是其他。 请点击此处查看该图的放大版本。
5.测序
- 保证正确SampleSheet.csv已经为运行作出的。见补充图1中的例子。
- 冲洗并擦干流动池,并添加600微升的DAL到解冻试剂盒。
- 按照屏幕上的提示准备测序序。
6.数据分析
- 执行生物信息学管道。利用在内部,定制设计的生物信息学管道识别突变,插入,缺失和扩增18。
- 管道完成后,检查错误/警告日志文件,如流水线处理的QC任何显著错误/警告援助。
- 分析运行统计( 表3),以保证测序文库已通过实验确定的QC度量( 图4)。通过在基因组数据观众观看.bam文件( 例如 ,基因组学结合手动六审查每个变种壶16(IGV))。
注:只有有效的等位基因频率范围内和覆盖范围的质量后,过滤最小深度以上的变种报告(使用人类基因组变异协会(HGVS)命名)。最终报告,每个外显子变异体分为:致病性,可能相关的疾病,未知意义(VUS)的变种,可能是良性的,良性。 5%以上等位基因频率的报告标准,除了那些被视为良性变异和变化的代名词所有变体的报道。
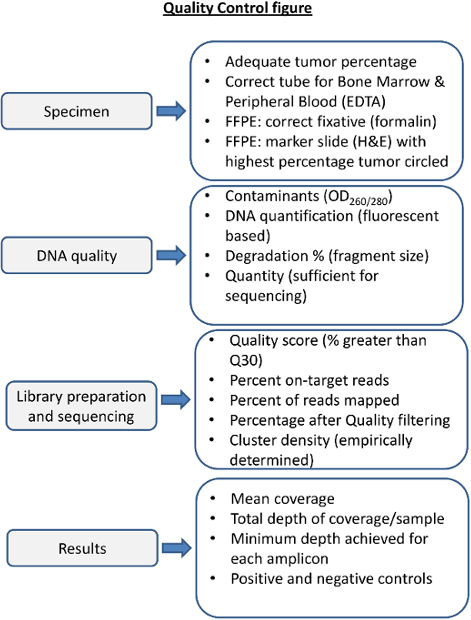
为NGS质量控制的步骤图4概述。在这个过程中每一步的质量控制是必要的,以确保测序将产生的结果,使得前后顺序指标考虑。合适的标本治疗是高品质的DNA至关重要。血液和不当的固定剂的骨髓能产生低质量的DNA。固体肿瘤标本固定不当可降解DNA( 例如 ,固定在B5)。 DNA的质量应该由分光装置进行评估蛋白质和RNA污染,并准确评估的量和DNA的完整性。测序度量需要在测序实验室凭经验确定并随后为每个测序反应和每标本。以报告每个样品的测序结果前应评估范围,深度和的阳性和阴性对照足够的性能。 请点击此处查看该图的放大版本。
结果
案例1 -血红素,NGS面板
从白血病外周血提取的DNA进行的足够质量和数量的(176毫微克/微升)用于血红素-NGS面板。覆盖的总体平均深度为4,933x(的1000倍覆盖范围的最低平均深度以上)。额外的运行统计数据见表3。以下250X覆盖了8个地区中,有3人因引物修剪不当( 即引物序列没有正确删除,由于测序错误),1个是分析的一种假象,和其他4个是不同的基因,没有报告变体的外显子的部分区域。虽然我们的临床方案只包括报告至少250读取覆盖的变种,至少有100的所有数据都读导入到数据库中以供审查。
数据处理F-ROM中的生物信息学管道检测到三个报告,疾病相关的基因突变;的错义突变在FLT3,在IDH2的错义突变,并在NPM1移码突变。与他们的等位基因频率的外显子变异表4中进行了说明。在一个FLT3常见的突变是FLT3 -internal串联重复(ITD),这是不能自动我们的管道打了 个电话,要求外显子14外显子14的目视检查目视检查FLT3的显示,在提交样品无插入或复制。该FLT3 I836del为1%的等位基因频率,并没有包含在最终的报告,因为它下跌5%最低验证等位基因频率之下。这种突变是不相同的DNA分子作为FLT3 D835Y变化上( 即 ,在相同的扩增子区域观察到的,而不是在"顺式"中的任何测序的读操作),它是仅由.bam音响的人工审查观察验证p.D835Y变化,莱斯。两个FLT3突变的下部等位基因频率表明这些突变可以代表异质性和/或克隆演变;然而,差别可能是由于该扩增子或单核苷酸多态性(SNP)接近或重叠的影响该等位基因的扩增引物序列测定性能。
案例1血红素NGS面板结果与FLT3,IDH2和 NPM1 AML鉴定突变,AML。突变三种常见的突变基因FLT3的成人患者中约25%是观察到AML(COSMIC数据库17),均内部串联重复(场ITD)或错义突变在酪氨酸激酶结构域。该FLT3-ITD中是比较常见的基因突变,并与标准化疗反应差有关,而FLT3激酶D的预后意义omain点突变,如在此的AML患者,对预后14不明确的影响。异柠檬酸脱氢酶2(NADP +),线粒体(IDH2)是编码是在AML中常用的突变外遗传修饰的基因。在表观遗传修饰的突变是比较常见的白血病,在IDH1和DNMT3A突变占这一类基因,导致基因失调的其他突变。在基因为核磷蛋白(NPM1)突变的AML中最常见的获得性突变之一,并且通常被认为是良好的预后因素(在不存在FLT3的- ITD)。
NPM1和IDH2的共同的突变已在文献中被描述为一个有利的预后指标5,用89%的3年总存活率。相比的整体3年生存率时,这代表了显著存活益处野生型NPM1和31%IDH2。例如,标准的护理实践包括NPM 1突变分析和FLT3-ITD突变。在这种情况下,只有一个NPM1突变的检测将无法适当地分层患者风险,作为二次突变可以是有利的( 例如,IDH2)或不利( 例如 ,TET2),减少了用于减轻骨髓移植的信心。
案例2 -固NGS面板
从FFPE组织提取的DNA是足够的质量和数量的固体NGS面板,用252纳克/微升的浓度,并只有4%以下1000碱基对(bp)的DNA组成。后的数据分析覆盖的平均深度为9167读取(远高于1000提供了最小深度截止读取)低于250阅读深度没有地区。附加QC指标笑WN在表3中 。
通过生物 信息学流水线处理的数据检测到两个疾病相关的突变:一个在帧插入在ERBB2(HER2 / neu基因 )的外显子20和TP53的错义突变。所有与他们的等位基因频率的外显子的变体示于表5表示。在ERBB2插入实际上代表重复的串联(HER2 / neu的 )序列,所反映的命名法。鉴定及测序的框架所需的插入人工审核确认通过IGV读取。检测的大于50%的突变频率,如图同时为TP53和的Her2 / neu的突变是暗示杂合事件(见讨论)的损失的。
固NGS小组结果2例肺腺癌检测突变我ÑERBB2(HER2 / neu基因 )和TP53,两个基因通常不为作为当前标准- -关心对肺癌患者的一部分。HER2 / neu基因在肺癌, 表皮生长因子受体编码类似另一种常用的突变基因酪氨酸激酶受体测试。激活HER2 / neu基因外显子20插入在2观察-肺腺癌的4%,占多数肺癌观察HER2 / neu基因的突变,并且通常见于肿瘤而不在其他司机的基因如EGFR和ALK 12突变。有证据表明潜在的几行各种治疗方案的患者激活HER2 / neu基因的插入,包括联合治疗HER2 / neu和mTOR抑制剂13,并与化疗15结合的单克隆抗体曲妥珠单抗显著疾病控制部分缓解。发现一个TP53变化不是不合作MMON癌症,但在这个时候有没有可行的疗法。
| 情况1 | 案例2 | |
| 启动总读取 | 2215926 | 2129110 |
| 百分比读取映射 | 98.42% | 98.29% |
| 百分比读取目标 | 99.01% | 97.29% |
| 百分比目标读取过滤器后 | 97.60% | 95.45% |
| 可用的百分比读取 | 94.87% | 91.79% |
| 上述250X覆盖基地的百分比 | 98.40% | 100% |
| 的基础百分比波夫1000X覆盖 | 95.90% | 99.70% |
| 覆盖下面250X -扩增子数 | 8 | 0 |
表 3: 测序运行QC度量这是最重要的运行统计数据的汇总,不包括平均覆盖面,即用于数据审查,以确定是否库准备的样品已通过QC。整个过程是成功的,如果所有的百分数都在90%以上,但它是可能的,与SW1的夹带或UB1在FPU洗涤步骤或引物串音,能有较低的"百分比上目标"中的80的范围内 - 90%。如果'百分比映射'太低,这将表明细菌或其它DNA的污染,因为所有的样品应对准人类。当这些指标都低于80%,将样品标记为进一步的审查,以帮助确定如何为proceed和提高的过程。
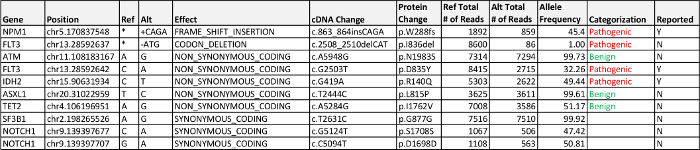
表4:案例1的结果检测致病,相关疾病,意义不明的变异(VUS),以上列出的5%等位基因频率的报告标准可能良性的外显子的变种,请点击此处下载此表。
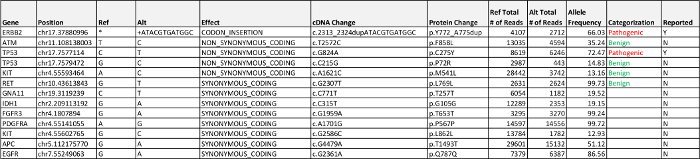
表5:案例2检测结果相关的致病性,疾病,意义不明的变异(VUS),高于5%的等位基因频率的呈报准则的报告中列出可能的良性外显子的变种,请点击此处下载此表。
补充图1:基于扩增子-SampleSheet.csv的一个例子。 此片材传送到定序执行何种化学方法(在此情况下,扩增子),什么工作流( 例如,GenerateFastq),什么应用与检测( 例如,FastqOnly),有多少个碱基(或读取),以序列(在此情况下,186 bp的点¯x186碱基对),最后什么样品用某些索引相关联(在这种情况下,双索引)。被突出显示为黄色的部分可以改为无论实验者希望,但在这种情况下,实验室使用这些参数。 请点击此处下载这个数字。
讨论
如本手稿描述的两个NGS测试临床上所提供的最重要的实际考虑是质量控制。具体来说,仔细考虑必须支付的质量和提取的DNA量。这是为FFPE样品这往往是用可变的DNA产量高度退化尤其重要。异丙醇沉淀法,是为了最大限度地从FFPE样品DNA产率,为发现基于列的方法有时会导致有限的洗脱体积的DNA剪切开发。因此,大多数的当检体产生浓度太低或为测定太降解的时间,这是最有可能是由于该组织的大小,类型,或固定和不提取过程。对血液/骨髓样本,如果有一个提取失败,它通常是由于样品被hemodilute( 即不具有足够数目的白细胞或肿瘤细胞在该拉伸的)或化学消融。
。NT">验证期间,进行DNA的质量和数量的可接受性截断应建立100的推荐输入 - 250纳克在测定通常使用;但是,如果DNA质量是好的,那么较低的输入量可以是成功的。此外,如果该DNA质量差( 即 ,扩增的DNA的量小于100 - 250毫微克)然后较高的输入量可以提高测序结果的质量(因为扩增的DNA的量会达到推荐的输入) 。指标DNA的质量和数量应推进DNA插入文库制备之前被应用到每个样本,这些样本在一个"灰色地带"( 见图2)应在实验室负责人或指定人员的自由裁量权运行。目前最好的办法预测如果测序过程中的DNA不会表现良好是执行基于定量PCR的测定法,允许输入DNA的定量和质量评估,这种方法解决了上述bioavailab在样本大小不同的片段,通过不同尺寸的片段( 如 100个基点,150基点,200基点和300基点)和比较收益率的放大ility。目前,文库制备涉及大量的手动步骤,其中在几个接合部之一的失误可导致库失败或以质量较差。微流体凝胶分析是唯一的QC步序之前检查库准备的问题。因此,有几个关键步骤,其中额外留心可以增加成功反应的概率。当务之急是保证正确的样品和寡核苷酸池用于每个样品。确保妥善记录每个样本包含96的一个独特的双索引的PCR引物对的组合,减少了样品混合起来的机会。此外,重要的是要保证过滤板(FPU)正确地排出;如果它不恰当漏这可能会导致EXTE图书馆准备nsion结扎一步次优执行,导致质量差的测序数据。库的QC后,重要的是,确保LNB1珠充分再悬浮并且LNB1 / LNA1溶液是作为该混合物的浓度使用,以确定文库的摩尔浓度将其添加到样品之前充分混合。最后,如果珠洗脱步骤导致库的次优量洗脱离珠粒会降低聚类密度,并可能导致库无法获得足够的平均覆盖率。相反地,过量图书馆,会导致质量较差的读取。因此,要在基于珠子的归一化步骤,以确保定序文库的最佳池和聚类一致是重要的。
除了文库制备,它是验证一个生物信息学管道,将产生从原始的,解复用FASTQ文件准确突变呼叫关键。选择一个因为有许多开源和市售的矫正器,变种呼叫者和NGS软件包,一个人必须要通过筛选定制的解决方案可能是费时。自定义算法将需要设计来提取基本性能统计数据,找出最逃避开源工具独特的经常性突变,并确定在每个位点的拷贝数状态。期间一个生物信息学流水线的验证过程中,重要的是要确定该达到或超过后质量过滤覆盖的两个最小深度( 例如 ,一个最小的250读取)和最小等位基因频率变体的报告的截止值( 例如 ,4个%)。因为这是一个复用基于扩增子的测定法,重要的是要确定最小平均覆盖深度( 例如 ,1000倍),该库需要达到能够得到最低执行扩增到最小深度的读出。此外,该测定的多路复用性质确实Ç澳洲英语脱靶效应和这些"神器"将需要被发现,并在发射前全面审核。所描述的测定法的另一个重要的限制是需要的样品以包含在以达到验证最小等位基因频率大于10%的肿瘤。
低频,1%,FLT3插入的检测是证据表明人工审核仍然在这个过程中所希望的。即使有5%的等位基因频率的截止,一些重要的突变可能错过因而手动审查将是至关重要的,以确定这些变体。对于FLT3-ITD中 ,对所有AML患者进行外显子14目视检查,以确保低级别或大的插入/重复不会被忽视。此外,HER2外显子20插入,其通常是旁边的引物序列,需要人工干预。尽管有强大的生物信息学管道,一些变种可以去忽略它是具有硬砍的只是性质关闭上述大部分的统计数据。将需要更好的生物信息,以帮助缓解这个问题,因为将更好地文库制备和/或测序的方法,因为它是更有利的是含有较少的文物和误报甚至更低截止拥有高质量的数据。
检测和等位基因频率的解释可能是困难的,由于在肿瘤百分比确定和基因组的一些区域的扩增偏差的难度。此外,超过50%的等位基因频率可以被检测,如在壳体2观察到这被解释为杂合事件的损失,无论是由于正常的等位基因的丧失,导致突变体的明显增加读取,一个突变等位基因( 例如 ,2突变体和一个正常复制)或其它机制的增益。这些机制可以通过利用阵列比较基因组杂交(aCGH 19)和/或一个SNP基因分型阵列阐明。20。
目前的目标富集方法依赖于任何低效杂交捕获或多重PCR技术的全日程序,导致需要对单个样品的测序更多的覆盖范围和更多的脱靶序列读取。预期在不久的将来对NGS分子肿瘤额外应用将包括更容易文库的制备方法,可以是完全自动化的,并且能够以非常低的量的DNA模板来处理样品( 即 ,小于1毫微克)以及样品高度降解脱氧核糖核酸。为了应对这些挑战,大多数方法想必会基于PCR的,无论是作为一个多PCR的方法,或大规模并行单一PCR方法。此外,个别的扩增子的分子条形码已经显示出显着降低背景测序噪声,并将使样品的测试与肿瘤细胞的比例较低,以实现较低的等位基因频率并朝向捕获circulat移动ING肿瘤细胞。
在癌组织疾病相关的基因突变的检测一直是护理标准几十年。从历史上看,基因经常一次测试顺序,一个基因/外显子,具有通向测试序列的端部的突变的鉴定。 NGS的出现已经允许偏差较小的方法来测序以并联许多癌症导致了与肿瘤相关的多个突变的标识相关联的多个基因。 NGS的用于癌症检测的体细胞突变的临床应用日益明显。事实上,肿瘤样本的基于NGS-分析代表了一种新的模式,挑战传统的,单一的基因检测,但其临床效用是很清楚的。今天临床实验室有令人兴奋的机会,以结婚认真方法验证和测试的解释与这个强大技术的应用。
披露声明
作者什么都没有透露。
致谢
作者要感谢丹尼尔野生的援助,用于读取生产的手稿和援助。
材料
| Name | Company | Catalog Number | Comments |
| Genomic DNA ScreenTape | Agilent Technology | 5067-5365 | |
| Genomic DNA Reagents | Agilent Technology | 5067-5366 | |
| High Sensitivity D1000 ScreenTape | Agilent Technology | 5067-5584 | |
| High Sensitivity D1000 Reagents | Agilent Technology | 5067-5585 | |
| TapeStation 2200 | Agilent Technology | G2965A | |
| TapeStation Analysis Software | Agilent Technology | A.01.04 or higher | |
| 96-well Tube Storage Racks | Any Vendor | ||
| 15/50 ml Tube Rack | Any Vendor | ||
| 96-well Plate Rack | Any Vendor | ||
| Pipette, single-channel, 0.5–2.5 μl | Any Vendor | ||
| Pipette, single-channel, 1–10 μl | Any Vendor | ||
| Pipette, single-channel, 2–20 μl | Any Vendor | ||
| Pipette, single-channel, 10–100 μl | Any Vendor | ||
| Pipette, single-channel, 20–200 μl | Any Vendor | ||
| Pipette, single-channel, 100–1,000 μl | Any Vendor | ||
| Serological Pipettor | Any Vendor | ||
| Vortexer | Any Vendor | ||
| Ice bucket | Any Vendor | ||
| Microcentrifuge (for tubes and strip tubes) | Any Vendor | ||
| Freezer, -20 °C | Any Vendor | ||
| 4 °C Refrigerator | Any Vendor | ||
| Water or Bead Bath | Any Vendor | ||
| Incubator (37 °C) | Any Vendor | ||
| Serological Pipettes, 1 ml | Any Vendor | ||
| Serological Pipettes, 5 ml | Any Vendor | ||
| Serological Pipettes, 10 ml | Any Vendor | ||
| Serological Pipettes, 25 ml | Any Vendor | ||
| Gloves | Any Vendor | ||
| Razor Blades/Scaples | Any Vendor | ||
| KimWipes | Any Vendor | ||
| 15 ml Conical Tube | Any Vendor | ||
| 50 ml Conical Tube | Any Vendor | ||
| Paper Towels | Any Vendor | ||
| 200 proof Ethanol | Any Vendor | Store in Flammable Cabinet | |
| 2-Propanol (Isopropanol) | Any Vendor | Store in Flammable Cabinet | |
| 25 ml Reservoirs | Any Vendor | ||
| 10 N NaOH | Any Vendor | ||
| Pipette, 8-channel, 1 – 10 μl | Any Vendor | ||
| Pipette, 8-channel, 10 – 100 μl | Any Vendor | ||
| Pipette, 8-channel, 20 – 300 μl | Any Vendor | ||
| Ice Bucket | Any Vendor | ||
| Water Squirt Bottle | Any Vendor | ||
| Alcohol Squirt Bottle | Any Vendor | ||
| Lens Cleaning Paper | Any Vendor | ||
| Plates, 96-well PCR, Semi-Skirted | Any Vendor | ||
| Tube strips, 8-well, 0.2 ml | Any Vendor | ||
| Agencourt AMPure XP Beads | Beckman Coulter | A63881 | |
| BioShake IQ or 3000-T elm | Bulldog Bio/Q.Instruments | 1808-0506/ 1808-0517 | |
| DropPlate96 S - LabChipDS | Caliper | 128876 | |
| DropPlate96 D - LabChipDS | Caliper | 132848 | |
| DropSense96 | Caliper (Trinean) | ||
| DropQuant Software | Caliper (Trinean) | ||
| Plate Sealing Film | Denville | B1212-5S | |
| Aluminum Seal Foil | Denville | B1212-6S | |
| Nuclease-Free, Pure Water System | EMD Millipore | ||
| 5424 centrifuge | Eppendorf | 22621408 | |
| 5804R centrifuge | Eppendorf | 22623508 | Both 15 ml tube and plate rotators, preferably a centrifuge that can go up to 2,500 x g. |
| Safe-Lock Tube 1.5 ml, Natural | Eppendorf | 22431021 | |
| 5 ml Tube, DNA LoBind Tube | Eppendorf | 30108310 | |
| 5430R Centrifuge | Eppendorf | 022620645 | Any plate rotator centrifuge will work |
| Hybex Microsample Incubator | Fisher Scientific | 1057-30-0 | |
| Hybex 0.2 ml Tube Block | Fisher Scientific | 1057-31-0 | |
| TruSeq Amplicon – Cancer Panel | Illumina | FC-130-1008 | 96 reactions |
| TruSeq Custom Amplicon | Illumina | PE-940-1011 | 96 reactions |
| TruSeq Custom Amplicon Index Kit | Illumina | FC-130-1003 | 96 Indices, 384 Samples |
| MiSeq Reagent Kit v3, 500 Cycles | Illumina | MS-102-3003 | |
| MiSeq Reagent Kit v2, 300 Cycles | Illumina | MS-102-2002 | |
| MiSeq Reagent Kit v2, 500 Cycles | Illumina | MS-102-2003 | |
| Experiment Manager | Illumina | 1.3 or higher | |
| MiSeq Reporter | Illumina | 2.0 or higher | |
| Sequencing Analysis Viewer | Illumina | 1.8 or higher | |
| TruSeq Index Plate Fixture and Collar Kit | Illumina | FC-130-1007 | |
| MiSeq v2 | Illumina | SY-410-1003 | |
| TruSeq Custom Amplicon Filter Plate | Illumina | FC-130-1006 | |
| Index Adapter Replacement Caps | Illumina | 11294657 | |
| Qubit 2.0 | Invitrogen | Q32866 | |
| Qubit 0.5 ml Tubes | Invitrogen | Q32856 | |
| Qubit dsDNA Broad Range Assay Kit | Invitrogen | Q32853 | |
| DynaMa6-96 Magnetic Stand, Side Skirted | Invitrogen | 120.27 | |
| GeneAmp PCR System 9700 (gold/silver block) | Life Technologies | N8050200 | |
| Gentra Puregene Blood Kit | Qiagen | 158489 | |
| Deparaffinization Solution (16 ml) | Qiagen | 19093 | |
| Buffer ATL (4 x 50ml) | Qiagen | 939011 | |
| Protein Precipitation Solution (50 ml) | Qiagen | 158910 | |
| DNA Hydration Solution (100 ml) | Qiagen | 158914 | |
| Glycogen Solution (500 μl) | Qiagen | 158930 | |
| Qiagen Proteinase K | Qiagen | 19133 | |
| Rnase (5 ml) | Qiagen | 158924 | |
| Nuclease-Free Water (10 x 50 ml) | Qiagen | 129114 | |
| Pestles | USA Scientific | 1415-5390 | |
| TipOne RPT 10 µl elongated filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips). | USA Scientific | 1180-3810 | |
| TipOne RPT 100 µl natural, beveled filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1840 | |
| TipOne RPT 200 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-8810 | |
| TipOne RPT 20 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1810 | |
| TipOne RPT 1,000 μl natural, graduated XL filter pipet tips in | USA Scientific | 1182-1830 |
参考文献
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med. 366 (10), 883-892 (2012).
- Campbell, P. J., et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature. 467 (7319), 1109-1113 (2010).
- Ding, L., et al. Clonal evolution in relapsed acute myeloid leukaemia revealed by whole-genome sequencing. Nature. 481 (7382), 506-509 (2012).
- Frampton, G. M., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nature Biotechnol. 31 (11), 1023-1031 (2013).
- Patel, J. P., et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 366 (12), 1079-1089 (2012).
- Forbes, S. A., et al. COSMIC (the Catalogue of Somatic Mutations in Cancer ): a resource to investigate acquired mutations in human cancer. Nucleic Acids Res. 38 (Database Issue), 652-657 (2010).
- Shih, A. H., Abdel-wahab, O., Patel, J. P., Levine, R. L. The role of mutations in epigenetic regulators in myeloid malignancies. Nat Rev Cancer. 12 (9), 599-612 (2012).
- Liersch, R., Müller-Tidow, C., Berdel, W. E., Krug, U. Prognostic factors for acute myeloid leukaemia in adults - biological significance and clinical use. Br J Haematol. 165 (1), 17-38 (2014).
- Bacher, U., Schnittger, S., Haferlach, T. Molecular genetics in acute myeloid leukemia. Curr Opin Oncol. 22 (6), 646-655 (2010).
- Subramanian, J., Govindan, R. Lung cancer in "Never-smokers": a unique entity. Oncology (Williston Park). 24 (1), 29-35 (2010).
- Sakashita, S., Sakashita, M., Tsao, M. S. Genes and pathology of non-small cell lung carcinoma. Semin Oncol. 41 (1), 28-39 (2014).
- Arcila, M. E., Chaft, J. E., Nafa, K. Prevalence clinicopathologic associations, and molecular spectrum of ERBB2 (HER2) tyrosine kinase mutations in lung adenocarcinomas. Clin Cancer Res. 18 (18), (2012).
- Gandhi, L., et al. Phase I study of neratinib in combination with temsirolimus in patients with human epidermal growth factor receptor 2-dependent and other solid tumors. J Clin Oncol. 32 (2), 68-75 (2014).
- Sheikhha, M. H., Awan, A., Tobal, K., Liu Yin, J. A. Prognostic significance of FLT3 ITD and D835 mutations in AML patients. Hematol J. 4 (1), 41-46 (2003).
- Mazières, J., et al. Lung cancer that harbors an HER2 mutation epidemiologic characteristics and therapeutic perspectives. J Clin Oncol. 31 (16), 1-8 (2014).
- Robinson, J. T., et al. Integrative Genomics Viewer. Nat Biotechnol. 29 (1), 495-500 (2011).
- Forbes, S. A., et al. COSMIC: exploring the world's knowledge of somatic mutations in human cancer. Nucleic Acids Res. 43 (Database issue), D805-D811 (2014).
- Daber, R., Sukhadia, S., Morrissette, J. J. Understanding the limitations of next generation sequencing informatics, an approach to clinical pipeline validation using artificial data sets. Cancer Genetics. 206 (12), 441-448 (2013).
- Haraksingh, R. R., et al. Genome-Wide Mapping of Copy Number Variation in Humans: Comparative Analysis of High Resolution Array Platforms. PLoS ONE. 6 (11), e27859(2011).
- de Leeuw, N., et al. SNP Array Analysis in Constitutional and Cancer Genome Diagnostics - Copy Number Variants, Genotyping and Quality Control. Cytogenet Genome Res. 135 (3-4), 212-221 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。