Method Article
固体と液体の腫瘍におけるアクショナブル変異の検出のための次世代シーケンシング
要約
This manuscript describes clinical protocols for two next-generation sequencing panels. One panel interrogates hematologic malignancies while the other panel targets genes commonly mutated in solid tumors. Molecular classification of driver mutations in human malignancies offers valuable prognostic and predictive information.
要約
As our understanding of the driver mutations necessary for initiation and progression of cancers improves, we gain critical information on how specific molecular profiles of a tumor may predict responsiveness to therapeutic agents or provide knowledge about prognosis. At our institution a tumor genotyping program was established as part of routine clinical care, screening both hematologic and solid tumors for a wide spectrum of mutations using two next-generation sequencing (NGS) panels: a custom, 33 gene hematological malignancies panel for use with peripheral blood and bone marrow, and a commercially produced solid tumor panel for use with formalin-fixed paraffin-embedded tissue that targets 47 genes commonly mutated in cancer. Our workflow includes a pathologist review of the biopsy to ensure there is adequate amount of tumor for the assay followed by customized DNA extraction is performed on the specimen. Quality control of the specimen includes steps for quantity, quality and integrity and only after the extracted DNA passes these metrics an amplicon library is generated and sequenced. The resulting data is analyzed through an in-house bioinformatics pipeline and the variants are reviewed and interpreted for pathogenicity. Here we provide a snapshot of the utility of each panel using two clinical cases to provide insight into how a well-designed NGS workflow can contribute to optimizing clinical outcomes.
概要
臨床腫瘍学の標本の次世代シーケンシング(NGS)は、ターゲッティング遺伝的変化および予測/予後分子マーカーを同定することの重要性に科学文献点を成長させるように、過去数年間でより広く利用可能になりました。マルチ遺伝子パネルは、分析し、病気が進行し、再発の両方の上皮1,2および血液3悪性腫瘍における全体exomeシーケンシング研究では、腫瘍の不均一性およびクローン進化の概念を固めてきました。さらに、そのようなポリメラーゼ連鎖反応(PCR)またはサンガー配列決定のような競合する技術とは異なり、NGSは、単一のアッセイ4内のすべての臨床的に関連する癌遺伝子における最もゲノム変化を検出することができます。
当初は2臨床NGSパネル、カスタム血液学パネル(ヘム-NGSパネル)および既製FFPE標本のためのがんパネル(ソリッドNGSパネル)で起動パーソナライズ診断センター(参照図1)。これらのパネルは、選択された遺伝子の臨床的に関連または高い関心領域をカバーします。すべての遺伝子またはエキソンが完全に覆われていません。アンプリコンを延長し、ライゲーションに続いてプローブハイブリダイゼーションによって生成されます。対象地域はさらに、配列決定のためにプールされる96サンプルまで可能、ユニバーサルデュアルインデックスプライマーを用いてPCRを用いて増幅しています。
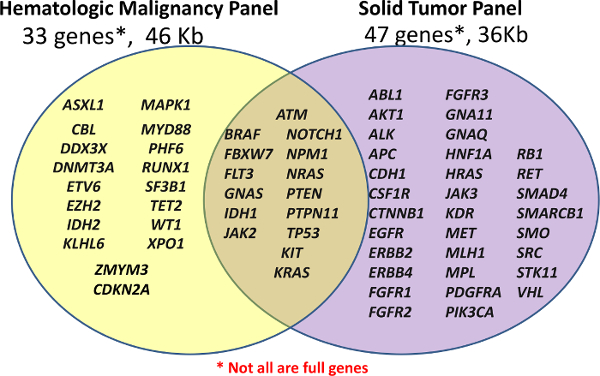
図1:パネルで覆われた遺伝子のリストライブラリ調製は33の遺伝子または既製のアンプリコンがんパネル(ソリッド-NGS)47遺伝子ののカスタム血液学パネル(ヘム-NGSパネル)のいずれかを使用して行われます。いくつかのアンプリコンは唯一の特定のホットスポットをカバーすることができるようにすべてではない遺伝子またはエキソンのは、完全に覆われている。 この図の拡大版をご覧になるにはこちらをクリックしてください。</ A>
ヘム-NGSパネルのコンテンツは、複数のソースから派生しますが、以前の臨床的有用性5の高さを実証するものとして説明急性骨髄性白血病(AML)に変異した16の遺伝子を中心としました。ソリッドNGSパネルは、商業的に(COSMIC)データベース6癌における体細胞突然変異のカタログで報告されているように癌で一般的に変異した遺伝子に基づいて対象地域で生産されています。
いくつかの重要なステップは、臨床NGSのためのワークフロー全体を特徴づけます。臨床医が検査を注文した後、病理医は腫瘍の割合とサンプルボリュームの分析を以下の試料の妥当性を判断します。我々の施設では、技術の背景配列決定エラー率(「騒音」)と標的アプローチの効率のために、少なくとも10%の腫瘍を必要とします。組織検査のために十分である場合には、ゲノムDNAを抽出します。このDNAは、次いで、(複数の品質管理にかけられますQC)の手順。 DNAは、QCに合格した場合、アンプリコンライブラリーが生成され、配列決定されます。得られたデータを、社内のバイオインフォマティクスパイプラインを介して分析されます。バイオインフォマティクス解析に続いて、変異体は、手動で見直され、臨床報告に組み込む前に、病原性のために解釈しました。下に私たちは、この厳格なワークフローを経て、最終的には臨床管理の変化につながった2例を説明します。
ケース1 -急性骨髄性白血病
患者Aからの骨髄生検は成熟せず、AMLのための診断でした。細胞遺伝学的研究は、骨髄標本に送信され、正常な女性核型を示しました。 95%の循環芽細胞は、そのように、末梢血試料はヘム-NGSパネルのパーソナライズされた診断テストのために送られた、存在がありました。
急性骨髄性白血病(AML)は、白血球の骨髄系統の血液学的な悪性腫瘍です。検出AMLにおける遺伝子変異の病因と予後7に重要と認識再発性遺伝子の変異と、予後および治療 のためにますます重要になってきています。 FLT3内部タンデム重複(ITDS)が少なく良好な治療成績8に関連付けられてきたがNPM1とCEBPAの変異は、良好な予後のリスクと関連しています。証拠の成長体は、AML 9におけるこれらおよび他の変異のための病原性の役割をサポートしています。
ケース2 -肺腺癌
患者Bから左鎖骨上の質量の生検は、肺腺癌を実証しました。 50%を超える腫瘍を有するロール/カールは、変異が標的治療的介入のために存在していたかどうかを識別するためにとして、ホルマリン固定パラフィン包埋(FFPE)リンパ節塊から生検材料は、ゲノムテスト(ソリッドNGSパネル)のために送られました。
肺CANCERは、米国における癌関連死亡の主要な原因であり、2つの主要なタイプの非小細胞肺癌(NSCLC)および小細胞肺癌(SCLC)に分割されています。 NSCLCはさらに、病変の組織学に基づいて、腺癌または扁平上皮癌のいずれかとして定義することができます。肺腺癌は喫煙者と非喫煙者の両方で見られる肺癌の最も一般的なサブタイプであり、かつ非喫煙者10のための肺癌の最も一般的な形式です。肺腺癌の分子の研究では、複数の癌遺伝子11の変異を同定しました。喫煙者で同定された最も一般的なドライバの変異は、KRASおよびBRAFにおける突然変異です。非喫煙者の中で最も一般的な変異は、EGFRにおける変異、および遺伝子ALK、RETとROS1を伴う再編成されています。肺腫瘍は、遺伝子ERBB2(HER2 / neuの )におけるインフレームエクソン20挿入に記載されています。 HEで最も一般的な異常R2 / neuが標的治療は、(:HER2 / neuのに対するヒト化モノクローナル抗体トラスツズマブ)使用可能な乳癌におけるこの遺伝子座の増幅です。 2で観察されたHER2 / neuのエクソン 20挿入-肺の4%が12(それぞれ、ネラチニブとテムシロリムス)13 HER2 / neuおよびmTOR阻害剤との併用療法に部分的な応答を示しているadenocarcimomas。
プロトコル
このプロトコルは、それぞれ、固体および液体腫瘍のゲノムプロファイリングのための2つの検証実験室で開発された試験の主要な工程を含みます。実験室で実施したテストは、1988年の臨床検査改善修正法(CLIA)の要件に従って行われます。
末梢血や骨髄から1. DNA抽出
- 表1に基づいて取るために血や骨髄どの程度を決定します。
| サンプル/ WBC | 血液1mlのように処理する量 |
| 骨髄 | 250μlの |
| 血液WBC 12,000 - 50,000 | 1ミリリットル |
| 血液WBC 50,000 - 10万 | 500μlの |
| 血液WBC10万 - 20万 | 200μlの |
| 血液WBC>20万 | 100μlの |
| *ブラッドWBC <12,000のために、血液の2ミリリットルを取ります | |
表1:表を使用する血液/骨髄ボリューム白血球数は、サンプルからサ ンプルへ変化するので、使用する血液の特定のボリュームを指定することは困難です。したがって、アッセイに使用する血液の量は、アッセイの前に開始する白血球数(WBC)を見ることによって決定されなければなりません。より少ない血液が利用されているが、依然として存在する細胞の数が通常よりも大きいので、使用される血液の量以来1mlを減少させるかのように扱われるべきです。
- ゲノムDNAを単離するための市販のキットのプロトコールに従ってください。
ホルマリン固定パラフィン包埋(FFPE)組織から2. DNA抽出
- に基づく病理学者は、H&Eスライド上に丸で囲んだ腫瘍領域は、ガイドH&Eスライドで未染色スライドをラインアップし、抽出のための類似の領域の輪郭を描きます。マクロ解剖のために、プロセスだけ1検体/時のスライドの患者のセット。
- 少しパラフィンを溶融するために45℃のヒートブロック上でスライドを加熱します。慎重に各試料を抽出するための新しいメスを用いて、スライド上にマークされているライン内の組織をこすり。適切に標識された1.5mlチューブにワックス擦過を置きます。掻き取ったワックスは非常に静電気で、チューブから飛び出す可能性があるので注意してください。
- ( - 30μmの合計25)ごとに5μmの5 6へのセクションの脱パラフィンソリューションの320μLを加えます。例えば、10μmのロール/カールの3つのセクションを含むチューブが処理されようとしている場合は、320μLを使用していますが、同じ厚さで5つのセクションが得られたならば、640μLを使用します。
- 少なくとも10秒間激しくボルテックスし、水溶液を行います組織/側面からワックスやキャップを除去し、溶液中にするために微量にスピンuick。 3分間56℃でインキュベートし、次いで5 RTでインキュベート - 10分。
- RTインキュベーション後、追加された脱パラフィンソリューションのすべての320μlのためのATLバッファー180μlを添加します。各試料のための新しい乳棒を用いて無菌ミニ乳棒を用いて組織10回ミンチ。それは非常に粘着することができますように、杵に付着した全く組織が存在しないことを確認してください。渦懸濁液を激しく3秒間、その後1分間最高速度で遠心します。
- 下の明確な相にプロテイナーゼKの10μLを加えます。組織が再懸濁されていることを確認するために上下にピペッティングにより穏やかに混合。ボルテックスしないでください。 500 rpmの - 400で振盪しながら一晩56℃でインキュベートします。
- 組織が完全に溶解されている場合は、次の朝は、(下の溶液が透明である場合、このエラーが発生している)を確認します。下の解決策は、foの最大速度で3秒間遠心激しくボルテックス、明確ではない場合R 1分。プロテイナーゼKを10μl、さらに30のために56℃でインキュベート - - 余分5を追加し60分。
- ホルムアルデヒド架橋を反転を助けるために1時間90℃でインキュベートします。 10分、その後、簡単に液体を統合する各チューブを遠心分離 - サンプルは5のために室温まで冷却します。
- ラベルされた1.5mlチューブに低い明確な相を転送します。 (例えば、複数のロールが使用される場合、場合など)は、同じ患者の検体からの複数のチューブが存在する場合、この時点では一本のチューブに下相を再結合します。注:精製操作を妨害してはならない脱パラフィン液の少量を転送するが、大量に転写される場合、危険性があります。
- RNaseを2μlの溶液を加えます。穏やかに攪拌または微量で25回とクイックスピンを反転。室温で5分間インキュベートします。
- Protein Precipitation Solutionを200μlのを追加します。一つまたは二つのロールをやっている場合は、200μLを使用しています。 3ロールをやっている場合一度だし、400μLを使用しています。均一に溶解緩衝液を混合する30秒間高速で激しくボルテックス。 5分間氷上でインキュベートまたはサンプルは時間まで氷上に滞在することができます。
- 5分間、5000×gで遠心分離します。沈殿したタンパク質は、タイト、白ペレットを形成すべきです。ラベルされた1.5mlチューブに上清を注ぎ、その後、少なくとも3分間、氷上でサンプルをインキュベートします。 3分間5000×gで遠心分離します。
- Buffer ATLのすべての180μlのために2-プロパノール(イソプロパノール)の200μLを加える(2 mlチューブを使用する必要があるかもしれない)ラベルされた1.5ミリリットルチューブに前に追加しました。例えば、3本ロールをやっている場合は、イソプロパノール600μlを添加します。以前のイソプロパノールに追加されたのBuffer ATLのすべての180μlのためのグリコーゲンの1μlを添加して、混合するためにチューブを数回転倒。
- 慎重イソプロパノール混合物中にタンパク質沈殿ステップからの上清を追加します。静かに少なくとも50回反転させてチューブを混ぜます。
- 最大SPでの遠心分離3分間EED。 DNAは、チューブの底に小さな白いペレットとして表示されます。
- 適切な廃棄物チューブに上清を注ぐまたは吸引します。それが失われたり、他の検体の廃棄物と混合されることはありませんので、ペレットは外れています場合には検体ごと別々1.5ミリリットル廃液チューブを保管してください。ペーパータオル上にチューブを逆さにし、イソプロパノールの大部分が除去されることを確認します。
- 新たに作製した70%エタノールを300μlを追加します。ペレットを洗浄するために軽く数回チューブを反転。より徹底した清掃を確実にするために追い出されてくるペレットを確保するようにしてください。
- 5分間、最大速度で遠心します。そしてその後、エタノールを注意深く取り除きます。ペレットが緩んでいるので、ゆっくりと注ぐまたは吸引し、ペレットを見ることができます。ペレットに触れることなく、チューブの内側から過剰のエタノールを除去します。以上のサンプルを乾燥させないように注意しながら、15分 - 5空気乾燥にサンプルを許可します。
- 電子へのDNA Hydration Solution100μlの - 25との間に追加ACHサンプルDNAペレットの大きさと組織の開始量に基づきます。ボルテックスチューブを激しくかつ簡単に微量でスピン。完全にDNAを再水和するために65℃で1時間インキュベートします。
3.ゲノムDNAの品質管理
注:DNAの品質管理(QC)のための3つの独立したステップがあります。各QC工程が行われている理由のさらなる説明については、 表2を参照してください。
| 楽器 | 結果 | 表示 | 理想的な範囲 |
| DropSense96 | A260 / A230 | 化学汚染物質の識別( 例えば、エタノール) | 1.50から2.2 |
| DropSense96 | A260 / A280 | タンパク質混入物の同定 | 1.60から2.2 |
| DropSense96 | 濃度 | DNA定量化 | > 1 ngの/μlの |
| TapeStation | DNAスミア | DNAの完全性の決意( 例えば 、分解/抽出したDNAの断片化) | >千塩基対50% |
| 量子ビット2.0 | 濃度 | より正確なDNA定量 | > 1 ngの/μlの |
表2:DNA QC予想される結果は、これらの値はすべて、ライブラリの準備段階に進むために、サンプルを許可する実行する前に考慮されます。
- 製造業者のプロトコルに従って、作業濃度サンプルの濃度(ng /μl)を得るための蛍光光度計に抽出したDNAの2μLを実行します。
- サンプルの品質(A260 / A230およびA260 / A280ラットをチェックするために、UV / VIS分光光度計で各2μlのサンプル - 1を実行します。IOS)製造業者の指示に従って。
- FFPEサンプルの場合:メーカーの指示に続いて、DNAの分解/断片化を評価するために、マイクロ流体ゲル電気泳動システム上で各試料の1μLを実行します。例については、 図2を参照してください。
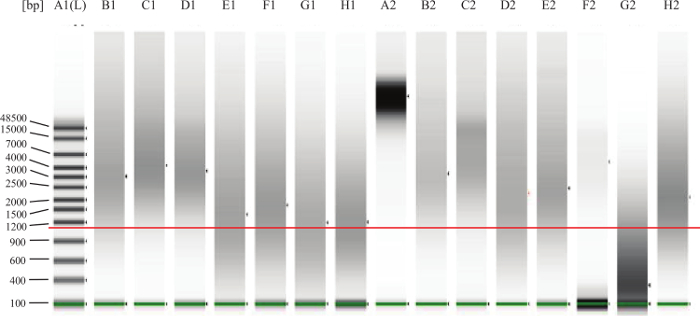
図2:ゲノムDNA QCゲルの例は、より低い帯域に渡る緑の線が低いマーカーを示すことです。追加-に赤線が約1,000塩基対を示すことです。 1新鮮なTISのスー ( 例えば 、末梢血または骨髄)から期待通りレーンA2は、完全に無傷のDNAを表します。レーンのB1、C1、D1、B2、C2、E2は良い、無傷のFFPE DNAの例です。レーンF2中のDNAはそのまま、あまりにも低濃度であるように思われます。レーンG2のDNAが分解または断片化され、アッセイでは動作しません。レーンE1、F1、G1、H1、D2、H2は、アッセイがうまく働くかもしれないことを意味する「グレーゾーン」に入るDNAを表しますが、DNAのいくつかは、あまりにも損傷または架橋されたので、それがアッセイでは実行されません可能性があります。 大きいを表示するには、こちらをクリックしてください。この図のバージョン。
4.アンプリコンライブラリの準備
- オリゴプールと結合したオリゴの拡張-ライゲーションのハイブリダイゼーション
- にも対応する各ゲノムDNAの250 ngの-プレPCRの部屋では、必要な低EDTA TEのボリューム、パネルのオリゴチューブ( 例えば 、ソリッドNGSパネルまたはヘム-NGSパネル)を5μl、および100を追加ハイブリダイゼーション(HYB)板としてラベルされた半スカート96ウェルプレート。
- HYBプレート内の各サンプルにシーケンシング試薬1用のオリゴハイブリダイゼーション(OHS1)の40μLを加えます。混合するために6回 - そっと少なくとも5をピペットと。回避するために、各列の後に変更のヒント交差汚染。
- 30秒1000×gで接着アルミホイルや遠心分離機でHYBプレートをシール。
- 1分間95℃で予備加熱したハイブリダイゼーションインキュベーターでHYBプレートをインキュベートします。 40°Cにハイブリダイゼーションインキュベーターの温度を設定します。限り、それは95°Cから40°C(〜90分)に減少するインキュベーターを取るようインキュベートし続けます。注:この段階的な冷却が適切なハイブリダイゼーションのために重要です。
- ハイブリダイゼーションのインキュベーションの20分、プレウォッシュフィルタープレートユニット(FPU) - 最後の15の間。現在のアッセイで使用する唯一の井戸を準備し、 すなわち 、唯一の前に開かれたフィルタープレートの新鮮な/未使用井戸を使用していますが、使用されている決して再利用ウェル。注:これは、フィルタープレート上のキット番号、フィルタープレート上のマーキング、およびプレートにまたがって使用シーラントに基づいて明確にする必要があります。
- マルチチャンネルピペットを用いて、各ウェルにストリンジェントな洗浄1(SW1)の45μlを添加します。
注意:ホルムアミドが含まれています。 20℃で3分間、2250×gでFPUをカバーし、遠心分離機。残留液ごとに単一のウェルを確認してください(> 15μL/ウェル)。 - 残留液体が存在する場合は、FPU 180°回転し、さらに3分間、再び遠心分離ステップを繰り返します。残液が二度目を通してスピンした場合、そこにフィルタープレートの欠陥であってもよく、整流板を交換する必要がありますされていない場合、その後、次のステップに進みます。
- マルチチャンネルピペットを用いて、各ウェルにストリンジェントな洗浄1(SW1)の45μlを添加します。
- ハイブリダイゼーションインキュベーターは40℃に冷却した後、凝縮を収集するために20℃で少なくとも30秒間、1000×gでプレートを遠心します。 FPUの対応する予め洗浄したウェルの中心にHYBプレートから各サンプルのボリューム全体を転送します。交差汚染を避けるために、各列の後にヒントを変更します。 20℃で3分間、2250×gでFPUと遠心分離機をカバーしています。
- 20℃で3分間、2250×gで45 SW1μlの遠心分離機を追加。 2回の洗浄の合計のために繰り返します。完全にすべてのSW1を除去するために、3分間2250×gで再びFPU 180°、遠心分離機を回転させます。
- FPUを隠します。適切な廃棄容器に(ホルムアミドを含む)すべてのフロースルーを捨てます。異なるMIDI廃棄物収集プレートを使用してFPUを再度組み立てます。 20℃で3分間、2250×gで各試料ウェルと遠心分離機にユニバーサルバッファ1(UB1)の45μLを加えます。注意:ホルムアミドが含まれています。
- FPUプレートおよびピペットアップと混合するダウン3回に各サンプルウェルにエクステンションライゲーションミックス3(ELM3)の45μLを加えます。注:拡張-ライゲーション反応は、フィルタープレートの膜上で行われます。
- 接着アルミ箔でFPUプレートを密封し、45分間予熱した37℃のインキュベーター中で全体FPUアセンブリをインキュベートします。
- インデックス作成およびPCR増幅
- インデックスは、インデックス付き増幅PLに対応するウェルに使用されている分量i5のプライマーチューブ(白キャップ、透明な溶液)垂直方向に、Hを介して、行Aと整列し、i7のプライマーチューブ(オレンジキャップ、黄色の溶液)水平方向を次のように配置された指標板の固定具にプライマーを、配置することにより(IAP)を食べました、IAPの各行にi7のプライマー(黄色溶液)の4μlを添加し、IAPの各列にi5のプライマー(透明な溶液)の4μlを添加、P10マルチチャンネルピペットを用いて12を介して列1に整列されます。
- 氷や冷却ブロックでは、サンプルあたりのPCRマスターミックス2(PMM2)の25μlにDNAポリメラーゼ1(TDP1)の0.5μLを添加することにより、PCRマスターミックスを準備します。簡単に反転、素早くボルテックスし、混合するためにPCRマスターミックスを遠心します。
- 混合するために、各IAPのウェルとピペットアップにPCRマスターミックスの22μlを添加して、ダウン3回。ウェル間のヒントを変更します。 4℃でIAPを保管してください。
- 45分間の伸長、ライゲーション反応(ステップ4.1.10)の後、インキュベーターからFPUを削除して、慎重にアルを削除uminumホイルシール。 20℃で3分間、2250×gで蓋と遠心機でカバー。
- FPU上の各サンプルウェルに50mMのNaOHを25μlを添加します。アップピペット上下に少なくとも6回。ピペット先端が膜に接触することを確認します。各列の後にヒントを変更します。 5分間、室温でインキュベートします。
- 次のようにIAPにFPUから溶出転送サンプル。
- 20μlに設定P100マルチチャンネルピペットを用いて、上下FPUプレート上のピペットのNaOHに少なくとも6回。わずかプレートから完全に吸引を確実にするためにFPUプレートを傾けます。
- IAPの対応する列への転送FPUから20μLを。静かにアップピペット上下に少なくとも6回は徹底的にPCRマスターミックスとDNAを結合します。 20℃で1分間の千×gで接着フィルム及び遠心分離機でIAPを封印。
- PCR後のルームにPCRプレートを持参し、サーマルサイクラー上でプレートをロードします。 PCR pを実行します。95℃で3分間の工程を熱変性からなるrogram。 30秒、30秒、62℃、60秒間72℃、95℃の25サイクルが続きます。 72℃で5分間の最終伸長が続きます。 10℃で保持して仕上げ。 PCRの完了後に次の段階に進んでいない場合は、プレートを一晩、サーマルサイクラー上に残ることができ、またはそれは二日まで2〜8℃で保存することができます。
- PCR精製およびビーズベースの正規化
- 次の段階の前に少なくとも20分間RTで4℃の冷蔵庫や場所から磁気精製ビーズ、溶出バッファー(EBT)、およびゲル電気泳動試薬を削除します。
- PCRが完了した後、20℃で1分間1,000×gで遠心分離は、凝縮を収集します。各PCR反応の転送1μlのサンプル1/5を希釈する水の4μLを含むチューブ/プレートウェルを除去します。アップピペットとミックスダウンします。
- 2μlのを追加PCRedサンプルは、マイクロ流体 - ゲル緩衝液の2μlに希釈しました。ストリップ/プレートをシール。 30秒1,000×gで、少なくとも30秒間、遠心分離のために1800 rpmで振ります。製造元のプロトコルに続いて、ライブラリの準備が許容ライブラリーが得られた場合( 図3参照 ) を評価するために、マイクロ流体ゲル上で混合物を実行します。
- 彼らはよく懸濁しており、色が均一に表示されるまで、磁気精製ビーズをVORTEX。各サンプルにビーズの45μlを添加します。
- 透明な接着剤フィルムでプレートをシールし、2分間1800 rpmでプレートを振ります。 10分間振盪せずに室温でインキュベートします。
- 磁気スタンドにプレートを置きます。上清をクリアした後、慎重に取り外し、上清を捨てます。任意のビーズが不注意先端に吸引されている場合は、バックプレートにビーズを分配し、2分間磁石上プレート休みをさせ、上澄みがクリアされたことを確認します。
- トン上のプレートと彼磁気スタンドは、各サンプルウェルに、新たに調製した80%エタノールを200μlを追加します。前後に数回プレートを移動します。 30秒間の磁気スタンドにプレートをインキュベートします。慎重に除去し、上清を捨てます。 2回の洗浄の合計のために繰り返します。
- 簡単に、チューブ側のいずれかのエタノールを引き下げるために千×gでプレートを遠心分離する磁気スタンド上にバックプレートを配置し、エタノールを除去するために、10μlに設定P10のマルチチャンネルピペットを用いて、過剰のエタノールを除去します。 8分 - 5のために空気乾燥にビーズを許可します。
- P100マルチチャンネルピペットを用いて、各ウェルにEBTの30μlを添加します。ビーズをチューブの側面をオフに来て確保するようにピペットで数回ダウン。透明な接着剤フィルムでプレートをシールし、2分間1800 rpmでプレートを振ります。
- 3分間振とうせずに室温でインキュベートします。ビーズを完全に再懸濁されていないサンプルがある場合は、緩やかにビーズを再懸濁するために上下にピペット。
- 磁気スタンドにプレートを置きます。 P100マルチチャンネルピペットを用いて、全く新しいプレートに20μlの上清を転送するには、ライブラリの正規化プレート(LNP)と呼ばれます。別のプレートに、個々のシーケンシングライブラリの残り〜10μLを転写残クリーンアップ図書館プレート(RCLP)と呼ばれます。必要であれば、それは、第二の配列決定の実行のための予備として使用することができるように、最終的なライブラリの準備と一緒に、このプレートを保管してください。次のステージに移行しない場合は、LNPとRCLPは-15〜-25℃で保存することができます。
- 激しくボルテックスし、図書館正規化ビーズ1(LNB1)を再懸濁します。完全にチューブの底にLNB1ビーズペレットを再懸濁することが重要です。サンプルあたりライブラリ正規化添加剤1の44μlの(LNA1)とLNB1の8μLを混合することにより、正規化ミックスを準備します。 20秒 - 勢いよく10のための正規化ミックスをボルテックス。
注意:LNA1は、ホルムアミドが含まれています。 - 断続的な反転AでND正規ミックスのボルテックス、LNPの各サンプルに45μlを添加します。透明な接着剤フィルムでプレートをシールし、30分間1,800 rpmでプレートを振ります。この30分間のインキュベーションは、ライブラリの表現とクラスタ密度に影響を与える可能性が大きいか小さいよりも30分のインキュベーションとして適切なライブラリの正規化のために重要です。
- 30分間のインキュベーションの間に、試薬カートリッジを解凍し、Hybをバッファ(HT1)によって配列決定のための試薬を準備する[注意:どちらも、ホルムアミドを含めます]。また、後工程のための氷を取得し、1.5ミリリットルの遠心分離管に適したヒートブロックを96℃に設定されていることを確認。
- 30分混合工程が完了すると、磁気スタンドにLNPを置きます。上清をクリアした後、慎重に取り外し、適切な廃棄容器に上清を廃棄し、マルチチャンネルピペットを使用しています。
- 次のようにライブラリの正規ウォッシュ1(LNW1)でビーズを磁気スタンドからLNPを取り外し、洗浄:
- 45を追加します。各サンプルウェルにLNW1μlの。
注意:ホルムアミドが含まれています。透明な接着剤フィルムでプレートをシールし、5分間1,800 rpmでプレートを振ります。 2回の洗浄の合計のために繰り返します。第二の洗浄後にすべてのLNW1を削除することを確認します。
- 45を追加します。各サンプルウェルにLNW1μlの。
- 磁気スタンドからLNPを削除し、マルチチャンネルピペットを使用して、サンプルを溶出させるために各ウェルに0.1NのNaOH(旧週未満)の30μlを添加します。透明な接着剤フィルムでプレートをシールし、5分間1,800 rpmでプレートを振ります。
- 5分間の溶出中、保管プレート(SGP)という名前の新しいプレートに使用されるように各ウェルにライブラリの正規化ストレージバッファ1(LNS1)の30μlを添加します。
- 磁気スタンドにLNPを置きます。上清をクリアしたら、SGPにLNS1に30μlの溶出を転送します。交差汚染を避けるために、サンプル間のヒントを変更します。
- 少なくとも30秒間千×gで接着フィルム及び遠心分離機でプレートをシール。
- 5を追加します。1;各サンプルのリットルは、標識したプールされたアンプリコンライブラリ(PAL)を1.5 mlチューブに配列決定されます。混ぜると簡単に微量にスピンダウンするPALをVORTEX。
- HT1の596μlの - 590 PAL10μlの - 使用されているものをシークエンシング化学(V2またはV3)に応じて、4を追加します。一般的に、V3化学のためHT1の592μlにV2化学とPALの8.5μlのためのHT1の595μlにPALの5.8μlを添加します。希薄化後アンプリコンライブラリ(DAL)チューブとしてこのチューブにラベルを付けます。
- DALをボルテックスし、短時間微量でスピンダウン。 2分間96℃でDALをインキュベートします。 DALチューブを3回反転し、配列決定のためのシーケンサを準備している間、少なくとも5分間氷上にDALを置きます。 5分後、DALをロードする準備ができました。
- SGPで仕上げた場合、接着剤アルミ箔フィルムでプレートをシールし、日付とプレートのIDとラベルを付けます。 -15 -25℃で密封しSGPとPALを保管してください。

図3:ライブラリ準備QCジェル例が低い帯域に渡る緑の線が下マーカーおよび上部バンドの上に紫色のラインを示すことで、より高いマーカーを示すことです。すべてがレーンH1、A2、B2、C2、E2、およびG2のためによく働きました。ライブラリの準備はレーンD2、F2、およびH2のために、最適に動作しませんでしたが、結果はまだ彼らはちょうど十分なカバレッジを持っていない可能性があり得ます。 A3の場合は、ライブラリの準備はほとんど働いていた可能性が最も高い、このDNAサンプルをアッセイに十分ではありませんでした。アリコートをよくPCRedから直接取得されるので、下のマーカー上記の低いバンドは、未使用のプライマーです。 NTCサンプルのみ未使用のプライマーのバンド、と他には何を持っている必要があります。 この図の拡大版をご覧になるにはこちらをクリックしてください。
5.シーケンシング
- 正しいSampleSheet.csvは、実行のために作られていることを確認します。例えば補足図1を参照してください。
- すすぎと乾燥フローセルを解凍試薬カートリッジにDALの600μlを添加します。
- 画面の指示に従うことにより、配列決定のためのシーケンサを準備します。
6.データ解析
- バイオインフォマティクスパイプラインを実行します。突然変異、挿入、欠失および増幅18を識別するために、社内、カスタム設計されたバイオインフォマティクスパイプラインを利用しています。
- パイプラインが完了した後、パイプライン処理のQCのいずれかの重大なエラー/警告助剤として、エラー/警告のログファイルを確認してください。
- 配列を決定し、ライブラリを確実にするために、実行統計( 表3)を分析経過したラボでは、QCメトリック( 図4)を決定しました。手動ゲノムデータビューワ( 例えば 、統合ゲノミクスViには.bamファイルを表示して、各バリアントを見直します水差し16(IGV))。
注:品質のフィルタリング後の検証アレル周波数範囲内とカバレッジの最小深上記のみの変異体は、(ヒトゲノムバリエーション協会の(HGVS)命名法を使用して)報告されています。おそらく良性、および良性、未知の重要性の病原性、おそらく疾患関連、バリアント(VUS):最終報告のために、各エクソンの変異体はに分類しました。 5%の対立遺伝子頻度の報告基準上記の全ての変異体は、それらとみなさ良性変種と同義の変化を除いて、報告されました。
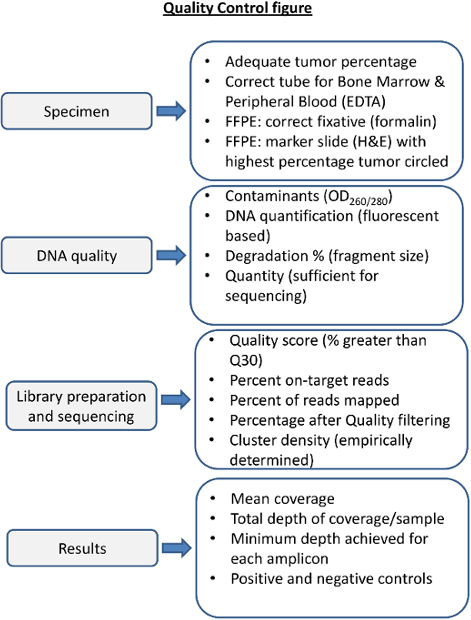
NGSための品質管理手順を図4概要プロセスの各ステップの品質管理は、前後配列決定メトリックが考慮されるような結果が得られるシーケンシングを確保する必要があります。適切な試料の処理は、高品質のDNAのために不可欠です。血と不適切な固定剤での骨髄は低品質のDNAを得ることができます。固形腫瘍標本の不適切な固定は、DNA(B5で例えば 、固定)を低下させることができます。 DNAの品質は分光光度手段によりタンパク質やRNA汚染について評価し、かつ正確にDNAの量および完全性について評価すべきです。シークエンシングのメトリックは、経験的にシーケンシング実験室で決定され、各配列決定反応、すべての検体について追跡する必要があります。各検体のための配列決定の結果を報告する前には、カバレッジ、深さ、陽性および陰性対照の適切なパフォーマンスのために評価されるべきである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
ケース1 -ヘム-NGSパネル
白血病末梢血から抽出したDNAは、ヘムNGSパネルのための十分な質と量(176 NG /μl)をありました。カバレッジの全体の平均深さは(最小値を超える1,000倍のカバレッジの深さを意味する)4,933xました。追加の実行統計が表3である。250×カバレッジ以下の8つの領域のうち、3は( すなわち 、プライマー配列が正しくにより配列決定エラーに除去されなかった)によるプライマーの不適切なトリミングにあったが、1は、アッセイの既知のアーティファクトでしたそして他の4なし報告義務のバリアントと異なる遺伝子のエクソンの部分領域でした。私たちの臨床プロトコルのみ、少なくとも250の読み取りによってカバー報告バリアントが含まれていますが、少なくとも100の読み取りを持つすべてのデータは、レビューのためにデータベースにインポートされます。
データ処理FROMバイオインフォマティクスパイプラインは3つの報告、疾患関連変異を検出しました。 FLT3におけるミスセンス変異、IDH2におけるミスセンス変異、およびNPM1でフレームシフト突然変異。彼らの対立遺伝子頻度とエクソン変異体は、表4に記載されている。FLT3における共通の変異は、自動的に私たちのパイプラインによって呼び出され、エクソン14のエクソン14目視検査の目視検査を必要とされていないFLT3 -internal縦列重複(ITD)でありますFLT3の提出検体内に挿入または重複を示しませんでした。 FLT3 I836delは1%の対立遺伝子頻度にあった、それは5%の検証最小対立遺伝子頻度を下回ったため、最終報告書には含まれていませんでした。この変異はFLT3の D835Yの変更と同じDNA分子上に存在しない( すなわち 、同じアンプリコン領域で観察されたが、ない「シス」シーケンシングのいずれかが読み込み中に)、それが唯一の.bam Fi接続の手動で確認することによって観察されましたレp.D835Yの変化を検証するとき。 2 FLT3変異の低い対立遺伝子頻度は、これらの変異は異質および/ またはクローン進化を表すことが示唆しています。しかし、違いは、アンプリコンまたは一塩基多型(SNP)の近く又はこの対立遺伝子の増幅に影響を与えプライマー配列と重複するためのアッセイの性能に起因する可能性があります。
ヘム-NGSのFLT3、IDH2、およびNPM1におけるAML同定された変異を持つケース1のためのパネルの結果、FLT3におけるAML。突然変異で3一般的に変異した遺伝子は、AML(COSMICデータベース17)の成人患者の〜25%で観察されたとされているか、されていますチロシンキナーゼドメインの内部直列重複(ITD)またはミスセンス変異。 FLT3-ITDSは、より一般的な変異であり、標準的な化学療法に反応不良に関連付けられている一方、FLT3キナーゼ dの予後的意義omain点突然変異は、このAML患者に見られるように、予後14に不明瞭な影響を有しています。イソクエン酸脱水素酵素2(NADP +)、ミトコンドリア(IDH2)は、一般に 、AMLにおいて変異されたエピジェネティックな修飾子をコードする遺伝子です。エピジェネティックな修飾子の変異はIDH1とDNMT3Aの変異は、遺伝子の調節不全につながる遺伝子のこのクラスの他の突然変異を表すと、AMLでは比較的一般的です。ヌ(NPM1)のための遺伝子の変異は、AMLの中で最も一般的な取得突然変異の一つであり、一般的に(FLT3の不在下で- ITD)は、良好な予後因子であると考えられています。
NPM1とIDH2の共変異は、89%の3年全生存率と、良好な予後指標5として文献に記載されています。全体の3年生存率と比較した場合、これは、有意な生存利益を示し31%の野生型NPM1とIDH2。例えば、標準のケアの実践は、NPM 1およびFLT3-ITD変異のための変異解析が含まれています。二次変異が良好なものとすることができるように、このシナリオでは、唯一のNPM1変異の検出は、リスクに対する適切に階層化患者に失敗するだろう( 例えば、IDH2)( 例えば 、TET2)または不利な、骨髄移植を緩和するための自信を減少させます。
ケース2 -ソリッドNGSパネル
FFPE組織から抽出したDNAは、252 ngの/μlの濃度と千塩基対(bp)以下のDNAのわずか4%で、ソリッドNGSパネルのための十分な質と量でした。データ分析の後カバレッジの平均深さは9167が250読み取り深度以下なしの領域と(よく千読み込みの私たちの最小深さカットオフより上)を読み込みました。追加のQCメトリックがshoあります表3のWN。
ERBB2(HER2 / neuの )のエキソン20におけるインフレームの挿入とTP53におけるミスセンス変異:バイオインフォマティクスパイプラインを介して処理されたデータは、二つの疾患関連変異を検出しました。彼らの対立遺伝子頻度を持つすべてのエクソン変異体は、表5に示されている。命名法に反映されるようにERBB2での挿入は、実際に、重複したタンデム(HER2 / neuの )配列を表します。同定および配列のインフレーム挿入が必要な手動審査の確認はIGVを介して読み取ります。 TP53とHER2 / neuの変異の両方に見られるように、50%を超えるの突然変異頻度の検出は、ヘテロ接合性の消失(LOH)イベント(説明を参照)を示唆する。
肺腺癌検出変異を有する症例2のための固体-NGSパネルの結果IERBB2(HER2 / NEU)およびTP53、一般的に現在の標準のケア肺癌患者のための一環としてのためにテストされていない二つの遺伝子。HER2 / neuのは、肺癌における他の一般的に突然変異した遺伝子に類似チロシンキナーゼ受容体をコードし、EGFRのn 。 20挿入が2で観察されるHER2 / NEUエクソン活性化-肺腺癌の4%を、肺癌で観察されたHER2 / neuの変異の大部分を占め、典型的には、EGFR及びALK 12のような他のドライバ遺伝子の変異なしに腫瘍に見られます。 HER2 / neuおよびmTOR阻害剤13と化学療法15と一緒にモノクローナル抗体トラスツズマブとの重大な疾患の制御との併用療法に部分的な応答を含むHER2 / neuの挿入を、活性化した患者のための様々な治療の選択肢のための証拠を示す可能性のあるいくつかの系統があります。 TP53の変化を発見することは異様なではありません癌におけるMMONが、この時点で何のアクション治療法はありません。
| ケース1 | ケース2 | |
| 総開始読み込み | 2215926 | 2129110 |
| 割合は、マッピングを読み取り | 98.42パーセント | 98.29パーセント |
| 割合は、ターゲットに読み込み | 99.01パーセント | 97.29パーセント |
| 割合は、フィルター後、ターゲットで読み込み | 97.60パーセント | 95.45パーセント |
| 使用可能なの割合は、読み込み | 94.87パーセント | 91.79パーセント |
| 250Xカバレッジ上記拠点の割合 | 98.40パーセント | 100% |
| 拠点aの割合BOVE 1000倍カバレッジ | 95.90パーセント | 99.70パーセント |
| 250倍以下カバレッジ-アンプリコン数 | 8 | 0 |
表3: シーケンシングを実行しQCメトリックこれは、ライブラリの準備サンプルはQCを通過したかどうかを判断するために、データレビューのために使用されている平均カバレッジを含まない最も重要な実行統計の要約です。 80の範囲で低い「ターゲット上のパーセント」を持つために、FPUの洗浄工程またはプライマーのクロストークでSW1またはUB1のキャリーオーバーで、全てのパーセンテージは90%を超えている場合は、全体のプロセスが成功したが、それは可能です - 90%。 「パーセントマップされた 'が低すぎると、すべてのサンプルがヒトに揃えなければならないとして、それは、細菌または他のDNAの混入を示すことになります。これらの仕様のいずれかが80%以下である場合には、サンプルがどのようにpまでの決定を助けるためにさらなる検討のためにフラグが立てられますroceedとプロセスを改善。
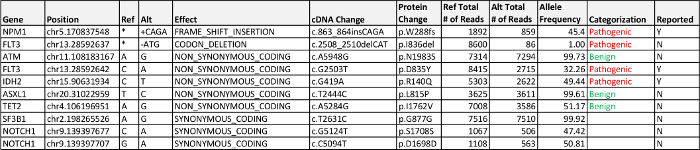
表4:ケース1の結果は、未知の重要性の病原体、疾患関連、バリアント(VUS)を検出し、5%の対立遺伝子頻度の報告基準以上の可能性が高い良性のエクソン変異体が記載されています。 このテーブルをダウンロードするにはこちらをクリックしてください。
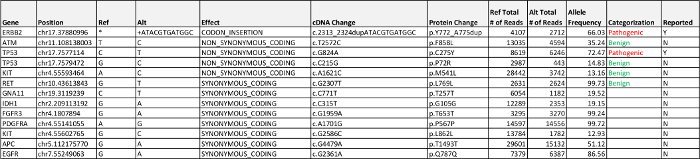
表5:。。ケース2の結果 、未知の重要性の病原体、疾患関連、バリアント(VUS)を検出し、おそらく5%の対立遺伝子頻度の報告基準以上の良性のエクソン変異体が記載されているこのテーブルをダウンロードするにはこちらをクリックしてください。
補足図1:アンプリコンベースSampleSheet.csvの例。 このシート(この場合、アンプリコン)を実行するためにどのような化学シーケンサに伝え、どのようなワークフロー( 例えば、GenerateFastq)、どのようなアプリケーションおよびアッセイ( 例えば、FastqOnly)、どのように多くの塩基(または読み込み)の配列(この場合は186 bpのX 186 bp)の、およびサンプルが)この場合、デュアルインデックス作成には(特定のインデックスに関連付けられている最後に何を。黄色で強調表示されている部品は、実験者が望むものは何でも変更することができますが、この場合、ラボでは、これらのパラメータを使用しています。 この図をダウンロードするにはこちらをクリックしてください。
ディスカッション
この原稿で説明する2つのNGSの試験が臨床的に提供されているように、最も重要な実用的な考慮事項は、品質管理です。具体的には、密接な考慮事項は、抽出したDNAの質と量に支払わなければなりません。これは、多くの場合、変数のDNA収率で高度に分解されFFPEサンプルのために特に重要です。イソプロパノール沈殿法、カラムベースの方法は時々制限された溶出体積を有するDNAの剪断をもたらすことが見出されたようFFPEサンプルからのDNAの収量を最大化するために開発されました。したがって、試料が低すぎる濃度を与えるまたはアッセイのためにあまりにも低下している時間のほとんどは、それが原因で、組織の大きさ、種類、または固定ではなく、抽出プロセスに最も可能性が高いです。抽出の失敗がある場合、血液/骨髄標本のために、それが原因hemodilute又は化学切除( すなわち 、不十分その抽選で白血球又は腫瘍細胞の数を有する)であるサンプルに通常です。
DNAの品質が良好であればしかし、その後、低入力量は、成功することができ; 250 ngの多くの場合、アッセイで使用されている - NT ">検証中に、DNAの質と量の受容のためのカットオフは、100の推奨入力を確立すべきです。 DNAの品質( すなわち 、増幅可能なDNAの量が100未満である- 250 ngの)悪い場合に加えて、(増幅可能なDNAの量が推奨される入力に到達するため)、次に高い入力量は、シーケンシング結果の品質を向上させることができ。DNAの質と量のためのメトリクスは、ライブラリの準備にDNAを進める前に、各サンプルに適用する必要があります。これらのサンプルを「グレーゾーン」( 図2参照)には、実験室のディレクターまたは指名の裁量で実行する必要があります。現時点でのベストDNAは、塩基配列決定の際に十分に機能していないかどうかを予測する方法は、入力DNAの定量および品質評価が可能になる定量PCRベースのアッセイを行うことである。このアプローチは、bioavailabに対処します異なるサイズのフラグメント( 例えば、100塩基対、150塩基対、200 bpおよび300 bp)の比較収量の増幅を経て、検体中の異なるサイズのフラグメントのility。現在、ライブラリの準備にはいくつかの節目の1に失策が失敗した場合や低品質のものであるとのいずれかにライブラリを引き起こす可能性が手動手順が多数含まれます。マイクロ流体ゲル分析を、配列決定の前に、ライブラリの準備の問題をチェックするための唯一のQC工程です。したがって、余分なマインドフルネスは、反応の成功の確率を高めることができますいくつかの重要なステップがあります。正確なサンプルとオリゴヌクレオチドプールを、各試料のために使用されることを保証することが不可欠です。確実かつ適切に各サンプルは二重インデックスPCRプライマー対の96のユニークな組み合わせのいずれかがサンプルミックスアップするための機会を減少させる含まれていることを記録します。また、正しくフィルタープレート(FPU)ドレインを確保することが重要です。それが適切に排水しない場合、これはエクステを引き起こす可能性がありますライブラリの準備のnsion-ライゲーション工程は、次善行い、質の悪い配列決定データをリードします。ライブラリQC後、LNB1ビーズを完全に再懸濁し、LNB1 / LNA1溶液をこの混合物の濃度は、ライブラリーのモル濃度を決定するために使用されるように、サンプルに追加する前に十分に混合することをされていることを確認することが重要です。ビーズ溶出工程は、ビーズをオフに溶出するライブラリの次善の量につながる場合最後に、クラスタリングの密度を減少させ、場合によっては適切な平均カバレッジを取得しないように、ライブラリの原因となります。逆に、ライブラリーの過剰は、貧しい品質が読み込みにつながります。したがって、シーケンサ上のライブラリの最適なプーリングとクラスタリングを確保するためのビーズベースの正規化ステップで一致することが重要です。
ライブラリーの調製に加えて、生の、逆多重化FASTQファイルから正確な変異コールを生成するバイオインフォマティクスパイプラインを検証することが重要です。選択1を取捨選択しなければならない多くのオープンソースと市販のアライナ、バリアント発信者、およびNGSソフトウェアパッケージがあるので、カスタムソリューションは、時間がかかる場合があります。カスタムアルゴリズムは、本質的なパフォーマンス統計を抽出し、ほとんどのオープンソースツールを逃れたユニークな定期的な変異を同定し、遺伝子座の各々の上にコピー数の状態を決定するように設計する必要があります。バイオインフォマティクスパイプラインの検証プロセス中に、満たす、または品質のフィルタリング後のカバレッジの最小深さ( 例えば 、250の最小読み取り)と最小対立遺伝子頻度の両方を超える変異体についての報告義務のカットオフ値を決定することが重要である( 例えば 、4 %)。この多重化されたアンプリコンベースのアッセイので、カバレッジの最小平均深さ( 例えば 、1,000倍)ライブラリの読み込みの最小深さを最低実行アンプリコンを得ることができるようにするために達成する必要があることを決定することが重要です。また、検定の多重化の性質は、cを行いますauseオフターゲット効果とこれらの「成果物」を発見し、完全に起動する前に吟味する必要があります。記載されたアッセイの別の重要な制限は、検証最小対立遺伝子頻度を達成するために、10%を超える腫瘍を含有する試料について必要です。
低周波数の検出は、1%、FLT3の挿入は手動レビューがこの過程でまだ望ましいことの証拠です。でも5%の対立遺伝子頻度カットオフを有する、いくつかの重要な突然変異は多分逃したので、マニュアルレビューは、これらの変異体を確認することが不可欠となります。 FLT3-ITDSについては、エクソン14の目視検査は見過ごさない低レベルまたは大規模な挿入/複製を確保するために、すべてのAML患者に対して行われます。また、一般的にプライマー配列の隣にあるHER2エクソン20の挿入は、手動による介入が必要です。堅牢なバイオインフォマティクスパイプラインを持つにもかかわらず、いくつかの変異体は、ハードカットを持つだけの性質である見落とさ行くことができます上記のほとんどの統計のためにオフ。より良いライブラリーの調製および/または配列決定の方法論が意志として少ないアーティファクトや偽陽性が含まれていても低いカットオフで質の良いデータを持っている方が有利であるため、より良いバイオインフォマティクスは、この問題を軽減するために必要とされるであろう。
対立遺伝子頻度の検出および解釈は、腫瘍の割合の決意とゲノムの一部の領域の増幅バイアスの困難に困難な場合があります。ケース2において観察されるように加えて、50%を超える対立遺伝子頻度は、これは、ヘテロ接合性の消失(LOH)正常な対立遺伝子の喪失に起因する場合、いずれかの変異体読み出しの見かけの増加をもたらす、Aとして解釈され、検出され得ます変異対立遺伝子( 例えば 、2変異体および1通常のコピー)または他のメカニズムのゲイン。これらのメカニズムは、アレイ比較ゲノムハイブリダイゼーション(のaCGH 19)および/ またはSNP遺伝子型決定のアレイを利用することによって明らかにすることができる。20。
現在のターゲット濃縮方法は、非効率なハイブリッドキャプチャまたは単一のサンプルとターゲットシーケンシング読み取りオフ以上の複数の配列決定の報道のための必要性をもたらす多重PCR技術のいずれかの完全日の手続きに依存しています。近い将来に予想されるNGS分子腫瘍学のための追加のアプリケーションは、完全に自動化することが、非常に低い入力DNA( すなわち 、1未満NG)の量だけでなく、高度に分解した試料でサンプルを処理することができることができます簡単にライブラリー調製方法が含まれますDNA。これらの課題に対処するために、ほとんどのメソッドは、おそらく、PCRベースのいずれかになります多段階のPCR法や超並列シングルプレックスPCRアプローチです。また、個々のアンプリコンの分子バーコードは劇的背景シーケンシングノイズを低減し、より低い対立遺伝子頻度を達成するために、腫瘍細胞の低い割合を有するサンプルの検査を可能にし、circulatを取り込むに向かって移動することが示されています腫瘍細胞る。
癌標本における疾患関連変異の検出は、数十年の治療の標準となっています。歴史的には、遺伝子は、多くの場合、試験配列の末端に導く変異の同定と、一度に連続して、一つの遺伝子/エキソンを試験しました。 NGSの出現は、腫瘍形成に関連付けられている複数の変異の同定につながる並列に多くの癌に関連した複数の遺伝子の配列を決定するに偏りの少ないアプローチを可能にしました。癌における体細胞変異の検出のためのNGSの臨床的有用性がますます明らかです。実際、腫瘍サンプルのNGSベースの分析では、伝統的な、単一の遺伝子検査に挑戦する新しいパラダイムを表すが、臨床的有用性は非常にはっきりしています。臨床検査室は本日、この強力な技術を適用して慎重な方法の検証とテストの解釈を結婚するエキサイティングな機会を持っています。
開示事項
著者らは、開示することは何もありません。
謝辞
著者は、生産の原稿と支援の読み取りのためにダニエル・ワイルドの支援を感謝したいです。
資料
| Name | Company | Catalog Number | Comments |
| Genomic DNA ScreenTape | Agilent Technology | 5067-5365 | |
| Genomic DNA Reagents | Agilent Technology | 5067-5366 | |
| High Sensitivity D1000 ScreenTape | Agilent Technology | 5067-5584 | |
| High Sensitivity D1000 Reagents | Agilent Technology | 5067-5585 | |
| TapeStation 2200 | Agilent Technology | G2965A | |
| TapeStation Analysis Software | Agilent Technology | A.01.04 or higher | |
| 96-well Tube Storage Racks | Any Vendor | ||
| 15/50 ml Tube Rack | Any Vendor | ||
| 96-well Plate Rack | Any Vendor | ||
| Pipette, single-channel, 0.5–2.5 μl | Any Vendor | ||
| Pipette, single-channel, 1–10 μl | Any Vendor | ||
| Pipette, single-channel, 2–20 μl | Any Vendor | ||
| Pipette, single-channel, 10–100 μl | Any Vendor | ||
| Pipette, single-channel, 20–200 μl | Any Vendor | ||
| Pipette, single-channel, 100–1,000 μl | Any Vendor | ||
| Serological Pipettor | Any Vendor | ||
| Vortexer | Any Vendor | ||
| Ice bucket | Any Vendor | ||
| Microcentrifuge (for tubes and strip tubes) | Any Vendor | ||
| Freezer, -20 °C | Any Vendor | ||
| 4 °C Refrigerator | Any Vendor | ||
| Water or Bead Bath | Any Vendor | ||
| Incubator (37 °C) | Any Vendor | ||
| Serological Pipettes, 1 ml | Any Vendor | ||
| Serological Pipettes, 5 ml | Any Vendor | ||
| Serological Pipettes, 10 ml | Any Vendor | ||
| Serological Pipettes, 25 ml | Any Vendor | ||
| Gloves | Any Vendor | ||
| Razor Blades/Scaples | Any Vendor | ||
| KimWipes | Any Vendor | ||
| 15 ml Conical Tube | Any Vendor | ||
| 50 ml Conical Tube | Any Vendor | ||
| Paper Towels | Any Vendor | ||
| 200 proof Ethanol | Any Vendor | Store in Flammable Cabinet | |
| 2-Propanol (Isopropanol) | Any Vendor | Store in Flammable Cabinet | |
| 25 ml Reservoirs | Any Vendor | ||
| 10 N NaOH | Any Vendor | ||
| Pipette, 8-channel, 1 – 10 μl | Any Vendor | ||
| Pipette, 8-channel, 10 – 100 μl | Any Vendor | ||
| Pipette, 8-channel, 20 – 300 μl | Any Vendor | ||
| Ice Bucket | Any Vendor | ||
| Water Squirt Bottle | Any Vendor | ||
| Alcohol Squirt Bottle | Any Vendor | ||
| Lens Cleaning Paper | Any Vendor | ||
| Plates, 96-well PCR, Semi-Skirted | Any Vendor | ||
| Tube strips, 8-well, 0.2 ml | Any Vendor | ||
| Agencourt AMPure XP Beads | Beckman Coulter | A63881 | |
| BioShake IQ or 3000-T elm | Bulldog Bio/Q.Instruments | 1808-0506/ 1808-0517 | |
| DropPlate96 S - LabChipDS | Caliper | 128876 | |
| DropPlate96 D - LabChipDS | Caliper | 132848 | |
| DropSense96 | Caliper (Trinean) | ||
| DropQuant Software | Caliper (Trinean) | ||
| Plate Sealing Film | Denville | B1212-5S | |
| Aluminum Seal Foil | Denville | B1212-6S | |
| Nuclease-Free, Pure Water System | EMD Millipore | ||
| 5424 centrifuge | Eppendorf | 22621408 | |
| 5804R centrifuge | Eppendorf | 22623508 | Both 15 ml tube and plate rotators, preferably a centrifuge that can go up to 2,500 x g. |
| Safe-Lock Tube 1.5 ml, Natural | Eppendorf | 22431021 | |
| 5 ml Tube, DNA LoBind Tube | Eppendorf | 30108310 | |
| 5430R Centrifuge | Eppendorf | 022620645 | Any plate rotator centrifuge will work |
| Hybex Microsample Incubator | Fisher Scientific | 1057-30-0 | |
| Hybex 0.2 ml Tube Block | Fisher Scientific | 1057-31-0 | |
| TruSeq Amplicon – Cancer Panel | Illumina | FC-130-1008 | 96 reactions |
| TruSeq Custom Amplicon | Illumina | PE-940-1011 | 96 reactions |
| TruSeq Custom Amplicon Index Kit | Illumina | FC-130-1003 | 96 Indices, 384 Samples |
| MiSeq Reagent Kit v3, 500 Cycles | Illumina | MS-102-3003 | |
| MiSeq Reagent Kit v2, 300 Cycles | Illumina | MS-102-2002 | |
| MiSeq Reagent Kit v2, 500 Cycles | Illumina | MS-102-2003 | |
| Experiment Manager | Illumina | 1.3 or higher | |
| MiSeq Reporter | Illumina | 2.0 or higher | |
| Sequencing Analysis Viewer | Illumina | 1.8 or higher | |
| TruSeq Index Plate Fixture and Collar Kit | Illumina | FC-130-1007 | |
| MiSeq v2 | Illumina | SY-410-1003 | |
| TruSeq Custom Amplicon Filter Plate | Illumina | FC-130-1006 | |
| Index Adapter Replacement Caps | Illumina | 11294657 | |
| Qubit 2.0 | Invitrogen | Q32866 | |
| Qubit 0.5 ml Tubes | Invitrogen | Q32856 | |
| Qubit dsDNA Broad Range Assay Kit | Invitrogen | Q32853 | |
| DynaMa6-96 Magnetic Stand, Side Skirted | Invitrogen | 120.27 | |
| GeneAmp PCR System 9700 (gold/silver block) | Life Technologies | N8050200 | |
| Gentra Puregene Blood Kit | Qiagen | 158489 | |
| Deparaffinization Solution (16 ml) | Qiagen | 19093 | |
| Buffer ATL (4 x 50ml) | Qiagen | 939011 | |
| Protein Precipitation Solution (50 ml) | Qiagen | 158910 | |
| DNA Hydration Solution (100 ml) | Qiagen | 158914 | |
| Glycogen Solution (500 μl) | Qiagen | 158930 | |
| Qiagen Proteinase K | Qiagen | 19133 | |
| Rnase (5 ml) | Qiagen | 158924 | |
| Nuclease-Free Water (10 x 50 ml) | Qiagen | 129114 | |
| Pestles | USA Scientific | 1415-5390 | |
| TipOne RPT 10 µl elongated filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips). | USA Scientific | 1180-3810 | |
| TipOne RPT 100 µl natural, beveled filter pipet tips in sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1840 | |
| TipOne RPT 200 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-8810 | |
| TipOne RPT 20 μl natural, beveled filter pipet tips in racks, sterilized racks, 10 racks of 96 tips (960 tips) | USA Scientific | 1180-1810 | |
| TipOne RPT 1,000 μl natural, graduated XL filter pipet tips in | USA Scientific | 1182-1830 |
参考文献
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med. 366 (10), 883-892 (2012).
- Campbell, P. J., et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature. 467 (7319), 1109-1113 (2010).
- Ding, L., et al. Clonal evolution in relapsed acute myeloid leukaemia revealed by whole-genome sequencing. Nature. 481 (7382), 506-509 (2012).
- Frampton, G. M., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nature Biotechnol. 31 (11), 1023-1031 (2013).
- Patel, J. P., et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 366 (12), 1079-1089 (2012).
- Forbes, S. A., et al. COSMIC (the Catalogue of Somatic Mutations in Cancer ): a resource to investigate acquired mutations in human cancer. Nucleic Acids Res. 38 (Database Issue), 652-657 (2010).
- Shih, A. H., Abdel-wahab, O., Patel, J. P., Levine, R. L. The role of mutations in epigenetic regulators in myeloid malignancies. Nat Rev Cancer. 12 (9), 599-612 (2012).
- Liersch, R., Müller-Tidow, C., Berdel, W. E., Krug, U. Prognostic factors for acute myeloid leukaemia in adults - biological significance and clinical use. Br J Haematol. 165 (1), 17-38 (2014).
- Bacher, U., Schnittger, S., Haferlach, T. Molecular genetics in acute myeloid leukemia. Curr Opin Oncol. 22 (6), 646-655 (2010).
- Subramanian, J., Govindan, R. Lung cancer in "Never-smokers": a unique entity. Oncology (Williston Park). 24 (1), 29-35 (2010).
- Sakashita, S., Sakashita, M., Tsao, M. S. Genes and pathology of non-small cell lung carcinoma. Semin Oncol. 41 (1), 28-39 (2014).
- Arcila, M. E., Chaft, J. E., Nafa, K. Prevalence clinicopathologic associations, and molecular spectrum of ERBB2 (HER2) tyrosine kinase mutations in lung adenocarcinomas. Clin Cancer Res. 18 (18), (2012).
- Gandhi, L., et al. Phase I study of neratinib in combination with temsirolimus in patients with human epidermal growth factor receptor 2-dependent and other solid tumors. J Clin Oncol. 32 (2), 68-75 (2014).
- Sheikhha, M. H., Awan, A., Tobal, K., Liu Yin, J. A. Prognostic significance of FLT3 ITD and D835 mutations in AML patients. Hematol J. 4 (1), 41-46 (2003).
- Mazières, J., et al. Lung cancer that harbors an HER2 mutation epidemiologic characteristics and therapeutic perspectives. J Clin Oncol. 31 (16), 1-8 (2014).
- Robinson, J. T., et al. Integrative Genomics Viewer. Nat Biotechnol. 29 (1), 495-500 (2011).
- Forbes, S. A., et al. COSMIC: exploring the world's knowledge of somatic mutations in human cancer. Nucleic Acids Res. 43 (Database issue), D805-D811 (2014).
- Daber, R., Sukhadia, S., Morrissette, J. J. Understanding the limitations of next generation sequencing informatics, an approach to clinical pipeline validation using artificial data sets. Cancer Genetics. 206 (12), 441-448 (2013).
- Haraksingh, R. R., et al. Genome-Wide Mapping of Copy Number Variation in Humans: Comparative Analysis of High Resolution Array Platforms. PLoS ONE. 6 (11), e27859(2011).
- de Leeuw, N., et al. SNP Array Analysis in Constitutional and Cancer Genome Diagnostics - Copy Number Variants, Genotyping and Quality Control. Cytogenet Genome Res. 135 (3-4), 212-221 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved