Method Article
对小鼠淋巴瘤模型监测肿瘤进展和治疗效果生物发光基于肿瘤定量方法
* 这些作者具有相同的贡献
摘要
生物发光成像是用于定位肿瘤和转移一个众所周知的工具,但是这些图像的量化通常需要复杂的计算和特定仪器。我们描述了易于使用luminoscore方法,基于精确采集条件,不需要计算,并且使肿瘤负荷和处理响应于在小鼠模型中进行监测。
摘要
Although bioluminescence imaging (BLI) shows promise for monitoring tumor burden in animal models of cancer, these analyses remain mostly qualitative. Here we describe a method for bioluminescence imaging to obtain a semi-quantitative analysis of tumor burden and treatment response. This method is based on the calculation of a luminoscore, a value that allows comparisons of two animals from the same or different experiments. Current BLI instruments enable the calculation of this luminoscore, which relies mainly on the acquisition conditions (back and front acquisitions) and the drawing of the region of interest (manual markup around the mouse). Using two previously described mouse lymphoma models based on cell engraftment, we show that the luminoscore method can serve as a noninvasive way to verify successful tumor cell inoculation, monitor tumor burden, and evaluate the effects of in situ cancer treatment (CpG-DNA). Finally, we show that this method suits different experimental designs. We suggest that this method be used for early estimates of treatment response in preclinical small-animal studies.
引言
早期肿瘤细胞的检测仍是一个挑战,是用于增强癌症治疗功效的关键。 体内生物发光成像(BLI)是一个非常敏感的,非侵入性的光学技术,广泛用于小动物监测肿瘤。萤火虫萤光素酶表达细胞通常用于此类实验1,2。此氧氧化D-萤光素与分子氧,但需要两个辅因子-镁离子和三磷酸腺苷3。萤火虫萤光素酶更适合于比海肾萤光素酶4,因为它的量子产率是更高的体内成像。
该氧化的衬底 - 氧化萤光素 - 自发发射光子返回到其基本状态,然后变为无效。所发射的光子具有围绕530nm的最大波长。高灵敏度摄像机可以从一个小动物的内部检测所述发光光子和提供,使得它POSS图像IBLE来定位肿瘤细胞。
通过光子计数准确量化肿瘤负荷的能力可以作为量化处理功效的强有力的和灵敏的工具。因为治疗效果可以越早检测,这种敏感性可能使人们有可能确定在哪个处理成为有效的确切时刻。
总发射光子的绝对定量是非常复杂的。收集光子的数目取决于肿瘤的深度和在光子通过发射的器官。基于组织吸收系数校正系数可以计算出如 图5所示 ,但肿瘤细胞数目的绝对定量需要知道由每个肿瘤细胞发射的光子的数量。而且,萤光素酶表达,像许多报告基因( 例如 ,荧光蛋白)不是均匀的,即使是在从一个单一的克隆6衍生的细胞群。路西法的数量在细胞中酶蛋白不能被精确地计算。标准化实验条件成立从而出现一个可靠的半定量分析的关键。
我们采用的方法luminoscore两个不同的小鼠淋巴瘤模型7,8,9。在这些模型中,同基因的肿瘤细胞注射到眼睛或皮肤获得,分别一次眼内淋巴瘤(PIOL)模型和皮下淋巴瘤(SCL)模型下。在每个这些原位模型,处理是在就地施用时,肿瘤接种PIOL七天后,当肿瘤已经达到在SCL其最大直径为0.5到0.7厘米
我们使用了luminoscore方法监测原位 CpG疗法的效果,先前显示为7,10,11有效。 CpG的是一个寡核苷酸序列和TLR9,一配体,其反过来是由众多的CE表达的细胞内受体免疫系统的LLS,包括树突细胞,B淋巴细胞,单核细胞,和天然杀伤细胞。的CpG-DNA是包含CpG基(CG)的免疫刺激基序的20聚体的DNA序列;控制(ODN控制)是一样的20聚体的DNA序列,所不同的是免疫刺激的CG序列被反转(GC)。在我们所研究的鼠淋巴瘤TLR9接合诱导凋亡10,激活免疫系统12,从而显著降低肿瘤负荷7,11。
在这里,我们描述了量化肿瘤负荷,并通过生物发光图像处理响应的标准方法。此方法依赖于成像过程的不同方面,从采集到的分析,以优化的可靠性,重现性,非用户的依赖,以及统计学意义。生物发光定量指标分配给每个鼠标;这个值,我们称之为luminoscore,可以进行比较,不仅动物,但人之间所以实验之间。
在这项工作中,我们着重于生物发光成像的过程,以及由luminoscore方法图像量化。我们显示用于验证注射,监测肿瘤负荷,并评估原位癌症治疗的功效本方法的有效性。每个点都是在代表结果说明使用不同的小鼠模型突出luminoscore方法的适应性实验。
研究方案
所有涉及小鼠过程符合欧盟的指导方针,法语条例动物实验(编号2001-464农业部法令,2001年5月),和国家研究所德拉桑特等德拉RECHERCHE MEDICALE(INSERM)委员会的指导方针动物研究,并分别由有关地方委员会批准(查尔斯·达尔文伦理委员会的动物实验,巴黎,法国;许可证号:P3 / 2009/004)。
1.细胞的制备
- 生长小鼠B淋巴瘤细胞系A20.IIA-luc2在补充有10%胎牛血清,100μg/ ml的青霉素,100微克/ ml链霉素,10mM的丙酮酸钠,50μM2-巯基乙醇,和0.50的RPMI-1640 Glutamax的培养基毫克/ ml潮霉素B.
- 维持细胞培养物,在37℃,5%CO 2和改变介质每两至三天。收获5毫升用吸管一天细胞悬浮液更换培养基后。
- 旋转单元3005;克10分钟,悬浮细胞在3ml无菌磷酸盐缓冲盐水(PBS)。重复此步骤两次以洗涤细胞。
- 加载Malassez计数室之前混合15微升30微升台盼蓝标记细胞悬液。与式计算细胞浓度:浓度(细胞/ ml)=细胞在计数网格* 3 * 1000号。
- 旋转细胞一次,在300×g离心10分钟。用移液管除去上清液。用C在步骤1.4计算出的浓度),细胞的数目是N = C * 3。
- 计算无菌PBS 1×中的5×10 7个细胞/ ml与下式的浓度,以获得细胞悬液的必需体积:PBS容积(毫升)= N /(5×10 7)。暂停将细胞沉淀(来自步骤1.5)在无菌PBS 1X的前一句中计算出的体积)。细胞悬浮液A在SCL模型中使用( 在体内注射体积为100微升:5×10 6细胞S)。
- 吸管10微升细胞悬浮液A和添加90微升无菌PBS在1.5ml管中,在每毫升5×10 6个细胞,得到100微升细胞悬浮液B辑。细胞悬浮液B是在PIOL模型中使用( 在体内注射体积是2微升:1×10 4个细胞)。
2.荧光素
- 在一个50毫升管稀1克D-萤光素钾盐粉末在30毫升无菌PBS 1X和摇动几秒钟,以溶解聚集体。
注:由于荧光素是光敏感,准备在黑暗的1.5毫升离心管500微升等分。 - 储存在-20℃的等分试样。
注:等分试样可存放数个月。
融化后,将等分试样不能在+ 4℃下储存超过1天。冻融循环是优选在4℃下贮存。 - 注入100微升D-萤光素钾盐溶液腹膜内为每个成像阿萨年。
注意:此溶液相当于每只小鼠3.3毫克的剂量为150毫克/公斤。
3.麻醉剂混和麻醉
- 制备通过在无菌PBS中1×混合氯胺酮120 mg / kg和赛拉嗪6毫克/公斤的麻醉剂溶液。
- 注入60微升麻醉剂混腹腔与将25g针头每个成像试验。手术(与PIOL或SCL模型),注入80微升混合物,得到更深入的麻醉。将鼠标放回笼子。
- 当鼠标不动的出现,从笼中取出,并轻轻挤压手指之间的鼠标的腿。如果鼠标与逃避反射反应,等待几分钟。重复上述动作,直到鼠标没有反应,这证实了满意的麻醉。
- 把鼠标放在一个保温盘或下一个变暖的光。
- 应用眼膏,以避免麻醉的成像试验或SCL在手术过程中眼睛干涩。应用手术的PIOL模型后眼膏。
4.手术和细胞接种
注:在保温盘或下一个变暖的光执行所有外科手术,在1型微生物安全柜在动物生物安全2级设施。在本节中使用的所有外科手术刀具使用前高压灭菌。
- 皮下淋巴瘤型号:
- 制备100微升在1-ml注射器与地下25针在步骤1.6中得到的细胞悬浮液。轻轻挤压上的手指之间的侧面的小鼠皮肤,在注射部位。插入针恰好进入皮肤褶皱。为确保皮下注射,不针放在深入到组织。
- 注入细胞进入皮褶。观察有无在皮肤下会出现一个小液体球,以确认注射正确执行。
- 制备100微升在1-ml注射器与地下25针在步骤1.6中得到的细胞悬浮液。轻轻挤压上的手指之间的侧面的小鼠皮肤,在注射部位。插入针恰好进入皮肤褶皱。为确保皮下注射,不针放在深入到组织。
- PIOL模型:
注:此PROCE杜热要求2的运营商,这里称为操作者1和操作2。- 结膜去除:
- 具有操作员1处解剖显微镜下鼠标。轻轻按压与眼睛的两侧的手指来清除它。保持这个姿势。
- 必须通过解剖显微镜操作2升书籍。握一把小单手钳的结膜;用另一只手,切只是钳子下面结膜用小一对外科剪刀。
- 具有操作员1释放步骤4.2.1.1按下鼠标的眼睛)
- 细胞注射:
- 准备一个10微升钝精密注射。通过它抽灭菌去离子水清洗。重复两次或三次,以确保有在注射器无气泡。然后准备2微升细胞悬浮液的注射。
- 具有操作员2轻轻按压与手指上Ë手眼的每一边将其清除。保持这个姿势。
- 有操作员1夹持眼用小钳子在一方面边缘,将其轻轻地向后伸展的组织。
- 必须通过解剖显微镜操作2升书籍。用另一只手,使得在同一个32克针鼠标的劣眼球的小孔。
- 具有操作员2放下针,拿起(用同一只手)精密注射器和针头插入步骤4.2.2.4所做的洞。
- 对用另一只手的注射器活塞操作1推。
- 有操作员2 V erify与在注射器中的细胞悬浮液已在眼球内被正确地喷射出的解剖显微镜(液体流很容易观察到的)。
- 具有操作员2 R emove的精密注射。
- 具有操作员1新闻稿的一个边缘进制眼睛笼罩在步骤4.2.2.3)
- 具有操作员2新闻稿眼睛的两侧步骤4.2.2.2按下)
- 立即应用眼膏。
注意:如果被正确执行的所有步骤,鼠标不应该在此过程中流血的。
- 结膜去除:
5.生物发光成像 - 0天
注:注入小鼠的所有产品必须在RT注射前。肿瘤细胞后,已经接种,并且在动物仍在麻醉,进行这些步骤的成像。
- 打开相机,打开采集软件。通过点击"初始化"按钮初始化相机,阶段,和透镜。初始化将需要10到15分钟,以完成。
- 注100微升的D-荧光素钾盐将25g针腹腔解决方案。不要静脉管理它。如果intravenou行政体系所需的任何原因,D-荧光素钠盐 ,必须使用而非D-萤光素钾盐 。
注:萤光素是在该浓度的过量反应物;因此,生物发光信号到达后3〜7分钟的高原,持续超过30分钟。 - 10分钟 D-荧光素注射后13,将标的鼠标在成像仪。鼠标放置在其自然的位置,其对相机后背 ,在平坦的位置成为可能。这一立场是自然的,容易复制。
- 勾选自动曝光功能,点击采集获取动物的背部 (后)的形象,与自动曝光功能。
注:自动曝光功能,通过从1秒曝光的图片计算它优化曝光时间。如果鼠标的生物发光信号是负的或非常低的,最佳曝光时间可能是自动设定为超过20分钟。在这种情况下,为8至10分钟的曝光时间可以是一个良好的折衷。曝光时间可以被手动设置,但图像不能包含饱和的像素 。 - 转动鼠标以暴露鼠标到相机的正面 。尽量扁平化鼠标和传播其前肢,使它们不会阻塞胸前。
- 采集动物的正视图像。验证自动曝光复选框被选中还是并在"采集"按钮,再次点击。
注:前图像会在背部图像之前被收购,反之亦然。正面和背面的图像的曝光时间可以根据鼠标的每一侧的相对强度是不同的。它正在使用的自动曝光功能时自动计算。量化只使用光子通量( 每秒光子)和不依赖于曝光时间。 - 把鼠标放在变暖高原e或下一个变暖的光,直到它从麻醉中恢复,然后将其放回笼子里。
6.生物发光成像 - 0天之后
- 打开相机,初始化相机,阶段,和透镜如在步骤5.1)。
- 麻醉小鼠的氯胺酮(120毫克/千克)/赛拉嗪(6毫克/公斤)混合物的60微升(见步骤3.1至3.5)腹膜内注射。
注:麻醉的这种方法允许成像每5天。执行日常成像,需要麻醉并适用于本麻醉剂使用生物发光成像,使用异氟醚的方法。 - 采集动物的正面和背面的图像,使用自动曝光功能,如在步骤5.5)和5.6)。处理鼠标按步骤5.7)。
7.生物发光定量与图像分析
注:luminoscore方法基于图像analysi秒。一旦图像已经根据上述步骤被收购,量化可以在任何时间执行(采集后立即含),以在每个时间点一luminoscore到每只小鼠关联。
- 通过点击"查看"菜单上显示"工具选项板",然后点击"工具选项板"如果尚未显示出来。点击工具面板中的"投资回报工具"选项卡。选择"轮廓"按钮,然后选择"免费抽奖"。
- 通过前视图下鼠标的边缘手动标记感兴趣区域(ROI)周围的鼠标的地区。与电脑鼠标右键单击关闭轮廓。
- 点击"查看"菜单,然后选择"ROI测量"上。确保"光辉(光子)"中的"测量类型"中选择了"ROI测量"窗口左下角的滚动菜单。如果不是,选择它。然后测量光子FLUX(PH / s)的记录在"总光通量[P / S]"框中的值。
注意:不要使用辉耀或者其他单位,是相对于投资回报率的表面积。 - 重复步骤7.2)和7.3)的后视图 。
- 总结从正面和背面视图得到的两个光子通量的值。结果是luminoscore。
- 比较的值使用适当的统计检验每个组(非参数双尾Mann-Whitney检验,例如)14。
结果
该Luminoscore方法可以用来验证肿瘤细胞注射
在涉及少数肿瘤细胞的注射模型或当注射部位不允许喷射的视觉验证,它可以是非常困难的,以确保注射液的质量。该luminoscore方法作为一种快速,便捷的工具来验证程序的质量和方便即时的一切都正确的确定。在这两个模型中,肿瘤是早在注射(图1A),10分钟后检测。图像单独足以验证肿瘤细胞存在于正确的位置。然而,量化图像提供注射的异质性的想法。的散点图(图1B)清楚地显示(黑点)的动物之间的差是接收和没有重新人为对象(红线)注射。有趣的是,在将SCL模型所获得的信号比在PIOL模型高100倍;这一发现与注射细胞的数目(5×10 6和1×10 4个细胞,分别地)相一致。
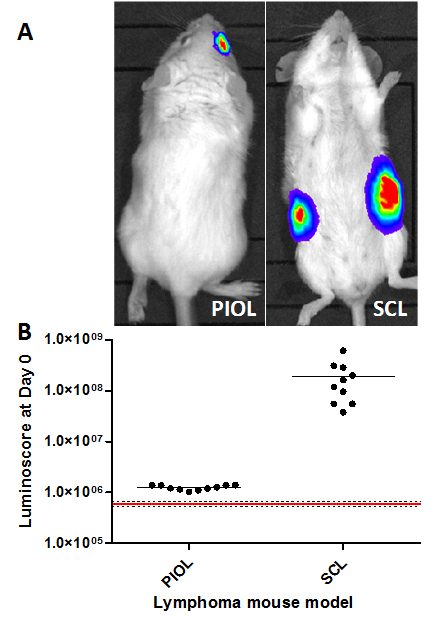
图1.验证不同小鼠淋巴瘤模型注射该 luminoscores测量不同型号淋巴瘤肿瘤细胞接种后10分钟。(A)两种型号的代表图像。(B)Luminoscore在不同型号的每个动物。红线对应于肿瘤细胞接种前10只动物测得的平均背景噪声;虚线是平均值+/-标准差。对于每个模型,所有的动物可以从背景噪声区别开来。在PIOL模型中,1×10 4个细胞INOCulated右眼的玻璃体,并在SCL模型,5×10 6细胞皮下注射到小鼠的各个侧面。 请点击此处查看该图的放大版本。
监测肿瘤负荷和治疗反应
该luminoscore也是用于研究肿瘤的生长和治疗功效的强有力的工具。 图2A示出了在控制肿瘤生长的监测的代表性图像和所述CpG处理PIOL基。小鼠每1×10 4个肿瘤细胞接种和治疗原位给药第7天的图像表明,在足够的时间(28天)后,转移开始出现的对照组中使用。尽管原发性肿瘤并未敏感治疗,更少所述CpG处理组(表1)中观察到转移。各组(图2B)中的肿瘤负荷进行定量分析表明CpG的减缓肿瘤的发展,产生经处理的和在28天(非参数双尾Mann-Whitney检验p值= 0.0079对照组之间的统计学显著差异)。尽管如此,肿瘤仍然生长在处理的小鼠中,其中没有存活(未示出数据)。这一发现与先前的报道一致:中央人民政府对初级眼肿瘤10没有显著影响。我们这里的ODN和CpG的组间的显著效果来自于转移生长抑制。
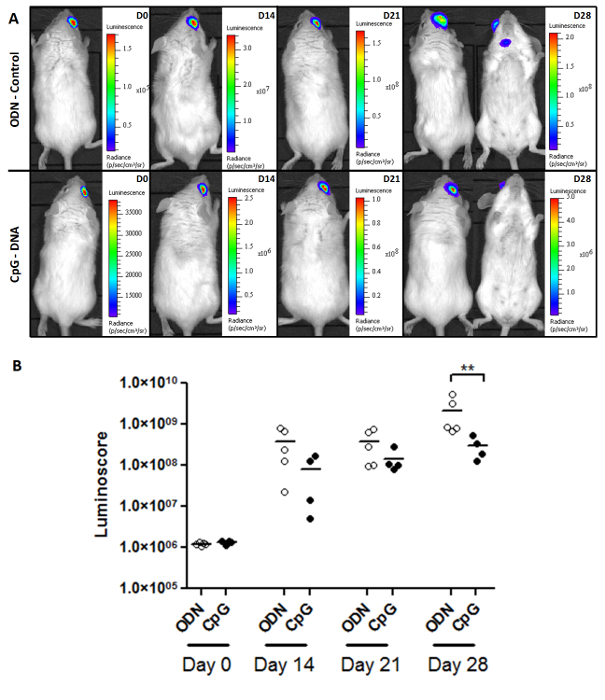
图2.监测肿瘤负荷和治疗反应。 (A)的两个基团的代表图像(ODN控制和CpG处理)○˚FPIOL的小鼠。(b)监测肿瘤负荷的luminoscore。作为对散点图所示,CpG基对luminoscore效果在第28天显著在这两个基团,该方法使得有可能以监测肿瘤负荷并测量轻微但显著(p值= 0.0079)CpG-的效果DNA,这可能没有被单独图像中检测到。 请点击此处查看该图的放大版本。
| 组 | 老鼠 | 转移的存在 | 位置 | 光子通量(PH / s)的 |
| 的CpG | 1 | 没有 | X | X |
| 2 | 是 | 眼睛引流lymp节点 | 9.32E + 05 | |
| 3 | 没有 | X | X | |
| 4 | 没有 | X | X | |
| 五 | 是 | 眼引流lymp节点 | 2.21E + 07 | |
| ODN | 1 | 是 | 眼引流lymp节点 | 1.06E + 07 |
| 2 | 是 | 眼引流lymp节点 | 7.25E + 07 | |
| 3 | 是 | 眼引流lymp节点+对侧 | 7.64E + 08 | |
| 4 | 是 | 眼引流lymp节点+对侧 | 1.74E + 09 | |
| 五 | 是 | 眼引流lymp节点+对侧 | 9.76E + 07 |
表1中。T他Luminoscore方法可以适用于不同的途径
该luminoscore方法不限于单一类型的小鼠模型; 图3示出,它可以适应不同的小鼠模型。在SCL模型,二肿瘤接枝在小鼠的每一侧。处理是在原位施用到单个侧在第0天,和对侧肿瘤作为它的控制(图3A)。因此,二ROI被每只小鼠得出:一个用于每个侧面(图3C)。在处理的和对照侧的luminoscore之间的比率描述了每个肿瘤的相对过程。该比率被设定为1在第0天,在施用治疗时。我们观察到治疗给药13天后在这个比率显著减少( 图3D;非参数双尾曼-惠特尼检验p = 0.004)。这种减少表明,处理过的侧肿瘤已被再吸收,在代表性生物发光图像(图3B)所示。
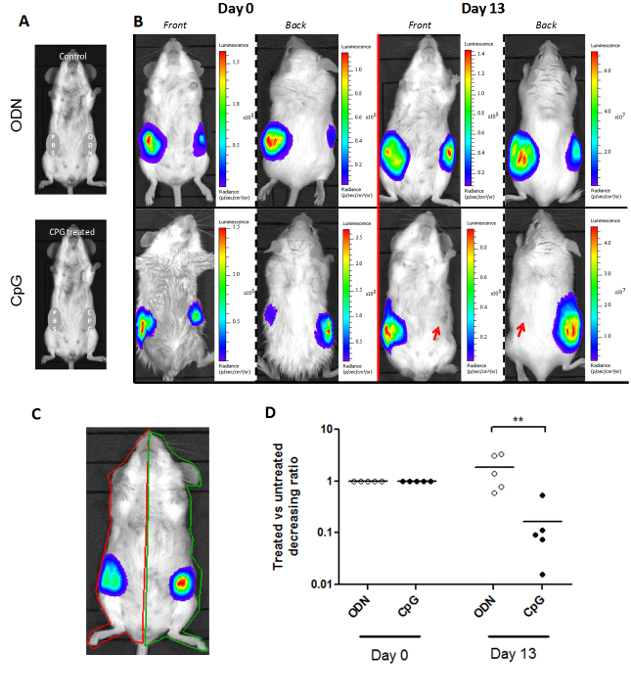
图3.适应的Luminoscore方法与两个主要的肿瘤部位模型。 (A)的SCL测定的实验设计。所述小鼠用在每个侧面的两个主要的肿瘤注射。一侧注入任一的CpG-DNA或ODN控制,而另一侧用PBS,以作为它的控制。(B)中 ,在0天和13天的治疗的CpG处理的和对照小鼠的代表性图像给药关于第0天的肿瘤生长受到抑制的小鼠的CpG的处理侧(C)的手动标记的每只动物感兴趣区域为两个主要的肿瘤位点。(D)的所述CpG处理或luminoscores之间的比率ODN控制端和PBS控制端是一个索引反映每个肿瘤的相同的动物中的相对增长。这比为1第0天第13天,所述CpG治疗组的比例已经下降显著(P = 0.004),揭示了抑制肿瘤生长在的CpG-DNA 原位管理。 请点击这里查看一个更大的版本这个数字。
讨论
由器官和组织的光吸收保持生物发光成像的限制,虽然这种限制是固有的任何光学成像模态。在我们的方法的上下文中,预期的解剖结构上的luminoscore的影响具有低可变性提供的研究是在一个给定的模型(位置和鼠标链)进行,允许随后的比较。生物发光不需要激励光,因此在体内成像比荧光更适于全身。
空间分辨率也是生物发光成像的限制,并从其中的生物发光的光子发射的脏器精确位置仍然困难。然而,该模型的良好的知识可以在肿瘤部位的定性位置帮助。在此基础生物发光法的唯一输出是luminoscore。位置不影响luminoscore因为INTERES的手动加价指定地区T(ROI)覆盖了整个鼠标。最后,萤火虫萤光素酶需要氧气。因此,生物发光成像通常会低估坏死肿瘤。再次,需要在模型的这个方面的一个很好的了解。
在本文中,我们的目标不是在评估的CpG的功效作为抗肿瘤的药物(这已被证明7,9,11),但描述允许生物发光数据集进行比较的方法。 我们确实描述量化旨在帮助标准化为在不同的地方在不同的时间比较不同试验中获取协议肿瘤负荷的方法和不需要计算机计算。以确保重现性和正确光子通量定量,所述成像设备必须与自制设备的光基准进行校准或所推荐的提供者的商业设备。
我们的协议需要认真注意的几个关键points:(一)首先,将小鼠麻醉的质量是用于获得清晰的图像,尤其是在具有长曝光时间的情况下的关键。 (二)该量化单元必须始终是光子通量,因为辐射取决于每个小鼠的表面积,并且可能是不相关的,用于比较不同的小鼠。 (三)的生物发光图像必须不含有饱和的像素,因为这些会偏压luminoscore。 (四)返回和前采集需要收集从肿瘤部位( 即,前采集不一定检测来自肿瘤的背面光子)发射的所有光子。各种不同的ROI附图luminoscore方法的发展过程中进行了测试。仅手动加价产生更有可能是统计学显著(数据未示出),结果令人满意。
Inoue等推荐的75毫克萤光素/ kg的剂量13。通过使用剂量为150毫克/公斤,而不是,成像的定时之后荧光素的管理保持不变,我们要确保高原持续整个长时间曝光的收购。荧光素必须在整个收购过程中过量的反应物。根据不同的模型,感兴趣的区域可以适于,如我们在我们提请每只动物2的ROI在SCL模型显示。在SCL模型中,治疗被注射时,肿瘤在其最大的直径,以限制可变性达到0.5厘米的植入。根据不同的小鼠中,肿瘤可能已经生长不同。标准化和比较小鼠,我们决定使用,揭示两翼肿瘤的相对生长处理和非处理侧之间的比率。
如果没有信号从注入小鼠预期为正,观察或者(i)细胞的数量是非常低,该信号是检测阈值以下;或(ii)小鼠缺乏氧气,需要立即治疗。
几个定量bioluminesc的ENCE分析由不同的作者描述需要复杂的计算和仪器( 例如 ,3D生物发光断层扫描)接近发出的生物发光的光子5,15的绝对定量。另外,对再现量化生物发光,特别是在肿瘤模型中,与2D生物发光成像的方法没有达成共识。我们的目的是规范图像采集协议,以限制用户的依赖。
CpG的原位注射接种肿瘤后两款车型降低肿瘤负荷。该luminoscore方法可以作为监测肿瘤免疫治疗的其他车型肿瘤负荷的工具。监测肿瘤负荷提供了一个可以提高我们的肿瘤的生长和转移性机制的理解不与肿瘤微环境的干扰一种非侵入性的方法。这和不使用这种方法的治疗有反应的动物的识别是通过S的增强验证uccessful肿瘤细胞注射在实验的开始。
在这里,我们使用A20.IIA-luc2细胞表现出luminoscore方法的适应性在SCL模式。然而,这种方法可以使用其它细胞系,只要它们表达荧光素酶,或适用于任何其他肿瘤模型中的T细胞研究(肿瘤特异性细胞毒性T细胞,调节性T细胞等 )的情况下。在罕见疾病的基因治疗的上下文中的体内基因转移的监视也可以使用luminoscore方法完成。
最后的数据显示,基于生物发光luminoscore方法能够比较实验之间,提供了灵活性和适应性,具体的实验需要,是无创纵向临床前研究的有用工具。
披露声明
The authors have nothing to disclose.
致谢
我们感谢科德利埃俱乐部研究中心(CEF,巴黎,法国),Genethon(埃夫里,法国) 和Genopole(CERFE,埃夫里,法国)的动物设施。我们感谢乔·安·卡恩对她的手稿仔细阅读。这项研究是由研究所国家德拉桑特的Et德拉Rechercher MEDICALE,巴黎第五大学,皮埃尔与玛丽·居里大学,协会倒拉RECHERCHE癌症中心,突尼斯方向兴业德拉RECHERCHE科学研究,法突尼斯CMCU支持项目,ThématiquesIncitatives德Genopole(ATIGE)的资金操作。 JC是由生命科学学院博士生前沿,并通过从INCA(国立研究所杜癌症)的奖学金支持。 RBA是从DGRS-INSERM和CMCU助学金获得者。 SD从国家研究所杜癌症获得了资助。
材料
| Name | Company | Catalog Number | Comments |
| CpG 1826 | Invivogen | Sequence: 5_-TCCATGACGTTCCTGACGTT Catalog number: tlrl-1826 | |
| ODN 1826 control | Invivogen | Sequence: 5_-TCCATGAGCTTCCTGAGCTT Catalog number: tlrl-1826c | |
| D-luciferin potassium salt | Interchim | Catalog number: FP-M1224D | |
| Ketamin | Virbac, France | ||
| Xylazin | Bayer Healthcare | Rompun 2% | |
| A20.IIA-luc2 cell line | A20.IIA transfected with pGL4.50[luc2/CMV/hygro]7 (Promega E1310) | ||
| Mice | Balb/cByj | Six-weeks old females from Charles River | |
| IVIS lumina Biolumienscence imager | Perkin Elmer | ||
| Living Image software | Perkin Elmer | Used for measuring photon flux on images and drawing ROIs | |
| R software (opensource) | R-project | Used for statistic tests | |
| Hamilton Precision Serynge 10 µl | Hamilton | Product number 7642-01100 | |
| Eye ointment | Lacrinorm | ||
| Dissecting microscope | ZEISS | Stemi 305 |
参考文献
- Rehemtulla, A., et al. Rapid and Quantitative Assessment of Cancer Treatment Response Using In Vivo Bioluminescence Imaging. Neoplasia. 2 (6), 491-495 (2000).
- Edinger, M., et al. Advancing animal models of neoplasia through in vivo bioluminescence imaging. European Journal of Cancer. 38 (16), 2128-2136 (2002).
- Hastings, J. W., Gibson, Q. H. The Role of Oxygen in the Photoexcited Luminescence of Bacterial Luciferase. Journal of Biological Chemistry. 242 (4), 720-726 (1967).
- Inouye, S., Shimomura, O. The Use of Renilla Luciferase, Oplophorus Luciferase, and Apoaequorin as Bioluminescent Reporter Protein in the Presence of Coelenterazine Analogues as Substrate. Biochemical and Biophysical Research Communications. 233 (2), 349-353 (1997).
- Pesnel, S., et al. Quantitation in Bioluminescence Imaging by Correction of Tissue Absorption for Experimental Oncology. Molecular Imaging and Biology. 13 (4), 646-652 (2010).
- Corre, G., et al. Stochastic Fluctuations and Distributed Control of Gene Expression Impact Cellular Memory. PLoS ONE. 9 (12), (2014).
- Ben Abdelwahed, R., et al. Lymphoma B-cell responsiveness to CpG-DNA depends on the tumor microenvironment. Journal of Experimental & Clinical Cancer Research CR. 32 (1), 18 (2013).
- Abdelwahed, R. B., et al. Preclinical Study of Ublituximab, a Glycoengineered Anti-Human CD20 Antibody, in Murine Models of Primary Cerebral and Intraocular B-Cell Lymphomas. Investigative Ophthalmology & Visual Science. 54 (5), 3657-3665 (2013).
- Donnou, S., Galand, C., Touitou, V., Sautès-Fridman, C., Fabry, Z., Fisson, S. Murine Models of B-Cell Lymphomas: Promising Tools for Designing Cancer Therapies. Advances in Hematology. 2012, (2012).
- Qi, X. -. F., et al. CpG oligodeoxynucleotide induces apoptosis and cell cycle arrest in A20 lymphoma cells via TLR9-mediated pathways. Molecular Immunology. 54 (3-4), 327-337 (2013).
- Houot, R., Levy, R. T-cell modulation combined with intratumoral CpG cures lymphoma in a mouse model without the need for chemotherapy. Blood. 113 (15), 3546-3552 (2009).
- Krieg, A. M. Toll-like receptor 9 (TLR9) agonists in the treatment of cancer. Oncogene. 27 (2), 161-167 (2008).
- Inoue, Y., Kiryu, S., Watanabe, M., Tojo, A., Ohtomo, K. Timing of Imaging after D-Luciferin Injection Affects the Longitudinal Assessment of Tumor Growth Using In Vivo Bioluminescence Imaging. International Journal of Biomedical Imaging. 2010, (2010).
- Mann, H. B., Whitney, D. R. On a Test of Whether one of Two Random Variables is Stochastically Larger than the Other. Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Darne, C., Lu, Y., Sevick-Muraca, E. M. Small animal fluorescence and bioluminescence tomography: a review of approaches, algorithms and technology update. Physics in Medicine and Biology. 59 (1), 1 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。