Method Article
Биолюминесценция основе метода Опухоль Количественное для мониторинга опухолевой прогрессии и эффектов лечения в лимфомы мыши Модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Биолюминесценции изображений является хорошо известным инструментом для локализации опухолей и метастазов, но количественное определение этих образов часто требует сложных вычислений и конкретных инструментов. Описывается простой в использовании метод luminoscore, основанный на точных условиях приобретения, не требует никаких расчетов, а также позволяет бремя опухоли и ответ на лечение, подлежащих мониторингу в мышиных моделях.
Аннотация
Although bioluminescence imaging (BLI) shows promise for monitoring tumor burden in animal models of cancer, these analyses remain mostly qualitative. Here we describe a method for bioluminescence imaging to obtain a semi-quantitative analysis of tumor burden and treatment response. This method is based on the calculation of a luminoscore, a value that allows comparisons of two animals from the same or different experiments. Current BLI instruments enable the calculation of this luminoscore, which relies mainly on the acquisition conditions (back and front acquisitions) and the drawing of the region of interest (manual markup around the mouse). Using two previously described mouse lymphoma models based on cell engraftment, we show that the luminoscore method can serve as a noninvasive way to verify successful tumor cell inoculation, monitor tumor burden, and evaluate the effects of in situ cancer treatment (CpG-DNA). Finally, we show that this method suits different experimental designs. We suggest that this method be used for early estimates of treatment response in preclinical small-animal studies.
Введение
Раннее обнаружение опухолевых клеток остается трудной задачей и имеет решающее значение для повышения эффективности лечения рака. В естественных условиях биолюминесценции томография (BLI) является очень чувствительным, неинвазивный оптический метод, широко используемый для мониторинга опухолей у мелких животных. Люциферазы светлячка-экспрессирующие клетки обычно используются для таких экспериментов 1,2. Это оксигеназы окисляет D-люциферин с молекулярным кислородом , но требует двух кофакторов - Mg 2+ и аденозинтрифосфата 3. Светлячок люциферазы является более подходящим для визуализации в естественных условиях , чем Renilla люциферазы 4 , поскольку его квантовый выход выше.
Окисленный субстрат - оксилюциферин - спонтанно испускает фотон, чтобы вернуться к его основного состояния, а затем становится неактивным. Излучаемые фотоны имеют максимальную длину волны около 530 нм. Камера с высокой чувствительностью может обнаружить люминесцирующие фотоны с внутренней стороны маленького животного и обеспечивают изображения, которые делают его POSSкими, чтобы определить местонахождение опухолевых клеток.
Способность точно определить количество опухолевой путем подсчета фотонов может служить мощным и чувствительным инструментом для количественной оценки эффективности лечения. Поскольку эффекты лечения могут быть обнаружены раньше, эта чувствительность может сделать возможным определить точный момент, когда лечение становится эффективным.
Абсолютное количественное определение суммарных излучаемых фотонов является очень сложным. Число фотонов, собранных зависит от глубины опухоли и на органы фотоны излучаются через. Коэффициенты коррекции на основе коэффициентов поглощения ткани можно рассчитать 5, но абсолютное количественное определение чисел опухолевых клеток требует знать число фотонов , испускаемых каждой опухолевой клетки. Кроме того, экспрессию люциферазы, как и у многих репортерных генов (например., Флуоресцентные белки) не является однородным, даже в популяции клеток , полученной из одного клона 6. Число ЛюцифераASE белки в клетках не может быть точно вычислена. Создание стандартных экспериментальных условиях, таким образом, оказывается решающим для надежного полуколичественного анализа.
Мы применили метод luminoscore к двум различным моделям лимфомы мыши 7,8,9. В этих моделях сингенных опухолевые клетки инъецируют в глаз или под кожу, чтобы получить, соответственно, первичный внутриглазной лимфома (Пиол) модели и подкожный лимфома модель (SCL). В каждой из этих моделей ортотопических, лечение проводят на месте, через семь дней после инокуляции опухоли для Пиол и , когда опухоль достигла 0,5 до 0,7 см в ее наибольшего диаметра для SCL.
Мы использовали метод luminoscore для мониторинга эффектов на месте CpG терапии, ранее было показано , чтобы быть эффективными 7,10,11. CpG представляет собой последовательность олигонуклеотида и лигандом TLR9, что в свою очередь является внутриклеточным рецептором затронутый целым рядом CELLS иммунной системы, в том числе дендритные клетки, В-лимфоциты, моноциты, и естественных клеток-киллеров. CpG-ДНК представляет собой последовательность ДНК 20-мера, которая содержит ВПУ (CG) иммуностимулирующий мотив; контроль (ОДН-контроль) является та же последовательность ДНК 20-мер, за исключением того, что иммуностимулирующая последовательность CG инвертируется (GC). TLR9 участие в мышиной лимфомы мы изучаем индуцирует апоптоз 10, активизирует иммунную систему 12, и тем самым значительно уменьшает опухолевую нагрузку 7,11.
Здесь мы опишем стандартизованный метод количественной оценки опухолевой нагрузки и реакции на лечение с помощью биолюминесценции изображений. Этот метод основан на различных аспектах процедуры визуализации, от приобретения до анализа, с целью оптимизации надежности, воспроизводимости не пользовательский зависимость, и статистическую значимость. Индекс биолюминесценции Количественное приписывается каждой мыши; это значение, которое мы называем luminoscore, можно сравнить не только между животными, но альтак между экспериментами.
В этой работе мы ориентируемся на процедуры визуализации биолюминесценции, а также количественной оценки изображений методом luminoscore. Показано , эффективность этого метода для проверки инъекции, мониторинга опухолевой и оценки эффективности лечения рака в точке. Каждая из этих точек иллюстрируется на репрезентативных результатов от экспериментов с использованием различных моделей мыши, чтобы выделить адаптивность метода luminoscore.
протокол
Все процедуры, связанные с мышами в соответствии с руководящими Европейского союза, французских правил для экспериментов на животных (Министерство сельского хозяйства Закон № 2001-464, май 2001 г.), а также руководящих принципов Национального де ла Санте и др де-ла-MEDICALE (INSERM) Комитета по Institut Recherche Исследования на животных, и были одобрены соответствующим местным комитетом (Darwin Комитет по этике для Чарльз Эксперименты на животных, Париж, Франция; Номер Разрешение: p3 / 2009/004).
1. Подготовка сотового
- Grow мыши B клеточной линии лимфомы A20.IIA-luc2 в среде RPMI-1640, Glutamax среде, дополненной 10% фетальной телячьей сыворотки, 100 мкг / мл пенициллина, 100 мкг / мл стрептомицина, 10 мМ пирувата натрия, 50 мкМ 2-меркаптоэтанола, и 0,50 мг / мл гигромицина B.
- Поддержание культуры клеток при 37 ° С в атмосфере 5% СО 2 и изменить среду каждые два-три дня. Урожай 5 мл суспензии клеток с помощью пипетки через один день после замены среды.
- Спин клетки при 3005; г в течение 10 мин и суспендирования клеток в 3 мл стерильного фосфатно-солевого буферного раствора (PBS). Повторите этот шаг в два раза, чтобы промыть клетки.
- Смешайте 15 мкл суспензии клеток с 30 мкл трипанового синего маркировки перед загрузкой счетнокамерное Malassez. Вычислить концентрацию клеток с формулой: концентрация (кл / мл) = количество клеток в счетной сетке * 3 * 1000.
- Крутить клетки еще один раз при 300 мкг в течение 10 мин. Удалить супернатант с помощью пипетки. С помощью C концентрацию, вычисленную на шаге 1.4), число ячеек N = С * 3.
- Рассчитать объем стерильной PBS 1X , необходимое для получения суспензии клеток А в концентрации 5 × 10 7 клеток / мл со следующей формулой: PBS , объем (мл) = N / (5 х 10 7). Приостановить осадок клеток (со стадии 1.5)) в объеме стерильной PBS 1x, вычисленного в предыдущем предложении. Суспензию клеток А для использования в модели SCL (в естественных условиях Вводимый объем составляет 100 мкл: 5 × 10 6 - элементныйс).
- Пипетка 10 мкл клеточной суспензии А и добавляют 90 мкл стерильной PBS в 1,5 мл пробирку , чтобы получить 100 мкл клеточной суспензии В в 5 х 10 6 клеток на мл. Суспензию клеток Б должна быть использована в модели Пиол (в естественных условиях Вводимый объем составляет 2 мкл: 1 х 10 4 клеток).
2. Люциферин
- Развести 1 г D-люциферин калийной соли порошка в 30 мл стерильной PBS 1x в 50-мл пробирку и встряхивают в течение нескольких секунд, чтобы растворить агрегаты.
Примечание: Поскольку люциферин является светочувствительным, подготовить 500 мкл аликвоты в темных 1,5 мл микропробирок. - Хранить аликвот при -20 ° С.
ПРИМЕЧАНИЕ: аликвоты могут храниться в течение нескольких месяцев.
После оттаивания аликвоты не должны храниться в течение более чем 1 день при + 4 ° С. циклов замораживания-оттаивания предпочтительнее хранения при температуре 4 ° С. - Вводят 100 мкл D-люциферин раствора соли калия внутрибрюшинно для каждого Асса изображенияу.
Примечание: Это решение соответствует 3,3 мг на мышь для дозы 150 мг / кг.
3. Обезболивающий Смесь и обезболивание
- Подготовить анестезирующий раствор путем смешивания кетамина 120 мг / кг и ксилазина 6 мг / кг в стерильном PBS 1x.
- Вводят 60 мкл смеси анестетиков внутрибрюшинно для каждого анализа изображений с иглой 25 G. Для хирургии (с Пиол или SCL модели), вводят 80 мкл смеси для получения более глубокой анестезии. Поместите мышь обратно в клетку.
- При появлении неподвижен мышь, удалите его из своей клетки и слегка сжать ногу мыши между пальцами. Если мышь реагирует с спасательную рефлекса, подождать несколько минут. Повторите действие, пока мышь не не вступает в реакцию, что подтверждает удовлетворительное обезболивание.
- Поместите курсор на разогреве пластины или под согревающим светом.
- Нанесите мазь для глаз, чтобы избежать глаз сухости во время обезболиванием для анализа изображений или для SCL хирургии. Применитьглазная мазь после операции по поводу модели Пиол.
4. Хирургическое лечение и инокуляции клеток
Примечание: Выполнение всех хирургических процедур на разогреве пластины или под согревающим светом, в 1-го типа микробиологической безопасности кабинета в животном уровне биологической безопасности 2 объекта. Все хирургические инструменты, используемые в этом разделе автоклавируют перед использованием.
- Подкожный Лимфома Модель:
- Подготовьте 100 мкл клеточной суспензии, полученной на стадии 1.6 в 1 мл шприц с иглой 25 G. Слегка сожмите кожу мыши на фланге между пальцами, в месте инъекции. Вставьте иглу точно в складки кожи. Для обеспечения подкожной инъекции, не кладите иглу глубоко в ткани.
- Вводят клеток в кожной складки. Обратите внимание, появляется ли немного жидкости мяч под кожу, чтобы подтвердить, что инъекция была выполнена правильно.
- Подготовьте 100 мкл клеточной суспензии, полученной на стадии 1.6 в 1 мл шприц с иглой 25 G. Слегка сожмите кожу мыши на фланге между пальцами, в месте инъекции. Вставьте иглу точно в складки кожи. Для обеспечения подкожной инъекции, не кладите иглу глубоко в ткани.
- Пиол модель:
Примечание: Эта процеДюре требует 2 операторов, упомянутых здесь в качестве оператора 1 и оператора 2.- Удаление конъюнктивы:
- У оператора 1 место мыши под рассекает микроскопом. Осторожно нажмите пальцами на каждой стороне глаза, чтобы очистить его. Поддерживать эту позицию.
- У оператора 2 л OOK через рассекает микроскопом. Захватите конъюнктивы с небольшим плоскогубцами в одной руке; с другой стороны, сократить конъюнктиву чуть ниже плоскогубцев с небольшой парой хирургических ножниц.
- У оператора 1 выпуск глаз мыши нажатой на шаге 4.2.1.1)
- инъекции клеток:
- Подготовьте 10 мкл тупые точности шприц. Промыть его путем откачки стерильной деионизированной воды через него. Повторите два или три раза, чтобы гарантировать, что нет никаких пузырей в шприц. Затем готовят 2 мкл клеточной суспензии для инъекций.
- У оператора 2 пресса осторожно пальцами нае руку на каждой стороне глаза, чтобы очистить его. Поддерживать эту позицию.
- У оператора 1 Возьмитесь за край глаза с небольшим плоскогубцами в одной руке и осторожно потяните ее назад , чтобы растянуть ткань.
- У оператора 2 л OOK через рассекает микроскопом. С другой стороны, делают маленькое отверстие в нижней глазным яблоком мыши с помощью иглы 32 G.
- У оператора 2 положил иглу и забрать (с той же стороны) прецизионного шприц и вставить иглу в отверстие , сделанное на этапе 4.2.2.4.
- У оператора 1 нажатие на поршень шприца с другой стороны.
- У оператора 2 V erify с рассекает микроскопом , что суспензия клеток в шприце правильно впрыскиваемого внутрь глазного яблока (поток жидкости легко наблюдать).
- У оператора 2 R алить прецизионного шприц.
- У оператора 1 г elease края А.Н.IMAL глаз схватился на этапе 4.2.2.3)
- У оператора 2 г elease стороны глаза прессованные на этапе 4.2.2.2)
- немедленно Нанесите мазь для глаз.
Примечание: Если все шаги были выполнены правильно, мышь не должна кровоточить на всех во время этой процедуры.
- Удаление конъюнктивы:
5. Биолюминесценция Imaging - день 0
Примечание: Все продукты, инъецированные в мышь должна быть при комнатной температуре перед инъекцией. После того, как опухолевые клетки были привиты, и в то время как животное все еще под наркозом, переходите к этим шагам для визуализации.
- Включите томографа и откройте программное обеспечение сбора данных. Инициализировать камеру, этапы и линзы, нажав на кнопку "Initialize". Инициализация займет от 10 до 15 минут, чтобы быть полным.
- Вводят 100 мкл D-люциферин калийной соли раствора внутрибрюшинно с иглой 25 G. Не вводить его внутривенно. Если intravenous введение требуется какой - либо причине, то D-люциферин натриевая соль должна использоваться вместо D-люциферин соли калия.
Примечание: Люциферин является избыток реагента при этой концентрации; Поэтому сигнал биолюминесценции достигает плато через 3 до 7 мин и сохраняется в течение более 30 мин. - 10 мин после того, как D-люциферин инъекции 13, поместите объект мышью в томографа. Поместите мышь в своем естественном положении, его спиной к камере, в качестве плоской позиции , как это возможно. Это положение является естественным и легко воспроизводимым.
- Tick функцию автоматического экспонирования, и нажмите на кнопку Acquire , чтобы получить изображение обратно (задний) животного, с функцией автоматической экспозиции.
Примечание: Функция автоматической экспозиции оптимизирует время экспозиции путем расчета его из 1-сек экспозиции изображения. Если сигнал биолюминесценции мышки является отрицательным или очень низким, оптимальное время экспозиции может бытьавтоматически устанавливается на более чем на 20 мин. В этом случае, время экспозиции от 8 до 10 минут может быть хорошим компромиссом. Время экспозиции может быть установлен вручную, но изображения не должны содержать насыщенные пиксели. - Переверните мышь , чтобы обнажить переднюю часть мыши к камере. Попробуйте придавить мышь и расправить конечности передних, так что они не блокируют грудь.
- Приобретают переднее изображение животного. Убедитесь, что флажок автоэкспозиции еще тикали и снова нажмите на кнопку "Acquire".
Примечание: Передняя изображение может быть приобретено до задней изображения и наоборот. Время экспозиции передних и задних изображений может отличаться в зависимости от относительной интенсивности каждой стороне мыши. Он рассчитывается автоматически при использовании функции автоматической экспозиции. Количественное использует только поток фотонов (фотонов в секунду) и не зависит от времени экспозиции. - Поместите курсор на разогреве Platе или под согревающим светом, пока он не выздоравливает от наркоза, а затем поместить его обратно в клетку.
6. Биолюминесценция Imaging - После того, как день 0
- Включите томографа, инициализировать камеру, этапы и линзы, как и в шаге 5.1).
- Обезболить мышь с внутрибрюшинного введения 60 мкл кетамина (120 мг / кг) / ксилазином (6 мг / кг), смесь (действия от 3,1 до 3,5).
Примечание: Этот метод позволяет обезболиванием изображений каждые 5 дней. Для выполнения ежедневной обработки изображений, способ, который использует изофлуран, как требуется обезболивающее и биолюминесценции Imager подходит для использования с этим наркозом. - Приобретать передней и задней изображения животного, с помощью функции автоэкспозиции, как на этапах 5.5) и 5.6). Ручка мыши, как на этапе 5.7).
7. Биолюминесценция Количественный и анализ изображений
Примечание: Метод luminoscore основан на analysi изображенииs. После того как изображения были получены в соответствии с приведенными выше шагами, Количественное определение может быть выполнено в любое время (в том числе и сразу после приобретения), чтобы связать luminoscore для каждой мыши в каждой временной точке.
- Отображение "палитры инструментов", щелкнув на меню "View", а затем нажмите на "Палитру", если уже не отображается. Нажмите на вкладку "ROI Tool" из палитры инструментов. Нажмите кнопку "Контур", а затем выберите "Free рисовать".
- Вручную отметьте область интереса (ROI) вокруг мыши, следуя края мыши на вид спереди. Закройте контур с правой кнопкой мыши на компьютерной мыши.
- Нажмите на меню "View", а затем "ROI измерений". Убедитесь, что "спектральной яркости (Фотоны)" выбрано в разделе "Типы измерений" меню прокрутки в нижней левой части окна «ROI измерений». Если нет, то выберите его. Затем измерьте фотон флУБ (фот / с) путем записи значения в "Total Flux [р / с]" коробка.
Примечание: Не следует использовать Radiance или любое другое устройство, которое по отношению к площади поверхности ROI. - Повторите шаги 7.2) и 7.3) для представления обратно.
- Суммировать значения потока фотонов двух полученных из вид спереди и сзади. В результате luminoscore.
- Сравните значения для каждой группы , используя соответствующий статистический тест (непараметрический двустороннего теста Манна-Уитни, к примеру) 14.
Результаты
Метод Luminoscore может служить для проверки к опухолевым клеткам инъекции
В моделях с впрыском небольшого количества опухолевых клеток или когда место инъекции не позволяет визуально контролировать инъекции, это может быть очень трудно гарантировать качество инъекции. Метод luminoscore служит быстрый и удобный инструмент для проверки качества процедуры и убедиться легко и мгновенно, что все было сделано правильно. В обеих моделях, опухоль обнаруживается еще в 10 мин после инъекции (Рис . 1А) Изображения в одиночку достаточно, чтобы убедиться, что опухолевые клетки присутствуют в правильном месте. Тем не менее, количественной оценки изображения дает представление о гетерогенности инъекции. Точка участка (рис 1B) ясно показывает разницу между животными , которые были получены (черные точки) и не воссоздалаceive (красная линия) инъекции. Интересно отметить, что сигнал, полученный в модели SCL в 100 раз выше, чем в модели Пиол; Этот результат согласуется с числом клеток вводят внутривенно (5 х 10 6 и 1 × 10 4 клеток, соответственно).
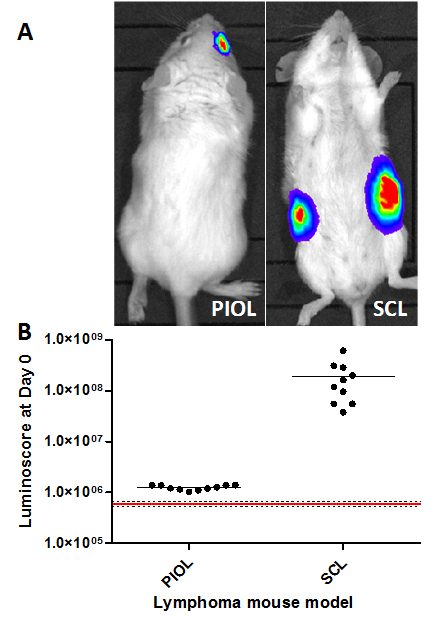
Рисунок 1. Проверка инъекций в различных моделях лимфомы мыши. В luminoscores измеряли через 10 мин инокуляции опухолевых клеток в различных моделях лимфомы. (A) репрезентативные образы обеих моделей. (B) Luminoscore каждого животного в разных моделях. Красная линия соответствует среднему фонового шума, измеренного на 10 животных до инокуляции опухолевых клеток; пунктирные линии обозначают среднее +/- стандартное отклонение. Для каждой модели, все животные, можно отличить от фонового шума. В модели Пиол, 1 × 10 4 клеток были INOCнерегулируемом в стекловидное тело правого глаза, а в модели SCL, 5 × 10 6 клеток подкожно в каждый бок мыши. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Мониторинг Опухоль вскрышных и ответной реакции на лечение
Luminoscore также является мощным инструментом для изучения роста опухоли и эффективности лечения. Рисунок 2А показывает типичные образы мониторинга роста опухоли в контроле и CpG лечение Пиол групп. Мышей заражают 1 × 10 4 опухолевых клеток в каждой, и лечение назначали на месте в День 7. Изображения показывают , что по истечении достаточного времени (28 дней), метастазы стали появляться в контрольной группе. Хотя первичная опухоль не появлялось чувствительна к обработке, меньшеМетастазы наблюдались в CpG-обработанной группе (таблица 1). Количественный анализ бремени опухоли в каждой группе (рис 2В) показывает , что CpG замедлил развитие опухоли, производя статистически значимую разницу между обработанной и контрольной группы после 28 дней (непараметрический двусторонний критерий Манна-Уитни р = 0,0079 ). Тем не менее, до сих пор опухоли росли в обработанных мышей, и ни один из них не выжила (данные не показаны). Этот вывод согласуется с предыдущими отчетами: CpG не оказывает существенного влияния на первичных опухолей глаза 10. Значительный эффект, который мы имеем здесь между ODN и группой CpG происходит от торможения роста метастазов.
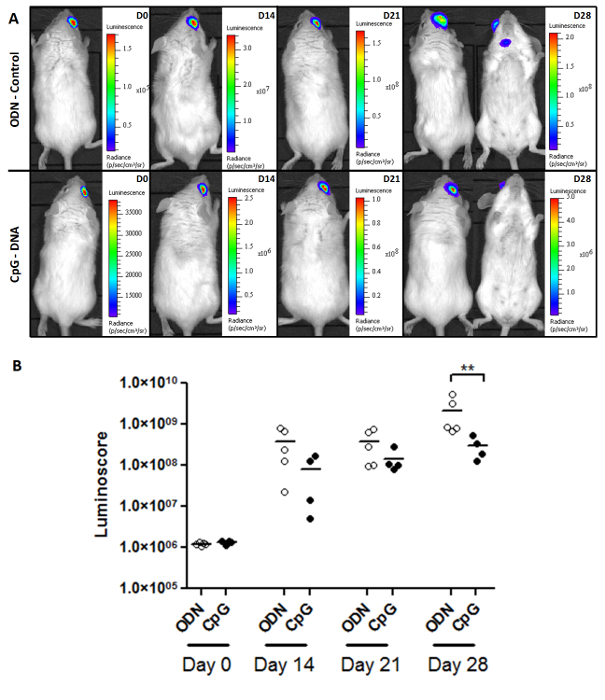
Рисунок 2. Мониторинг Опухоль вскрышных и реакции на лечение. (A) Типичные изображения двух групп (ОДН-контроль и CpG лечение) ое Пиол мышей , несущих. опухолевой (B) Мониторинг с luminoscore. Как видно на точечном участке, эффект CpG на luminoscore значительна на 28-й день в этих двух группах, этот метод позволил контролировать опухолевой массы и измерить небольшие, но существенные (р = 0,0079) эффекты CpG- ДНК, которые могли бы не были обнаружены только изображения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| групп | мышь | Наличие метастазов | Место нахождения | Фотон поток (тел / с) |
| CpG | 1 | Нет | Икс | Икс |
| 2 | да | Eye осушение узел lymp | 9.32E + 05 | |
| 3 | Нет | Икс | Икс | |
| 4 | Нет | Икс | Икс | |
| 5 | да | Eye-осушение lymp узел | 2.21E + 07 | |
| ОДН | 1 | да | Eye-осушение lymp узел | 1.06E + 07 |
| 2 | да | Eye-осушение lymp узел | 7.25E + 07 | |
| 3 | да | Eye-осушение lymp узел + контралатеральная | 7.64E + 08 | |
| 4 | да | Eye-осушение lymp узел + контралатеральная | 1.74E + 09 | |
| 5 | да | Eye-осушение lymp узел + контралатеральная | 9.76E + 07 |
Таблица 1. Tон Luminoscore метод может быть адаптирован к различным подходам
Метод luminoscore не ограничивается одним типом модели мыши. На рисунке 3 показано , что он может быть адаптирован к различным моделям мыши. В модели SCL, две опухоли прививают на каждой стороне мыши. Лечение вводят на месте с одной стороны на день 0, и контралатеральной опухоли служит в качестве контроля (фиг.3А). Таким образом, два ROI были нарисованы на мышь: по одному для каждой стороны (рис 3C). Соотношение между luminoscore на обработанных и контрольных сторон описывает относительный ход каждой опухоли. Это соотношение было установлено значение 1 в 0 день, когда лечение назначали. Мы наблюдали значительное уменьшение этого отношения через 13 дней после введения лечения (рис 3D; непараметрический двухвостый Манна-Уитни тест р = 0,004). Это снижение показывает, что обработанная на стороне опухолибыл рассасываются, как показано на репрезентативных биолюминесценции изображений (рис 3B).
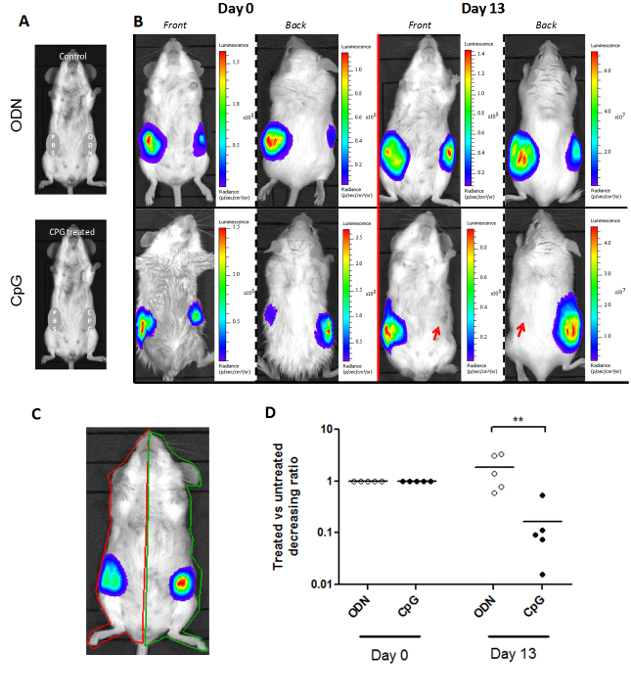
Рисунок 3. Адаптация метода Luminoscore к модели с двумя первичными опухолевыми сайтов. (А) Экспериментальный дизайн из SCL анализа. Мышам вводили два первичных опухолей в каждый бок. Одна сторона вводят либо CpG-ДНК или ОДН-контроль, а с другой стороны с PBS, чтобы служить в качестве контроля. (Б) Типичные изображения CpG-обработанных и контрольных мышей в день 0 и день 13. Лечение проводилось в день 0. рост опухоли ингибируется на CpG - обработанной стороне мыши. (C) вручную разметить интерес областей на животное в течение двух первичных опухолевых участков. (D) отношение между luminoscores КПГ обработанных или сторона ОДН-контроль и контроль со стороны PBS представляет собой индекс,отражает относительный рост каждой опухоли в пределах того же самого животного. Это соотношение было установлено на 1 день 0. На 13 -й день, отношение CpG-обработанной группе значительно уменьшилось (р = 0,004), обнаруживая ингибирование роста опухоли путем введения на месте из CpG-ДНК. Пожалуйста , нажмите здесь , чтобы просмотреть увеличенная версия этой фигуры.
Обсуждение
Поглощение света органов и тканей остается ограничение визуализации биолюминесценции, хотя это ограничение присуще любым оптическим метода визуализации. В контексте нашего подхода, влияние анатомических структур на luminoscore, как ожидается, имеют низкую изменчивость при условии, что исследования проводятся в данной модели (местонахождения и мыши цепи), что позволяет затем сравнивать. Биолюминесценция не нужен свет возбуждения и , таким образом , более приспособлен для всего тела в естественных изображений , чем флуоресценции.
Пространственное разрешение также ограничение визуализации биолюминесценции, и точное местонахождение органа, из которого испускаются фотоны биолюминесценции остается сложной. Тем не менее, хорошее знание модели может помочь в качественном местоположении опухолевых участков. Единственный выход в этом методе биолюминесценции основе является luminoscore. Расположение не влияет на luminoscore, потому что ручной разметки региона Interesт (ROI) охватывает всю мышь. Наконец, люциферазы светлячка требует кислорода. Соответственно, биолюминесценции томография обычно занижает некротических опухоли. Опять же, хорошее знание этого аспекта модели требуется.
В этой статье мы не стремимся к оценке эффективности CpG в качестве лекарственного средства с противоопухолевой (которая уже была продемонстрирована 7,9,11) , но описать способ , позволяющий сравнение биолюминесценции наборов данных. На самом деле мы опишем метод количественного опухолевой нагрузки, предназначенный, чтобы помочь стандартизировать протокол сбора для сравнения различных анализов в разных местах в разное время, и, что не требует компьютерных расчетов. Для того, чтобы обеспечить воспроизводимость и правильность количественной оценки поток фотонов, устройство формирования изображения должен быть откалиброван с легкой ссылкой для домашних устройств или в соответствии с рекомендациями поставщика для коммерческих устройств.
Наш протокол требует особого внимания к нескольким критическим рoints: (I) Во-первых, качество анестезии мыши имеет решающее значение для получения четких изображений, особенно в тех случаях, с длительными экспозициями. (II) Блок Количественное должен быть всегда поток фотонов, так как светимость зависит от площади поверхности каждой мыши и могут быть ненужными для сравнения разных мышей. (III) биолюминесценции изображения не должны содержать насыщенные пиксели, потому что они будут смещения в luminoscore. (IV) задней и передней приобретение должны собирать все фотоны , испускаемые из участка опухоли (то есть, передний приобретение не обязательно может обнаружить фотоны от задней части опухоли). Различные различные ROI чертежи были проверены в ходе разработки метода luminoscore. Только ручной разметки Удовлетворительные результаты получены, более вероятно, будут статистически значимыми (данные не показаны).
Inoue и др. рекомендовать люциферин дозе 75 мг / кг 13. При использовании в дозе 150 мг / кг вместо того, чтобы, выбор времени визуализации после того, какАдминистрация люциферин остается неизменным, и мы гарантируем, что плато длится на протяжении длительного приобретения экспозиции. Люциферин должен быть избыток реагента на протяжении всего процесса приобретения. В зависимости от модели, область интереса может быть адаптирована, как мы показали в модели SCL , где мы нарисовали два ROI на одно животное. В SCL модели, лечение вводится , когда опухоль достигает 0,5 см в наибольшего диаметра , чтобы ограничить изменчивость приживления. В зависимости от мышей, опухоль, возможно, выросли по-разному. Для стандартизации и сравнить мышей, мы решили использовать соотношение между обработанной и необработанной стороне, который показывает относительный рост обоих флангах опухолей.
Если сигнал не наблюдается из нагнетаемого мыши, как ожидается, будет положительным, либо (I) количество клеток, очень низкий и сигнал ниже порога обнаружения; или (II) мыши не хватает кислорода и требует немедленной помощи.
Некоторые из количественных bioluminescENCE анализов , описанных различными авторами требуют сложных расчетов и инструментов (например, 3D биолюминесценции томография) , чтобы приблизиться к абсолютной количественной оценки излучаемых фотонов биолюминесценции 5,15. Там нет консенсуса по методу количественного биолюминесценции воспроизводимо, особенно в опухолевых моделях, с 2D биолюминесценции томографа. Наша цель состояла в том, чтобы стандартизировать протокол получения изображений, чтобы ограничить пользователя зависимость.
Нагнетание CpG на месте после прививки опухоли снижается опухолевой массы в обеих моделях. Метод luminoscore может служить в качестве инструмента для мониторинга опухолевой в других моделях опухолей иммунотерапии. Мониторинг опухолевой обеспечивает неинвазивный метод, который может улучшить наше понимание роста опухоли и механизмов метастазирования, не мешая микросреды опухоли. Идентификация животных, которые делают и не поддаются лечению с помощью этого метода усиливается за счет проверки синъекции uccessful опухолевых клеток в начале эксперимента.
Мы здесь показали адаптируемость метода luminoscore в модели SCL, используя A20.IIA-luc2 клеток. Тем не менее, этот метод может быть адаптирован к любой другой модели опухоли с использованием других клеточных линий при условии , что они выражают люциферазы, или в контексте исследований Т-клеток (опухоль специфических цитотоксических Т-клеток, регуляторных Т-клеток и т.д.). Мониторинг естественных условиях переноса генов в в контексте генной терапии редкого заболевания также может быть сделано с помощью метода luminoscore.
Наконец, данные показывают, что биолюминесценции на основе метода luminoscore позволяет сравнивать между экспериментами, обеспечивает гибкость и адаптируемость к конкретным экспериментальным потребностям, и является полезным инструментом для неинвазивных продольных доклинических исследований.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы благодарим животных объектов научно - исследовательского центра кордельеров (CEF, Париж, Франция), Genethon (Эври, Франция) и Генополис (CERFE, Эври, Франция). Мы благодарим Джо Энн Кану за ее внимательного прочтения рукописи. Это исследование было поддержано Национальным институтом де ла Санте Et де ла Rechercher MEDICALE, Париж Декарт университета Пьера и Марии Кюри, Ассоциация пур ля Recherche Contre ле Рак, тунисское направление женераль де ла Научных Исследований, франко-тунисское КМУУ проект, а действия Thématiques Incitatives де Генополис (ATIGE) фондов. JC был поддержан Frontiers в Life Science докторской школе и в общении с INCA (Национальный институт рака дю). РБА был получателем грантов от DGRS-INSERM и КМУУ. SD получил грант от Национального Института Рака дю.
Материалы
| Name | Company | Catalog Number | Comments |
| CpG 1826 | Invivogen | Sequence: 5_-TCCATGACGTTCCTGACGTT Catalog number: tlrl-1826 | |
| ODN 1826 control | Invivogen | Sequence: 5_-TCCATGAGCTTCCTGAGCTT Catalog number: tlrl-1826c | |
| D-luciferin potassium salt | Interchim | Catalog number: FP-M1224D | |
| Ketamin | Virbac, France | ||
| Xylazin | Bayer Healthcare | Rompun 2% | |
| A20.IIA-luc2 cell line | A20.IIA transfected with pGL4.50[luc2/CMV/hygro]7 (Promega E1310) | ||
| Mice | Balb/cByj | Six-weeks old females from Charles River | |
| IVIS lumina Biolumienscence imager | Perkin Elmer | ||
| Living Image software | Perkin Elmer | Used for measuring photon flux on images and drawing ROIs | |
| R software (opensource) | R-project | Used for statistic tests | |
| Hamilton Precision Serynge 10 µl | Hamilton | Product number 7642-01100 | |
| Eye ointment | Lacrinorm | ||
| Dissecting microscope | ZEISS | Stemi 305 |
Ссылки
- Rehemtulla, A., et al. Rapid and Quantitative Assessment of Cancer Treatment Response Using In Vivo Bioluminescence Imaging. Neoplasia. 2 (6), 491-495 (2000).
- Edinger, M., et al. Advancing animal models of neoplasia through in vivo bioluminescence imaging. European Journal of Cancer. 38 (16), 2128-2136 (2002).
- Hastings, J. W., Gibson, Q. H. The Role of Oxygen in the Photoexcited Luminescence of Bacterial Luciferase. Journal of Biological Chemistry. 242 (4), 720-726 (1967).
- Inouye, S., Shimomura, O. The Use of Renilla Luciferase, Oplophorus Luciferase, and Apoaequorin as Bioluminescent Reporter Protein in the Presence of Coelenterazine Analogues as Substrate. Biochemical and Biophysical Research Communications. 233 (2), 349-353 (1997).
- Pesnel, S., et al. Quantitation in Bioluminescence Imaging by Correction of Tissue Absorption for Experimental Oncology. Molecular Imaging and Biology. 13 (4), 646-652 (2010).
- Corre, G., et al. Stochastic Fluctuations and Distributed Control of Gene Expression Impact Cellular Memory. PLoS ONE. 9 (12), (2014).
- Ben Abdelwahed, R., et al. Lymphoma B-cell responsiveness to CpG-DNA depends on the tumor microenvironment. Journal of Experimental & Clinical Cancer Research CR. 32 (1), 18 (2013).
- Abdelwahed, R. B., et al. Preclinical Study of Ublituximab, a Glycoengineered Anti-Human CD20 Antibody, in Murine Models of Primary Cerebral and Intraocular B-Cell Lymphomas. Investigative Ophthalmology & Visual Science. 54 (5), 3657-3665 (2013).
- Donnou, S., Galand, C., Touitou, V., Sautès-Fridman, C., Fabry, Z., Fisson, S. Murine Models of B-Cell Lymphomas: Promising Tools for Designing Cancer Therapies. Advances in Hematology. 2012, (2012).
- Qi, X. -. F., et al. CpG oligodeoxynucleotide induces apoptosis and cell cycle arrest in A20 lymphoma cells via TLR9-mediated pathways. Molecular Immunology. 54 (3-4), 327-337 (2013).
- Houot, R., Levy, R. T-cell modulation combined with intratumoral CpG cures lymphoma in a mouse model without the need for chemotherapy. Blood. 113 (15), 3546-3552 (2009).
- Krieg, A. M. Toll-like receptor 9 (TLR9) agonists in the treatment of cancer. Oncogene. 27 (2), 161-167 (2008).
- Inoue, Y., Kiryu, S., Watanabe, M., Tojo, A., Ohtomo, K. Timing of Imaging after D-Luciferin Injection Affects the Longitudinal Assessment of Tumor Growth Using In Vivo Bioluminescence Imaging. International Journal of Biomedical Imaging. 2010, (2010).
- Mann, H. B., Whitney, D. R. On a Test of Whether one of Two Random Variables is Stochastically Larger than the Other. Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Darne, C., Lu, Y., Sevick-Muraca, E. M. Small animal fluorescence and bioluminescence tomography: a review of approaches, algorithms and technology update. Physics in Medicine and Biology. 59 (1), 1 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены