Method Article
Método Tumor Quantificação Baseada em bioluminescência para a progressão do tumor Monitoramento e efeitos do tratamento em modelos de ratos linfoma
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
imagem de bioluminescência é uma ferramenta bem conhecida para localizar tumores e metástases, mas a quantificação dessas imagens muitas vezes requer cálculos complexos e instrumentos particulares. Nós descrevemos o método luminoscore de usar fácil, com base nas condições de aquisição precisas, sem necessidade de cálculos, e permitindo que a carga tumoral e resposta ao tratamento a ser monitorado em modelos do rato.
Resumo
Although bioluminescence imaging (BLI) shows promise for monitoring tumor burden in animal models of cancer, these analyses remain mostly qualitative. Here we describe a method for bioluminescence imaging to obtain a semi-quantitative analysis of tumor burden and treatment response. This method is based on the calculation of a luminoscore, a value that allows comparisons of two animals from the same or different experiments. Current BLI instruments enable the calculation of this luminoscore, which relies mainly on the acquisition conditions (back and front acquisitions) and the drawing of the region of interest (manual markup around the mouse). Using two previously described mouse lymphoma models based on cell engraftment, we show that the luminoscore method can serve as a noninvasive way to verify successful tumor cell inoculation, monitor tumor burden, and evaluate the effects of in situ cancer treatment (CpG-DNA). Finally, we show that this method suits different experimental designs. We suggest that this method be used for early estimates of treatment response in preclinical small-animal studies.
Introdução
A detecção precoce de células de tumor permanece um desafio e é essencial para melhorar a eficácia do tratamento do cancro. In vivo imagem de bioluminescência (BLI) é, uma técnica não-invasiva óptica muito sensível, amplamente utilizado para monitorizar tumores em animais de pequeno porte. As células que expressam a luciferase do pirilampo são vulgarmente utilizados para tais experiências 1,2. Este oxigenase oxida D-luciferina com oxigénio molecular, mas requer dois cofatores - Mg 2+ e trifosfato de adenosina 3. Firefly luciferase é mais adequado para imagiologia in vivo do que a luciferase da Renilla 4 porque o seu rendimento quântico é maior.
O substrato oxidado - oxiluciferina - emite um fóton espontaneamente para retornar ao seu estado fundamental e, em seguida, torna-se inativo. Os fótons emitidos têm um comprimento de onda máximo de cerca de 530 nm. Uma câmara de alta sensibilidade podem detectar os fotões luminescentes a partir do interior de um animal pequeno e proporcionar imagens que tornam POSSvel para localizar células tumorais.
A capacidade para quantificar a carga tumoral com precisão pela contagem de fotões pode servir como uma ferramenta poderosa e sensível para a quantificação da eficácia do tratamento. Porque os efeitos do tratamento pode ser detectado mais cedo, esta sensibilidade pode torná-lo possível determinar o momento exato em que um tratamento torna-se eficaz.
quantificação absoluta do total de fótons emitidos é muito complexa. O número de fotões recolhidos depende da profundidade do tumor e nos órgãos os fotões são emitidos através. Os coeficientes de correcção com base em coeficientes de absorção de tecido pode ser calculado 5, mas a quantificação absoluta do número de células tumorais requer conhecer o número de fotões emitidos por cada célula tumoral. Além disso, a expressão de luciferase, como a de muitos genes repórter (por ex., Proteínas fluorescentes) não é homogéneo, mesmo em uma população de células derivadas a partir de um único clone 6. O número de luciferproteínas ase em células não pode ser calculado com exatidão. O estabelecimento de condições experimentais padronizadas aparece, assim, crucial para uma análise semi-quantitativa confiável.
Nós aplicamos o método luminoscore a dois modelos diferentes de linfoma do rato 7,8,9. Nestes modelos, as células tumorais singeneicas são injectados para dentro do olho ou sob a pele para se obter, respectivamente modelo, um modelo de linfoma primário intra-ocular (Piol) e um linfoma subcutânea (SCL). Em cada um destes modelos ortotópicos, o tratamento é administrado in situ, sete dias após a inoculação do tumor para Piol e quando o tumor atingiu 0,5 a 0,7 cm no seu maior diâmetro para SCL.
Foi utilizado o método luminoscore para monitorar os efeitos da terapia em CpG situ, mostrado previamente para ser eficaz 7,10,11. CpG é uma sequência de oligonucleótidos e um ligando de TLR9, que por sua vez é um receptor intracelular expressos por numerosas cells do sistema imune, incluindo as células dendríticas, linfócitos B, monócitos, e células assassinas naturais. CpG-ADN é uma sequência de ADN de 20-mer que contém o CpG (CG) motivo imunoestimulante; o controlo (ODN-controlo) é a mesma sequência de ADN de 20-mer, excepto que a sequência CG imunoestimulante é invertido (GC). Acoplamento TLR9 no linfoma murino que estão a estudar induz a apoptose 10, activa o sistema imunitário 12, e, assim, reduz significativamente a carga do tumor 7,11.
Aqui nós descrevemos um método padronizado para quantificar a carga tumoral e resposta ao tratamento por meio de imagens bioluminescentes. Este método baseia-se em diferentes aspectos do procedimento de imagem, desde a aquisição à análise, para otimizar a confiabilidade, reprodutibilidade, a dependência não-usuário, e significância estatística. Um índice de bioluminescência quantificação é atribuído a cada rato; este valor, que nós chamamos uma luminoscore, pode ser comparado não apenas entre animais, mas alassim entre os experimentos.
Neste trabalho, vamos nos concentrar no procedimento de imagem de bioluminescência, bem como a quantificação imagem pelo método luminoscore. Mostramos a eficácia deste método para verificar a injeção, monitorando a carga tumoral, e avaliar a eficácia de no tratamento do câncer situ. Cada um destes pontos é ilustrado nos resultados representativos das experiências utilizando diferentes modelos de ratinho para realçar a capacidade de adaptação do método luminoscore.
Protocolo
Todos os procedimentos envolvendo ratos cumpridas as orientações da União Europeia, a regulamentação francesa na experimentação animal (Ministério da Agricultura Lei n.º 2001-464, de Maio de 2001), e as diretrizes do National la Santé et de la Médicale (INSERM) Comissão do Institut de Recherche sobre Pesquisa animal, e foram aprovados pelo comitê local relevante (Comitê de Ética Darwin a Charles para Experimentação animal, Paris, França; número de autorização: P3 / 2009/004).
1. Preparação de células
- Cresça B de ratinho linha celular de linfoma A20.IIA-luc2 em meio RPMI-1640 suplementado com Glutamax soro fetal de vitelo 10%, 100 ug / ml de penicilina, 100 ug / ml de estreptomicina, piruvato de sódio 10 mM, 50 uM de 2-mercaptoetanol, e 0,50 mg / ml de higromicina B.
- Manter a cultura de células a 37 ° C, 5% de CO 2 e mudança de meio todos os dois a três dias. Colheita 5 ml da suspensão de células com uma pipeta de um dia após a mudança do meio.
- células giram em 3005; g durante 10 min e suspender as células em 3 ml de solução salina estéril tamponada com fosfato (PBS). Repetir este passo duas vezes para lavar as células.
- Misturar 15 ul de suspensão celular com 30 ul de Azul de Tripano antes de carregar rotulagem uma câmara de contagem de Malassez. Calcula-se a concentração de células com a fórmula: Concentração (células / mL) = número de células na grade de contagem * 3 * 1.000.
- Girar a células mais uma vez a 300 xg durante 10 min. Remover o sobrenadante com uma pipeta. Com C a concentração calculada no passo 1.4), o número de células é N = C * 3.
- Calcular o volume de PBS estéril 1x necessária para obter uma suspensão de células numa concentração de 5 x 10 7 células / mL com a seguinte fórmula: PBS Volume (ml) = N / (5 x 10 7). Suspende-se o sedimento de células (do passo 1.5)) no volume de PBS estéril 1x calculada na frase anterior. A suspensão celular é para ser usado no modelo SCL (in vivo volume injectado é 100 ul: 5 x 10 6 célulass).
- Pipetar 10 ul de suspensão de células A e adicionar 90 ul de PBS estéril num tubo de 1,5 ml para se obter 100 ul de suspensão de célula B a 5 x 10 6 culas por ml. A suspensão de células B é para ser usado no modelo Piol (in vivo volume injectado é de 2 ul: 1 x 10 4 células).
2. Luciferin
- Dilui-se 1 g de pó de sal de potássio de D-luciferina em 30 ml de PBS estéril 1x num tubo de 50 ml e agita-se durante alguns segundos para dissolver os agregados.
NOTA: Devido a luciferina é sensível à luz, preparar 500 mL alíquotas na obscuridade 1,5 ml microtubos. - Armazenar as alíquotas a -20 ° C.
NOTA: As aliquotas podem ser armazenados durante vários meses.
Após o descongelamento, as alíquotas não deve ser armazenada por mais de 1 dia a + 4 ° C. ciclos de congelação-descongelação são preferidos para armazenamento a 4 ° C. - Injectar 100 ul de solução de sal de potássio de D-luciferina intraperitonealmente para cada ASSA imagiologiay.
NOTA: Esta solução corresponde a 3,3 mg por rato para uma dose de 150 mg / kg.
3. mistura de anestésicos e anestesia
- Prepara-se uma solução de anestésico por mistura de cetamina 120 mg / kg de xilazina e 6 mg / kg em 1 x PBS estéril.
- Injectar 60 ul de mistura de anestésicos por via intraperitoneal para cada ensaio de imagem com uma agulha 25 G. Para a cirurgia (com a Piol ou modelo SCL), 80 ul de injectar a mistura para se obter uma anestesia profunda. Coloque o mouse de volta em sua gaiola.
- Quando o rato aparece imóvel, removê-lo da sua gaiola e aperte suavemente a perna do rato entre os dedos. Se o rato reage com um reflexo de fuga, aguarde alguns minutos. Repita o procedimento até que o mouse não reagir, o que confirma anesthetization satisfatório.
- Posicione o mouse sobre uma placa de aquecimento ou sob uma luz de aquecimento.
- Aplicar pomada para evitar a secura ocular durante a anestesia para o ensaio de imagem ou para a cirurgia SCL. Aplique opomada após a cirurgia para o modelo Piol.
4. Cirurgia e inoculação de células
Observação: executar todos os procedimentos cirúrgicos em uma placa de aquecimento ou sob uma luz de aquecimento, em um tipo de cabine de segurança 1 microbiológico em um 2 instalação de nível animal biossegurança. Todos os instrumentos cirúrgicos utilizados nesta seção foram autoclavados antes do uso.
- Subcutânea linfoma Modelo:
- Preparação de 100 ul da suspensão de células obtida na etapa 1.6 em uma seringa de 1 ml com uma agulha G 25. Espremer suavemente a pele do rato, no flanco entre os dedos, no local da injecção. Inserir a agulha exatamente na dobra da pele. Para assegurar a injecção subcutânea, não coloque a agulha profundamente no tecido.
- Injetar as células no dobras cutâneas. Observe se uma pequena bola líquido aparece sob a pele para confirmar que a injeção foi realizada corretamente.
- Preparação de 100 ul da suspensão de células obtida na etapa 1.6 em uma seringa de 1 ml com uma agulha G 25. Espremer suavemente a pele do rato, no flanco entre os dedos, no local da injecção. Inserir a agulha exatamente na dobra da pele. Para assegurar a injecção subcutânea, não coloque a agulha profundamente no tecido.
- Modelo Piol:
NOTA: Este procedure requer 2 operadores, referidas aqui como operador de 1 e 2 do operador.- A remoção da conjuntiva:
- Tem Operador 1 lugar o mouse sob um microscópio de dissecação. Pressione suavemente com os dedos em cada lado do olho para limpá-la. Manter esta posição.
- Tem Operador 2 l ook através do microscópio de dissecação. Aderência da conjuntiva com um pequeno par de alicates em um lado; com a outra mão, cortar a conjuntiva logo abaixo dos alicates com um pequeno par de tesouras cirúrgicas.
- Tem Operador 1 liberação olho do mouse pressionado no passo 4.2.1.1)
- injeção de células:
- Prepare a 10 mL de seringa sem corte de precisão. Lavá-lo através do bombeamento de água deionizada estéril através dele. Repita duas ou três vezes para garantir que não haja bolhas na seringa. Em seguida, preparar 2 ul de suspensão de células para injecção.
- Tem Operador 2 pressione suavemente com os dedos de one mão de cada lado do olho para limpá-la. Manter esta posição.
- Tem Operador 1 prender a borda do olho com um pequeno par de alicates em uma mão e puxe-o delicadamente para trás para esticar o tecido.
- Tem Operador 2 l ook através do microscópio de dissecação. Com a outra mão, faça um pequeno furo no globo ocular inferior do rato com uma agulha 32 G.
- Tem Operador 2 colocar a agulha e pegar (com a mesma mão) da seringa de precisão e inserir a agulha no buraco feito no passo 4.2.2.4.
- Tem Operador 1 empurrar o êmbolo da seringa com a outra mão.
- Tem Operador 2 v ERIFIQUE com o microscópio de dissecação que a suspensão de células na seringa foi injectada correctamente no interior do globo ocular (o fluxo de líquido é facilmente observável).
- Tem Operador 2 r emove a seringa de precisão.
- Possui um operador R elease a borda do umimal olho agarrou no passo 4.2.2.3)
- Tem Operador 2 R elease os lados do olho pressionado no passo 4.2.2.2)
- Aplicar a pomada imediatamente.
NOTA: Se todos os passos foram realizados corretamente, o mouse não deve sangrar durante todo este procedimento.
- A remoção da conjuntiva:
5. A bioluminescência Imaging - Dia 0
NOTA: Todos os produtos injetados no rato deve estar à temperatura ambiente antes da injecção. Depois de o tumor células foram inoculadas, e enquanto o animal é anestesiado ainda, prosseguir para estes passos para a criação de imagens.
- Ligue o gerador de imagens e abra o software de aquisição. Inicialize a câmara, os estágios, e as lentes, clicando no botão "Inicializar". A inicialização levará de 10 a 15 minutos para ser concluída.
- Injectar 100 ul de solução de sal de potássio de D-luciferina por via intraperitoneal com uma agulha 25 G. Não administrar por via intravenosa. Se intravenous administração é necessário por qualquer razão, o sal de sódio D-luciferina deve ser usado em vez de sal de potássio de D-luciferina.
NOTA: luciferina é o excesso de reagente a esta concentração; Por conseguinte, o sinal de bioluminescência atinge um patamar após 3 a 7 min e persiste por mais de 30 min. - 10 min após a injeção de D-luciferina 13, coloque o mouse assunto no imager. Posicione o mouse na sua posição natural, de costas para a câmera, em uma posição o mais plano possível. Esta posição é natural e facilmente reprodutível.
- Assinale o recurso de auto-exposição, e clique em Acquire para adquirir a imagem de volta (posterior) do animal, com o recurso de auto-exposição.
NOTA: O recurso de auto-exposição otimiza o tempo de exposição, calculando-lo a partir da imagem de exposição a 1-seg. Se o sinal de bioluminescência do rato é negativo ou muito baixa, o tempo de exposição ideal pode serautomaticamente ajustado para mais de 20 min. Neste caso, um tempo de exposição de 8 a 10 minutos pode ser um bom compromisso. Tempo de exposição pode ser ajustada manualmente, mas as imagens não devem conter pixels saturadas. - Vire o mouse para expor a frente do mouse para a câmera. Tente para achatar o rato e espalhou os seus membros anteriores para que eles não bloqueiam o peito.
- Adquirir uma imagem frontal do animal. Verifique se a caixa de auto-exposição ainda está marcada e clique novamente no botão "Acquire".
NOTA: A imagem frontal pode ser adquirido antes de a imagem para trás e vice-versa. O tempo de exposição de imagens da parte dianteira e da parte traseira podem ser diferentes, dependendo da intensidade relativa de cada um dos lados do rato. Ele é calculado automaticamente quando usando o recurso de auto-exposição. Quantificação utiliza apenas o fluxo de fótons (fótons por segundo) e não depende do tempo de exposição. - Posicione o mouse em um plat aquecimentoE ou sob uma luz de aquecimento até que ele se recupera da anestesia e, em seguida, colocá-lo de volta em sua gaiola.
6. A bioluminescência Imaging - Depois do Dia 0
- Ligue o gerador de imagens, inicializar a câmera, os estágios, e as lentes como no passo 5.1).
- Anestesiar o rato com uma injecção intraperitoneal de 60 uL da mistura de cetamina (120 mg / kg) / xilazina (6 mg / kg) (ver passos 3.1 a 3.5).
NOTA: Este método de anestesia permite imagens a cada 5 dias. Para realizar imagem diária, um método que utiliza isoflurano como é exigido o anestésico e um gerador de imagens bioluminescência apropriado para uso com este anestésico. - Adquirir imagens dianteiras e traseiras do animal, usando o recurso de auto-exposição, como nos passos 5.5) e 5.6). Lidar com o mouse como no passo 5.7).
7. A bioluminescência Quantificação e Análise de Imagem
NOTA: O método luminoscore é baseado em analysi imagems. Uma vez que as imagens tenham sido obtidas de acordo com os passos acima, a quantificação pode ser realizada em qualquer momento (incluindo imediatamente após a aquisição), para associar um luminoscore para cada rato em cada ponto de tempo.
- Mostrar a "Paleta", clicando no menu "View" e, em seguida, clique em "Paleta" se já não estiver exibido. Clique na aba "ROI de ferramentas" da paleta de ferramentas. Escolha o botão "Contorno" e selecione "draw Livre".
- Marcar manualmente a região de interesse (ROI) em torno do rato, seguindo as bordas do mouse sobre a vista frontal. Feche o contorno com um clique direito no mouse do computador.
- Clique no menu "View" e depois "Medidas de ROI". Certifique-se de "Radiance (fótons)" é selecionado em "Tipos de Medição" menu de rolagem no canto inferior esquerdo da janela "Medições de ROI". Se não, selecione-o. Em seguida, medir a fl photonUX (ph / s), gravando o valor no "Total Flux [s p /]" caixa.
NOTA: Não use Radiance ou qualquer outra unidade que é relativo à área de superfície do ROI. - Repita os passos 7.2) e 7.3) para a vista de volta.
- Somar os valores de fluxo de dois fótons obtidos a partir de vista dianteira e traseira. O resultado é o luminoscore.
- Comparar os valores para cada grupo utilizando um teste estatístico apropriado (não-paramétrico bicaudal teste de Mann-Whitney, por exemplo) 14.
Resultados
O Método Luminoscore pode servir para Verifique se a injecção do tumor celular
Em modelos que envolvem a injecção de um pequeno número de células de tumor ou em que o local da injecção não permitir a verificação visual da injecção, pode ser muito difícil assegurar a qualidade da injecção. O método luminoscore serve como uma ferramenta rápida e conveniente para verificar a qualidade do processo e verificar facilmente e instantaneamente que tudo correu bem. Em ambos os modelos, o tumor é detectável tão cedo como 10 min após a injecção (Figura 1A). As imagens por si só suficiente para verificar que as células tumorais estão presentes no local correto. No entanto, quantificar as imagens fornece uma ideia da heterogeneidade da injeção. O gráfico de pontos (Figura 1B) mostra claramente a diferença entre os animais que receberam (pontos pretos) e não receber (linha vermelha) injeções. Curiosamente, o sinal obtido no modelo SCL é 100 vezes mais elevada do que no modelo Piol; este resultado é consistente com o número de células injectadas (5 x 10 6 e 1 x 10 4 células, respectivamente).
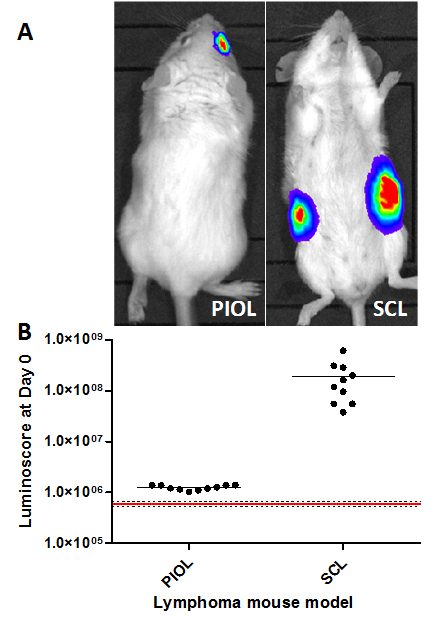
Figura 1. Verificação de injeção em diferentes modelos do rato do linfoma. Os luminoscores medidos 10 min após a inoculação de células tumorais em modelos de linfoma diferentes. (A) Imagens representativas de ambos os modelos. (B) Luminoscore de cada animal nos diferentes modelos. A linha vermelha corresponde à média do ruído de fundo medido em 10 animais antes da inoculação das células tumorais; as linhas a tracejado são o desvio médio padrão +/-. Para cada modelo, todos os animais podem ser distinguidas a partir de ruído de fundo. No modelo Piol, 1 x 10 4 células foram INOCpovoadas no vítreo do olho direito, e no modelo de SCL, 5 x 10 6 células subcutaneamente em cada flanco do mouse. Por favor clique aqui para ver uma versão maior desta figura.
Monitorando a carga tumoral e resposta ao tratamento
O luminoscore é também uma ferramenta poderosa para estudar o crescimento do tumor e eficácia do tratamento. A Figura 2A mostra imagens representativas da monitorização do crescimento do tumor no controle eo CpG grupos tratados com Piol. Os ratinhos foram inoculados com 1 x 10 4 células tumorais cada, e o tratamento foi administrado in situ no dia 7. As imagens mostram que, após um tempo suficiente (28 dias), começaram a aparecer metástases no grupo de controlo. Embora o tumor primário não pareceu sensível ao tratamento, menosAs metástases foram observados no grupo tratado com CpG (Tabela 1). A análise quantitativa da carga do tumor em cada grupo (Figura 2B) mostra que CpG retardou o desenvolvimento do tumor, produzindo uma diferença estatisticamente significativa entre o grupo de controlo após 28 dias (não-paramétrico bicaudal teste de Mann-Whitney p = 0,0079 tratada e ). No entanto, os tumores cresceram ainda nos murganhos tratados, e nenhum deles sobreviveram (dados não mostrados). Este resultado é consistente com relatórios anteriores: CpG não tem efeitos significativos sobre tumores oculares primários 10. O efeito significativo de que temos aqui entre o ODN de CpG e o grupo vem da inibição do crescimento de metástases.
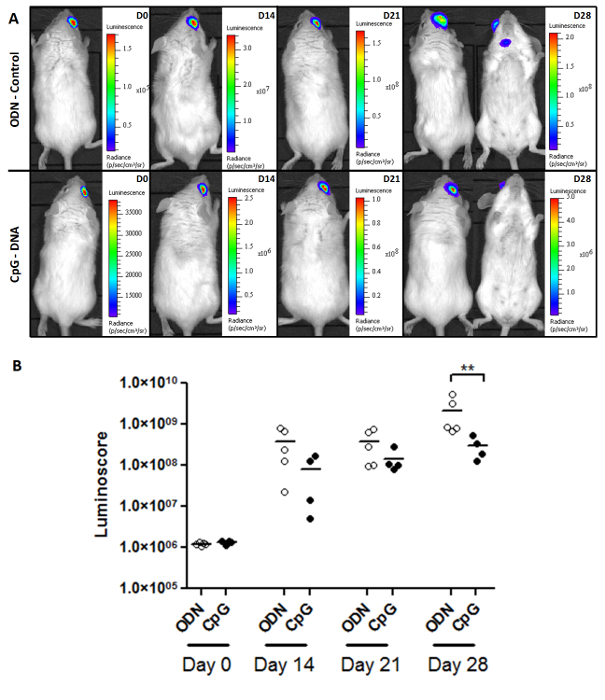
Figura 2. Monitorização carga tumoral e resposta ao tratamento. (A) Imagens representativas de os dois grupos (ODN-controlo e tratados com CpG) Ocamundongos f Piol-rolamento. carga tumoral (B) Monitorização com o luminoscore. Como visto no gráfico de pontos, o efeito de CpG na luminoscore é significativa no dia 28. Nestas dois grupos, este método, foi possível controlar a carga tumoral e para medir os (p = 0,0079), mas ligeiros efeitos significativos de CpG- DNA, que não poderia ter sido detectada por imagens por si só. por favor clique aqui para ver uma versão maior desta figura.
| grupos | Rato | A presença de metástases | Localização | Fluxo de fótons (pH / s) |
| CpG | 1 | Não | X | X |
| 2 | sim | Nó lymp-drenagem dos olhos | 9.32E + 05 | |
| 3 | Não | X | X | |
| 4 | Não | X | X | |
| 5 | sim | Eye-drenagem nó lymp | 2.21E + 07 | |
| ODN | 1 | sim | Eye-drenagem nó lymp | 1.06E + 07 |
| 2 | sim | Eye-drenagem nó lymp | 7.25E + 07 | |
| 3 | sim | Eye-drenagem nó lymp + contralateral | 7.64E + 08 | |
| 4 | sim | Eye-drenagem nó lymp + contralateral | 1.74E + 09 | |
| 5 | sim | Eye-drenagem nó lymp + contralateral | 9.76E + 07 |
Tabela 1. tele Método Luminoscore pode ser adaptado a diferentes abordagens
O método luminoscore não está limitado a um único tipo de modelo de rato. A Figura 3 mostra que ele pode ser adaptado a diferentes modelos de ratos. No modelo SCL, dois tumores são enxertados em cada um dos lados do rato. O tratamento é administrado in situ para um único lado no dia 0, e o tumor contralateral serve como o seu controlo (Figura 3A). Portanto, foram desenhados dois ROI por ratinho: um para cada lado (Figura 3C). A relação entre o luminoscore nos lados tratados e de controlo descreve o curso relativo de cada tumor. Esta proporção foi ajustada para 1 no dia 0, quando o tratamento foi administrado. Observou-se uma diminuição significativa nesta proporção de 13 dias após a administração do tratamento (Figura 3D; não-paramétrico de duas caudas de Mann-Whitney p = 0,004). Esta diminuição revela que o tumor do lado tratadafoi reabsorvida, como mostrado nas imagens representativas de bioluminescência (Figura 3B).
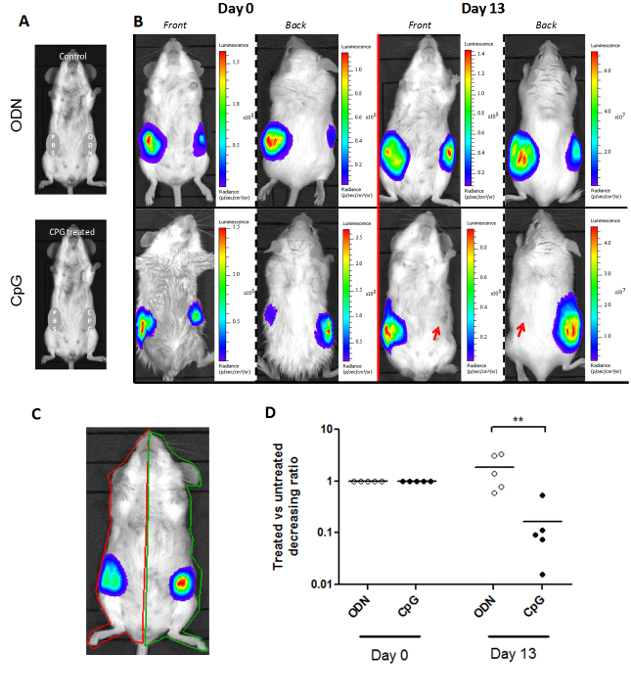
Figura 3. Adaptação do método Luminoscore a um modelo com dois Sites tumor primário. (A) O delineamento experimental de um ensaio SCL. Os ratinhos foram injectados com dois tumores primários em cada flanco. Um lado é injectados com CpG-ADN ou ODN-controlo, e o outro lado com PBS, para servir como o seu controlo. (B) Imagens representativas de murganhos tratados com CpG e de controlo no dia 0 e no dia 13. O tratamento foi administrado no dia 0. o crescimento tumoral foi inibido no lado tratado com CpG do rato. (C) a marcado manualmente-se regiões de interesse por animal para dois locais do tumor primário. (D) a razão entre os luminoscores do CpG-tratados ou lado ODN-controle e no lado de controle PBS é um índice quereflecte o crescimento relativo de cada tumor dentro do mesmo animal. Esta proporção foi ajustada para 1 no dia 0. No dia 13, a razão entre o grupo tratado com CpG tinha diminuído significativamente (p = 0,004), revelando a inibição do crescimento do tumor por administração in situ de CpG ADN. Por favor clique aqui para visualizar uma versão maior desta figura.
Discussão
A absorção da luz por órgãos e tecidos permanece uma limitação de imagem de bioluminescência, embora esta limitação é intrínseco a qualquer modalidade de imagem óptica. No âmbito da nossa abordagem, espera-se que os efeitos de estruturas anatómicas no luminoscore ter baixa variabilidade, desde que os estudos são realizados num determinado modelo (localização e Strand rato), permitindo, em seguida, as comparações. A bioluminescência não precisa de luz de excitação e, portanto, é mais adaptada ao corpo inteiro in vivo de imagens de fluorescência.
A resolução espacial é também uma limitação de imagem de bioluminescência e localização precisa do órgão a partir do qual são emitidos fotões bioluminescência continua a ser difícil. No entanto, um bom conhecimento do modelo pode ajudar na localização qualitativa dos locais tumorais. A única saída no presente método à base de bioluminescência é o luminoscore. Localização não influencia a luminoscore porque o mark-up Região Manual de Interest (ROI) cobre todo o mouse. Finalmente, firefly luciferase requer oxigênio. Assim, imagem de bioluminescência normalmente subestima tumores necrosados. Mais uma vez, um bom conhecimento deste aspecto do modelo é necessária.
Neste trabalho, não estamos com o objetivo de avaliar a eficácia de CpG como uma droga anti-tumor (que já foi demonstrado 7,9,11), mas para descrever um método permitindo a comparação de conjuntos de dados de bioluminescência. Nós, de facto descrever um método para quantificar a carga tumoral destina-se a ajudar a padronizar o protocolo de aquisição para a comparação de diferentes ensaios em locais diferentes em momentos diferentes e que não necessita de cálculos de computador. Para garantir a reprodutibilidade e a quantificação de fluxo de fótons correcto, o dispositivo de imagem deve ser calibrado com uma luz de referência para os dispositivos caseiros ou como recomendado pelo fornecedor para dispositivos comerciais.
Nosso protocolo requer muita atenção a vários p críticaoints: (i) Em primeiro lugar, a qualidade da anestesia rato é crucial para a obtenção de imagens claras, especialmente nos casos com tempos de exposição longos. (Ii) A unidade de quantificação deve ser sempre ser o fluxo de fótons por radiação depende da área de superfície de cada murganho e pode ser irrelevante para a comparação de ratos diferentes. (Iii) As imagens bioluminescência não deve conter pixels saturados, porque estes distorceria o luminoscore. (iv) Voltar e aquisição de frente são obrigados a recolher todos os fótons emitidos a partir do local do tumor (ou seja, a aquisição da frente pode não necessariamente detectar fótons da parte de trás do tumor). Vários desenhos ROI diferentes foram testadas durante o desenvolvimento do método de luminoscore. Apenas o manual marca-se resultados satisfatórios, que são mais susceptíveis de ser estatisticamente significativo (dados não apresentados).
Inoue et al. recomendar uma dose luciferina de 75 mg / kg 13. Ao utilizar uma dose de 150 mg / kg em vez disso, o tempo de imagiologia após oadministração luciferina permanece inalterado e podemos garantir que o planalto dura toda uma aquisição de exposição a longo. Luciferina deve ser o excesso de reagente durante todo o processo de aquisição. Dependendo do modelo, da região de interesse pode ser adaptada, como se mostrou no modelo SCL onde se extraiu duas ROI por animal. No modelo SCL, o tratamento é injectado quando o tumor atinge 0,5 cm na sua maior diâmetro para limitar a variabilidade do enxerto. Dependendo dos murganhos, o tumor pode ter crescido de forma diferente. Para padronizar e comparar ratos, decidimos utilizar uma relação entre o lado tratado e não-tratado que revela o crescimento relativo de ambos os tumores flancos.
Se nenhum sinal for observada a partir de um ratinho injectado deverá ser positivo, ou (i) o número de células é muito baixo e o sinal está abaixo do limite de detecção; ou (ii) o mouse não tem oxigênio e exige cuidados imediatos.
Vários dos bioluminesc quantitativaAs análises cia descrita por vários autores requerem cálculos complexos e instrumentos (por exemplo, tomografia bioluminescência 3D) para abordar a quantificação absoluta de fótons emitidos bioluminescência 5,15. Não há consenso sobre um método para quantificação de bioluminescência reprodutível, especialmente em modelos de tumores, com um gerador de imagens bioluminescência 2D. Nosso objetivo foi padronizar o protocolo de aquisição de imagem para limitar user-dependência.
A injecção de CpG in situ após a inoculação do tumor reduziu a carga de tumor em ambos os modelos. O método luminoscore pode servir como uma ferramenta para monitorizar a carga tumoral em outros modelos de imunoterapia de tumor. Monitorando a carga do tumor proporciona um método não invasivo que pode melhorar a nossa compreensão dos mecanismos de crescimento tumoral e metastização, sem interferir com o microambiente do tumor. A identificação dos animais e que fazem não respondem ao tratamento com este método é reforçado pela verificação de sinjecção das células tumorais uccessful no início da experiência.
Nós aqui mostrou a adaptabilidade do método luminoscore num modelo SCL usando células A20.IIA-luc2. No entanto, este método pode ser adaptado a qualquer outro modelo de tumor utilizando outras linhas de células, desde que expressam a luciferase, ou no contexto de estudos de células T (células T citotóxicas específicas de tumores, as células T reguladoras, etc.). A monitorização in vivo da transferência do gene no contexto da terapia genética de doenças raras, também poderia ser feita utilizando o método luminoscore.
Finalmente os dados mostram que o método luminoscore à base de bioluminescência permite a comparação entre os experimentos, oferece flexibilidade e adaptabilidade às necessidades específicas experimental, e é uma ferramenta útil para estudos pré-clínicos longitudinais não-invasivos.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Agradecemos às instalações animais do Centro de Pesquisa Cordelier (CEF, Paris, França), Généthon (Evry, França) e Genopole (CERFE, Evry, França). Agradecemos Jo Ann Cahn para sua leitura cuidadosa do manuscrito. Esta pesquisa foi apoiada pelo Institut National de la Santé Et de la Rechercher Médicale, Paris Descartes University, Pierre & Marie Curie University, a Association pour la Recherche contre le Cancer, a Direcção da Tunísia Générale de la Recherche Scientifique, CMCU o franco-tunisino projeto e as ações Thématiques Incitatives de Genopole fundos (ATIGE). JC foi apoiada pelos Fronteiras em Ciências da Vida escola de doutorado e por uma bolsa do INCA (Instituto Nacional do Câncer du). RBA foi um destinatário de doações da DGRS-INSERM eo CMCU. SD recebeu uma bolsa do Institut National Cancer du.
Materiais
| Name | Company | Catalog Number | Comments |
| CpG 1826 | Invivogen | Sequence: 5_-TCCATGACGTTCCTGACGTT Catalog number: tlrl-1826 | |
| ODN 1826 control | Invivogen | Sequence: 5_-TCCATGAGCTTCCTGAGCTT Catalog number: tlrl-1826c | |
| D-luciferin potassium salt | Interchim | Catalog number: FP-M1224D | |
| Ketamin | Virbac, France | ||
| Xylazin | Bayer Healthcare | Rompun 2% | |
| A20.IIA-luc2 cell line | A20.IIA transfected with pGL4.50[luc2/CMV/hygro]7 (Promega E1310) | ||
| Mice | Balb/cByj | Six-weeks old females from Charles River | |
| IVIS lumina Biolumienscence imager | Perkin Elmer | ||
| Living Image software | Perkin Elmer | Used for measuring photon flux on images and drawing ROIs | |
| R software (opensource) | R-project | Used for statistic tests | |
| Hamilton Precision Serynge 10 µl | Hamilton | Product number 7642-01100 | |
| Eye ointment | Lacrinorm | ||
| Dissecting microscope | ZEISS | Stemi 305 |
Referências
- Rehemtulla, A., et al. Rapid and Quantitative Assessment of Cancer Treatment Response Using In Vivo Bioluminescence Imaging. Neoplasia. 2 (6), 491-495 (2000).
- Edinger, M., et al. Advancing animal models of neoplasia through in vivo bioluminescence imaging. European Journal of Cancer. 38 (16), 2128-2136 (2002).
- Hastings, J. W., Gibson, Q. H. The Role of Oxygen in the Photoexcited Luminescence of Bacterial Luciferase. Journal of Biological Chemistry. 242 (4), 720-726 (1967).
- Inouye, S., Shimomura, O. The Use of Renilla Luciferase, Oplophorus Luciferase, and Apoaequorin as Bioluminescent Reporter Protein in the Presence of Coelenterazine Analogues as Substrate. Biochemical and Biophysical Research Communications. 233 (2), 349-353 (1997).
- Pesnel, S., et al. Quantitation in Bioluminescence Imaging by Correction of Tissue Absorption for Experimental Oncology. Molecular Imaging and Biology. 13 (4), 646-652 (2010).
- Corre, G., et al. Stochastic Fluctuations and Distributed Control of Gene Expression Impact Cellular Memory. PLoS ONE. 9 (12), (2014).
- Ben Abdelwahed, R., et al. Lymphoma B-cell responsiveness to CpG-DNA depends on the tumor microenvironment. Journal of Experimental & Clinical Cancer Research CR. 32 (1), 18 (2013).
- Abdelwahed, R. B., et al. Preclinical Study of Ublituximab, a Glycoengineered Anti-Human CD20 Antibody, in Murine Models of Primary Cerebral and Intraocular B-Cell Lymphomas. Investigative Ophthalmology & Visual Science. 54 (5), 3657-3665 (2013).
- Donnou, S., Galand, C., Touitou, V., Sautès-Fridman, C., Fabry, Z., Fisson, S. Murine Models of B-Cell Lymphomas: Promising Tools for Designing Cancer Therapies. Advances in Hematology. 2012, (2012).
- Qi, X. -. F., et al. CpG oligodeoxynucleotide induces apoptosis and cell cycle arrest in A20 lymphoma cells via TLR9-mediated pathways. Molecular Immunology. 54 (3-4), 327-337 (2013).
- Houot, R., Levy, R. T-cell modulation combined with intratumoral CpG cures lymphoma in a mouse model without the need for chemotherapy. Blood. 113 (15), 3546-3552 (2009).
- Krieg, A. M. Toll-like receptor 9 (TLR9) agonists in the treatment of cancer. Oncogene. 27 (2), 161-167 (2008).
- Inoue, Y., Kiryu, S., Watanabe, M., Tojo, A., Ohtomo, K. Timing of Imaging after D-Luciferin Injection Affects the Longitudinal Assessment of Tumor Growth Using In Vivo Bioluminescence Imaging. International Journal of Biomedical Imaging. 2010, (2010).
- Mann, H. B., Whitney, D. R. On a Test of Whether one of Two Random Variables is Stochastically Larger than the Other. Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Darne, C., Lu, Y., Sevick-Muraca, E. M. Small animal fluorescence and bioluminescence tomography: a review of approaches, algorithms and technology update. Physics in Medicine and Biology. 59 (1), 1 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados