需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
快速一步酶法合成海藻糖类似物的全净化水
摘要
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
摘要
化学修饰的海藻糖,或海藻糖类似物的版本,在生物学,生物技术和制药科学应用,其他领域中。例如,海藻糖类似物轴承可检测标记已被用于检测结核分枝杆菌 ,并且可以具有应用程序作为结核病诊断显像剂。海藻糖水解稳定版本也正在采取由于其用作无热量甜味剂和生物保护剂的潜力。尽管这类的各种应用的化合物的吸引力,其潜在的由于缺乏对他们的生产一个健壮的路由的仍未实现。在这里,我们报告海藻糖类似物的快速,高效的生物催化一步合成绕过与化学合成相关的问题进行详细的协议。通过利用从Thermoproteus TENAX耐高温海藻糖合酶(TRET)酶,海藻糖类似物可以是发电机密封编在从葡萄糖类似物和高收率尿苷二磷酸葡萄糖单一步骤在15-60分钟(不超过定量转化)。一个简单的和快速的非色谱纯化协议,它由旋透析和离子交换的,可以在水溶液中在短短的45分钟递送已知浓度的许多海藻糖类似物。在未反应的葡萄糖类似物仍保持的情况下,可以进行海藻糖类似物产物的色谱纯化。总体而言,该方法提供了快速合成和海藻糖类似物纯化即是有效的,可访问的非化学家"绿色"生物催化的平台。为了举例说明了该方法的适用性,我们描述了一种协议,用于合成,所有水的净化,和基于海藻糖点击化学探针分枝杆菌,所有这些都用了不到1小时,使分枝杆菌的荧光检测的施用。在未来,我们设想,除OTH呃应用中,该协议可以被应用到基于海藻糖探针结核病诊断的快速合成。例如,短寿命核素改性的海藻糖类似物( 例如 ,(18)F-改性海藻糖)可用于先进的临床成像方式如正电子发射断层扫描,计算机断层扫描(PET-CT)。
引言
海藻糖是由由1,1-α,α-糖苷键( 图1A)连接的两个葡萄糖部分的对称非还原二糖。而海藻糖是从人类和其他哺乳动物不存在,它是在细菌,真菌,植物和无脊椎动物1常见。海藻糖在大多数生物体的主要作用是为了防止环境压力,如干燥1。另外,一些人病原体需要海藻糖毒力,包括结核引起结核分枝杆菌 ,它利用海藻糖作为细胞膜的生物合成的介体和作为一个积木为免疫调节糖脂2的结构。
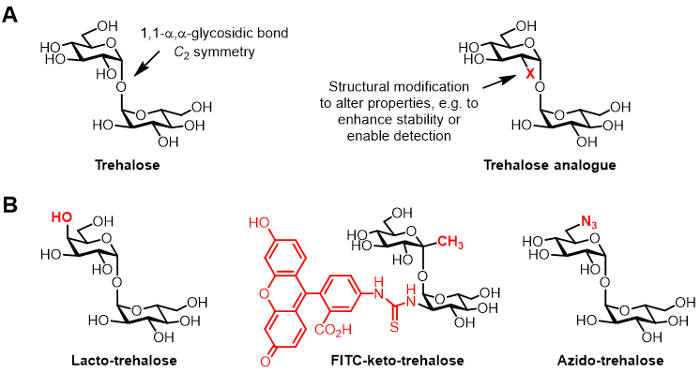
图1: 海藻糖和海藻糖类似物。 (A天然海藻糖和非天然海藻糖类似物,其中X是一个结构修改的)结构。在具有如biopreservation和生物成像的潜在应用的文献报道海藻糖类似物(B)的实施例。
由于其独特的结构和生理功能,海藻糖已经引起显著悉心生物(TECHNO)使用逻辑和生物医学应用3。在以自然观察如海藻糖的保护性能,其惊人的能力,以帮助维持生命在经历了极度脱水4 -具备刺激了biopreservation应用中的广泛使用的"复活"的植物。海藻糖已被用于保持一个宽的生物样品,如核酸,蛋白质,细胞和组织3个这样的阵列。例如,海藻糖在许多药物t一起使用作为稳定添加剂帽是在市场上,包括几个抗癌单克隆抗体3。还有,海藻糖用作在食品工业中的甜味剂,它广泛地用于在两个食品和化妆品工业产品保存。海藻糖为这些类型的商业应用的采用最初是由无法从天然来源或通过合成获得纯海藻糖的大批量的限制。然而,对于经济的生产从淀粉海藻糖的有效酶促过程最近被开发出来,这刺激了其广泛的商业用途 5。
化学修饰的海藻糖的衍生物,在此称为海藻糖类似物,都获得了越来越多的关注的各种应用(在图1A中所示的通用结构; 图1B示出的海藻糖的类似物的具体例子)6。例如,乳海藻糖海藻糖类似物与半乳糖代替其葡萄糖单位之一,因此它的4-位羟基具有倒置立体化学构。乳海藻糖具有相同的稳定性质海藻糖而是降解抗性通过肠酶,使得它作为一种无热量的食品添加剂6,7吸引力。
本集团的海藻糖类似物的兴趣,主要涉及他们的具体分枝杆菌探针和抑制剂的价值。巴里和Davis组开发了荧光素共轭酮海藻糖类似物,命名为FITC酮基海藻糖,这被证明代谢标记的活结核分枝杆菌的细胞壁,通过荧光显微镜8启用其检测。所述Bertozzi教授实验室开发小叠氮基海藻糖(TreAz)类似物,可以代谢标记细胞壁,随后是DETected使用点击化学和荧光分析9。这些进步指向使用基于海藻糖探针作为结核病诊断显像剂的可能性。海藻糖类似物也已实行如结核分枝杆菌的抑制剂由于其潜在的破坏在用于活性和毒力10,11,12所必需的细菌通路。
到目前为止,主要障碍显影海藻糖类似物的生物(TECHNO)逻辑和生物医学应用是缺乏有效的合成方法。这两个传统路线,以生产海藻糖类似物依靠化学合成( 图2)。一种途径涉及天然海藻糖desymmetrization /修改,而另一个涉及开始适当官能化单糖积木并且执行化学糖基化,以伪造1,1-α,α-糖苷键。这些方法中,最近已在综述文章13,14所讨论的,已经证明了从结核分枝杆菌 15完成小批量的复杂含海藻糖的天然产品,例如sulfolipid-1的多步合成是有用的。然而,这两种方法一般是低效率的,耗费时间,不能访问非化学家和,另外,不被认为是环境友好的。因此,用于合成某些类型的海藻糖类似物,这些策略是不理想的。
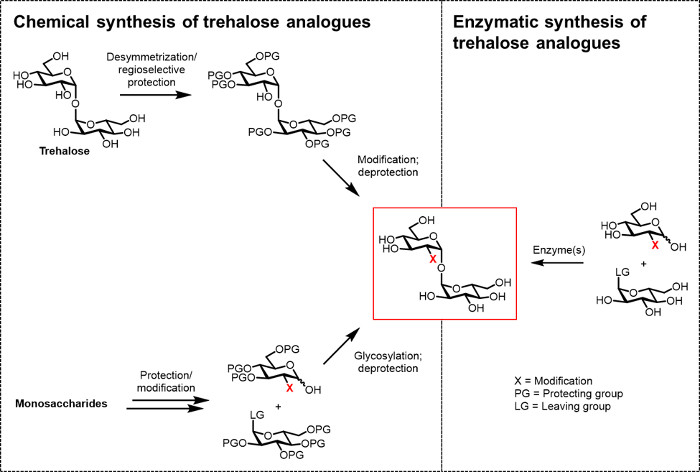
图2: 途径海藻糖合成类似物。化学方法对海藻糖合成类似物,如左图所示,使用包括难以PROTEC多步程序化/去保护,desymmetrization,和/或糖基化的步骤。酶法合成,如右图所示,使用酶,以立体转换简单,未受保护的基材海藻糖在水溶液中的类似物。本文所报道酶促协议使用海藻糖合酶(TRET)酶对葡萄糖类似物和UDP-葡萄糖转化成海藻糖类似物在一个单一的步骤。 请点击此处查看该图的放大版本。
海藻糖类似物的高效生物催化路线将促进生产,评价,这个充满希望的类分子的应用。而海藻糖生产5商用酶促过程并不适用于合成的类似物,因为它利用淀粉作为底物,还有其它生物合成路径在大自然的方式,可为海藻糖合成类似物被利用。但是,这方面的研究,这是最近点评 ,是有限的。一份报告使用的大肠杆菌海藻糖合成途径的启发方法,从相应的氟葡萄糖访问单个氟海藻糖类似物。然而,这种方法需要一个三酶系统具有有限的效率和通用性8。已探索了另一种方法是在相反方向,这在原理允许从葡萄糖类似物和葡萄糖-1-磷酸6,16,17海藻糖类似物的一步合成使用海藻糖磷酸酶(TREP)。虽然这种方法可能有未来的承诺,反相以及留住TrePs目前有用于模拟合成的缺点。例如,反相TrePs具有令人望而却步EXPEnsive供体分子(β-D-葡萄糖-1-磷酸)和保留TrePs具有差的酶表达产率/稳定性和有限的基板滥交。显著的改善( 例如 ,通过酶工程)将前TREP介导的模拟合成需要的是实用的。
目前,对于海藻糖类似物的酶促合成的最实际的方法是使用一个海藻糖合酶(TRET)酶,它转换葡萄糖和尿苷二磷酸(UDP)的葡萄糖转化为海藻糖在一个单一的步骤6。我们最近报道了使用Thermoproteus TENAX TRET-热稳定和单向酶18的-to从葡萄糖类似物和UDP-葡萄糖( 图3)19合成海藻糖类似物。这种酶只操作在合成方向,并且避免在TREP系统中发现海藻糖降解的问题。这一步反应库仑ð在1小时内完成,并且各种各样海藻糖类似物在高产率被访问从容易获得的葡萄糖类似物基板( 见表1中的代表性的成果(高达> 99%为通过高效液相色谱法(HPLC)测定)部分)。
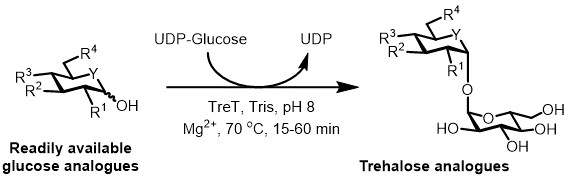
图3: 海藻糖类似物TRET催化一步法合成。从T. TENAX所述TRET酶可立体选择性加入现成的葡萄糖类似物和UDP-葡萄糖以形成海藻糖类似物中的一个步骤。 R 1〜R 4 =可变结构修饰,例如叠氮,氟,脱氧,硫代,立体,或同位素标记的修改; Y =可变的杂原子,例如氧或硫,或同位素标记的杂原子。
在这里,我们提供的广告etailed协议用于TRET合成过程中,其中包括从大肠杆菌表达和TRET的纯化,优化TRET反应条件,那就是在水相中完全进行的改进纯化方法。该修改协议使得在半制备规模(10-100毫克)多样海藻糖类似物的权宜和高效合成和纯化。我们还证明了制备和在不到1小时,这使分枝杆菌细胞的快速荧光检测施用基于海藻糖探针分枝杆菌使用该协议。
研究方案
1.十大大肠杆菌表达TRET纯化
注意:请联系作者,要求TRET表达大肠杆菌 (的pBAD质粒TRET,含蛋白质阿糖胞苷的控制,转化E.十大下T. TENAX TRET基因大肠杆菌 19)及所附材料转让协议。以下方案通常给出的约4毫克/升的蛋白质产量。
- 准备TRET表达大肠杆菌 3毫升过夜培养。
- 条纹十大大肠杆菌与一个LB培养基(LB)含有100μg/ mL氨苄青霉素的琼脂平板的pBAD-TRET表达载体转化。
- 孵育所述板在37℃下约48小时。
- 从板挑取单菌落,接种3毫升含在培养管100微克/毫升氨苄青霉素的LB液体培养基中。
- 放置在振荡培养箱所述管在37#176;Ç点¯x175转过夜。
- 诱导TRET表达大肠杆菌蛋白的表达。
- 添加750毫升了不起肉汤补充有100微克/毫升氨苄青霉素到2800毫升费恩巴赫培养瓶中。转让1毫升肉汤从烧瓶到试管为作为空白以后使用。
- 添加在步骤1.1.4至培养烧瓶中产生的3毫升过夜培养,然后将烧瓶在培养箱并在37℃×200转动摇。定期检查文化的吸收在600纳米与步骤1.2.1收集的空白。
- 一旦在600的吸光度0.5-1.0之间处达到,通过加入1M的阿拉伯糖溶液(终浓度为1mM),以在培养750微升诱导TRET表达。烧瓶返回到培养箱中,在37℃下×200转摇过夜。
- 颗粒和裂解TRET表达大肠杆菌细胞。
- 转移文化聚丙烯bottle和离心机在4000 xg离心在4℃下15分钟。
- 弃去上清液并重新悬浮在15ml磷酸盐缓冲盐水的(PBS)中沉淀。
- 在4000 xg离心细胞悬液转移至50 mL锥形管并离心15分钟,4℃。弃去上清液并继续到细胞裂解(步骤1.3.4)或在-80℃长期保存沉淀。
- 在50mL锥形管溶解1蛋白酶抑制剂的迷你片剂在20ml洗涤缓冲液(50mM的NaH 2 PO 4,500 mM氯化钠,的20mM咪唑,pH 8.0)中的。
- 蛋白酶含抑制剂的洗涤缓冲液转移到含颗粒的锥形管中。涡旋直至沉淀重新悬浮。
- 传送再悬浮细胞至一个100毫升烧杯中,并通过超声处理裂解细胞(上45秒脉冲序列45秒断用2分钟和15秒的运行时间以75%的幅度)。
- 转移裂解物至50 mL金属锥形管和离心机在15000 xg离心在4℃下60分钟。
- 通过0.2-0.45微米注射器过滤到50mL锥形管澄清通道的裂解液。
注意:得到的溶胞产物的典型浓度为100毫克/毫升。
- 用快速蛋白液相层析(FPLC)从大肠杆菌细胞裂解物纯化TRET。
- 设置了FPLC与镍亲和柱(5毫升床体积)。用10毫升去离子水,或直到柱是清洁的污染物洗柱。平衡,用20毫升的洗涤缓冲液的柱(50毫米的NaH 2 PO 4,500 mM氯化钠,的20mM咪唑,pH 8.0)中以1毫升/分钟的流速。
- 装载从步骤1.3.8获得至色谱柱上的裂解液(20毫升)中,在1毫升/分钟的流速洗脱用洗涤缓冲液未加标签的蛋白质,直到吸光度达到背景水平(通常80-100毫升的洗涤缓冲液是必需的) 。
- 洗脱His-标记TRET通过使用线性克从1-100%在60分钟内以1毫升/分钟的流速洗脱缓冲液(50mM的NaH 2 PO 4,500 mM氯化钠,250mM咪唑,pH 8.0)中的radient。收集4毫升馏分直到TRET已洗脱的吸光度达到基线水平。
注意:通常情况下,需要60毫升洗脱缓冲液以洗脱蛋白质,并且该蛋白质在60%-100%的洗脱缓冲液范围洗脱。大约10-15毫升纯TRET在洗脱缓冲液中获得。 - 通过在针对洗脱缓冲液空白测量280nm处的吸光度确定TRET的浓度。
- 交换TRET成三(羟甲基)氨基甲烷(TRIS)通过透析缓冲液中。
- 根据制造商的说明制备透析管后,通过用离子交换水,然后的Tris缓冲液(50mM的Tris,300mM的氯化钠,pH值8.0)冲洗素它。
- 加载TRET样品放入使用注射器和钝针透析管。透析过夜抗拒着2升Tris缓冲。
- 通过在对从透析洗涤收集的空白测量280nm处的吸光度确定TRET的浓度。
- 转移TRET溶液到50毫升锥形管中,并进行到海藻糖类似物合成(步骤2)或酶储存于4℃。
注:TRET是一个热稳定的蛋白。该TRET在4℃下保存在Tris缓冲液中数月而不观察活动的显著损失。
2.使用TRET海藻糖酶类似物的一步合成
注意:下面的协议描述了基于4毫升容积的反应规模,可以根据反应的效率和产品的分子量提供约15-30毫克海藻糖类似物。反应组分可以缩放如果需要的话,以获得更多或更少的海藻糖类似物。
- 添加葡萄糖类似物(0.080毫摩尔,质量将取决于分子量),UDP-葡萄糖(0。160毫摩尔,97.6毫克), 氯化镁 (0.080毫摩尔,16.3毫克)于15毫升锥形管中。这些组分的最终浓度将是分别为20毫米,40毫米和20毫米。
- 添加TRET在Tris缓冲液(来自步骤1.5.4获得),如果有必要,Tris缓冲液的适当体积(50毫摩尔Tris,300mM的氯化钠,pH值8.0),以达到300微克/毫升和最终的最终酶浓度的4mL的体积。吸管将混合物上下轻轻或反转管以溶解固体。
- 孵育在70℃以300rpm振荡1小时的反应,然后置于冰上的管冷却。
从原油酶促反应混合物海藻糖类似物3.净化
- 直到所有的液体通过过滤器的预冲洗离心过滤单元(标称分子量限度(NWML)10 kDa)的加入3毫升去离子水至离心过滤器单元,并在3000 xg离心离心以除去痕量甘油在膜入管(大约20分钟)。重复两次。完成之前立即或在反应(步骤2.3)在这一步。
- 冷却该酶促反应混合物(来自步骤2.3获得)后,将其转移到预漂洗离心过滤单元。冲洗反应管用1mL的去离子水,并转移到离心过滤单元。对于产品的最大回收反应管重复漂洗。
- 在3000 xg离心离心离心过滤单元,直到所有的液体通过过滤器进入管(大约20分钟)。在3000 xg离心冲洗离心过滤单元与3毫升去离子水和离心机上腔室,直到所有的液体通过过滤器进入管(大约20分钟)。重复漂洗产品的最大回收。
- 丢弃离心过滤器单元的上部腔室。混合床离子交换树脂(3克)到滤液中添加在管(典型滤液体积的底部存储介质为8-15毫升取决于冲洗的数目)。在室温下搅拌1小时,以足够能保持悬浮在溶液中的树脂珠粒的速度一磁力搅拌棒。
- 倒出上清液并将其过滤以除去树脂。加入5毫升的去离子水来冲洗剩余的树脂。倒出上清液并过滤,它与从第一滗析的产物溶液合并。树脂产品的最大回收重复清洗。
- 分析薄层色谱(TLC)或高效液相色谱法的反应来确定葡萄糖类似物的原料的海藻糖类似物产物的完全转化是否达到了。参见步骤4.1 TLC分析和步骤4.2进行HPLC分析。
- 通过冻干或旋转蒸发除去水,得到干燥产物。如果TLC或HPLC分析期间没有观察到未反应的葡萄糖类似物,纯化通过色谱法是不必要的。权衡产物,得到的反应一愕LD和执行核磁共振(NMR)光谱分析(步骤4.3),以确认产品的结构和纯度。
- 如果TLC分析过程中观察到的未反应的葡萄糖类似物,它从用尺寸排阻柱海藻糖类似物分开。
- 准备根据制造商的说明含有去离子水饱和的,超细的P2聚丙烯酰胺珠大小排阻介质1×100厘米柱。
注:尺寸排阻柱可以用离子交换水洗涤后可重复使用。 - 重新溶解的干燥酶反应产物在0.5毫升去离子水(来自步骤3.7获得)。应用该产物溶液,以手动的大小排阻柱或通过使用柱流速适配器。冲洗包含具有去离子水另一个0.5mL的粗产物小瓶,并且将其装载到尺寸排阻柱。
- 通过重力流洗脱用去离子水产物和收集的2μm左右馏分1L体积。
- 通过TLC(步骤4.1)分析级分。汇集含纯海藻糖类似物的级分。
- 通过冻干或旋转蒸发除去水,得到干燥产物。权衡产物,得到反应产率,并继续NMR分析(见步骤4.3)。
- 准备根据制造商的说明含有去离子水饱和的,超细的P2聚丙烯酰胺珠大小排阻介质1×100厘米柱。
4.海藻糖模拟产品分析
- 执行TRET反应薄层色谱(TLC)分析。
注意:此过程也可以用来分析大小排阻柱级分。可能有必要集中之前TLC分析,以在TLC板上观察化合物染色反应混合物或柱级分。- 标记泳道用铅笔TLC板表面上,并应用分析物和相关标准(多个)到适当的车道,包括葡萄糖类似物标准,海藻糖类似物标准(如果有的话),将反应混合物(或馏分从收集规格Exclusion柱纯化),和共点。施加各样品的TLC板后,让板干燥。
注:对于反应分析,样品通常为2微升加到TLC板。 - 开发使用正丁醇/乙醇/去离子水的TLC板(5:3:2)。
- 擦干开发薄层板上,然后将它浸入5%H 2 SO 4的乙醇(糖染色),热上高设置一个热板,直到含糖点可以可视化(一般为5分钟)。
- 标记泳道用铅笔TLC板表面上,并应用分析物和相关标准(多个)到适当的车道,包括葡萄糖类似物标准,海藻糖类似物标准(如果有的话),将反应混合物(或馏分从收集规格Exclusion柱纯化),和共点。施加各样品的TLC板后,让板干燥。
- 执行使用任何能够分离和检测的碳水化合物的HPLC系统TRET反应混合物的HPLC分析。该协议涉及到使用氨丙基HPLC柱和检测用折射率碳水化合物的分离。
- 附加包含柱前后卫的HPLC色谱柱氨丙基(4.6×250毫米)。
- 以0.4的流量平衡以在去离子水中80%乙腈氨基丙基柱毫升/分钟。
- 加载的反应产物(或标准)的到氨基丙基柱的溶液。
- 以0.4毫升/分钟的流速和50℃的柱温洗脱产物(或标准),在去离子水中的80%乙腈。典型地,所使用的运行时间为40分钟。
注意:两个葡萄糖类似物原料和海藻糖类似物产物可通过折射率被检测到,尽管可以使用其他方法,如蒸发光散射检测器(ELSD)。使用所描述的条件下,葡萄糖类似物通常洗脱10-15之间15-25分钟之间分钟和海藻糖类似物洗脱。
- 纯化海藻糖类似物的NMR分析。
- 溶解在D 2 O中(700微升)纯化海藻糖类似物,将溶液转移到NMR管中。
- 获得1 H和根据适当NMR设施协议。13 C NMR光谱。
5。 TRET合成海藻糖类似物的分枝杆菌检测中的应用
- 合成,纯化和管理6 TreAz以耻垢分枝杆菌 (Msmeg)。
- 添加6-叠氮基-6-脱氧吡喃葡萄糖(6-GlcAz,0.020毫摩尔,4.1毫克),UDP-葡萄糖(0.040毫摩尔,24.4毫克), 氯化镁 (0.020毫摩尔,4.1毫克)于15毫升锥形管中。
- 添加TRET在Tris缓冲液(来自步骤1.5.4获得),以实现300微克/毫升的最终酶浓度和1毫升的最终体积。吸管将混合物上下轻轻或反转管以溶解固体。
- 孵育在70℃振荡15分钟进行反应。
- 稀释酶反应混合物用3毫升的去离子水,并将其转移到预先洗涤的离心过滤单元(NMWL 10kDa的)。在3000 xg离心离心过滤装置直到大部分液体通过过滤器进入管,大约10分钟。
- 丢弃日离心过滤单元电子上议院。混合床离子交换树脂(0.75)加入到管中,搅拌/摇在室温下添加25分钟。倒出上清液并将其过滤以除去树脂。
注意:步骤5.1.1-5.1.5在不到1小时提供6-叠氮基海藻糖(6- TreAz)中的大约5毫浓度的水溶液。在5mM的浓度是基于底物向产物的定量转化,并且在纯化步骤需要的地方,在这些步骤中假设产物的损失最小稀释估计。该溶液可以是无菌过滤如果需要除了生物样品之前。 - 6- TreAz产物溶液适当体积添加到耻垢分枝杆菌的对数相培养(Msmeg),通常以达到100-1,000微升的最终培养物体积和25微米的〜最终-6- TreAz浓度。孵育细胞在37℃,所需的时间量,通常为60分钟。
- 执行点击化学缀合荧光基团叠氮化标记的细胞。在这个协议中,使用铜-催化的叠氮化物-炔环加成(CuAAC),以在Msmeg递送荧光团与细胞表面叠氮化物。
- 离心细胞在3900×g离心5分钟,然后洗涤细胞用含有0.5%牛血清白蛋白的PBS。重复两次。
- 重悬在4%的多聚甲醛的沉淀的细胞在PBS中解决这些问题。 10分钟温育后,重复步骤5.2.1至洗涤细胞。
- 重悬在138微升PBS沉淀的细胞。
- 添加在DMSO炔羧基罗丹明110(炔-488)的1mM储备液3微升。
- 添加抗坏血酸钠在去离子水中新鲜制备的60毫原液的3微升。
- 添加三[(1-苄基-1H-1,2,3-三唑-4-基)甲基]胺(TBTA)的叔丁醇/二甲亚砜6.4毫米原液(DMSO)中的3微升4:1。
- 加入3&#956:L在去离子水中的CuSO 4的50mM储备液。
- 吸管将细胞悬液上下,然后在黑暗中室温下培养30分钟。
- 重复步骤5.2.1至洗涤细胞。重新悬浮在150μL的PBS中的细胞。
- 进行细胞荧光分析。在这个协议中,使用荧光显微镜可视化标记Msmeg的细胞荧光。
- 加悬浮在PBS中至显微镜载玻片细菌细胞的10微升和液体轻轻扩散成使用盖玻片边缘的薄层。放置空气中的暗干燥。
- 添加安装介质的10μL在干燥的样品,然后将盖玻片在样品和应用胶粘剂( 如指甲油),以固定。
- 图象使用放大100倍的荧光显微镜的幻灯片。
结果
T. TENAX TRET从大肠杆菌中的大约4毫克使用标准蛋白质表达和纯化技术/ L的产率获得。单个镍亲和层析步骤足以从大肠杆菌裂解物纯化TRET(代表性FPLC跟踪示于图4)。如建立了我们对TRET合成过程初始公布的,重组的T。TENAX TRET能够转换各种各样葡萄糖类似物-其中许多的是可商购到相应的海藻糖类似物以高效率19。
讨论
海藻糖类似物有冲击各个领域,从食物和药品的保存到微生物感染6的诊断和治疗的潜力。现有的多步化学合成方法是要修改后的多个站点生产复杂海藻糖类似物有用的( 如 ,自然发生的复杂的分枝杆菌糖脂)。然而,这些方法不可避免地冗长和低效的,即使当施加到比较简单的单取代海藻糖类似物9,13,14
披露声明
The authors have nothing to disclose.
致谢
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
材料
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
参考文献
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。