A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
צעד אחד ראפיד סינתזה האנזימטית-כל מימית טיהור של אנלוגים trehalose
In This Article
Summary
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Abstract
מבחינה כימית גרסאות מותאמות של trehalose, או אנלוגים trehalose, יש יישומים בביולוגיה, ביוטכנולוגיה, ומדע התרופות, בין שדות אחרים. למשל, אנלוגים trehalose נושאות תגים לזיהוי שימשו לגילוי שחפת Mycobacterium ייתכן יישומים כסוכני הדמיה לאבחון שחפת. גרסאות יציבה hydrolytically של trehalose גם אלה נשאפים בשל הפוטנציאל שלהם לשמש ממתיקים שאינם הקלורי וסוכני מוגני ביו. למרות הערעור של מש' זו של חומרים עבור יישומים שונים, את הפוטנציאל שלהם נשאר בלתי ממומש בשל חוסר מסלול חזק לייצור שלהם. כאן אנו מדווחים פרוטוקול מפורט לסינתזת biocatalytic צעד אחד המהירה ויעילה של אנלוגים trehalose שעוקפת את הבעיות קשורות סינתזה כימית. על ידי ניצול של synthase trehalose thermostable (TreT) האנזים מן Thermoproteus Tenax, אנלוגים trehalose יכול להיות generatאד בשינה בצעד אחד לבין מקבילי גלוקוז וגלוקוז דיפוספט uridine בתשואה גבוהה (עד מרה כמוני) ב 15-60 דקות. פרוטוקול טיהור פשוט ומהיר ללא chromatographic, אשר מורכב של דיאליזת ספין חילוף יונים, יכול לספק אנלוגים trehalose רבים של ריכוז ידוע בתמיסה מימית קטן כמו 45 דקות. במקרים בהם אנלוגי גלוקוז unreacted עדיין נשאר, טיהור chromatographic של המוצר אנלוגי trehalose יכול להתבצע. בסך הכל, שיטה זו מספקת פלטפורמת biocatalytic "ירוקה" לסינתזה המזורזת וטיהור אנלוגים trehalose כי הוא יעיל ונגיש-כימאים לא. כדי להדגים את תחולתה של שיטה זו, אנו מתארים פרוטוקול לסינתזה, כל-מימית טיהור, והמינהל של בדיקה הכימיה לחץ מבוסס-trehalose כדי mycobacteria, שכולן לקח פחות משעה 1 ואפשרה גילוי הקרינה של mycobacteria. בעתיד, אנו צופים כי, בין othאה יישומים, פרוטוקול זה ניתן להחיל את הסינתזה המהירה של בדיקות מבוססות trehalose לאבחון שחפת. למשל, נמשך זמן קצר אנלוגים trehalose שונים-רדיונוקלידים (למשל, 18 F-modified trehalose) יוכל לשמש עבור שיטות הדמיה קליניות מתקדמות כגון טומוגרפיה-טומוגרפיה ממוחשבת של פליטת פוזיטרונים (PET-CT).
Introduction
Trehalose הוא דו סוכר סימטרי הלא צמצום מורכב משני moieties גלוקוז כי מצטרפים (איור 1 א) 1,1-α, α-glycosidic אג"ח. בעוד trehalose נעדר בני אדם ויונקים אחרים, הוא נפוץ למצוא חיידקים, פטריות, צמחים, וחסרי חוליות 1. התפקיד העיקרי של trehalose ברוב האורגניזמים הוא להגן מפני לחצים סביבתיים, כגון התייבשות 1. בנוסף, פתוגנים אנושיים מסוימים דורשים trehalose עבור ארסיות, כולל שחפת Mycobacterium גרימה-שחפת, אשר מנצלת trehalose כמתווך של ביוסינתזה מעטפת תא כאבן בניין לבניית glycolipids אימונו-2.
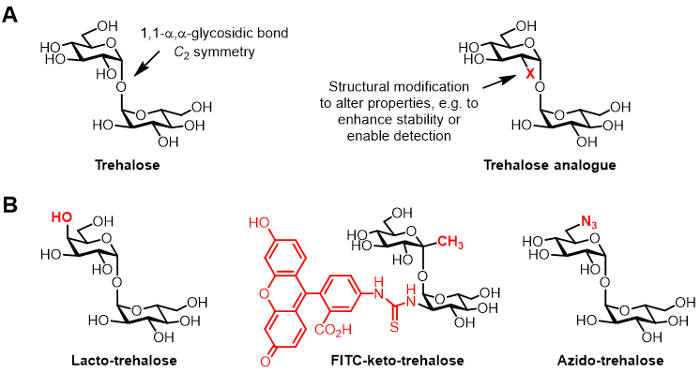
איור 1: trehalose ו אנלוגים trehalose. (אמבנים) של trehalose הטבעי באנלוג trehalose טבעי, כאשר X הוא שינוי מבני. (ב) דוגמאות של אנלוגים trehalose מהמדווח בספרות כי יש יישומים פוטנציאליים biopreservation ו bioimaging.
בשל המבנה פיסיולוגי הפונקציות הייחודיים שלה, trehalose משך תשומת לב משמעותית לשימוש ביו (טכנו) יישומים הגיוניים ביו 3. מאפייני המגן של trehalose שנצפתה Nature-למשל, היכולת המרשימה שלה כדי לסייע לקיים חיים בצמחים "תחיית מתים" שעברו התייבשות קיצונית 4 -האם דרבנו השימוש הנרחב שלה ביישומי biopreservation. Trehalose נעשה שימוש כדי לשמור על מגוון רחב של דגימות ביולוגיות, כגון חומצות גרעין, חלבונים, תאים ורקמות 3. למשל, trehalose משמש כתוסף מייצב מספר t תרופותכובע הנמצא בשוק, כולל נוגדנים חד שבטיים כמה אנטי סרטניים 3. כמו כן, trehalose משמש כממתיק בתעשיית המזון, וזה נעשה שימוש נרחב לשימור מוצר בשתי תעשיות המזון והקוסמטיקה. אימוץ trehalose עבור סוגים אלה של יישומים מסחריים בתחילה היה מוגבל על ידי חוסר היכולת להשיג בכמויות גדולות של trehalose הטהור ממקורות טבעיים או באמצעות סינתזה. עם זאת, תהליך אנזימטי יעיל לייצור החסכוני של trehalose מעמילן פותח לאחרונה, אשר דרבן השימוש המסחרי הנרחב שלו 5.
מבחינה כימית שונה נגזרות של trehalose, תיקרא להלן אנלוגים trehalose, צברו תשומת לב גוברת עבור יישומים שונים (מבנה גנרי שמוצג באיור 1 א; דוגמאות ספציפיות של אנלוגים trehalose שמוצג באיור 1) 6. לדוגמה, לקטו-trehalose הוא אנלוגי trehalose עם אחת מיחידות גלוקוז שלה מוחלף עם גלקטוז, ובכך קבוצת הידרוקסיל 4-עמדתה בעל תצורה stereochemical הפוכה. יש לקטו-trehalose אותו במאפייני הייצוב כמו trehalose אבל הוא עמיד השפלה ידי אנזימים במעיים, מה שהופך אותו אטרקטיבי כתוסף מזון שאינו הקלורי 6, 7.
העניין של הקבוצה שלנו ב אנלוגים trehalose מתייחס בעיקר לשווים כפי בדיקות ספציפיות mycobacteria ומעכבים. קבוצות בארי דייוויס פתחו אנלוגי trehalose-keto מצומדות-והעמסה, בשם FITC-קטו-trehalose, אשר הוצג מטבולית לתייג את דופן התא של שחפת חייה, מה שמאפשר זיהוי על ידי הקרינה מיקרוסקופיה 8. המעבדה Bertozzi שפותחה קטן azido-trehalose (TreAz) אנלוגים שיכול מבחינה מטבולית לתייג את דופן התא, ובהמשך להיות detected באמצעות כימיה לחץ קרינת ניתוח 9. ההתפתחויות הללו מצביעות על האפשרות של שימוש בדיקות מבוסס trehalose כסוכני הדמיה לאבחון שחפת. אנלוגים trehalose יש גם רדופים כמו מעכבים מ שהחפת בשל הפוטנציאל שלהם לשבש מסלולי החיידק חיוניים כדאי ארסי 10, 11, 12.
עד כה, המכשול העיקרי לפיתוח אנלוגים trehalose עבור ביו (טכנו) יישומים הגיוניים ביו הוא חוסר שיטות סינטטיות יעילות. שני המסלולים המסורתיים לייצור אנלוגים trehalose להסתמך על סינתזה כימית (איור 2). תוואי אחד כרוך desymmetrization / שינוי של trehalose הטבעי, ואילו השני כרוך החל אובניים בניין monosaccharide פונקציונלי כראוי וביצוע הכימי glycosylation כדילזייף את הקשר 1,1-α, α-glycosidic. גישות אלה, ואשר נדונו לאחרונה במאמרי ביקורת 13, 14, הוכיחו שימושיות עבור להשיג סינתזה רבה שלבים של כמויות קטנות של מוצרים טבעיים מורכבים המכיל trehalose, כגון -1 sulfolipid משחפת מ 15. עם זאת, שתי הגישות הן בדרך כלל לא יעילות, זמן רב, נגיש שאינם כימאים, וכן, בנוסף, אינם נחשבים להיות ידידותי לסביבה. לפיכך, סינתזת סוגים מסוימים של אנלוגים trehalose, אסטרטגיות אלה אינן אידיאליות.
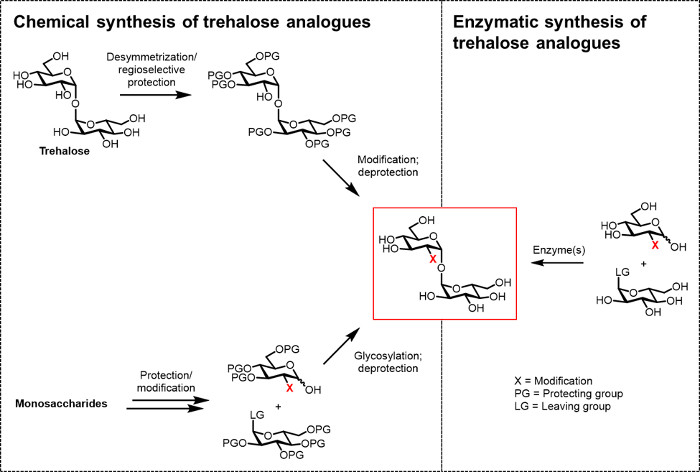
איור 2: גישות סינתזה אנלוגית trehalose. כימית גישות סינתזה אנלוגית trehalose, יוצגה בפינה השמאלית, השתמש נהלים רבים שלבים שכוללים פרוטק קשהtion / deprotection, desymmetrization, ו / או צעדים glycosylation. סינתזה אנזימתי, יוצג בפינה הימנית, משתמשת אנזים (ים) האחרונים stereoselectively להמיר מצעים פשוטים, לא מוגנים כדי trehalose אנלוגים בתמיסה מימית. פרוטוקול האנזימטית דיווחה בזאת משתמשת synthase trehalose (TreT) אנזים להמיר אנלוגים גלוקוז ו- UDP גלוקוז לתוך אנלוגים trehalose בשלב אחד. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוואי biocatalytic יעילים אנלוגים trehalose יקלו על הייצור, הערכה, והיישום של הכיתה המבטיחה הזה של מולקולות. בעוד התהליך המסחרי אנזימטי לייצור trehalose 5 אינו מסתגל כדי לסנתז אנלוגים משום שהוא מנצל עמילן כמו מצע, יש נתיב biosynthetic אחרדרכים בטבע כי עשוי להיות מנוצלת לסינתזה אנלוגית trehalose. עם זאת, המחקר בתחום זה, אשר נסקר 6 לאחרונה, היה מוגבל. אחד הדיווחים השתמשו בשיטה בהשראת מסלול biosynthetic trehalose Escherichia coli לגשת אנלוגי fluoro-trehalose אחת מן-גלוקוז fluoro המקביל. עם זאת, גישה זו דורשת מערכה תלת-אנזים הגבילה יעילות בכלליות 8. גישה אחרת, שהיה כבר בחנה היא להשתמש phosphorylase trehalose (TreP) בכיוון ההפוך, אשר באופן עקרוני מתיר סינתזת צעד אחד של אנלוגים trehalose לבין מקבילי גלוקוז וגלוקוז-1-פוספט 6, 16, 17. למרות שגישה זו עשויה להיות הבטחה עתידית, הן TrePs ההיפוך והשמירה כרגע יש חסרונות לסינתזה אנלוגית. לדוגמה, TrePs היפוך יש expe להחרידמולקולת תורם nsive (β-D- גלוקוז 1-פוספט) ו TrePs שמירה יש תשואות ביטוי אנזים עניה / יציבות הפקרות מצע מוגבלת. שיפורים משמעותיים (למשל, באמצעות הנדסת אנזים) יהיה צורך לפני הסינתזה אנלוגית בתיווך TreP הוא מעשי.
כיום, הגישה המעשית ביותר לסינתזה האנזימטית של אנלוגים trehalose היא להשתמש synthase trehalose (TreT) אנזים, אשר ממירה דיפוספט גלוקוז uridine (UDP) -glucose לתוך trehalose בתוך יחיד בשלב 6. אנחנו דיווחנו לאחרונה על שימוש Thermoproteus Tenax TreT-אנזים thermostable ו חד כיווני 18 -כדי לסנתז אנלוגים trehalose לבין מקבילי גלוקוז ו- UDP-גלוקוז (איור 3) 19. אנזים זה פועל רק בכיוון הסינטטי ימנע את הבעיה של שפלת trehalose נמצאת במערכת TreP. coul תגובה חד-שלבית זוd להסתיים 1 שעה, ועוד מגוון רחב של אנלוגים trehalose היו לגשת בתשואה גבוהה (עד> 99% כפי שנקבע על ידי כרומטוגרפיה נוזלית ביצועים גבוהים (HPLC)) מ מצעים אנלוגיים גלוקוז זמינים (ראה לוח 1 נציג התוצאות סָעִיף).
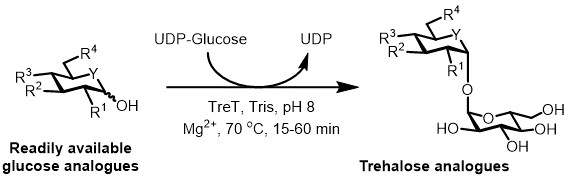
איור 3: סינתזת צעד אחד TreT-זרז של אנלוגים trehalose. האנזים TreT מהטי Tenax יכול stereoselectively להצטרף אנלוגים גלוקוז זמינים ו- UDP גלוקוז כדי ליצור אנלוגים trehalose בצעד אחד. R 1 -R 4 = שינוי המבנים משתנים, למשל azido-, fluoro-, deoxy-, thio-, stereochemical, או שינויי תווית איזוטופי; Y = heteroatom משתנה, למשל חמצן או גופרית, או isotopically שכותרתו heteroatom.
כאן, אנו מספקים מודעהפרוטוקול etailed עבור תהליך סינתזת TreT, כוללים ביטוי וטיהור TreT מן E. coli, אופטימיזציה תנאי תגובת TreT, וכן שיטת טיהור משופרת כי מתבצעת לחלוטין בשלב המימי. פרוטוקול שונה זו מאפשר סינתזה וטיהור ומועילות ויעילה של אנלוגים trehalose המגוונים בסולם למחצה preparative (10-100 מ"ג). כמו כן, אנו מדגימים את השימוש בפרוטוקול זה להכנה ונהל בדיקה מבוססת-trehalose כדי mycobacteria בתוך פחות משעה 1, הדבר שאפשרה גילוי הקרינה המהיר של תאי mycobacterial.
Protocol
1. ביטוי טיהור של TreT מ coli Top10 E.
הערה: נא ליצור קשר עם הכותבים לבקש זן החיידק TreT להביע (פלסמיד pBAD TreT, המכיל את הגן ט Tenax tret בשליטת החלבון AraC, הופך Top10 E. coli 19) והסכם העברת החומר הנלווה . הפרוטוקול הבא בדרך כלל נותן תשואת חלבון של כ -4 מ"ג / L.
- הכן תרבות הלילה 3 מ"ל של TreT להביע E. coli.
- Top10 E. coli Streak הפך עם pBAD-TreT וקטור ביטוי על מרק lysogeny (LB) צלחת אגר המכיל 100 מיקרוגרם / מ"ל אמפיצילין.
- דגירה את הצלחת על 37 מעלות צלזיוס למשך כ 48 שעות.
- פיק מושבה אחת מהצלחת ולחסן 3 מיליליטר של מדיום נוזל LB המכיל אמפיצילין 100 מיקרוגרם / מיליליטר צינור תרבות.
- מניחים את הצינור בתוך חממה רועד ב 37 & #176; C x 175 סל"ד לילה.
- להשרות ביטוי החלבון TreT להביע E. coli.
- להוסיף 750 מרק נהדר מ"ל השלימו עם 100 מיקרוגרם / מ"ל אמפיצילין בקבוק תרבות 2,800 מ"ל Fernbach. העברת 1 מ"ל מרק מהבקבוק קובט לשימוש מאוחר יותר בתור ריק.
- מוסיף את תרבות 3 מיליליטר הלילה שנוצרה בשלב 1.1.4 בקבוק התרבות, ולאחר מכן למקם את הבקבוק באינקובטור ולנער על 37 מעלות צלזיוס x 200 סל"ד. לבדוק מדי פעם את ספיגת התרבות ב 600 ננומטר לעומת הריק שנאסף בשלב 1.2.1.
- לאחר הספיגה ב 600 ננומטר מגיעה בין 0.5-1.0, להשרות ביטוי TreT על ידי הוספת 750 μL של 1 M פתרון arabinose (1 ריכוז סופי מ"מ) לתרבות. מחזירים את הבקבוק אל האינקובטור ולנער לילה בשעה 37 ° C x 200 סל"ד.
- גלולת lyse תאי חיידק TreT להביע.
- מעבירים את התרבות על b פוליפרופילןottle צנטריפוגות במשך 15 דקות XG ב 4000 ב 4 מעלות צלזיוס.
- בטל supernatant מחדש להשעות גלולה ב 15 מ"ל של תמיסת מלח פוספט שנאגרו (PBS).
- מעבירים את ההשעיה לתא צינור חרוטי 50 מ"ל ו צנטריפוגות במשך 15 דקות ב 4000 XG ב 4 מעלות צלזיוס. בטל supernatant יעבור תא תמוגה (שלב 1.3.4) או לאחסן הגלולה ללא הגבלה זמן ב -80 מעלות צלזיוס.
- ממיסים לוח מיני 1 מעכבי פרוטאז ב 20 מ"ל של חיץ לשטוף (50 מ"מ לאא 2 PO 4, 500 מ"מ NaCl, 20 מ"מ imidazole, pH 8.0) בצינור חרוטי 50 מ"ל.
- מעביר את החיץ לשטוף מעכב המכיל פרוטאז אל צינור החרוטים המכיל הגלולה. וורטקס עד הגלולה הוא מושעה מחדש.
- העבירו מחדש מושעה תאים כדי מבחנת מיליליטר 100 ו lyse התאים על ידי sonication (רצף דופק של 45 שניות על, 45 שניות את עם זמן ריצה של 2 דקות ו -15 שניות אמפליטודה של 75 אחוזים).
- מעבירים את lysate אל צינור חרוטי מתכת 50 מ"לו צנטריפוגות במשך 60 דקות ב 15,000 XG ב 4 מעלות צלזיוס.
- להבהיר את lysate ידי מעבר דרך פילטר מזרק 0.2-0.45 מיקרומטר לתוך צינור חרוטי 50 מ"ל.
הערה: ריכוז אופייני lysate המתקבל הוא 100 מ"ג / מ"ל.
- לטהר TreT מן lysate תא החיידק באמצעות כרומטוגרפיה נוזלית חלבון מהיר (FPLC).
- הגדרת FPLC עם טור זיקה ניקל (נפח המיטה 5 מ"ל). לשטוף את העמודה עם 10 מ"ל של מים ללא יונים או עד טור נקי מכל מזהמים. לאזן את העמודה באמצעות 20 מ"ל של חיץ לשטוף (50 מ"מ לאא 2 4 PO, 500 מ"מ NaCl, 20 imidazole מ"מ, pH 8.0) בקצב זרימה של 1 מ"ל / דקה.
- טען את lysate (20 מ"ל) המתקבל צעד 1.3.8 על הטור ו elute חלבונים לא מתוייגת עם חיץ לשטוף בקצב זרימה של 1 מ"ל / דקה עד ספיגת מגיע לרמות הרקע (בדרך כלל 80-100 מ"ל של חיץ לשטוף נדרשים) .
- Elute שלו מתויג TreT באמצעות גרם ליניאריradient של חיץ elution (50 מ"מ לאא 2 PO 4, 500 מ"מ NaCl, 250 מ"מ imidazole, pH 8.0) 1-100% מעל 60 דקות בקצב זרימה של 1 מ"ל / דקה. אסוף 4 שברי מיליליטר עד TreT יש eluted ואת הספיגה מגיעה לרמת בסיס.
הערה: בדרך כלל, 60 מ"ל של חיץ elution נדרשים elute החלבון, ואת החלבון elutes בטווח 60-100% חיץ elution. כ 10-15 מ"ל של TreT טהור במאגר elution מתקבלים. - קבע את הריכוז של TreT על ידי מדידת ספיגת ב 280 ננומטר נגד ריק חיץ elution.
- המרת TreT לתוך טריס (hydroxymethyl) aminomethane (טריס) חיץ על ידי דיאליזה.
- לאחר הכנת צינורות דיאליזה פי הוראות היצרן, הממשלה היא על ידי שטיפה עם מים ללא יונים ואז חיץ טריס (50 מ"מ טריס, 300 מ"מ NaCl, pH 8.0).
- טען המדגם TreT לתוך צינורות דיאליזה באמצעות מזרק מחט קהה. Dialyze בן לילהונגדי 2 ליטר של טריס חיץ.
- קבע את הריכוז של TreT על ידי מדידת ספיגת ב 280 ננומטר נגד ריק שנאספו מן הרחצה דיאליזה.
- מעבירים את הפתרון TreT צינור חרוטי 50 מ"ל ולהמשיך סינתזה אנלוגי trehalose (שלב 2) או לאחסן את האנזים ב 4 ° C..
הערה: TreT הוא חלבון thermostable. TreT אוחסן חיץ טריס ב 4 מעלות צלזיוס במשך כמה חודשים ללא התבוננות אובדן משמעותי של הפעילות.
2. סינתזה צעד אחד של אנלוגים trehalose שימוש אנזים TreT
הערה: הפרוטוקול הבא מתאר בסולם תגובה מבוסס על 4 נפחי מיליליטר, אשר יכול לספק כ 15-30 מ"ג של אנלוגי trehalose תלוי יעיל תגובה ועל משקל מולקולרי של המוצר. רכיבי התגובה וניתן לשנותם כדי להשיג פחות או יותר אנלוגי trehalose אם ירצו בכך.
- להוסיף אנלוגי גלוקוז (0.080 mmol, המוני יהיה תלוי המשקל המולקולרי), גלוקוז UDP (0.160 מילימול, 97.6 מ"ג), ו MgCl 2 (0.080 mmol, 16.3 מ"ג) כדי צינור חרוטי 15 מ"ל. הריכוזים הסופיים של רכיבים אלה יהיו 20 מ"מ, 40 מ"מ, ו -20 מ"מ, בהתאמה.
- להוסיף TreT טריס חיץ (המתקבל צעד 1.5.4), ואם יש צורך, נפח מתאים של חיץ טריס (50 מ"מ טריס, 300 מ"מ NaCl, pH 8.0) כדי להשיג ריכוז האנזים הסופי של 300 מיקרוגרם / מ"ל ו סופית נפח 4 מ"ל. Pipet את התערובת למעלה ולמטה בעדינות או להפוך את הצינור כדי לפזר את המוצקים.
- דגירה התגובה על 70 מעלות צלזיוס עם רועד ב 300 סל"ד במשך שעה 1, ולאחר מכן למקם את הצינור על קרח כדי לקרר.
טיהור 3. אנלוגים trehalose מתערובת התגובה האנזימטית גולמי
- טרום לשטוף יחידת מסנן צנטריפוגלי (מגבלת משקל מולקולרי הנומינלי (NWML) 10 KDA) להסיר גליצרול עקבות בקרום ידי הוספת 3 מ"ל של מים ללא יונים אל יחידת מסנן צנטריפוגלי ו centrifuging ב 3,000 XG עד שכל הנוזל עובר דרך המסנןלתוך הצינור (כ 20 דק '). חזור פעמיים נוספות. שלם צעד זה מייד לפני או במהלך התגובה (שלב 2.3).
- לאחר קירור תערובת התגובה האנזימטית (המתקבלת צעד 2.3), ולהעביר אותו אל יחידת מסנן צנטריפוגלי מראש שטופים. יש לשטוף את צינור התגובה עם 1 מ"ל של מים ללא יונים והעברה יחידת מסנן צנטריפוגלי. שטיפה חוזרת של צינור התגובה להתאוששות מקסימלית של המוצר.
- צנטריפוגה יחידת מסנן צנטריפוגלי ב 3000 XG עד שכל הנוזל עובר דרך המסנן לתוך הצינור (כ 20 דק '). יש לשטוף את החדר העליון של יחידת מסנן צנטריפוגלי עם 3 מ"ל מים צנטריפוגות deionized ב 3000 XG עד שכל הנוזל עובר דרך המסנן לתוך הצינור (כ 20 דק '). חזור שטיפה להתאוששות מקסימלית של המוצר.
- מחק את החדר העליון של יחידת מסנן צנטריפוגלי. להוסיף שרף מעורב-מיטת יון-חליפין (3 גרם) אל התסנין בתחתית הצינור (כרך התסנין הטיפוסיume הוא 8-15 מ"ל תלוי במספר שטיפות). מערבבים בטמפרטורת החדר למשך שעה 1 עם בר ומערבבים מגנטי במהירות מספיק כדי לשמור על חרוזים שרף המרחפים הפתרון.
- למזוג supernatant ולסנן אותה להסיר את השרף. הוסף 5 מ"ל מים ללא יונים לשטוף את שרף הנותרים. למזוג supernatant ולסנן אותו, שילוב עם פתרון המוצר מן decantation הראשון. שטיפה חוזרת של שרף להתאוששות מקסימלית של המוצר.
- לנתח את התגובה על ידי כרומטוגרפיה בשכבה דקה (TLC) או HPLC כדי לקבוע אם המרה מלאה של אנלוגי גלוקוז חומר המוצא למוצר אנלוגי trehalose הושגה. ראה שלב 4.1 לניתוח TLC צעד 4.2 לניתוח HPLC.
- סר מים על ידי lyophilization או אידוי סיבובי לתת המוצר היבש. אם לא אנלוגי גלוקוז unreacted נצפתה במהלך TLC או ניתוח HPLC, טיהור ידי כרומטוגרפיה הוא מיותר. לשקול את המוצר כדי לקבל את תגובת Yield ולבצע תהודה מגנטית גרעינית (NMR) ספקטרוסקופיות ניתוח (שלב 4.3) כדי לאשר מבנה המוצר וטוהר.
- אם אנלוגי גלוקוז unreacted נצפה במהלך ניתוח TLC, להפריד אותו אנלוגי trehalose באמצעות טור הדרת גודל.
- הכין טור 1 x 100 סנטימטרים המכיל תקשורת הדרת גודל חרוז polyacrylamide P2 רווי במי deionized, במיוחד קנס לפי הוראות היצרן.
הערה: עמודת הדרת הגודל ניתן לעשות שימוש חוזרת לאחר שטיפה עם מים ללא יונים. - Re-לפזר את מוצר התגובה האנזימטית היבש (המתקבל צעד 3.7) ב 0.5 מיליליטר של מים ללא יונים. החל פתרון המוצר לעמודת הדרת הגודל באופן ידני או באמצעות מתאם זרם טור. יש לשטוף את הבקבוקון שהכיל מוצר הגולמי עם 0.5 מיליליטר מי deionized, לטעון אותו לתוך טור דרת גודל.
- Elute המוצר עם מים ללא יונים על ידי זרימת כוח הכבידה ולאסוף שברים של כ -2 מ 'נפח L.
- לנתח את השברים על ידי TLC (שלב 4.1). פינת השברים המכילים אנלוגי trehalose טהור.
- סר מים על ידי lyophilization או אידוי סיבובי לתת המוצר היבש. לשקול את המוצר כדי להשיג את תשואת התגובה וממשיך ניתוח NMR (ראה שלב 4.3).
- הכין טור 1 x 100 סנטימטרים המכיל תקשורת הדרת גודל חרוז polyacrylamide P2 רווי במי deionized, במיוחד קנס לפי הוראות היצרן.
4. ניתוח של מוצרי trehalose Analogue
- בצעו כרומטוגרפיה-שכבה דקה (TLC) ניתוח של תגובת TreT.
הערה: הליך זה יכול לשמש גם כדי לנתח שברי עמודת הדרת גודל. זה עשוי להיות נחוץ כדי לרכז את שברי תערובת או עמודת תגובה לפני ניתוח TLC להתבונן מכתים המתחם על צלחת TLC.- מארק נתיבי על פני צלחת TLC עם עיפרון ולהחיל אנליטי (ים) ו תקן מתאים (ים) האחרונים הנתיבים המתאימים, לרבות תקן גלוקוז האנלוגי, התקן האנלוגי trehalose (אם קיימים), את תערובת התגובה (או השברים שנאספו דואר גודלטיהור טור xclusion), וא-נקודה co. לאחר החלת כל דגימה לצלחת TLC, לאפשר צלחת לייבוש.
הערה: לקבלת ניתוח תגובה, בדרך כלל 2 μL של מדגם מוחל על צלחת TLC. - לפתח את צלחת TLC באמצעות n -butanol / אתנול / מים ללא יונים (5: 3: 2).
- יבש את צלחת TLC המפותחות, ואז לטבול את זה ב 5% H 2 SO 4 באתנול (כתם סוכר) ומחממים על פלטה חשמלית על הגדרה גבוהה עד כתמים המכילים סוכר ניתן דמיינו (בדרך כלל 5 דקות).
- מארק נתיבי על פני צלחת TLC עם עיפרון ולהחיל אנליטי (ים) ו תקן מתאים (ים) האחרונים הנתיבים המתאימים, לרבות תקן גלוקוז האנלוגי, התקן האנלוגי trehalose (אם קיימים), את תערובת התגובה (או השברים שנאספו דואר גודלטיהור טור xclusion), וא-נקודה co. לאחר החלת כל דגימה לצלחת TLC, לאפשר צלחת לייבוש.
- ביצוע ניתוח HPLC של תערובות התגובה TreT באמצעות כל מערכת HPLC מסוגל להפריד ואיתור פחמימות. פרוטוקול זה כרוך הפרדת פחמימות באמצעות טור HPLC aminopropyl וזיהוי באמצעות מקדם שביר.
- צרף aminopropyl עמודה (4.6 x 250 מ"מ) המכיל שומר מראש עמודת HPLC.
- לאזן aminopropyl עמודה עם 80% אצטוניטריל במים deionized בקצב זרימה של 0.4 mL / min.
- טען את הפתרון של מוצר תגובה (או רגיל) על טור aminopropyl.
- Elute המוצר (או רגיל) עם 80% אצטוניטריל במים deionized בקצב זרימה של 0.4 mL / min ובטמפרטורה טור של 50 מעלות צלזיוס. בדרך כלל, זמן הריצה בשימוש הוא 40 דקות.
הערה: שניהם אנלוגי גלוקוז חומר המוצא והמוצר האנלוגי trehalose יכולים להיות מזוהה על ידי קדם שביר, אם כי שיטות אחרות כגון זיהוי פיזור אור האוויר (ELSD) יוכל לשמש. שימוש בתנאים המתוארים, אנלוגים גלוקוז בדרך כלל elute בין אנלוגים 10-15 דקות trehalose elute בין 15-25 דקות.
- ניתוח התמ"ג של אנלוגים trehalose מטוהרים.
- ממיסים אנלוגי trehalose מטוהרים D 2 O (700 μL) ולהעביר הפתרון צינור NMR.
- רוכשת 1 H ו- 13 ספקטרום C תמ"ג פי פרוטוקולי מתקן תמ"ג מתאימים.
ילדה = "jove_title"> 5. החלת-מסונתז TreT אנלוגים trehalose כדי זיהוי של Mycobacteria
- לסנתז, לטהר, ולנהל 6-TreAz למ 'smegmatis (Msmeg).
- להוסיף glucopyranose 6-azido-6-deoxy (6-GlcAz, 0.020 mmol, 4.1 מ"ג), גלוקוז UDP (0.040 mmol, 24.4 מ"ג), ו MgCl 2 (0.020 mmol, 4.1 מ"ג) כדי צינור חרוטי 15 מ"ל.
- להוסיף TreT טריס חיץ (המתקבל צעד 1.5.4) כדי להשיג ריכוז האנזים הסופי של 300 מיקרוגרם / מ"ל ו נפח סופי של 1 מ"ל. Pipet את התערובת למעלה ולמטה בעדינות או להפוך את הצינור כדי לפזר את המוצקים.
- דגירת התגובה על 70 מעלות צלזיוס עם רעד במשך 15 דקות.
- לדלל את תערובת התגובה האנזימטית עם 3 מ"ל של מים ללא יונים ולהעביר אותו ליחידה מסנן צנטריפוגלי מראש שטף (NMWL 10 KDA). צנטריפוגה יחידת מסנן ב 3000 XG עד שרוב הנוזל עובר דרך המסנן לתוך הצינור, כ 10 דק '.
- ה מחקתא דואר העליון של יחידת מסנן צנטריפוגלי. להוסיף שרף מעורבת-מיטה יון-חליפין (0.75 גר ') אל הצינור ומערבבים / שייק בטמפרטורת החדר למשך 25 דקות. למזוג supernatant ולסנן אותה להסיר את השרף.
הערה: שלבים 5.1.1-5.1.5 לספק בתמיסה מימית של 6-azido-trehalose (6-TreAz) בכ -5 ריכוז מ"מ פחות מ -1 שעה. ריכוז 5 המ"מ נאמד על בסיס ההמרה כמוני של מצע למוצר ואת הדילול שלוקח מקומות במהלך השלבים לטיהור, בהנחת הפסד מינימאלי של המוצר במהלך השלבים הבאים. הפתרון יכול להיות סטרילי, מסוננים לפני בנוסף דגימה ביולוגית אם תרצה בכך. - להוסיף הנפח המתאים של פתרון מוצר 6-TreAz לתרבות יומן פאזיים של מ smegmatis (Msmeg), בדרך כלל כדי להשיג נפח תרבות סופי של 100-1,000 μL וריכוז 6-TreAz סופי של ~ 25 מיקרומטר. דגירת התאים ב 37 מעלות צלזיוס למשך פרק הזמן הרצוי, בדרך כלל 60 דקות.
- בצע לחץ כימיה כדי להטות fluorophore לתאים שכותרתו יזידו. בפרוטוקול זה, השתמש cycloaddition Cu-catalyzed אזיד-אלקין (CuAAC) כדי לספק fluorophore כדי azides-פני תא Msmeg.
- צנטריפוגה התאים ב 3,900 XG במשך 5 דקות, ולאחר מכן לשטוף את התאים עם PBS המכיל אלבומין 0.5% שור. חזור פעמיים.
- Re- להשעות את התאים pelleted ב 4% para-הפורמלין PBS לתקן אותם. לאחר דוגרים במשך 10 דקות, חזור על שלב 5.2.1 כדי לשטוף את התאים.
- Re- להשעות תאים pelleted ב 138 μL PBS.
- להוסיף 3 μL של פתרון המניות 1 מ"מ של אלקין-carboxyrhodamine 110 (אלקין-488) ב DMSO.
- להוסיף 3 μL של פתרון מוכן טרי 60 מ"מ המניות של ascorbate נתרן במים deionized.
- להוסיף 3 μL של פתרון המניות 6.4 מ"מ של טריס [(1-בנזיל-1H-1,2,3-triazol-4-י.ל.) מתיל] אמין (TBTA) ב טרט -butanol / dimethylsulfoxide (DMSO) 4: 1.
- הוסף 3 & #956; L של פתרון המניות 50 מ"מ של CuSO 4 במים deionized.
- Pipet למעלה ההשעיה תא ולמטה, ואז דגירה בחושך בטמפרטורת החדר למשך 30 דקות.
- חזור על שלב 5.2.1 כדי לשטוף את התאים. מחדש להשעות את התאים 150 μL PBS.
- ביצוע ניתוח הקרינה הסלולרית. בפרוטוקול זה, השתמש מיקרוסקופ פלואורסצנטי לדמיין קרינה סלולרית של Msmeg שכותרתו.
- הוסף 10 μL של תאים חיידקיים המרחפים PBS לשקופית מיקרוסקופ קלות להפיץ את הנוזל לתוך שכבה דקה באמצעות קצה coverslip. אפשר לייבוש באוויר בחושך.
- הוסף 10 μL של מדיום גובר על המדגם המיובש, ולאחר מכן למקם תלושים לכסות על המדגם וליישם דבק (למשל, לק) כדי לשתק.
- תמונה שקופיות באמצעות מיקרוסקופ פלואורסצנטי בהגדלה 100X.
תוצאות
ט Tenax TreT התקבל בחיידק הזה תשואה של כ -4 מ"ג / L להשתמש בביטוי חלבון סטנדרטי טכניקות טיהור. צעד כרומטוגרפיה זיקת ניקל יחיד היה מספיק כדי לטהר TreT מן lysate coli (עקבות FPLC נציג מוצגות באיור 4). כפי שנקבע בפרסום הראשוני שלנו על תהליך הסינ?...
Discussion
אנלוגים trehalose יש פוטנציאל להשפיע בתחומים שונים, החל משימור מזון ותרופות כדי אבחון וטיפול של זיהומים חיידקים 6. שיטות קיימות סינתזה כימית רבות שלבים שימושיות להפקת אנלוגים trehalose מורכבים עם מספר אתרים של שינוי (למשל, המתרחשים glycolipids mycobacterial מורכב באופן...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Materials
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
References
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved