JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
빠른 한 단계 효소 합성 및 트레 할로 오스 유사체의 모든 수계 정화
요약
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
초록
화학적으로 트레 할로 오스 또는 트레 할로 오스 유사체의 버전을 수정, 다른 분야들 사이 생물학, 생명 공학, 제약 과학에서 응용 프로그램을 보유하고 있습니다. 예를 들어, 검출 가능한 태그 담 트레할로스 유사체는 결핵균을 검출하기 위해 사용 된 결핵 진단 조영제로서 응용을 가질 수있다. 트레 할로 오스의 가수 분해 안정 버전 인해 비 칼로리 감미료 및 바이오 보호용 에이전트로 사용하기 위해 자신의 잠재력을 추구하고있다. 다양한 애플리케이션에 대한 이러한 부류의 화합물의 호소력에도 불구하고, 이들 전위는 그들의 제조를위한 강력한 경로의 부족으로 이루어지지 남아있다. 여기서는 화학 합성과 관련된 문제를 우회 트레할로스 유사체의 신속하고 효율적인 원스텝 생 촉매 합성 상세한 프로토콜을보고한다. 테르 모 프로테우스 속에서 TENAX에서 열 안정성 트레할로스 합성 효소 (TreT) 효소를 이용하여, 트레 할로 오스 유사체는 generat라는 될 수 있습니다에드 포도당 유사체 및 높은 수율 딘 인산 포도당에서 하나의 단계 (정량 전환까지) 15-60 분입니다. 스핀 투석 및 이온 교환 이루어져 간단하고 신속하게 비 - 크로마토 그래피 정제 프로토콜은 적은 45 분에 수용액에서 알려진 농도의 다양한 트레할로스 유사체를 제공 할 수있다. 반응 글루코오스 유사체가 남아 경우, 트레할로스 아날로그 생성물의 크로마토 그래피 정제가 수행 될 수있다. 전반적으로,이 방법은 비 화학자 효율적이고 신속한 접근 할 수있는 합성 및 트레할로스 유사체 정화용 "녹색"생 촉매 플랫폼을 제공한다. 이 방법의 적용 성을 예시하기 위해서, 합성 모든 수성 정제 프로토콜을 기술하고, 마이코 박테리아의 형광 검출을 1 시간 미만을 가져다 사용할 모두 결핵균에 트레 할로 오스 계 클릭 화학 프로브의 투여. 미래에, 우리는 OTH들 것을 구상애플리케이션 ER,이 프로토콜은 결핵 진단 트레할로스 기반 프로브의 신속한 합성을 적용 할 수있다. 같은 양전자 방출 단층 촬영 - 컴퓨터 단층 촬영 (PET-CT) 등 (예를 들면, 18 F 변성 트레할로스) 고급 임상 이미징을 위해 사용될 수있는 예를 들어, 단기 핵종 변성 트레할로스 유사체.
서문
트레할로스는 1,1-α, α-글리코 시드 결합 (도 1a)에 의해 결합 된 두 개의 글루코스 잔기로 구성된 대칭 비 환원성 이당이다. 트레할로스는 인간 및 다른 포유 동물에서 존재하지 않는 반면, 박테리아, 곰팡이, 식물, 무척추 동물 (1)에 일반적으로 발견된다. 대부분의 유기체 트레할로스의 주요 역할은 탈수 한 환경 적 스트레스로부터 보호하는 것이다. 또한, 일부 인간 병원체 셀 봉투 생합성 중재자와 면역 당지질 2의 구성에 대한 빌딩 블록으로서 트레할로스를 이용하여 결핵을 유발 결핵균 포함한 독성에 대한 트레 할로 오스를 필요로한다.
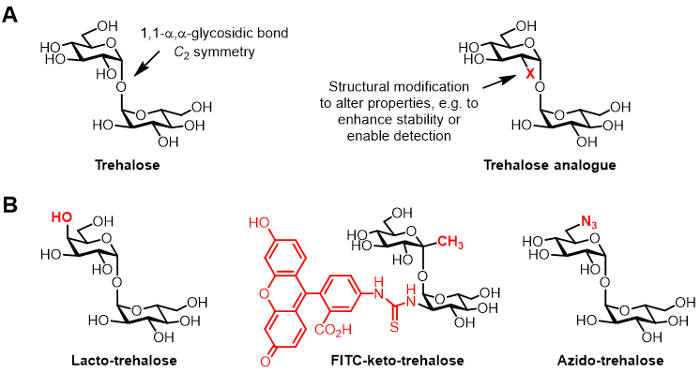
그림 1 : 트레 할로 오스 트레 할로 오스 유사체. (AX는 구조적인 변경 천연 트레 할로 오스와 부 자연스러운 트레 할로 오스 아날로그의) 구조. biopreservation 및 bioimaging 응용 가능성이 문헌에보고 트레할로스 유사체의 (B) 예.
그것의 독특한 구조와 생리 기능에, 트레 할로 오스는 논리 바이오 (테크노)의 사용 및 생물 의학 응용 프로그램 3 상당한 관심을 받고있다. 자연 - 예에서 관찰 트레 할로 오스의 보호 특성은 눈에 띄는 기능은 4 봤어이 biopreservation 애플리케이션에 광범위한 사용을 가했다 극도의 탈수를받은 "부활"식물에서 생명을 유지하는 데 도움. 트레할로스는 핵산, 단백질, 세포 및 조직과 같은 생물학적 시료 (3)의 다양한 배열을 유지하기 위해 사용되었다. 예를 들면, 트레 할로 오스는 제약 t 다수의 안정화 첨가제로서 사용모자 여러 항암 모노클로 날 항체 (3)를 포함하여 시판된다. 뿐만 아니라, 트레 할로 오스는 식품 산업에서 감미료로 사용되며, 광범위 모두 식품 및 화장품 산업에서의 제품의 보존에 사용된다. 상용 애플리케이션의 이러한 유형에 대한 트레 할로 오스의 채용은 처음 천연 공급원 또는 합성을 통해 순수 트레할로스 벌크 수량을 얻을 수 없다는 의해 제한되었다. 그러나, 전분 트레할로스의 경제적 생산을위한 효율적인 효소 처리는 최근 널리 상업적 이용을 가했다하는 개발 된 5.
(6) 화학적으로 트레 할로 오스 유도체, 변성 (도 1b에 도시 트레할로스 유사체의 특정 예를 일반적인 구조는도 1a에 도시 된) 다양한 애플리케이션에 대한 관심 증가를 얻고, 트레할로스 유사체로 지칭. 예를 들어, 락토 트레할로스, 따라서 그것의 4 위치 수산기가 반전 된 입체 구조를 갖는다 갈락토스 치환의 글루코오스 단위 중 하나로 트레 유사체이다. 락토 트레 할로 오스 트레 할로 오스와 같은 안정화 특성을 가지고 있지만, 비 칼로리 식품 첨가물 6,7대로 매력적 장내 효소 분해에 내성이다.
트레 할로 오스 유사체에 우리 그룹의 관심은 주로 결핵균 특이 프로브 및 억제제로서 자신의 가치에 관한 것이다. 배리 데이비스 그룹은 형광 현미경 (8)의 검출을 가능하게 대사 라이브 결핵균의 세포벽을 라벨에 표시 된 FITC 케토 트레 할로 오스라는 이름의 형광 접합 케토 트레 할로 오스 아날로그를 개발. Bertozzi 연구소는 대사 탐지 할 수 이후 세포벽 레이블 및 수있는 작은 아지 트레 할로 오스 (TreAz) 유사체를 개발반사된다 클릭 화학 형광 분석 (9)를 사용. 이러한 발전은 결핵 진단 조영제로 트레할로스 기반 프로브를 사용할 수있는 가능성을 지적한다. 트레할로스 유사체는 생존하고 독성도 10,도 11,도 12에 필수적인 세균의 경로를 방해하기 때문에 그 전위에 결핵균의 억제제로 진행되고있다.
지금까지 생체 (테크노) 논리 및 생의학 애플리케이션을 위해 트레할로스 유사체를 개발하는 주요 장애물은 효율적인 합성 방법의 부족이다. 트레 할로 오스 유사체를 생산하는 두 개의 전통적인 노선들은 화학 합성에 (그림 2) 의존한다. 다른 제대로 작용 단당류 빌딩 블록으로 시작하고 화학 글리코 실화를 수행하는 동안 수반 한 경로는 자연 트레할로스 desymmetrization / 수정을 포함1,1-α, α-글리코 시드 결합을 위조. 최근 리뷰 기사 13, 14에서 논의 된 이러한 접근은 결핵균 (15)로부터 같은 sulfolipid-1과 같은 복잡한 트레 할로 오스 함유 천연 제품, 소량의 다단계 합성을 수행하기위한 유용한 입증했다. 그러나, 두 방식이 아닌 화학자 일반적으로, 시간 - 소모적 액세스 비효율적이며, 또한 환경 친화적 인 것으로 간주되지 않는다. 따라서, 트레 할로 오스 유사체의 특정 유형을 합성, 이러한 전략은 적합하지 않다.
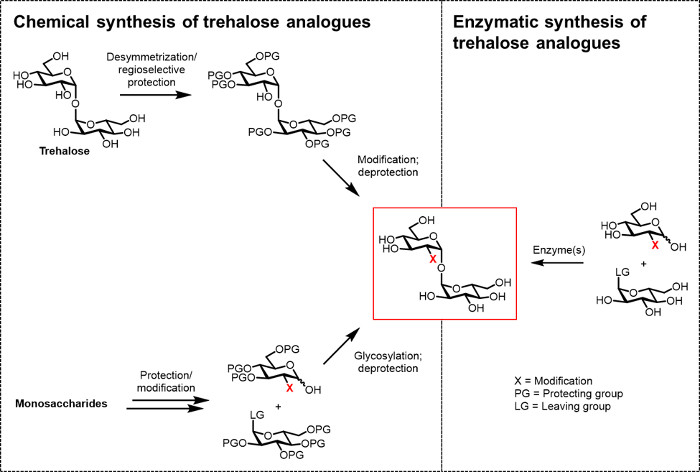
그림 2 : 트레 할로 오스 아날로그 합성에 접근. 화학 왼쪽 그림, 트레 할로 오스 아날로그 합성에 접근, 어려운 PROTEC을 포함 다단계 절차를 사용하여기 / 탈 보호, desymmetrization 및 / 또는 당화 단계. 오른쪽 그림과 효소 합성, 입체 수용액에서 유사체를 트레 할로 오스 간단, 보호되지 않은 기판을 변환 효소 (들)를 사용합니다. 본원에보고 된 효소 프로토콜은 단일 단계로 오스 글루코오스 유사체로 유사체 및 UDP 글루코스로 변환하는 트레할로스 합성 효소 (TreT) 효소를 사용한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
트레할로스 유사체하는 효율적인 생 촉매 경로 분자 유망한 클래스의 제조, 평가하고, 프로그램을 촉진한다. 트레할로스 생산 5 상업적 효소 프로세스가 기재로서 전분을 이용하기 때문에 유사체의 합성에 적용 할 수는 없지만, 다른 생합성 경로에 존재트레 할로 오스 아날로그 합성에 이용 될 수있다 자연의 방법. 그러나, 최근 6을 검토하고이 지역에있는 연구는 제한적이었다. 한 보고서는 해당 플루오로 포도당에서 하나의 플루오로 트레 할로 오스 아날로그에 액세스 할 수 대장균 트레 할로 오스 생합성 경로에서 영감을하는 방법을 사용했다. 그러나,이 방법은 효율성과 보편성 8 제한적 세 효소 시스템을 필요로한다. 탐색 된 다른 방법은 원칙적으로 당 유사체 및 글루코스 -1- 인산 6, 16, 17에서 트레 할로 오스 유사체의 한 단계 합성을 허용 역방향에서 오스 포스 (TreP)를 사용하는 것이다. 이 접근 방식은 미래의 약속을 가질 수 있지만, 모두 반전 및 유지 이윤이 쏠쏠 히 남는는 현재 아날로그 합성 단점이있다. 예를 들어, 반전 이윤이 쏠쏠 히 남는는 엄청나게 expe의이nsive 기증자 분자 (β-D- 글루코오스 -1- 인산) 및 유지 이윤이 쏠쏠 히 남는 가난한 효소 발현 수율 / 안정성 및 제한 기판 성행위 있습니다. (효소 공학을 통해 예) 상당한 개선이 TreP 매개 아날로그 합성하기 전에 필요한 것은 실용적입니다.
현재, 트레할로스 유사체의 효소 적 합성을위한 가장 실용적인 방법은 포도당, 우리 딘 디 포스페이트 (UDP)이 단일 단계 6에서 트레 할로 오스 변환 글루코스 신타 제 (TreT) 효소를 사용하는 것이다. 최근 글루코오스 유사체 및 UDP 글루코스 (도 3) (19)로부터 트레할로스 유사체를 합성 -to 테르 모 프로테우스 속 TENAX-TreT 내열성 단방향 효소 (18)의 사용을보고 하였다. 이 효소는 합성 방향으로 동작하며 TreP 시스템에서 발견 트레할로스 열화의 문제를 피할 수있다. 이것은 단계 반응 coul1 시간 내에 완료 D 및 쉽게 사용할 글루코오스 유사체 기판 (대표 결과 표 1 참조에서 (고성능 액체 크로마토 그래피 (HPLC)에 의해 측정> 99 %까지) 트레할로스 유사체의 광범위한 다양한 고 수율로 액세스 된 섹션).
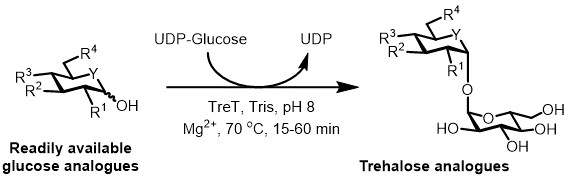
도 3 : 트레 할로 오스 유사체 TreT 촉매 작용 한 단계 합성. T.의 TENAX에서 TreT 효소는 입체 한 번에 트레 할로 오스 유사체를 형성하기 위해 쉽게 사용할 포도당 유사체 및 UDP - 포도당을 가입 할 수 있습니다. R 1 -R 4 = 변수 구조 변경, 예를 들어, 아지, 플루오로, 데 옥시, 싸이, 입체, 또는 동위 원소 라벨 변경에 대한; Y는 예를 들어 산소 또는 황, 또는 동위 원소로 표지 된 헤테로 가변 헤테로 =.
여기, 우리는 광고를 제공TreT 반응 조건에 최적화 된 대장균으로부터 발현 및 정제 TreT 포함한 TreT 합성 공정 etailed 프로토콜, 및 성상 전적으로 수행하는 개선 된 정제 방법. 이 수정 된 프로토콜은 반 예비 규모 (10 ~ 100 mg)을에 다양한 트레 할로 오스 유사체의 편법하고 효율적인 합성 및 정제 할 수 있습니다. 또한 제조 및 마이코 박테리아 세포의 급속한 형광 검출을 가능 1 시간 미만에서 마이코 박테리아에 트레할로스 기반 프로브를 관리하기위한 이러한 프로토콜의 사용을 입증한다.
프로토콜
상위 10 위 대장균 1. 발현 및 TreT의 정제
주 : TreT 발현 대장균 요청할 저자 연락하십시오 첨부 물질 전달 계약 (상위 10 위 E.로 변환 된 AraC 단백질의 제어하에 T.에 TENAX의 tret 유전자를 함유 pBAD TreT 플라스미드 19 대장균) . 다음 프로토콜은 일반적으로 약 4 ㎎ / ℓ의 단백질 수율을 제공합니다.
- 대장균을 TreT가 발현의 3 mL의 야간 문화를 준비합니다.
- 원성 육즙 (LB) 100 μg의 / ㎖의 앰피 실린을 함유하는 아가 플레이트 pBAD-TreT 발현 벡터로 형질 전환 킬 상위 10 위 대장균.
- 약 37 ℃에서 48 시간 동안 플레이트를 인큐베이션.
- 플레이트에서 하나의 식민지를 선택하고 문화 튜브에 100 μg의 / ㎖의 암피실린을 포함하는 LB 액체 배지의 3 mL를 접종.
- 37 & #에서 진탕 배양기에서 튜브를 배치176; C 하룻밤 175 RPM을 X.
- 대장균 TreT이 발현 된 단백질의 발현을 유도한다.
- 추가 750 mL를 좋아요 국물은 2,800 mL의 FERNBACH 문화 플라스크에 100 μg의 / ML의 암피실린로 보충. 빈으로 나중에 사용하기 위해 큐벳에 플라스크에서 전송 한 ML의 국물.
- 문화 플라스크 단계 1.1.4에서 생성 된 3 mL의 하룻밤 문화를 추가 한 후 인큐베이터에서 플라스크를 배치하고 37 ° C X 200 rpm으로 흔들. 주기적으로 단계 1.2.1에서 수집 한 빈 대 600 nm에서 문화의 흡광도를 확인합니다.
- 0.5-1.0 사이 도달 내지 600 nm에서의 흡광도되면 배양 1 M 용액 아라비 노스 (1 mM의 최종 농도) 750 μL를 첨가하여 TreT 발현을 유도한다. 인큐베이터에 플라스크를 돌아 X 200 rpm으로 37 ° C에서 하룻밤 흔들.
- 펠렛은 TreT 발현하는 대장균을 용균하고.
- 폴리 프로필렌 (B)에 문화를 전송ottle 4 ° C에서 4,000 XG에 15 분 동안 원심 분리기.
- 뜨는을 취소하고 인산염 완충 식염수 15 ㎖ (PBS)의 펠렛을 다시 일시 중지합니다.
- 4 ° C에서 4,000 XG에 15 분 동안 50 ML 원뿔 튜브와 원심 분리기에 세포 현탁액을 전송합니다. 뜨는을 취소하고 하나 용해 (단계 1.3.4)를 세포 또는 -80 ° C에서 무기한 펠렛을 저장하기 위해 진행합니다.
- 한 50㎖ 원추형 튜브에 세척 완충액 (50 mM의 NaH를 2 PO 4, 500 mM의 염화나트륨, 20 mM의 이미 다졸, pH를 8.0) 20㎖에 한 미니 프로테아제 억제제 정제를 용해.
- 펠렛을 함유하는 원뿔형 튜브에 단백질 분해 효소 억제제 - 함유 세척 완충액을 전송. 펠릿 때까지 소용돌이는 다시 일시 중단됩니다.
- (75 % 진폭에서 2 분 15 초 실행 시간과 오프 45 초 45 초의 펄스 시퀀스)를 100ml의 비커에 재 현탁 세포를 전송하고 초음파로 세포를 용균.
- 50㎖의 금속 원추형 튜브 해물 전송4 ° C에서 15,000 XG에 60 분 동안 원심 분리기.
- 한 50㎖ 원추형 튜브에 0.2-0.45 ㎛의 주사기 필터를 통과하여 분해물을 명확히.
참고 얻어지는 파쇄물의 전형적인 농도 / ㎖ 100 밀리그램이다.
- 고속 단백질 액체 크로마토 그래피 (FPLC)를 사용하여 E. 콜라이 세포 용 해물로부터 정제 TreT.
- 니켈 친 화성 칼럼 (5 ㎖ 침대 볼륨)으로 FPLC를 설정합니다. 탈 이온수 10 mL로 또는 열이 어떤 오염 물질이 깨끗해질 때까지 열을 씻으십시오. 세척 완충액 20 ㎖를 사용하여 열 평형 (50 밀리미터의 NaH 2 PO 4, 500 mM의 염화나트륨, 20 mM의 이미 다졸, pH를 8.0) 1 mL / 분의 유속.
- 칼럼 상 단계 1.3.8에서 얻어진 용 해물 (20 ㎖)을로드하고 흡광도 배경 수준에 도달 할 때까지 1 mL / 분의 유속으로 세척 완충액으로 태그되지 않은 단백질을 용출 (세척 완충액 중 통상 80 ~ 100 mL의 필요) .
- 용출 선형 g을 사용하여 TreT을 그의 - 태그1 mL / 분의 유속으로 60 분에 걸쳐 1-100%에서 용출 완충액 (50 mM의 NaH를 2 PO 4, 500 mM의 NaCl을 250 mM의 이미 다졸, pH를 8.0)의 radient. TreT이 용출하고 흡광도가 기준선 수준에 도달 할 때까지 4 ML의 분수를 수집합니다.
주 : 일반적으로, 용출 완충액 60 mL의 단백질을 용출하기 위해 필요하며, 단백질은 60-100% 용출 완충액 범위에서 용출. 약 용출 버퍼의 순수한 TreT 10 ~ 15 mL를 얻을 수있다. - 용출 버퍼 빈에 대한 280 nm에서 흡광도를 측정하여 TreT의 농도를 결정합니다.
- 트리스으로 교환 TreT 투석에 의해 (히드 록시 메틸) 아미노 메탄 (트리스) 버퍼입니다.
- 제조업체의 지시에 따라 투석 튜브를 제조 한 후, 탈 이온수 다음 트리스 완충액 (50 mM 트리스, 300 mM의 염화나트륨, pH를 8.0)으로 세척하여 프라임.
- 주사기와 무딘 바늘을 사용하여 투석 튜브에 TreT 샘플을로드합니다. 하룻밤을 투석트리스 완충액 2 L gainst.
- 투석 세척 수집 빈에 대해 280 nm에서 흡광도를 측정하여 TreT의 농도를 결정한다.
- 50 ML 원뿔 튜브에 TreT 솔루션을 전송하고, 트레 할로 오스 아날로그 합성 (2 단계)로 진행 또는 4 ℃에서 효소를 저장합니다.
참고 : TreT는 내열성 단백질이다. TreT 활동의 상당한 손실을 관측하지 않고 몇 달 동안 4 ℃에서 트리스 버퍼에 저장 하였다.
TreT 효소를 사용하여 트레 할로 오스 유사체 2. 한 단계의 합성
주 :이 프로토콜은 아래의 반응 효율 및 제품의 분자량에 따라 아날로그 오스 약 15 내지 30 ㎎을 전달할 수 4 mL의 부피에 기초하여, 반응 스케일을 설명한다. 반응 구성 요소를 원하는 경우 다소 트레 할로 오스 아날로그를 얻기 위해 확장 할 수 있습니다.
- (0.080 몰, 질량이 분자량에 따라 달라집니다) 포도당 유사체를 추가, UDP - 포도당 (0.15 ML 원뿔 관 160 밀리몰, 97.6 mg)을, 및 (0.080 밀리몰의 MgCl 2, 16.3 mg)을 얻었다. 이러한 구성 요소의 최종 농도는 각각 20 밀리미터, 40 밀리미터, 20 밀리미터이 될 것입니다.
- 필요한 경우 트리스 완충액의 적절한 양 (50 mM의 트리스, 300 mM의 염화나트륨, pH를 8.0) 300 μg의 / mL의 최종의 최종 효소 농도를 달성하기 위해 (단계 1.5.4로부터 구입) 트리스 완충액 TreT 추가 및 4 mL의 부피. 피펫은 혼합물을 상하로 부드럽게 또는 고체를 용해 튜브를 반전한다.
- 1 시간 동안 300 rpm으로 진탕 70 ° C에서 반응을 품어 후 냉각 얼음에 튜브를 배치합니다.
조 효소 반응 액으로부터 트레할로스 유사체 3. 정제
- 모든 액체가 필터를 통과 할 때까지 원심 필터 부 탈 이온수 3 mL로 첨가하고, 3,000 × g으로 원심 분리하여 막 중의 미량 글리세롤을 제거하기 위해 원심 분리 필터 장치 (명목 분자량 한계 (NWML) 10 kDa의)을 사전 린스튜브로 (약 20 분). 두 개의 추가 번 반복합니다. 직전 또는 반응 (단계 2.3) 동안이 단계를 완료합니다.
- (단계 230에서 얻은) 효소 반응 액을 냉각시킨 후, 미리 세정 원심 필터 유닛으로 옮긴다. 원심 필터 부 탈 이온수 및 전사 1 mL로 반응 관을 헹군다. 생성물의 최대 회수하는 반응 관의 세정을 반복.
- 모든 액체가 튜브 (약 20 분)에 필터를 통과 할 때까지 3000 XG에서 원심 필터 장치를 원심 분리기. 모든 액체가 튜브 (약 20 분)에 필터를 통과 할 때까지 3000 XG에 탈 이온수 및 3 ㎖ 원심 분리기로 원심 분리 필터 유닛의 상부 챔버를 씻어. 제품의 최대 복구를 위해 세척을 반복합니다.
- 원심 필터 유닛의 상부 챔버를 버린다. 튜브 (일반 여과 부피의 하단 여액에 혼합 베드 이온 교환 수지 (3g)를 첨가UME는 헹굼 수에 따라 8-15 ㎖)이다. 용액에 현탁 수지 입자를 유지하기에 충분한 속도에서 자기 교반 막대로 1 시간 동안 실온에서 교반 하였다.
- 상등액을 경사 분리하고 상기 수지를 제거하도록 필터. 나머지 수지를 씻어 탈 이온수 5 mL를 추가합니다. 상등액을 경사 분리하고 상기 제 경사 분리로부터의 생성물 용액을 결합하여 필터. 제품의 최대 복구를위한 수지의 반복 세척.
- 트레할로스 아날로그 제품을 출발 물질 글루코오스 유사체의 완전한 전환이 달성되었는지 여부를 결정하기 위해 박층 크로마토 그래피 (TLC) 또는 HPLC에 의해 반응을 분석한다. TLC 분석 단계 4.1 참조 및 HPLC 분석을 위해 단계 4.2.
- 건조 된 제품을 제공하기 위해 동결 건조 또는 회전 증발에 의해 물을 제거합니다. 미 반응 글루코오스 유사체은 TLC 또는 HPLC 분석에서 관찰되지 않으면, 크로마토 그래피는 필요가 없다. 반응 yie를 얻기 위해 제품의 무게LD 및 핵 자기 공명을 수행는 (NMR) 분광 분석 (단계 4.3) 제품 구조 및 순도를 확인합니다.
- 반응 글루코오스 유사체는 TLC 분석에서 관찰 한 경우에, 크기 배제 컬럼을 사용하여 트레 할로 오스, 아날로그에서 분리.
- 제조업체의 지침에 따라 탈 이온수 포화, 여분의 미세 P2 폴리 아크릴 아미드 비드 크기 배제 매체를 포함하는 1 × 100cm 열을 준비합니다.
주 : 크기 배제 컬럼을 탈 이온수로 세척 후 재사용 될 수있다. - 재용 건조 효소 반응 생성물을 탈 이온수 0.5 ㎖의 (단계 3.7로부터 구입). 수동 크기 배제 컬럼 또는 열 흐름 어댑터를 사용하여 제품 솔루션을 적용한다. 탈 이온수 다른 0.5 mL를 조질 생성물을 함유 바이알 린스 및 크기 배제 컬럼에로드.
- 중력 유동에 의해 탈 이온수로 생성물을 용리 약 2m의 분획을 수집L 양.
- TLC (단계 4.1)에 의해 분수를 분석합니다. 순수한 트레할로스 유사체를 함유하는 분획을 풀.
- 건조 된 제품을 제공하기 위해 동결 건조 또는 회전 증발에 의해 물을 제거합니다. 반응 수율을 얻고 NMR 분석을 진행 할 수있는 제품을 체중 (단계 4.3 참조).
- 제조업체의 지침에 따라 탈 이온수 포화, 여분의 미세 P2 폴리 아크릴 아미드 비드 크기 배제 매체를 포함하는 1 × 100cm 열을 준비합니다.
트레 할로 오스 아날로그 제품 4. 분석
- TreT 반응의 박층 크로마토 그래피 (TLC) 분석을 수행한다.
주 :이 절차는 또한 크기 배제 칼럼 분획물을 분석하는데 사용될 수있다. 이는 TLC 플레이트 상에 화합물 염색을 관찰 할 TLC 분석에 앞서 반응 혼합물 또는 열 분획을 농축 할 필요가있다.- 마크 연필로 TLC 플레이트 상에 레인 수집 적절한 글루코오스 유사체 표준 트레할로스 아날로그 표준 (사용 가능한 경우), 반응 혼합물을 포함한 레인 (또는 분획 분석 물 (들)과 관련 표준 (들)에 적용 크기 전자xclusion 컬럼 정제), 및 공동 스폿. TLC 판에 각각의 샘플을 적용한 후, 플레이트가 건조 할 수 있습니다.
비고 : 반응 분석을 위해 샘플을 통상 2 μL를 TLC 플레이트에인가된다. - n 개의 부탄올 / 에탄올 / 탈 이온수를 사용하여 TLC 판 개발 (5 : 3 : 2).
- 설탕 함유 명소가 (일반적으로 5 분)을 시각화 할 수있을 때까지 다음 높은 설정에 핫 플레이트에 에탄올 (사탕 얼룩) 및 열에서 5 % H 2 SO 4를 찍어, 개발 TLC 판을 건조시킵니다.
- 마크 연필로 TLC 플레이트 상에 레인 수집 적절한 글루코오스 유사체 표준 트레할로스 아날로그 표준 (사용 가능한 경우), 반응 혼합물을 포함한 레인 (또는 분획 분석 물 (들)과 관련 표준 (들)에 적용 크기 전자xclusion 컬럼 정제), 및 공동 스폿. TLC 판에 각각의 샘플을 적용한 후, 플레이트가 건조 할 수 있습니다.
- 분리 탄수화물을 검출 할 수있는 임의의 HPLC 시스템을 사용 TreT 반응 혼합물의 HPLC 분석을 수행한다. 이 프로토콜은 굴절율을 이용하여 아미노 프로필 HPLC 컬럼 및 검출을 이용하여 분리 탄수화물을 포함한다.
- HPLC에 미리 열 가드를 포함 아미노 프로필 컬럼 (4.6 × 250 mm)를 연결합니다.
- 0.4의 유속을 탈 이온수에 80 % 아세토 니트릴 아미노 칼럼을 평형화용액 / 분.
- 아미노 프로필 열 상 반응 생성물 (또는 표준)의 솔루션을로드합니다.
- 0.4 mL / 분의 유속 및 50 ℃의 칼럼 온도에서 탈 이온수 중 80 % 아세토 니트릴 제품 (또는 표준)을 용리시킨다. 일반적으로 사용되는 실행 시간은 40 분입니다.
주 : 이러한 증발 광산란 검출 (ELSD)과 같은 다른 방법을 사용할 수 있지만 당 유사체를 출발 물질 및 트레할로스 아날로그 제품 모두는 굴절률에 의해 검출 될 수있다. 분, 트레 할로 오스 유사체는 15 ~ 25 분 사이에 용출 10 ~ 15 사이에 기술 된 조건을 사용하여, 포도당 유사체는 일반적으로 용출.
- 정제 트레할로스 유사체의 NMR 분석.
- D 2 O (700 μL)의 정제 된 트레할로스 유사체를 용해 및 NMR 튜브 용액 옮긴다.
- 1 H NMR 적절한 설비 프로토콜에 따라 13 C NMR 스펙트럼을 획득.
(5)에게. 마이코 박테리아의 검출에 TreT 합성 트레 할로 오스 유사체의 응용 프로그램
- , 합성 정제 및 M. smegmatis에 6 TreAz (Msmeg)를 관리 할 수 있습니다.
- 15 ML 원뿔 튜브에 6 아지 6 데 옥시의 글루 코피 라노스 (6 GlcAz, 0.020 몰, 4.1 mg)을, UDP - 포도당 (0.040 몰, 24.4 mg)을, 그리고의 MgCl 2 (0.020 몰, 4.1 mg)을 추가합니다.
- 300 μg의 / ㎖의 최종 효소 농도와 1 ㎖의 최종 부피를 달성하기 위해 (단계 1.5.4로부터 구입) 트리스 완충액 TreT 추가. 피펫은 혼합물을 상하로 부드럽게 또는 고체를 용해 튜브를 반전한다.
- 15 분 동안 진탕 70 ° C에서 반응을 품어.
- 탈 이온수 3 mL로 효소 반응 혼합물을 희석하고, 미리 세척 원심 필터 유닛 (10 kDa의 NMWL)로 전송. 대부분의 액체는 대략 튜브에 필터를 통해 10 분을 통과 할 때까지 3000 XG에 필터 장치를 원심 분리기.
- 취소 일원심 필터 유닛의 전자 다락방. 25 분 동안 실온에서 교반하고 튜브 / 흔들림 혼합 베드 이온 교환 수지 (0.75 g)를 추가한다. 상등액을 경사 분리하고 상기 수지를 제거하도록 필터.
주의 : 단계 5.1.1-5.1.5 1 시간 미만 5㎜ 정도의 농도로 6 아지 트레할로스 (6- TreAz)의 수용액을 제공한다. 5 mM의 농도는 제품 기판의 정량적 변환 단계 동안 생성물의 최소 손실을 가정하고, 정화 단계 동안에에 대한 소요 희석에 기초하여 추정된다. 용액을 멸균 여과 원한다면 생물학적 샘플에 첨가하기 전에 될 수있다. - 100-1,000 μL의 최종 배양 부피 및 25 μM ~ 최종 6 TreAz 농도를 달성하기 위해 일반적으로 M. smegmatis의 로그 상 문화 (Msmeg) 6- TreAz 생성물 용액의 적절한 용적을 추가한다. 시간의 원하는 양 일반적 60 분 동안 37 ℃에서 세포를 인큐베이션.
- 아 지드 표지 세포에 형광 공역하기 위해 화학을 클릭 수행합니다. 이 프로토콜에서 Msmeg에서 세포 표면 아 지드에 형광 물질을 제공하기 위해 구리 - 촉매 아 지드 - 알킨 사이클로 (CuAAC)를 사용합니다.
- 5 분 동안 3,900 XG에서 세포를 원심 분리하고 PBS 0.5 % 소 혈청 알부민을 함유하는 세포를 세척 하였다. 두 번 반복합니다.
- 이를 해결하기 위해 PBS에 4 % 파라 포름 알데히드의 펠렛 세포를 다시 일시 중지합니다. 10 분 동안 배양 한 후, 세포를 세척하는 단계 5.2.1를 반복합니다.
- 138 μL PBS에서 펠렛 세포를 다시 일시 중지합니다.
- DMSO의 알킨-carboxyrhodamine 110 (알킨-488)의 1 ㎜ 주식 솔루션의 3 μL를 추가합니다.
- 탈 이온수에 아스 코르 빈산 나트륨의 새로 제조 한 60 mM의 원액의 3 μL를 추가합니다.
- 을 t- 부탄올 / 디메틸 설폭 트리스 [(1- 벤질 -1H- 1,2,3- 트리아 졸 -4- 일) 메틸] 아민 (TBTA)의 6.4 mM의 스톡 솔루션 (DMSO) 3 μL 추가 4 : 1.
- 3 & # 추가956; 탈 이온수 CuSO 4의 50 mM의 스톡 용액 L.
- 피펫 세포 현탁액의 상하 후 실온에서 30 분 동안 어둠 속에서 배양한다.
- 단계를 반복 5.2.1 세포를 씻어. 150 μL PBS의 세포를 다시 일시 중지합니다.
- 세포의 형광 분석을 수행합니다. 이 프로토콜에 표시된 Msmeg의 세포 형광을 시각화하기 위해 형광 현미경을 사용합니다.
- 현미경 슬라이드를 PBS에 현탁하고, 박테리아 세포의 10 μL를 추가하고 가볍게 커버 슬립의 에지를 이용하여 얇은 층으로 액체를 확산. 어둠 속에서 공기 건조 할 수 있습니다.
- 다음 접착제를 커버 샘플을 통해 미끄러 져 배치하고 적용, 건조 된 샘플을 통해 설치 매체의 10 μL를 추가합니다 (예를 들어, 매니큐어)를 고정합니다.
- 이미지 100X 배율 형광 현미경을 사용하여 슬라이드.
결과
T. TENAX TreT 약 4 mg의 표준 단백질 발현 및 정제 기술을 사용하여 / L의 수율로 대장균을 얻었다. 단일 니켈 친 화성 크로마토 그래피 단계 (대표 FPLC 트레이스가도 4에 도시 됨) 대장균 파쇄물로부터 TreT를 정화하기에 충분했다. TreT 합성 과정에 대한 우리의 초기 출판물에 설립 된 바와 같이, 재조합 T.의 TENAX TreT는 다양한 포도당 유사?...
토론
트레할로스 유사체는 식품 및 의약품의 보존에서 미생물 감염 (6)의 진단 및 치료에 다양한 분야에 영향을 미칠 가능성이있다. 기존의 다단계 화학 합성 방법은 (당연히 복잡한 마이코 박테리아 당지질 발생, 예를 들어) 수정의 여러 사이트와 복잡한 트레 할로 오스 유사체를 생산하는 데 유용합니다. 그러나, 이들 방법은 비교적 간단한 일 치환 트레할로스 유사체
공개
The authors have nothing to disclose.
감사의 말
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
자료
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
참고문헌
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유