Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Rapid One-step Synthèse enzymatique et All-aqueuse Purification de tréhalose Analogues
Dans cet article
Résumé
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Résumé
versions de tréhalose, ou analogues tréhalose modifiés chimiquement, des applications de la biologie, de la biotechnologie et de la science pharmaceutique, entre autres domaines. Par exemple, les analogues tréhalose portant des étiquettes détectables ont été utilisées pour détecter Mycobacterium tuberculosis et peuvent avoir des applications telles que la tuberculose des agents d'imagerie de diagnostic. versions Hydrolytiquement stables de tréhalose sont également poursuivis en raison de leur potentiel d'utilisation comme édulcorants non caloriques et agents bioprotectrices. Malgré l'attrait de cette classe de composés pour diverses applications, leur potentiel reste inexploité en raison de l'absence d'une voie solide pour leur production. Ici, nous rapportons un protocole détaillé pour la synthèse en une étape biocatalytique rapide et efficace des analogues de tréhalose qui évite les problèmes associés à la synthèse chimique. En utilisant la thermostable tréhalose synthase (TRET) enzyme de Thermoproteus tenax, les analogues de tréhalose peuvent être generated en une seule étape à partir des analogues de glucose et uridine diphosphate glucose avec un rendement élevé (jusqu'à conversion quantitative) en 15-60 min. Un protocole de purification chromatographique non simple et rapide, qui consiste à filer une dialyse et d'échange d'ions, peut offrir de nombreux analogues de tréhalose de concentration connue dans une solution aqueuse en aussi peu que 45 minutes. Dans les cas où l'analogue du glucose qui n'a pas réagi reste encore, la purification chromatographique du produit analogue tréhalose peut être effectuée. Dans l'ensemble, cette méthode fournit un "vert" plate-forme de biocatalytique pour la synthèse accélérée et la purification des analogues de tréhalose qui est efficace et accessible aux non-chimistes. Pour illustrer l'applicabilité de cette méthode, nous décrivons un protocole pour la synthèse, tout aqueuse purification, et l'administration d'un click chemistry sonde à base de tréhalose à mycobactéries, qui a pris moins de 1 heure et a permis la détection de fluorescence des mycobactéries. Dans l'avenir, nous prévoyons que, entre OTHer les applications, ce protocole peut être appliqué à la synthèse rapide des sondes à base de trehalose pour le diagnostic de la tuberculose. Par exemple, de courte durée analogues de tréhalose radionucléide modifiés (par exemple, 18 tréhalose F modifié) pourrait être utilisé pour les modalités cliniques avancées d'imagerie telles que la tomographie par émission de positons-calculée (PET-CT).
Introduction
Trehalose est un disaccharide symétrique non réducteur consistant en deux fractions de glucose qui sont liés par un 1,1-α, une liaison α-glycosidique (figure 1A). Alors que le tréhalose est absent de l' homme et d' autres mammifères, on trouve communément dans les bactéries, les champignons, les plantes et les invertébrés 1. Le rôle principal de tréhalose dans la plupart des organismes est de protéger contre les contraintes environnementales, telles que la dessiccation 1. En outre, certains agents pathogènes humains exigent tréhalose pour la virulence, y compris le Mycobacterium tuberculosis tuberculosis causant, qui utilise le tréhalose en tant que médiateur de l' enveloppe cellulaire biosynthèse et comme un bloc de construction pour la construction de glycolipides immunomodulateurs 2.
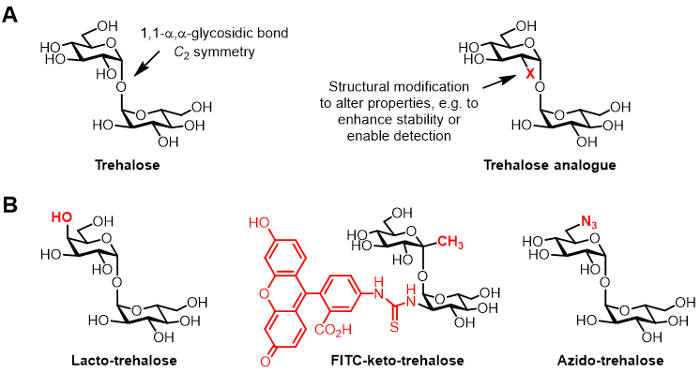
Figure 1: tréhalose et analogues tréhalose. (ALes structures de tréhalose) naturel et un analogue de tréhalose non naturel, où X est une modification structurelle. (B) Des exemples d'analogues de tréhalose dans la littérature qui ont des applications potentielles en imagerie biologique et biopréservation.
En raison de sa structure unique et les fonctions physiologiques, tréhalose a attiré beaucoup d' attention pour une utilisation en bio (techno) logique et applications biomédicales 3. Les propriétés protectrices du tréhalose observée dans nature- par exemple, sa capacité de frappe pour aider à maintenir la vie dans les plantes "résurrection" qui ont subi une déshydratation extrême 4 -avoir stimulé son utilisation intensive dans des applications de biopréservation. Tréhalose a été utilisé pour conserver une grande variété d'échantillons biologiques, tels que des acides nucléiques, des protéines, des cellules, des tissus et 3. Par exemple, le tréhalose est utilisé comme additif stabilisant dans un certain nombre de produits pharmaceutiques tchapeau sont sur le marché, y compris plusieurs anticorps monoclonaux anti-cancer 3. De plus, le tréhalose est utilisé comme édulcorant dans l'industrie alimentaire, et il est largement utilisé pour la conservation des produits dans les deux industries alimentaires et cosmétiques. L'adoption de tréhalose pour ces types d'applications commerciales était initialement limitée par l'impossibilité d'obtenir des quantités en vrac de tréhalose pur à partir de sources naturelles ou par synthèse. Cependant, un procédé enzymatique efficace pour la production économique de tréhalose à partir d'amidon a été récemment mis au point, ce qui a stimulé son utilisation commerciale à grande échelle 5.
Les dérivés de tréhalose chimiquement modifié, désigné ici comme analogues de tréhalose, ont acquis un intérêt croissant pour des applications diverses (structure générale représentée sur la figure 1A, des exemples spécifiques d'analogues de trehalose représentées sur la figure 1B) 6. Par exemple, le lacto-tréhalose est un analogue de tréhalose avec l'une de ses unités de glucose remplacé par le galactose, donc son groupe hydroxyle en position 4 a une configuration stéréochimique inversée. Lacto-tréhalose a les mêmes propriétés stabilisantes que le trehalose mais résiste à la dégradation par les enzymes intestinales, ce qui rend attrayant comme additif alimentaire non calorique 6, 7.
L'intérêt de notre groupe dans les analogues de tréhalose est principalement liée à leur valeur en tant que sondes et des inhibiteurs spécifiques de mycobactéries. Les groupes Barry et Davis ont développé un céto-analogue de tréhalose conjugué à la fluorescéine, du nom FITC-céto-tréhalose, qui a été montré pour étiqueter métaboliquement la paroi cellulaire de M. tuberculosis en temps réel, permettant sa détection par microscopie à fluorescence à 8. Le laboratoire Bertozzi développé plus petit azido-tréhalose (TreAz) analogues qui pourraient métaboliquement étiqueter la paroi cellulaire et ensuite être detète utilisant clic chimie et analyse de fluorescence 9. Ces progrès indiquent la possibilité d'utiliser des sondes à base de trehalose comme agents d'imagerie de diagnostic de la tuberculose. Analogues de tréhalose ont également été poursuivis comme inhibiteurs de M. tuberculosis en raison de leur potentiel de perturber les voies de la bactérie qui sont essentiels pour la viabilité et la virulence 10, 11, 12.
Jusqu'à présent, le principal obstacle au développement des analogues de tréhalose pour les bio (techno) applications logiques et biomédicales est le manque de méthodes de synthèse efficaces. Les deux voies traditionnelles de la production d' analogues de tréhalose reposent sur la synthèse chimique (figure 2). Une voie consiste désymétrisation / modification du tréhalose naturel, tandis que l'autre consiste à commencer par convenablement fonctionnalisés, des blocs de construction monosaccharides et à effectuer la glycosylation chimiqueforger le 1,1-α, liaison α-glycosidique. Ces approches, qui ont été récemment abordés dans les articles de revue 13, 14, se sont avérées utiles pour accomplir la synthèse multi - étapes de petites quantités de produits naturels complexes contenant du tréhalose, tels que sulfolipide-1 de M. tuberculosis 15. Cependant, les deux approches sont généralement inefficaces, de temps, inaccessible aux non-chimistes, et, en outre, ne sont pas considérés comme respectueux de l'environnement. Ainsi, pour la synthèse de certains types d'analogues de trehalose, ces stratégies ne sont pas idéales.
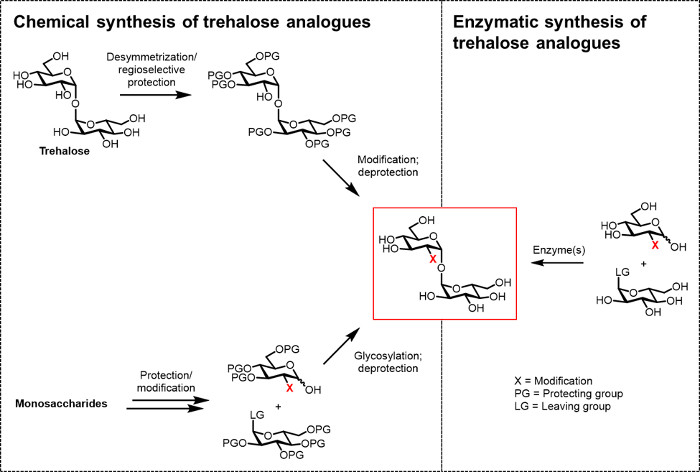
Figure 2: Approches à la synthèse du tréhalose analogique. approches chimiques pour la synthèse du tréhalose analogique, montré sur la gauche, utiliser les procédures qui impliquent plusieurs étapes protec difficiletion étapes / déprotection, Desymmetrization et / ou glycosylation. Synthèse enzymatique, illustré à droite, utilise une enzyme (s) pour convertir stéréosélectivement substrats simples, non protégés à trehalose analogues en solution aqueuse. Le protocole enzymatique rapportée ici utilise une enzyme tréhalose synthase (TRET) pour convertir le glucose et les analogues de l'UDP-glucose dans les analogues de tréhalose en une seule étape. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Une biocatalytique voie efficace aux analogues tréhalose faciliterait la production, l'évaluation et l'application de cette classe prometteuse de molécules. Bien que le procédé enzymatique commerciale pour la production de tréhalose 5 ne sont pas adaptables à la synthèse des analogues car il utilise l' amidon comme substrat, il existe un autre chemin biosynthétiquedes moyens dans la nature qui peuvent être exploitées pour la synthèse de l'analogue de tréhalose. Cependant, la recherche dans ce domaine, qui a été récemment examiné 6, a été limitée. Un rapport a utilisé une méthode inspirée de la voie de biosynthèse du trehalose Escherichia coli pour accéder à un analogue de la fluoro-tréhalose à partir du fluoro-glucose correspondante. Cependant, cette approche nécessite un système à trois enzymes qui a l' efficacité et de la généralité 8 limitée. Une autre approche a été explorée consiste à utiliser tréhalose - phosphorylase (PRT) dans le sens inverse, ce qui permet , en principe , la synthèse une étape d'analogues de tréhalose à partir d' analogues de glucose et de glucose-1-phosphate de 6, 16, 17. Bien que cette approche peut avoir un avenir prometteur, les deux TREPS inverseurs et de retenue ont actuellement des inconvénients pour la synthèse analogique. Par exemple, TREPS inverseurs ont une expé prohibitifnsive molécule donneuse (β-D-glucose-1-phosphate) et TREPS de retenue ont une faible rendement d'expression d'une enzyme / stabilité et la promiscuité de substrat limitée. Des améliorations significatives (par exemple, par l' intermédiaire de l' ingénierie enzymatique) seront nécessaires avant que la synthèse analogique TREP-médiée est pratique.
À l' heure actuelle, l'approche la plus pratique pour la synthèse enzymatique des analogues de tréhalose est d'utiliser une tréhalose synthase (TRET) une enzyme qui convertit le glucose et l' uridine diphosphate (UDP) Glucose dans le tréhalose en une seule étape 6. Nous avons récemment rapporté l'utilisation de Thermoproteus tenax Tret-une enzyme thermostable et unidirectionnel 18 -à synthétiser des analogues de tréhalose des analogues de glucose et UDP-glucose (Figure 3) 19. Cette enzyme ne fonctionne que dans le sens synthétique et évite le problème de la dégradation de la tréhalose trouve dans le système PRT. Cette réaction coul en une étaped être achevée en 1 heure, et une grande variété d'analogues de tréhalose ont été consultées avec un rendement élevé (jusqu'à> 99% telle que déterminée par chromatographie liquide à haute performance (HPLC)) à partir de facilement disponibles substrats analogues de glucose (voir le tableau 1 dans les résultats représentatifs section).
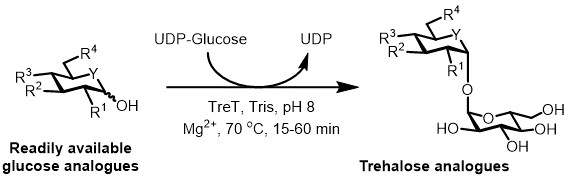
Figure 3: Tret-synthèse catalysée par une étape d'analogues de tréhalose. TRET l'enzyme de T. tenax peut se joindre stéréosélectivement facilement disponibles analogues du glucose et UDP-glucose pour former des analogues de tréhalose en une seule étape. R 1 -R 4 = modification structurelle variable, par exemple azido-, fluoro-, désoxy-, thio-, stéréochimique ou modifications d'étiquettes isotopiques; Y = hétéroatome variable, par exemple de l'oxygène ou du soufre, ou un hétéroatome isotope.
Ici, nous fournissons adetailed protocole pour le procédé de synthèse TRET, y compris l' expression et la purification de TRET de E. coli, optimisé les conditions de réaction TRET et un procédé amélioré de purification qui est réalisée entièrement dans la phase aqueuse. Ce protocole modifié permet la synthèse et la purification rapide et efficace des analogues de tréhalose diverses sur une échelle semi-préparative (10-100 mg). Nous démontrons également l'utilisation de ce protocole pour la préparation et l'administration d'une sonde à base de trehalose à mycobactéries en moins de 1 heure, ce qui a permis la détection de fluorescence rapide des cellules mycobactériennes.
Protocole
1. Expression et purification de TRET à partir de E. coli Top10
NOTE: S'il vous plaît contacter les auteurs pour demander l'Tret exprimant la souche de E. coli (pBAD Tret plasmide, contenant le gène tret T. tenax sous le contrôle de la protéine AraC, transformée en Top10 E. coli 19) et l'accord de transfert de matériel d' accompagnement . Le protocole suivant donne généralement un rendement en protéines d'environ 4 mg / L.
- Préparer un 3 mL culture de nuit de Tret exprimant E. coli.
- Strie Top10 de E. coli transformé avec le vecteur d'expression pBAD-TRET sur un bouillon de lysogénie (LB) gélose contenant 100 ug / ml d' ampicilline.
- Incuber la plaque à 37 ° C pendant environ 48 heures.
- Choisir une colonie unique de la plaque et inoculer 3 ml de milieu liquide LB contenant 100 ug / ml d'ampicilline, dans un tube de culture.
- Placer le tube dans un incubateur sous agitation à 37 & #176; C x 175 rpm pendant la nuit.
- Induire l' expression des protéines dans les TRET exprimant E. coli.
- Ajouter 750 ml Terrific Broth supplémenté avec 100 ug / ml d'ampicilline dans un flacon Fernbach mL de la culture 2,800. Transfert 1 ml de bouillon de la fiole dans une cuvette pour une utilisation ultérieure comme un blanc.
- Ajouter la culture de la nuit 3 mL généré à l'étape 1.1.4 dans le flacon de culture, puis placer le ballon dans un incubateur et agiter à 37 ° C x 200 rpm. Vérifiez régulièrement l'absorbance de la culture à 600 nm par rapport à l'ébauche recueillies à l'étape 1.2.1.
- Une fois que l'absorbance à 600 nm atteint entre 0,5 à 1,0, induire l'expression TRET par addition de 750 ul d'une solution 1 M arabinose (1 mM, concentration finale) à la culture. Remettre le ballon à l'incubateur et agiter une nuit à 37 ° C x 200 rpm.
- Pellet et lyser les cellules de E. coli exprimant Tret.
- Transférer la culture à un polypropylène bottle et centrifuger pendant 15 min à 4000 xg à 4 ° C.
- Jeter le surnageant et remettre en suspension le culot dans 15 ml de solution saline tamponnée au phosphate (PBS).
- Transférer la suspension cellulaire à un ml tube et centrifugeuse 50 conique pendant 15 min à 4000 g à 4 ° C. Jeter le surnageant et soit procéder à la lyse cellulaire (étape 1.3.4) ou stocker le culot indéfiniment à -80 ° C.
- Dissoudre 1 inhibiteur de la protéase mini - comprimé dans 20 ml de tampon de lavage (50 mM de NaH 2 PO 4, NaCl 500 mM, imidazole 20 mM, pH 8,0) dans un tube de 50 ml conique.
- Transférer le tampon de lavage contenant un inhibiteur de la protéase dans le tube conique contenant la pastille. Vortex jusqu'à ce que le culot est remis en suspension.
- Transférer les cellules remises en suspension dans un bécher de 100 mL et lyser les cellules par sonication (séquence d'impulsions de 45 secondes sur 45 secondes avec un temps de course de 2 min et 15 secondes à une amplitude de 75 pour cent).
- Transférer le lysat dans un tube conique de 50 ml de métalet centrifuger pendant 60 min à 15 000 xg à 4 ° C.
- Clarifier le lysat par passage à travers un filtre à seringue de 0,2 à 0,45 um dans un tube de 50 ml conique.
Remarque: la concentration typique de lysat obtenu est de 100 mg / ml.
- Purifier Tret de E. coli lysat cellulaire en utilisant la chromatographie liquide rapide de protéines (FPLC).
- Mettre en place FPLC avec une colonne d'affinité de nickel (5 volumes de lit ml). Laver la colonne avec 10 ml d'eau déminéralisée ou jusqu'à ce que la colonne est propre de tout contaminant. Equilibrer la colonne en utilisant 20 ml de tampon de lavage (50 mM de NaH 2 PO 4, NaCl 500 mM, imidazole 20 mM, pH 8,0) à un débit de 1 mL / min.
- Chargez le lysat (20 ml) obtenu à l'étape 1.3.8 sur la colonne et éluer les protéines non marquées avec du tampon de lavage à un débit de 1 ml / min jusqu'à ce que l'absorbance atteigne des niveaux de fond (typiquement 80-100 mL de tampon de lavage sont nécessaires) .
- Eluer marquée par His Tret en utilisant un linéaire gradient de tampon d'élution (50 mM de NaH 2 PO 4, NaCl 500 mM, imidazole 250 mM, pH 8,0) 1-100% sur 60 min à un débit de 1 mL / min. Collecter 4 fractions mL jusqu'à Tret a élue et l'absorbance atteint le niveau de référence.
NOTE: En règle générale, 60 ml de tampon d'élution sont nécessaires pour éluer la protéine et la protéine est éluée dans la gamme de tampon d'élution de 60 à 100%. Environ 10-15 ml de pur TRET dans le tampon d'élution sont obtenus. - Déterminer la concentration de TRET en mesurant l'absorbance à 280 nm par rapport à une ébauche de tampon d'élution.
- TRET en échange de tris (hydroxyméthyl) aminométhane (Tris) , un tampon par dialyse.
- Après avoir préparé le tube de dialyse selon les instructions du fabricant, le premier par un rinçage à l'eau déminéralisée et ensuite un tampon de Tris (Tris 50 mM, NaCl 300 mM, pH 8,0).
- Chargez l'échantillon Tret dans le tube de dialyse en utilisant une seringue et une aiguille émoussée. Dialyser nuit ungainst 2 L de tampon Tris.
- Déterminer la concentration de TRET en mesurant l'absorbance à 280 nm contre un blanc recueilli à partir du lavage de dialyse.
- Transférer la solution Tret à un tube de 50 ml conique et procéder à la synthèse analogique tréhalose (étape 2) ou stocker l'enzyme à 4 ° C.
NOTE: Tret est une protéine thermostable. TRET l'a stocké dans un tampon de Tris à 4 ° C pendant plusieurs mois sans observer de perte significative d'activité.
2. Une étape de synthèse de tréhalose Analogues Utilisation de Tret Enzyme
NOTE: Le protocole décrit ci-dessous une échelle de réaction sur la base de 4 ml de volume, ce qui peut fournir environ 15 à 30 mg de tréhalose analogique en fonction de l'efficacité de la réaction et le poids moléculaire du produit. Les composants de la réaction peuvent être mis à l'échelle afin d'obtenir plus ou moins de tréhalose analogique si on le souhaite.
- Ajouter analogue du glucose (0,080 mmol, masse dépendra du poids moléculaire), l'UDP-glucose (0.160 mmol, 97,6 mg) et du MgCl2 (0,080 mmol, 16,3 mg) dans un tube de 15 ml conique. Les concentrations finales de ces constituants seront 20 mM, 40 mM et 20 mM, respectivement.
- TRET ajouter dans du tampon Tris (obtenue à l'étape 1.5.4) et, le cas échéant, un volume approprié de tampon Tris (Tris 50 mM, NaCl 300 mM, pH 8,0) pour obtenir une concentration enzymatique finale de 300 pg / mL et une finale volume de 4 ml. Pipet le mélange monter et descendre doucement ou inverser le tube pour dissoudre les solides.
- Incuber la réaction à 70 ° C sous agitation à 300 tours par minute pendant 1 heure, puis placer le tube sur la glace pour refroidir.
3. La purification du tréhalose à partir Analogues Mélange réactionnel brut Enzymatic
- Prérincer une unité de filtre centrifuge (limite nominale du poids moléculaire (NWML) de 10 kDa) pour éliminer les traces de glycerol dans la membrane par addition de 3 ml d'eau déminéralisée à l'unité de filtration centrifuge et une centrifugation à 3000 x g jusqu'à ce que tout le liquide passe à travers le filtredans le tube (environ 20 minutes). Répéter deux fois de plus. Terminez cette étape immédiatement avant ou pendant la réaction (étape 2.3).
- Après refroidissement du mélange réactionnel enzymatique (obtenu à l'étape 2.3), le transférer vers l'unité de filtre centrifuge de pré-rinçage. Rincer le tube de réaction avec 1 ml d'eau déminéralisée et le transfert à l'unité de filtre centrifuge. Répéter le rinçage du tube de réaction pour la récupération maximale du produit.
- Centrifuger l'unité de filtre centrifuge à 3000 x g jusqu'à ce que tout le liquide passe à travers le filtre dans le tube (environ 20 minutes). Rincer la chambre supérieure de l'unité de filtration centrifuge avec 3 ml d'eau déminéralisée et on centrifuge à 3000 x g jusqu'à ce que tout le liquide passe à travers le filtre dans le tube (environ 20 minutes). Répéter le rinçage pour la récupération maximale du produit.
- Jeter la chambre supérieure de l'unité de filtre centrifuge. Ajouter une résine échangeuse d'ions à lit mixte (3 g) au filtrat à la partie inférieure du tube (typique filtrat volUME est 8-15 ml en fonction du nombre de rinçages). On agite à la température ambiante pendant 1 heure avec un barreau d'agitation magnétique à une vitesse suffisante pour maintenir les billes de résine en suspension dans la solution.
- Décanter le surnageant et le filtrer pour éliminer la résine. Ajouter 5 ml d'eau déminéralisée pour rincer la résine restante. Décanter le surnageant et le filtrer, en le combinant avec la solution de produit à partir de la première décantation. Répéter le rinçage de la résine pour la récupération maximale du produit.
- Analyser la réaction par chromatographie sur couche mince (CCM) ou par HPLC pour déterminer si une conversion complète de l'analogue de glucose sensible à la tréhalose produit analogue de départ a été obtenue. Voir l'étape 4.1 pour l'analyse TLC et l'étape 4.2 pour l'analyse HPLC.
- Éliminer l'eau par lyophilisation ou evaporation rotative pour donner le produit séché. Si aucun analogue qui n'a pas réagi de glucose a été observée lors de l'analyse par CCM ou HPLC, purification par chromatographie est nécessaire. Peser le produit pour obtenir la yie de réactionld et effectuer la résonance magnétique nucléaire (RMN) analyse spectroscopique (étape 4.3) pour confirmer la structure du produit et de la pureté.
- Si inaltéré analogue du glucose a été observée lors de l'analyse par CCM, la séparer de l'analogue de tréhalose en utilisant une colonne d'exclusion de taille.
- Préparer une colonne de 1 x 100 cm contenant, des médias P2 polyacrylamide exclusion de taille de perles extra-fines désionisée saturée d'eau selon les instructions du fabricant.
REMARQUE: La colonne d'exclusion de taille peut être réutilisée après lavage avec de l'eau déminéralisée. - Re-dissoudre le produit de la réaction enzymatique a séché (obtenu à l'étape 3.7) dans 0,5 ml d'eau déminéralisée. Appliquer la solution de produit à la colonne d'exclusion de taille manuellement ou à l'aide d'un adaptateur d'écoulement de la colonne. Rincer le flacon qui contenait le produit brut avec encore 0,5 ml d'eau déminéralisée, et le charger dans la colonne d'exclusion de taille.
- Éluer le produit avec de l'eau déminéralisée par écoulement gravitaire et de recueillir des fractions d'environ 2 mL volume.
- Analyser les fractions par CCM (étape 4.1). Réunir les fractions contenant analogue de tréhalose pur.
- Éliminer l'eau par lyophilisation ou evaporation rotative pour donner le produit séché. Peser le produit pour obtenir le rendement de réaction et procéder à l'analyse par RMN (voir étape 4.3).
- Préparer une colonne de 1 x 100 cm contenant, des médias P2 polyacrylamide exclusion de taille de perles extra-fines désionisée saturée d'eau selon les instructions du fabricant.
4. Analyse de tréhalose analogiques Produits
- Effectuer la chromatographie sur couche mince (CCM) de la réaction Tret.
REMARQUE: Cette procédure peut également être utilisée pour analyser la taille colonne d'exclusion des fractions. Il peut être nécessaire de concentrer le mélange de réaction ou de colonne des fractions avant analyse par CCM pour observer composé coloration sur la plaque CCM.- Mark voies sur la surface de la plaque de CCM avec un crayon et appliquer analyte (s) et standard (s) pertinent pour les voies appropriées, y compris la norme analogue du glucose, la norme tréhalose analogique (si disponible), le mélange réactionnel (ou fractions collectées à partir taille exclusion colonne de purification), et un co-spot. Après l'application de chaque échantillon sur la plaque de CCM, laisser sécher la plaque.
NOTE: Pour l'analyse de la réaction, typiquement de 2 pi de l'échantillon est appliqué sur la plaque de CCM. - Développer la plaque CCM en utilisant n - butanol / éthanol / eau déminéralisée (5: 3: 2).
- Sécher la plaque TLC développé, puis le tremper dans 5% H 2 SO 4 dans l' éthanol (tache de sucre) et de la chaleur sur une plaque chauffante sur le réglage élevé jusqu'à ce que les taches contenant du sucre peuvent être visualisées (typiquement 5 min).
- Mark voies sur la surface de la plaque de CCM avec un crayon et appliquer analyte (s) et standard (s) pertinent pour les voies appropriées, y compris la norme analogue du glucose, la norme tréhalose analogique (si disponible), le mélange réactionnel (ou fractions collectées à partir taille exclusion colonne de purification), et un co-spot. Après l'application de chaque échantillon sur la plaque de CCM, laisser sécher la plaque.
- Effectuer une analyse HPLC des mélanges réactionnels TRET en utilisant un système HPLC capable de séparer et détecter les hydrates de carbone. Ce protocole implique la séparation d' hydrate de carbone en utilisant une colonne HPLC aminopropyle et la détection en utilisant l' indice de réfraction.
- Fixer aminopropyl colonne (4,6 x 250 mm) contenant un agent de pré-colonne à la HPLC.
- Equilibrer aminopropyl colonne avec 80% d'acétonitrile dans de l'eau déminéralisée à un débit de 0,4 à écoulementml / min.
- Chargez la solution du produit de réaction (ou standard) sur la colonne aminopropyle.
- Éluer le produit (ou standard) avec 80% d'acétonitrile dans de l'eau déminéralisée à un débit de 0,4 ml / min et une température de colonne de 50 ° C. En règle générale, la durée d'exécution utilisée est de 40 min.
Remarque: les deux la matière analogue du glucose de départ et le produit analogue trehalose peuvent être détectés par l'indice de réfraction, bien que d'autres procédés tels que la détection de la diffusion de lumière évaporatif (ELSD) pourraient être utilisés. En utilisant les conditions décrites, les analogues de glucose éluent typiquement entre 10-15 min et analogues trehalose éluées entre 15 à 25 min.
- Une analyse par RMN des analogues de tréhalose purifié.
- Dissoudre analogue de tréhalose purifiée dans D 2 O (700 pi) et transférer la solution dans un tube de RMN.
- Acquérir 1 H et des spectres RMN C 13 selon les protocoles d'établissement de RMN appropriés.
5. TRET application de tréhalose synthétisé Analogues à la détection de mycobactéries
- Synthétiser, purifier, et administrer 6-TreAz à M. smegmatis (Msmeg).
- Ajouter 6-azido-6-désoxy glucopyranose (6-GlcAz, 0,020 mmole, 4,1 mg), de l' UDP-glucose (0,040 mmol, 24,4 mg) et du MgCl2 (0,020 mmole, 4,1 mg) dans un tube de 15 ml conique.
- TRET ajouter dans du tampon Tris (obtenue à l'étape 1.5.4) pour obtenir une concentration enzymatique finale de 300 ug / ml et un volume final de 1 ml. Pipet le mélange monter et descendre doucement ou inverser le tube pour dissoudre les solides.
- Laisser incuber la réaction à 70 ° C avec agitation pendant 15 min.
- On dilue le mélange de réaction enzymatique avec 3 ml d'eau déminéralisée et le transférer vers une unité de filtre centrifuge prélavé (LMMN de 10 kDa). Centrifuger l'unité de filtration à 3000 x g jusqu'à ce que la majeure partie du liquide passe à travers le filtre dans le tube, soit environ 10 min.
- e Jetere chambre supérieure de l'unité de filtre centrifuge. Ajouter résine échangeuse d'ions à lit mixte (0,75 g) au tube et remuer / secouer à la température ambiante pendant 25 min. Décanter le surnageant et le filtrer pour éliminer la résine.
REMARQUE: Les étapes 5.1.1-5.1.5 fournir une solution aqueuse de 6-azido-tréhalose (6-TreAz) à environ 5 mM, la concentration en moins de 1 heure. La concentration 5 mM est estimée en se basant sur la conversion quantitative du substrat en produit et la dilution qui a lieu au cours des étapes de purification, en supposant une perte minimale de produit au cours de ces étapes. La solution peut être stérilisée par filtration avant l'addition à un échantillon biologique, le cas échéant. - Ajouter le volume approprié de solution de produit 6-TreAz à une culture en phase logarithmique de M. smegmatis (Msmeg), généralement pour atteindre un volume de culture final de 100-1.000 pi et une concentration finale de 6-TreAz de ~ 25 uM. Incuber les cellules à 37 ° C pendant la durée désirée, typiquement 60 min.
- Effectuer cliquez sur la chimie pour conjuguer un fluorophore aux cellules azoture marqué. Dans ce protocole, utilisez Cu catalysée azide-alkyne cycloaddition (CuAAC) pour délivrer un fluorophore à azides cellulaire surface dans Msmeg.
- Centrifuger les cellules à 3900 xg pendant 5 min, puis laver les cellules avec du PBS contenant 0,5% d'albumine de sérum bovin. Répéter deux fois.
- Re-suspendre les cellules granulées à 4% para-formaldehyde dans du PBS pour les fixer. Après incubation pendant 10 min, répéter l'étape 5.2.1 pour laver les cellules.
- Re-suspendre les cellules granulées dans 138 ul de PBS.
- Ajouter 3 pi d'une solution mère 1 mM de alcyne-carboxyrhodamine 110 (Acétylène-488) dans le DMSO.
- Ajouter 3 pi d'une 60 mM solution fraîchement préparée d'ascorbate de sodium dans de l'eau déminéralisée.
- Ajouter 3 pi d'une solution mère de 6,4 mM de Tris [(1-benzyl-1H-1,2,3-triazol-4-yl) méthyl] amine (TBTA) dans le tert - butanol / diméthylsulfoxyde (DMSO) 4: 1.
- Ajouter 3 & #956; L d'une solution mère de 50 mM de CuSO 4 dans de l' eau déminéralisée.
- Pipet la suspension cellulaire de haut en bas, puis incuber dans l'obscurité à la température ambiante pendant 30 min.
- Répétez l'étape 5.2.1 pour laver les cellules. Re-suspendre les cellules dans 150 ul de PBS.
- Effectuer une analyse de fluorescence cellulaires. Dans ce protocole, utiliser la microscopie à fluorescence pour visualiser la fluorescence cellulaire marqué Msmeg.
- Ajouter 10 pi de cellules bactériennes en suspension dans du PBS à une lame de microscope et légèrement étaler le liquide en une couche mince en utilisant le bord d'une lamelle couvre-objet. Laisser sécher à l'air dans l'obscurité.
- Ajouter 10 pi de milieu de montage sur l'échantillon séché, puis placez la couverture glisse sur l'échantillon et appliquer l' adhésif (par exemple, vernis à ongles) pour immobiliser.
- Image les diapositives à l'aide d'un microscope à fluorescence à 100X.
Résultats
T. tenax TRET a été obtenue à partir de E. coli dans un rendement d'environ 4 mg / L en utilisant des techniques d'expression de protéines et de purification standard. Une étape de Chromatographie d'affinité de nickel seul était suffisant pour purifier TRET à partir de E. coli lysat (FPLC une trace représentative est représentée sur la figure 4). Comme établi dans notre publication initiale sur le processus de synthèse ...
Discussion
Analogues de tréhalose ont le potentiel d'avoir un impact divers domaines, de la conservation des aliments et des produits pharmaceutiques pour le diagnostic et le traitement des infections microbiennes 6. Les méthodes existantes de synthèse en plusieurs étapes chimiques sont utiles pour produire des analogues de trehalose complexes avec de multiples sites de modification (par exemple, des glycolipides mycobactériens complexes d' origine naturelle). Cependant, ces procédés...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
matériels
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Références
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon