Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Rápida de un solo paso Síntesis enzimática y All-Purificación acuosa de trehalosa Análogos
En este artículo
Resumen
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Resumen
versiones de trehalosa, o análogos de trehalosa químicamente modificado, tienen aplicaciones en la biología, la biotecnología y la ciencia farmacéutica, entre otros campos. Por ejemplo, los análogos de trehalosa que llevan etiquetas detectables se han utilizado para detectar Mycobacterium tuberculosis y pueden tener aplicaciones como agentes de formación de imágenes de diagnóstico de la tuberculosis. Las versiones estables frente a la hidrólisis de trehalosa también están siendo perseguidos debido a su potencial para su uso como edulcorantes no calóricos y agentes bioprotectivas. A pesar del atractivo de esta clase de compuestos para diversas aplicaciones, su potencial se ha cumplido debido a la falta de una ruta sólida para su producción. Aquí, se presenta un protocolo detallado para la síntesis de una sola etapa biocatalıtica rápida y eficaz de los análogos de trehalosa que no pasa por los problemas asociados con la síntesis química. Mediante la utilización de la enzima termoestable trehalosa sintasa (TRET) de Thermoproteus tenax, análogos de trehalosa puede ser geed en un solo paso a partir de análogos de glucosa y glucosa uridina difosfato con un alto rendimiento (hasta conversión cuantitativa) en 15 a 60 min. Un protocolo de purificación no cromatográfico simple y rápida, que consiste en diálisis giro y de intercambio de iones, puede entregar muchos análogos de trehalosa de concentración conocida en solución acuosa en tan poco como 45 min. En los casos en que no ha reaccionado análogo de la glucosa sigue siendo, purificación cromatográfica del producto análogo de trehalosa se puede realizar. En general, este método proporciona una plataforma biocatalıtica "verde" para la síntesis acelerada y purificación de análogos de trehalosa que sea eficiente y accesible a los no químicos. Para ejemplificar la aplicabilidad de este método, se describe un protocolo para la síntesis, todos acuoso purificación, y la administración de una sonda química clic a base de trehalosa micobacterias, todo lo cual llevó a menos de 1 hora y permitió la detección de fluorescencia de las micobacterias. En el futuro, prevemos que, entre OTHer aplicaciones, este protocolo se puede aplicar a la rápida síntesis de sondas a base de trehalosa para el diagnóstico de la tuberculosis. Por ejemplo, los análogos de corta duración trehalosa radionucleido-modificados (por ejemplo, 18 trehalosa F-modificados) pueden utilizarse para aplicar las técnicas de imagen clínicos avanzados como la tomografía computarizada, tomografía por emisión de positrones (PET-TC).
Introducción
La trehalosa es un disacárido simétrico no reductor que consiste en dos fracciones de glucosa que están unidas por un 1,1-α, enlace α-glucosídico (Figura 1A). Mientras que la trehalosa está ausente de los seres humanos y otros mamíferos, que se encuentra comúnmente en las bacterias, los hongos, las plantas y los invertebrados 1. La función principal de trehalosa en la mayoría de los organismos es proteger contra el estrés ambiental, como la desecación 1. Además, algunos patógenos humanos requieren trehalosa para la virulencia, incluyendo la tuberculosis Mycobacterium tuberculosis que causa, que utiliza trehalosa como un mediador de la biosíntesis de envoltura celular y como un bloque de construcción para la construcción de glicolípidos inmunomoduladores 2.
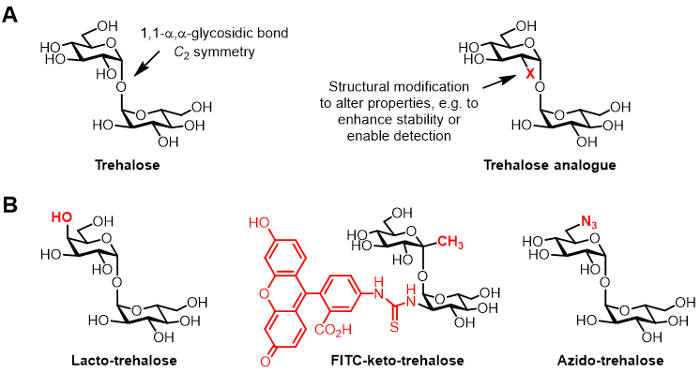
Figura 1: La trehalosa y análogos de trehalosa. (A) Estructuras de trehalosa natural y un análogo no natural de trehalosa, en donde X es una modificación estructural. (B) Ejemplos de análogos de trehalosa en la literatura que tienen aplicaciones potenciales en biopreservación y bioimagen.
Debido a su singular estructura y las funciones fisiológicas, trehalosa ha llamado la atención significativa para su uso en bio (tecno) lógico y aplicaciones biomédicas 3. Las propiedades protectoras de la trehalosa se observa en la naturaleza- por ejemplo, su capacidad de ataque para ayudar a mantener la vida en las plantas "resurrección" que se han sometido a la deshidratación extrema 4 -tienen estimuló su amplio uso en aplicaciones biopreservación. La trehalosa se ha utilizado para conservar una gran variedad de muestras biológicas, tales como ácidos nucleicos, proteínas, células y tejidos 3. Por ejemplo, la trehalosa se utiliza como un aditivo estabilizador en una serie de productos farmacéuticos tsombrero están en el mercado, incluyendo varios anticuerpos monoclonales anti-cáncer 3. Además, la trehalosa se usa como edulcorante en la industria alimentaria, y se utiliza ampliamente para la conservación del producto en las industrias de alimentos y cosméticos. La adopción de la trehalosa para estos tipos de aplicaciones comerciales se inicialmente limitada por la incapacidad de obtener grandes cantidades de trehalosa pura a partir de fuentes naturales o mediante síntesis. Sin embargo, un proceso enzimático eficaz para la producción económica de trehalosa a partir de almidón se ha desarrollado recientemente, que ha estimulado su uso comercial generalizado 5.
Derivados de trehalosa químicamente modificado, denominado en este documento como análogos de trehalosa, han ganado cada vez más atención para diversas aplicaciones (estructura genérica muestra en la Figura 1A; ejemplos específicos de análogos de trehalosa que se muestran en la Figura 1B) 6. Por ejemplo, lacto-trehalosa es un análogo de trehalosa con una de sus unidades de glucosa sustituidos con galactosa, de este modo el grupo hidroxilo posición 4 tiene una configuración estereoquímica invertida. Lacto-trehalosa tiene las mismas propiedades estabilizantes como trehalosa, pero es resistente a la degradación por enzimas intestinales, por lo que es atractivo como un aditivo alimentario no calórico 6, 7.
El interés de nuestro grupo de análogos de trehalosa se refiere principalmente a su valor como sondas y los inhibidores de micobacterias-específica. Los grupos Barry y Davis desarrollaron un análogo ceto-trehalosa conjugada con fluoresceína, llamada FITC-ceto-trehalosa, que se mostró para etiquetar metabólicamente la pared celular de M. tuberculosis vivo, lo que permite su detección por microscopía de fluorescencia 8. El laboratorio Bertozzi desarrollado más pequeño azido-trehalosa (TreAz) análogos que podría etiquetar metabólicamente la pared celular y, posteriormente, ser deteja usando química de clic y el análisis de fluorescencia 9. Estos avances apuntan a la posibilidad de utilizar sondas basadas en trehalosa como agentes de formación de imágenes de diagnóstico para la tuberculosis. Análogos de trehalosa se han perseguido también como inhibidores de M. tuberculosis debido a su potencial para perturbar vías en la bacteria que son esenciales para la viabilidad y virulencia 10, 11, 12.
Hasta ahora, el principal obstáculo para el desarrollo de análogos de trehalosa para aplicaciones biológicas y biomédicas lógicos (tecno) es la falta de métodos sintéticos eficientes. Las dos rutas tradicionales a la producción de análogos de trehalosa se basan en la síntesis química (Figura 2). Una vía implica desimetrización / modificación de trehalosa natural, mientras que la otra consiste en partir de bloques de construcción de monosacáridos adecuadamente funcionalizados y la realización de glicosilación química paraforjar el 1,1-α, α-glucosídico vínculo. Estos enfoques, que recientemente han sido discutidos en artículos de revisión 13, 14, han demostrado ser útiles para llevar a cabo la síntesis de múltiples pasos de pequeñas cantidades de productos naturales que contienen trehalosa complejos, como sulfolípidos-1 de M. tuberculosis 15. Sin embargo, ambos enfoques son generalmente ineficientes, que consume tiempo, inaccesible a los no-químicos, y, además, no se consideran para ser amigable con el medio ambiente. Por lo tanto, para la síntesis de ciertos tipos de análogos de trehalosa, estas estrategias no son ideales.
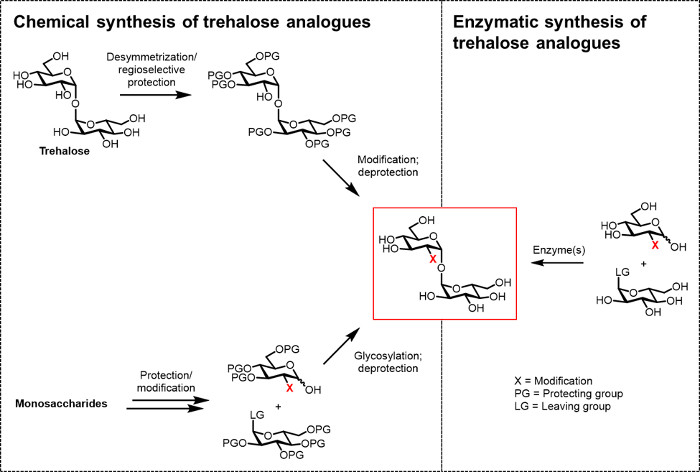
Figura 2: Enfoques para la síntesis de trehalosa analógica. Químicas para la síntesis de trehalosa analógica, que se muestra a la izquierda, utilice los procedimientos de varios pasos que implican difíciles protecciónpasos ción / desprotección, desimetrización, y / o glicosilación. Síntesis enzimática, que se muestra a la derecha, utiliza la enzima (s) para convertir estereoselectivamente sustratos simples, no protegidos a los análogos de la trehalosa en solución acuosa. El protocolo enzimática informado en el presente documento utiliza una enzima trehalosa sintasa (TRET) para convertir análogos de glucosa y UDP-glucosa en análogos de trehalosa en un solo paso. Haga clic aquí para ver una versión más grande de esta figura.
Una ruta biocatalıtica eficiente a los análogos de trehalosa facilitaría la producción, evaluación y aplicación de esta prometedora clase de moléculas. Mientras que el proceso enzimático comercial para la producción de trehalosa 5 no es adaptable a la síntesis de análogos, ya que utiliza almidón como sustrato, hay otro camino biosintéticoformas en la naturaleza que pueden ser explotadas para la síntesis de trehalosa analógica. Sin embargo, la investigación en esta área, que ha sido recientemente revisado 6, ha sido limitado. En un informe se utiliza un método inspirado en la ruta de biosíntesis de trehalosa Escherichia coli acceder a un único análogo fluoro-trehalosa a partir del correspondiente fluoro-glucosa. Sin embargo, este enfoque requiere un sistema de tres enzimas que ha eficiencia y generalidad 8 limitado. Otro enfoque que se ha explorado es utilizar fosforilasa trehalosa (TREP) en la dirección inversa, que, en principio, permite la síntesis de una sola etapa de los análogos de trehalosa a partir de análogos de glucosa y glucosa-1-fosfato de 6, 16, 17. Aunque este enfoque puede tener un futuro prometedor, tanto la inversión y la retención Treps actualmente tienen inconvenientes para la síntesis analógica. Por ejemplo, Treps inversoras tienen una expe prohibitivamentemolécula nsive donante (β-D-glucosa 1-fosfato) y Treps de retención tienen pobres rendimientos de expresión enzima / estabilidad y la promiscuidad de sustrato limitada. Se necesitarán mejoras significativas (por ejemplo, a través de ingeniería de enzimas) antes de la síntesis analógica mediada por TREP es práctico.
En la actualidad, el enfoque más práctico para la síntesis enzimática de los análogos de trehalosa es el uso de una enzima trehalosa sintasa (TRET), que convierte la glucosa y la uridina difosfato (UDP) -glucosa en trehalosa en un solo paso 6. Recientemente hemos informado de la utilización de Thermoproteus tenax TRET-una enzima termoestable y unidireccional 18: para sintetizar análogos de trehalosa a partir de análogos de glucosa y UDP-glucosa (Figura 3) 19. Esta enzima solamente opera en la dirección sintético y evita el problema de la degradación de trehalosa se encuentra en el sistema TREP. Este coul reacción de una etapad completará en 1 hora, y se accede a una amplia variedad de análogos de trehalosa con un alto rendimiento (hasta> 99% según se determinó por cromatografía líquida de alta resolución (HPLC)) a partir de sustratos análogos de glucosa fácilmente disponibles (véase la Tabla 1 en los resultados representativos sección).
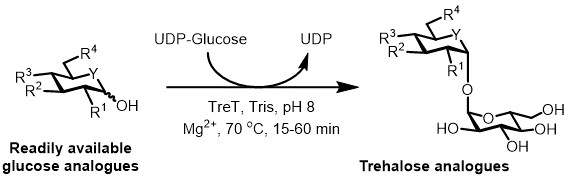
Figura 3: catalizada por TRET síntesis de una sola etapa de los análogos de trehalosa. La enzima TRET de T. tenax puede unirse de manera estereoselectiva análogos de glucosa fácilmente disponibles y UDP-glucosa para formar análogos de trehalosa en un solo paso. R 1 -R 4 = modificación estructural variable, por ejemplo azido, fluoro-, desoxi-, tio-, estereoquímica, o modificaciones de etiquetas isotópicas; Y = heteroátomo variable, por ejemplo oxígeno o azufre, o heteroátomo marcado isotópicamente.
Aquí, proporcionamos anuncioprotocolo etailed para el proceso de síntesis TRET, incluyendo la expresión y purificación de TRET de E. coli, optimizado las condiciones de reacción TRET, y un método de purificación mejorado que se lleva a cabo en su totalidad en la fase acuosa. Este protocolo modificado permite la síntesis conveniente y eficiente y la purificación de diversos análogos de trehalosa en una escala semi-preparativa (10-100 mg). También demostramos el uso de este protocolo para la preparación y administración de una sonda a base de trehalosa para micobacterias en menos de 1 hora, lo que permitió la detección de fluorescencia rápida de células micobacterianas.
Protocolo
1. Expresión y purificación de tret del Top10 de E. coli
NOTA: Por favor, póngase en contacto con los autores para solicitar la cepa de E. coli que expresan tret (plásmido pBAD tret, que contiene el gen tret T. tenax bajo el control de la proteína AraC, transformado en E. coli Top10 19) y el acuerdo de transferencia de material complementario . El siguiente protocolo normalmente da un rendimiento de proteína de aproximadamente 4 mg / L.
- Preparar un cultivo de una noche de 3 ml de Tret-expresión de E. coli.
- Streak Top10 de E. coli transformada con el vector de expresión pBAD-tret en un caldo de lysogeny (LB) placa de agar que contiene 100 mg / ml de ampicilina.
- Incubar la placa a 37 ° C durante aproximadamente 48 horas.
- Elija una única colonia de la placa e inocular 3 ml de medio líquido LB que contenía 100 mg / ml de ampicilina en un tubo de cultivo.
- Colocar el tubo en una incubadora de agitación a 37 & #176; C x 175 rpm durante la noche.
- Inducir la expresión de proteínas en Tret-expresión de E. coli.
- Añadir 750 ml de caldo Terrific suplementado con 100 mg / ml de ampicilina en un matraz de cultivo de 2.800 ml Fernbach. Transferencia de 1 ml de caldo del matraz a una cubeta para su uso posterior como un blanco.
- Añadir el cultivo de una noche de 3 ml generada en el paso 1.1.4 para el frasco de cultivo, a continuación, colocar el matraz en una incubadora y agitar a 37 ° C x 200 rpm. Compruebe periódicamente la absorbancia del cultivo a 600 nm frente al blanco recogido en el paso 1.2.1.
- Una vez que la absorbancia a 600 nm alcanza entre 0,5 a 1,0, inducir la expresión TRET mediante la adición de 750 l de solución 1 M arabinosa (1 mM de concentración final) a la cultura. Devolver el frasco a la incubadora y agitar durante la noche a 37 ° C x 200 rpm.
- Pellets y lisar las células de E. coli que expresan TRET.
- Transferir la cultura de un polipropileno bottle y centrifugar durante 15 minutos a 4000 xga 4 ° C.
- Desechar el sobrenadante y resuspender el precipitado en 15 ml de solución salina tamponada con fosfato (PBS).
- Transferir la suspensión celular a un tubo cónico de 50 ml y centrifugar durante 15 min a 4000 xg a 4 ° C. Descartar el sobrenadante y, o bien proceder a la lisis celular (paso 1.3.4) o almacenar el pellet indefinidamente a -80 ° C.
- Disolver 1 inhibidor de la proteasa Mini tableta en 20 ml de tampón de lavado (50 mM NaH 2 PO 4, NaCl 500 mM, imidazol 20 mM, pH 8,0) en un tubo cónico de 50 mL.
- Transferir el tampón de lavado que contiene inhibidor de proteasa al tubo cónico que contenía el sedimento. Vortex hasta que el sedimento se resuspendió.
- Transferencia de las células resuspendidas a un vaso de precipitados de 100 ml y lisar las células por sonicación (secuencia de impulsos de 45 segundos en 45 segundos con un tiempo de ejecución de 2 min y 15 segundos a una amplitud de 75 por ciento).
- Transferir el lisado a un tubo cónico de 50 ml de metaly se centrifuga durante 60 minutos a 15.000 xga 4 ° C.
- Aclarar el lisado mediante el paso a través de un filtro de jeringa de 0,2-0,45 micras en un tubo cónico de 50 mL.
NOTA: La concentración típica de lisado obtenido es 100 mg / ml.
- Purificar tret de E. coli lisado celular utilizando cromatografía líquida rápida de proteínas (FPLC).
- Configurar el FPLC con una columna de afinidad de níquel (5 ml de volumen de lecho). Lavar la columna con 10 ml de agua desionizada o hasta que la columna está limpio de cualquier contaminante. Equilibrar la columna utilizando 20 ml de tampón de lavado (50 mM NaH 2 PO 4, NaCl 500 mM, imidazol 20 mM, pH 8,0) a una velocidad de flujo de 1 ml / min.
- Cargar el lisado (20 ml) obtenido de la etapa 1.3.8 en la columna y eluir las proteínas no marcadas con tampón de lavado a una velocidad de flujo de 1 ml / min hasta que la absorbancia alcanza los niveles de fondo (se requieren típicamente 80 a 100 ml de tampón de lavado) .
- Eluir Su-etiquetados tret mediante el uso de un lineal gradient de tampón de elución (50 mM NaH 2 PO 4, NaCl 500 mM, imidazol 250 mM, pH 8,0) 1 a 100% durante 60 min a un caudal de 1 ml / min. Recoger fracciones de 4 mL hasta tret ha eluido y la absorbancia alcanza el nivel basal.
NOTA: Por lo general, se requieren 60 ml de tampón de elución para eluir la proteína, y la proteína se eluye en el rango tampón de elución 60-100%. Se obtienen aproximadamente 10 a 15 ml de pura TRET en tampón de elución. - Determinar la concentración de TRET midiendo la absorbancia a 280 nm contra un blanco de tampón de elución.
- Cambio de TRET en tris (hidroximetil) aminometano (Tris) tampón por diálisis.
- Después de preparar los tubos de diálisis de acuerdo con las instrucciones del fabricante, el primer por aclarado con agua desionizada y luego tampón Tris (Tris 50 mM, NaCl 300 mM, pH 8,0).
- Cargar la muestra tret en el tubo de diálisis usando una jeringa y aguja roma. Se dializa durante la noche unagainst 2 L de tampón de Tris.
- Determinar la concentración de TRET midiendo la absorbancia a 280 nm frente a un blanco recogido del lavado de diálisis.
- Transferir la solución tret a un tubo cónico de 50 ml y proceder a la síntesis de trehalosa analógica (paso 2) o almacenar la enzima a 4 ° C.
NOTA: tret es una proteína termoestable. El TRET se almacenó en tampón Tris a 4 ° C durante varios meses sin observar una pérdida significativa de actividad.
2.-Una etapa de síntesis de trehalosa Análogos Utilizando la Enzima tret
NOTA: El protocolo siguiente se describe una escala de reacción basado en 4 ml de volumen, que puede suministrar aproximadamente 15 a 30 mg de análogo de trehalosa en función de eficacia de la reacción y el peso molecular del producto. Los componentes de la reacción se pueden escalar para obtener más o menos análogo trehalosa si se desea.
- Añadir análogo de la glucosa (0,080 mmol, masa dependerá del peso molecular), UDP-glucosa (0.160 mmol, 97,6 mg), y MgCl 2 (0,080 mmol, 16,3 mg) a un tubo cónico de 15 mL. Las concentraciones finales de estos componentes serán 20 mM, 40 mM, y 20 mM, respectivamente.
- Añadir TRET en tampón Tris (obtenido de la etapa 1.5.4) y, si es necesario, un volumen apropiado de tampón Tris (Tris 50 mM, NaCl 300 mM, pH 8,0) para conseguir una concentración final de enzima de 300 mg / ml y una final volumen de 4 ml. Pipetear la mezcla arriba y abajo suavemente o invertir el tubo para disolver los sólidos.
- Incubar la reacción a 70 ° C con agitación a 300 rpm durante 1 hora, a continuación, colocar el tubo en hielo para enfriar.
3. Purificación de trehalosa Análogos de mezcla bruta de reacción enzimática
- Pre-enjuague una unidad de filtro centrífugo (límite de peso molecular nominal (NWML) 10 kDa) para eliminar glicerol traza en la membrana mediante la adición de 3 ml de agua desionizada a la unidad de filtro de centrífuga y centrifugar a 3000 xg hasta que todo el líquido pasa a través del filtroen el tubo (aproximadamente 20 min). Repetir dos veces más. Complete este paso inmediatamente antes de o durante la reacción (paso 2.3).
- Después de enfriar la mezcla de reacción enzimática (obtenido de la etapa 2.3), la transferencia a la unidad de filtro centrífugo pre-enjuagado. Enjuague el tubo de reacción con 1 ml de agua desionizada y traslado a la unidad de filtro centrífugo. Repetir el enjuague del tubo de reacción para la recuperación máxima de producto.
- Centrifugar la unidad de filtro de centrífuga a 3.000 xg hasta que todo el líquido pasa a través del filtro en el tubo (aproximadamente 20 min). Enjuague la cámara superior de la unidad de filtro centrífugo con 3 ml de agua desionizada y se centrifuga a 3.000 xg hasta que todo el líquido pasa a través del filtro en el tubo (aproximadamente 20 min). Repita el enjuague para la recuperación máxima del producto.
- Desechar la cámara superior de la unidad de filtro centrífugo. Añadir la resina de intercambio iónico de lecho mixto (3 g) al filtrado en la parte inferior del tubo (típico filtrado volume es 8-15 ml en función del número de aclarados). Se agita a temperatura ambiente durante 1 hora con una barra de agitación magnética a una velocidad suficiente para mantener las perlas de resina en suspensión en la solución.
- Decantar el sobrenadante y filtrar para eliminar la resina. Añadir 5 ml de agua desionizada para enjuagar la resina restante. Decantar el sobrenadante y filtrarla, combinándola con la solución de producto de la primera decantación. Repetir el enjuague de la resina para la recuperación máxima de producto.
- Analizar la reacción por cromatografía en capa fina (TLC) o HPLC para determinar si se consiguió la conversión completa del material de análogo de la glucosa al producto análogo de trehalosa de partida. Ver el paso 4.1 para el análisis de TLC y de paso 4.2 para el análisis por HPLC.
- Eliminar el agua por liofilización o evaporación rotatoria para dar el producto seco. Si no se observó ningún análogo de la glucosa sin reaccionar durante TLC o el análisis de HPLC, la purificación por cromatografía es innecesario. Pesar el producto para obtener la reacción Yield y realizar de resonancia magnética nuclear (NMR) espectroscópica de análisis (paso 4.3) para confirmar la estructura del producto y la pureza.
- Si se observó análogo de la glucosa que no ha reaccionado durante el análisis de TLC, separarlo del análogo de trehalosa usando una columna de exclusión de tamaño.
- Preparar una columna de 1 x 100 cm que contiene, medios P2 de poliacrilamida tamaño de las perlas de exclusión desionizada saturada con el agua extra-fina de acuerdo con las instrucciones del fabricante.
NOTA: La columna de exclusión puede ser reutilizado después de lavar con agua desionizada. - Re-disolver el producto de la reacción enzimática se secaron (obtenido de la etapa 3.7) en 0,5 ml de agua desionizada. Aplicar la solución de producto a la columna de exclusión de tamaño de forma manual o mediante el uso de un adaptador de flujo de la columna. Enjuague el vial que contenía el producto en bruto con otros 0,5 ml de agua desionizada, y cargarlo en la columna de exclusión de tamaño.
- Eluir el producto con agua desionizada por flujo de gravedad y recoger las fracciones de aproximadamente 2 mvolumen L.
- Analizar las fracciones por TLC (paso 4.1). Se combinan las fracciones que contienen trehalosa pura analógica.
- Eliminar el agua por liofilización o evaporación rotatoria para dar el producto seco. Pesar el producto para obtener el rendimiento de la reacción y proceder a análisis de RMN (véase el paso 4.3).
- Preparar una columna de 1 x 100 cm que contiene, medios P2 de poliacrilamida tamaño de las perlas de exclusión desionizada saturada con el agua extra-fina de acuerdo con las instrucciones del fabricante.
4. Análisis de la trehalosa analógicos Productos
- Realizar un análisis de cromatografía en capa fina (TLC) de la reacción TRET.
NOTA: Este procedimiento también se puede utilizar para analizar fracciones de la columna de exclusión por tamaño. Puede ser necesario concentrar las fracciones mezcla de reacción o de la columna antes del análisis TLC de observar la tinción de compuesto en la placa de TLC.- Marca de carriles en la superficie de la placa de TLC con un lápiz y aplicar analito (s) y estándar (s) de interés para los carriles apropiados, incluyendo el estándar análogo de la glucosa, el estándar analógico trehalosa (si está disponible), la mezcla de reacción (o fracciones recogidas de tamaño de correopurificación XCLUSIÓN columna), y un co-punto. Después de aplicar cada muestra a la placa de TLC, dejar que la placa se seque.
NOTA: Para el análisis de la reacción, típicamente de 2 l de muestra se aplica a la placa de TLC. - Desarrollar la placa de TLC utilizando n-butanol / etanol / agua desionizada (5: 3: 2).
- Secar la placa de TLC desarrollada, luego sumergirlo en el 5% de H 2 SO 4 en etanol (tinción de azúcar) y el calor en una placa caliente a fuego alto hasta que las manchas que contienen azúcar pueden ser visualizados (típicamente 5 min).
- Marca de carriles en la superficie de la placa de TLC con un lápiz y aplicar analito (s) y estándar (s) de interés para los carriles apropiados, incluyendo el estándar análogo de la glucosa, el estándar analógico trehalosa (si está disponible), la mezcla de reacción (o fracciones recogidas de tamaño de correopurificación XCLUSIÓN columna), y un co-punto. Después de aplicar cada muestra a la placa de TLC, dejar que la placa se seque.
- Realizar análisis de HPLC de TRET mezclas de reacción utilizando cualquier sistema de HPLC capaz de separar y detectar los hidratos de carbono. Este protocolo implica la separación de hidratos de carbono utilizando una columna de HPLC de aminopropilo y la detección mediante el índice de refracción.
- Adjuntar aminopropil columna (4,6 x 250 mm) que contiene un protector de pre-columna a la HPLC.
- Equilibrar aminopropil columna con 80% de acetonitrilo en agua desionizada a una velocidad de flujo de 0,4mL / min.
- Cargar la solución de producto de reacción (o estándar) en la columna de aminopropilo.
- Eluir el producto (o estándar) con 80% de acetonitrilo en agua desionizada a una velocidad de flujo de 0,4 ml / min y una temperatura de columna de 50 ° C. Típicamente, el tiempo de ejecución utilizado es 40 min.
NOTA: Tanto el material análogo de la glucosa de partida y el producto análogo trehalosa pueden ser detectados por el índice de refracción, aunque se podrían utilizar otros métodos tales como la detección de dispersión de luz evaporativo (ELSD). Usando las condiciones descritas, los análogos de glucosa típicamente eluyen entre 10 a 15 min y trehalosa análogos eluyen entre 15 a 25 min.
- El análisis de RMN de los análogos de trehalosa purificada.
- Disolver análogo de trehalosa purificada en D2O (700 l) y transferir la solución a un tubo de RMN.
- Adquirir 1 H y 13 C espectros de NMR de acuerdo con los protocolos de las instalaciones de RMN correspondientes.
5. Aplicación de sintetizado-TRET trehalosa Análogos a la detección de micobacterias
- Sintetizar, purificar y administrar de 6 TreAz de M. smegmatis (Msmeg).
- Añadir 6-azido-6-deoxi glucopiranosa (6-GlcAz, 0,020 mmol, 4,1 mg), UDP-glucosa (0,040 mmol, 24,4 mg), y MgCl 2 (0,020 mmol, 4,1 mg) a un tubo cónico de 15 mL.
- Añadir TRET en tampón Tris (obtenido de la etapa 1.5.4) para conseguir una concentración final de enzima de 300 mg / ml y un volumen final de 1 ml. Pipetear la mezcla arriba y abajo suavemente o invertir el tubo para disolver los sólidos.
- Incubar la reacción a 70 ° C con agitación durante 15 min.
- Se diluye la mezcla de reacción enzimática con 3 ml de agua desionizada y la transfiere a una unidad de filtro centrífugo pre-lavado (NMWL 10 kDa). Centrifugar la unidad de filtro a 3.000 xg hasta que la mayor parte del líquido pasa a través del filtro en el tubo, aproximadamente 10 min.
- º descartee cámara superior de la unidad de filtro centrífugo. Añadir resina de intercambio iónico de lecho mixto (0,75 g) al tubo y remover / batido a temperatura ambiente durante 25 min. Decantar el sobrenadante y filtrar para eliminar la resina.
NOTA: Los pasos 5.1.1-5.1.5 proporcionan una solución acuosa de 6-azido-trehalosa (6-TreAz) a una concentración de aproximadamente 5 mM en menos de 1 hora. La concentración 5 mM se estima en base a la conversión cuantitativa de sustrato a producto y de la dilución que tiene lugar durante las etapas de purificación, suponiendo una pérdida mínima de producto durante estos pasos. La solución puede ser esterilizada por filtración antes de la adición a una muestra biológica, si se desea. - Añadir el volumen apropiado de solución de producto 6-TreAz a un cultivo en fase logarítmica de M. smegmatis (Msmeg), típicamente para conseguir un volumen de cultivo final de 100-1.000 l y una concentración final 6-TreAz de ~ 25 M. Se incuban las células a 37 ° C para la cantidad deseada de tiempo, típicamente 60 min.
- Realizar haga clic en la química para conjugar un fluoróforo a las células marcadas con azida. En este protocolo, utilizar catalizada por Cu cicloadición de azida-alquino (CuAAC) para entregar un fluoróforo a azidas de la superficie celular en Msmeg.
- Centrifugar las células a 3900 xg durante 5 min, y después se lavan las células con PBS que contenía 0,5% de albúmina de suero bovino. Repetir dos veces.
- Vuelva a suspender las células sedimentadas en 4% para-formaldehído en PBS para solucionarlos. Después de incubar durante 10 min, repita el paso 5.2.1 para lavar las células.
- Vuelva a suspender las células sedimentadas en 138 l de PBS.
- Añadir 3 l de una solución madre 1 mM de alquino-carboxirodamina 110 (Alquino-488) en DMSO.
- Añadir 3 l de una solución recién preparada de stock 60 mM de ascorbato de sodio en agua desionizada.
- Añadir 3 l de una solución 6,4 mM de Tris [(1-bencil-1H-1,2,3-triazol-4-il) metil] amina (TBTA) en terc-butanol / dimetilsulfóxido (DMSO) 4: 1.
- Añadir 3 y #956; L de una solución madre 50 mM de CuSO 4 en agua desionizada.
- Pipetear la célula suspensión arriba y abajo, a continuación, se incuba en la oscuridad a temperatura ambiente durante 30 min.
- Repita el paso 5.2.1 para lavar las células. Volver a suspender las células en 150 l de PBS.
- Realizar análisis de fluorescencia celular. En este protocolo, utilizar microscopía de fluorescencia para visualizar la fluorescencia celular de Msmeg etiquetado.
- Añadir 10 l de células bacterianas en suspensión en PBS a un portaobjetos de microscopio y ligeramente extender el líquido en una capa fina, utilizando el borde de un cubreobjetos. Dejar secar al aire en la oscuridad.
- Añadir 10 l de medio de montaje sobre la muestra seca, a continuación, colocar la cubierta se desliza sobre la muestra y se aplica adhesivo (por ejemplo, esmalte de uñas) para inmovilizar.
- Imagen de las diapositivas utilizando un microscopio de fluorescencia a un aumento de 100X.
Resultados
T. tenax TRET se obtuvo de E. coli con un rendimiento de aproximadamente 4 mg / L usando la expresión y purificación de proteínas técnicas estándar. Una etapa de cromatografía de afinidad de níquel sola era suficiente para purificar TRET de lisado de E. coli (una traza FPLC representativo se muestra en la Figura 4). Según se establece en nuestra publicación inicial en el proceso de síntesis tret, T. tenax recombinante tret es...
Discusión
Análogos de trehalosa tienen el potencial de impactar en diversos campos, desde la conservación de alimentos y productos farmacéuticos para el diagnóstico y el tratamiento de infecciones microbianas 6. Existentes métodos de síntesis química de múltiples etapas son útiles para producir análogos de trehalosa complejas con múltiples sitios de modificación (por ejemplo, de origen natural glicolípidos micobacterianos complejos). Sin embargo, estos métodos son invariablemente lar...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Materiales
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Referencias
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados