É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Rápida em uma etapa enzimática Síntese e All-aquosa Purificação da trealose Análogos
Neste Artigo
Resumo
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Resumo
versões de trealose, ou análogos de trealose quimicamente modificados, têm aplicações em biologia, biotecnologia e ciência farmacêutica, entre outros campos. Por exemplo, análogos de trealose rolamento etiquetas detectáveis têm sido utilizados para detectar o Mycobacterium tuberculosis e pode ter aplicações como agentes de imagiologia de diagnóstico de tuberculose. versões hidroliticamente estáveis de trealose também estão sendo perseguidos devido ao seu potencial para uso como adoçantes não calóricos e agentes bioprotetoras. Apesar do recurso desta classe de compostos para diversas aplicações, o seu potencial permanece insatisfeita devido à falta de uma rota robusta para a sua produção. Aqui, relatamos um protocolo detalhado para a síntese de um só passo biocatalítico rápida e eficiente de análogos de trealose que ultrapassa os problemas associados com a síntese química. Através da utilização da enzima termoestável trealose sintase (t Ret) de Thermoproteus tenax, análogos de trealose pode ser generatEd num único passo a partir de análogos de glucose e glucose uridina difosfato com um rendimento elevado (até à conversão quantitativa) em 15-60 min. Um protocolo de purificação de não-cromatográfico simples e rápida, que consiste de diálise e centrifugação de permuta iónica, pode proporcionar muitos análogos de trealose de concentração conhecida em solução aquosa em menos de 45 min. Nos casos em que não reagiu análogo de glucose ainda permanece, purificação cromatográf ica do produto análogo de trealose pode ser realizada. No geral, este método fornece uma plataforma biocatalítico "verde" para a síntese acelerada e purificação de análogos de trealose que seja eficiente e acessível a não-químicos. Para exemplificar a aplicação do presente método, é descrito um protocolo para a síntese, todos aquoso purificação, e administração de um clique sonda química à base de trealose a micobactérias, todas as quais demorou menos de uma hora e permitiu a detecção de fluorescência de micobactérias. No futuro, prevemos que, entre other aplicações, este protocolo pode ser aplicado para a rápida síntese de sondas à base de trealose para diagnóstico de tuberculose. Por exemplo, de curta duração análogos trealose modificado com radionuclídeos (por exemplo, 18 trealose F-modificada) poderiam ser usados para modalidades de imagens clínicas avançadas como a tomografia por emissão de positrões tomografia-computadorizada (PET-CT).
Introdução
A trealose é um dissacárido não redutor simétrico que consiste em duas metades de glicose que são unidas por uma 1,1-α, ligação α-glicosídica (Figura 1A). Enquanto trealose está ausente de seres humanos e outros mamíferos, ele é normalmente encontrada em bactérias, fungos, plantas e invertebrados 1. O principal papel da trealose na maioria dos organismos é proteger contra stresses ambientais, tais como dessecação 1. Além disso, alguns agentes patogénicos humanos exigir trealose para virulência, incluindo o Mycobacterium tuberculosis causadoras de tuberculose, a qual utiliza trealose como um mediador da biossíntese do envelope celular e como um bloco de construção para a construção de glicolípidos imunomoduladores 2.
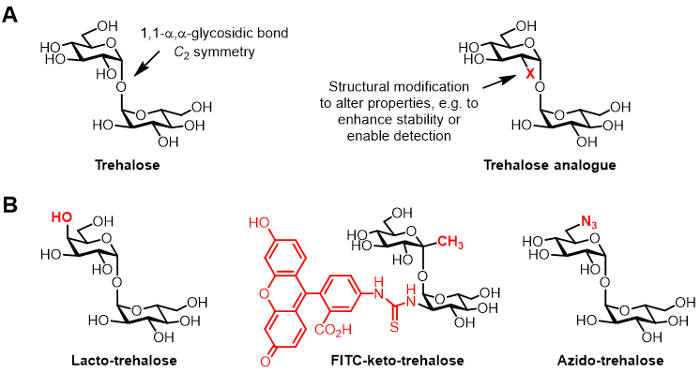
Figura 1: A trealose e análogos de trealose. (AEstruturas de trealose) natural e um análogo de trealose não natural, em que X é uma modificação estrutural. (B) Os exemplos de análogos de trealose relatados na literatura que têm aplicações potenciais em biopreservação e bioimaging.
Devido à sua estrutura única e as funções fisiológicas, trealose tem atraído uma atenção significativa para utilização em bio (tecno) lógica e aplicações biomédicas 3. As propriedades de proteção de trealose observados na Natureza, por exemplo, a sua capacidade impressionante para ajudar a sustentar a vida em plantas "ressurreição" que foram submetidos a desidratação extrema 4 -ter estimulou sua ampla utilização em aplicações Bioconservação. A trealose foi utilizada para preservar uma grande variedade de amostras biológicas, tais como ácidos nucleicos, proteínas, células e tecidos 3. Por exemplo, a trealose é utilizado como um aditivo estabilizante em um certo número de produtos farmacêuticos tchapéu estão no mercado, incluindo vários anticorpos monoclonais anti-câncer 3. Assim, a trealose é utilizado como um adoçante na indústria alimentar e é amplamente utilizado para a conservação do produto em ambos os indústrias alimentar e cosmética. A adopção de trealose para estes tipos de aplicações comerciais foi inicialmente limitada pela incapacidade de obter grandes quantidades de trealose pura a partir de fontes naturais ou através de síntese. No entanto, um processo enzimático eficaz para a produção económica de trealose a partir de amido foi recentemente desenvolvido, que tem estimulado o seu uso comercial generalizado 5.
Derivados de trealose, quimicamente modificada, aqui referidos como análogos de trealose, ganharam cada vez mais atenção para várias aplicações (estrutura genérica mostrada na Figura 1A; Exemplos específicos de análogos de trealose mostrados na Figura 1B) 6. Por exemplo, lacto-trealose é um análogo de trealose com uma das suas unidades de glucose substituída com galactose, assim, o seu grupo hidroxilo na posição 4 tem uma configuração estereoquímica invertida. Lacto-trealose tem as mesmas propriedades estabilizadores como trealose, mas é resistente à degradação por enzimas intestinais, tornando-o atractivo como um aditivo alimentar não calórico 6, 7.
O interesse de nosso grupo no análogos trealose refere-se principalmente ao seu valor como sondas e inibidores específicos de micobactérias. Os grupos Barry e Davis desenvolvido um análogo ceto-trealose fluoresceína conjugado, com o nome de FITC-ceto-trealose, o que foi mostrado para metabolicamente rotular a parede celular de M. tuberculosis ao vivo, permitindo a sua detecção por microscopia de fluorescência 8. O laboratório Bertozzi desenvolvido menor azido-trealose (TreAz) análogos que poderia metabolicamente rotular a parede celular e, subsequentemente, ser detected usando clique química e análise de fluorescência 9. Estes avanços apontam para a possibilidade de utilização de sondas baseadas em trealose como agentes de imagiologia de diagnóstico para a tuberculose. Análogos trealose também têm sido perseguido como inibidores de M. tuberculosis devido ao seu potencial para perturbar percursos na bactéria que são essenciais para a viabilidade e virulência de 10, 11, 12.
Até agora, o principal obstáculo para o desenvolvimento de análogos de trealose para bio (tecno) aplicações lógicas e biomédicas é a falta de métodos sintéticos eficientes. As duas rotas tradicionais para a produção de análogos de trealose dependem de síntese química (Figura 2). Uma via envolve desymmetrization / alteração de trealose natural, enquanto a outra envolve começando com blocos de construção de monossacárido apropriadamente funcionalizadas e realizando a glicosilação químicaforjar a, ligação α-glicosídica 1,1-α. Estas abordagens, que foram recentemente discutidas em artigos de revisão 13, 14, provaram ser úteis para realizar a síntese de várias etapas de pequenas quantidades de produtos naturais contendo trealose complexos, tais como sulfolipido-1 a partir de M. tuberculosis 15. No entanto, ambas as abordagens são geralmente ineficientes, demorado, inacessível aos não-químicos, e, além disso, não são considerados como sendo amigos do ambiente. Assim, para a síntese de certos tipos de análogos de trealose, estas estratégias não são ideais.
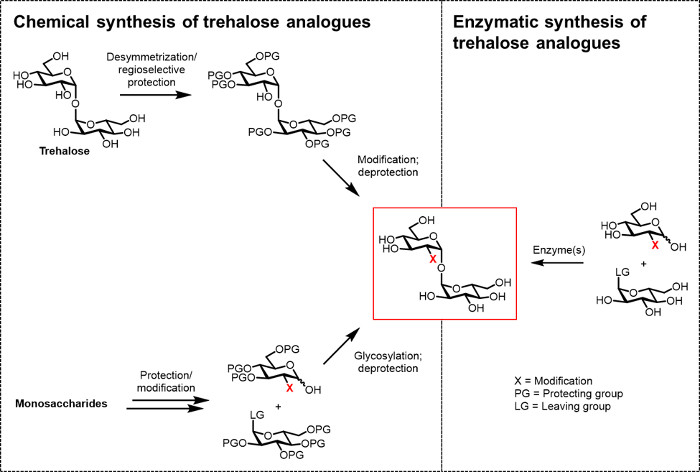
Figura 2: Abordagens para a síntese de trealose analógico. Chemical abordagens para a síntese de trealose analógico, mostrada à esquerda, utilize os procedimentos de várias etapas que envolvem difícil protecpassos ção / desprotecção, desymmetrization, e / ou glicosilação. Síntese enzimática, mostrado no lado direito, utiliza enzima (s) para converter substratos estereosselectivamente simples, não protegida para trealose análogos em solução aquosa. O protocolo enzimática aqui relatada utiliza um enzima sintase de trealose (t Ret) para converter os análogos de glucose e UDP-glicose em análogos de trealose num único passo. Por favor clique aqui para ver uma versão maior desta figura.
Uma rota biocatalítico eficiente de análogos de trealose facilitaria a produção, avaliação e aplicação desta classe promissora de moléculas. Embora o processo enzimático comercial para a produção de trealose 5 não é adaptável para a síntese de análogos, porque utiliza o amido como um substrato, há outro caminho biossintéticoformas de arte na natureza que podem ser exploradas para a síntese analógica trealose. No entanto, a investigação nesta área, que foi recentemente revisto 6, tem sido limitada. Um relatório usou um método inspirado na via biossintética trealose Escherichia coli para acessar um único analógico fluoro-trealose do flúor-glucose correspondente. No entanto, esta abordagem requer um sistema de três-enzima que tenha a eficiência e a generalidade 8 limitado. Outra abordagem que tem sido explorada é a utilização de trealose-fosforilase (TREP) no sentido inverso, o que, em princípio, permite a síntese de uma etapa de análogos de trealose a partir de análogos de glucose e glucose-1-fosfato-6, 16, 17. Embora esta abordagem pode ter promessa de futuro, ambos os inversores e reter TrePs atualmente têm desvantagens para a síntese analógica. Por exemplo, TrePs invertendo ter uma expe proibitivamentensive molécula de dador (β-D-glucose-1-fosfato) e TrePs de retenção têm rendimentos de expressão de enzima pobre / estabilidade e promiscuidade substrato limitada. Melhorias significativas (por exemplo, através de engenharia enzimática) serão necessários antes da síntese analógica TREP-mediada é prático.
Actualmente, a abordagem mais prática para a síntese enzimática de análogos de trealose é a utilização de uma enzima sintetase de trealose (t Ret), que converte a glicose e difosfato de uridina (UDP) -glucose em trealose num único passo 6. Recentemente, relatou a utilização de Thermoproteus tenax-Tret uma enzima termoestável e unidireccional 18 -para sintetizar análogos de trealose a partir de análogos de glucose e UDP-glucose (Figura 3) 19. Esta enzima funciona apenas no sentido sintético e evita o problema de degradação de trealose foi encontrado no sistema TREP. Este coul reacção de um passod ser completada em 1 hora, e uma ampla variedade de análogos de trealose foram acedidos com um rendimento elevado (até> 99% tal como determinado por cromatografia líquida de alta eficiência (HPLC)) a partir de substratos análogo da glicose prontamente disponíveis (ver Tabela 1 nos resultados representativos seção).
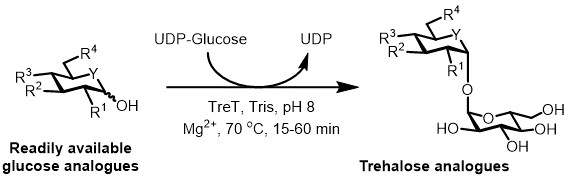
Figura 3: síntese de um só passo Tret-catalisada de análogos de trealose. A enzima Tret de T. tenax estereosselectivamente pode juntar-se análogos de glicose prontamente disponíveis e UDP-glicose para formar análogos de trealose em um passo. R 1 -R 4 = modificação estrutural variável, por exemplo azido, fluoro, desoxi-, tio-, estereoquímica, ou modificações marcador isotópico; Y = heteroátomo variável, por exemplo oxigénio ou enxofre, ou heteroátomo marcado isotopicamente.
Aqui, nós fornecemos adProtocolo PORMENORIZADA para o processo de síntese Tret, incluindo a expressão e purificação de Tret partir de E. coli, as condições de reacção optimizado Tret, e um método de purificação melhorado, que é levada a cabo inteiramente na fase aquosa. Este protocolo modificado permite a síntese conveniente e eficiente e purificação de diversos análogos de trealose à escala semi-preparativa (10-100 mg). Nós também demonstrar o uso deste protocolo para preparar e administrar uma sonda à base de trealose a micobactérias em menos de 1 hora, o que permitiu a detecção de fluorescência rápida de células de micobactérias.
Protocolo
1. Expressão e purificação de t Ret de Top10 de E. coli
NOTA: Entre em contato com os autores para solicitar a estirpe de E. coli Tret expressando (plasmídeo pBAD Tret, contendo o gene tret T. tenax sob o controle da proteína AraC, transformado em Top10 de E. coli 19) eo acordo de transferência de material acompanhante . O protocolo seguinte tipicamente dá um rendimento de proteína de aproximadamente 4 mg / L.
- Prepara-se uma cultura durante a noite 3 mL de t Ret-expressando E. coli.
- Streak Top10 de E. coli transformada com o vector de expressão de pBAD-Tret em um caldo de lisogenia (LB) placa de agar contendo 100 ug / ml de ampicilina.
- Incubar a placa a 37 ° C durante aproximadamente 48 horas.
- Escolher uma única colónia da placa e inocular 3 mL de meio líquido LB contendo 100 ug / ml de ampicilina, num tubo de cultura.
- Colocar o tubo em uma incubadora com agitação a 37 & #176; C x 175 rpm durante a noite.
- Induzem a expressão de proteínas em Tret-expressando E. coli.
- Adicionar 750 ml de Terrific Broth suplementado com 100 ug / ml de ampicilina para um frasco de cultura de 2800 mL de Fernbach. Transferir 1 ml de caldo do frasco para uma cuvete para utilização posterior como um branco.
- Adicionar a cultura durante a noite 3 mL gerado no passo 1.1.4 do frasco de cultura, em seguida, colocar o balão numa incubadora e agitar a 37 ° C x 200 rpm. Verifique periodicamente a absorção da cultura a 600 nm contra o branco recolhido na etapa 1.2.1.
- Uma vez que a absorvância a 600 nm atinge entre 0,5-1,0, induzir a expressão Tret por adição de 750 mL de solução 1 M de arabinose (concentração final 1 mM) à cultura. Devolver o frasco para a incubadora e agitar durante a noite a 37 ° C x 200 rpm.
- Pellet e lisar as células de E. coli que expressam Tret.
- Transferir a cultura para um polipropileno bottle e centrifugar durante 15 min a 4000 xg, a 4 ° C.
- Descartar o sobrenadante e ressuspender o sedimento em 15 mL de solução salina tamponada com fosfato (PBS).
- Transferir a suspensão de células para um tubo cónico de 50 ml e centrifugar durante 15 min a 4000 xg, a 4 ° C. Descartar o sobrenadante e quer proceder à lise celular (passo 1.3.4) ou armazenar indefinidamente o sedimento a -80 ° C.
- Dissolve-se um inibidor da protease do mini-comprimido em 20 mL de tampão de lavagem (50 mM de NaH 2 PO 4, 500 mM NaCl, imidazole 20 mM, pH 8,0) num tubo cónico de 50 mL.
- Transferir a solução de lavagem contendo o inibidor de protease para o tubo cónico contendo o sedimento. Vortex até que o sedimento é re-suspensa.
- Transferir as células ressuspensas para uma proveta de 100 ml e lisar as células por sonicação (sequência de impulsos de 45 segundos ligado, 45 segundos desligado com um tempo de execução de 2 minutos e 15 segundos a uma amplitude de 75 por cento).
- Transferir o lisado para um tubo cónico de 50 mL de metale centrifuga-se durante 60 min a 15000 xg, a 4 ° C.
- Clarificar o lisado pela passagem através de um filtro de seringa de 0,2-0,45? M para um tubo cónico de 50 mL.
NOTA: A concentração típica de lisado obtido é de 100 mg / mL.
- Purifica-se Tret a partir de E. coli ligado celular utilizando cromatografia líquida de proteínas rápida (FPLC).
- Configure o FPLC com uma coluna de níquel de afinidade (5 volume de leito mL). Lava-se a coluna com 10 mL de água desionizada, ou até que a coluna é limpa de quaisquer contaminantes. Equilibrar a coluna utilizando 20 ml de tampão de lavagem (50 mM de NaH 2 PO 4, 500 mM NaCl, imidazole 20 mM, pH 8,0) a um caudal de 1 mL / min.
- Carregar o lisado (20 ml) obtido a partir do passo 1.3.8 na coluna e eluir proteínas não marcados com tampão de lavagem, a uma taxa de fluxo de 1 ml / min até a absorvância atinge os níveis de base (tipicamente 80-100 mL de tampão de lavagem são necessárias) .
- Eluir marcada com His Tret usando um g linearradient de tampão de eluição (50 mM de NaH 2 PO 4, 500 mM de NaCl, 250 mM de imidazol, pH 8,0) 1-100% ao longo de 60 min a uma velocidade de fluxo de 1 mL / min. Recolha 4 frações mL até Tret foi eluído e a absorvância atinge o nível da linha de base.
NOTA: Tipicamente, 60 ml de tampão de eluição são necessárias para eluir a proteína e a proteína é eluída na gama de 60-100% de tampão de eluição. Aproximadamente 10-15 ml de Tret pura em tampão de eluição são obtidos. - Determinar a concentração de Tret medindo a absorvância a 280 nm contra um branco de tampão de eluição.
- Troca Tret em tris (hidroximetil) aminometano (TRIS) por diálise.
- Depois de preparar a tubagem de diálise de acordo com as instruções do fabricante, prime-lo por lavagem com água desionizada e em seguida tampão Tris (Tris 50 mM, NaCl 300 mM, pH 8,0).
- Carregar a amostra Tret na tubagem de diálise, utilizando uma seringa e uma agulha romba. Diálise durante a noite umgainst 2 L de tampão Tris.
- Determinar a concentração de Tret medindo a absorvância a 280 nm contra um branco recolhido a partir da lavagem de diálise.
- Transferir a solução para um Tret tubo cónico de 50 mL e prossiga para a síntese de análogo de trealose (passo 2) ou armazenar a enzima a 4 ° C.
NOTA: t Ret é uma proteína termoestável. O Tret foi armazenada em tampão de Tris a 4 ° C durante vários meses sem observar uma perda significativa de actividade.
2. Um passo de síntese de trealose Análogos Usando Tret Enzyme
NOTA: O protocolo que se segue descreve uma escala de reacção com base em 4 mL de volume, que pode fornecer aproximadamente 15-30 mg de análogo de trealose de acordo com a eficiência de reacção e o peso molecular do produto. Os componentes da reacção pode ser dimensionada para obter mais ou menos trealose análogo, se desejado.
- Adicionar análogo da glicose (0,080 mmol, massa irá depender do peso molecular), UDP-glucose (0.160 mmol, 97,6 mg), e MgCl2 (0,080 mmol, 16,3 mg) para um tubo cónico de 15 mL. As concentrações finais destes componentes será de 20 mM, 40 mM e 20 mM, respectivamente.
- Adicionar Tret em tampão Tris (obtido a partir do passo 1.5.4) e, se necessário, um volume apropriado de tampão Tris (Tris 50 mM, NaCl 300 mM, pH 8,0) para alcançar uma concentração final de enzima de 300 ug / mL e uma última volume de 4 ml. Pipetar a mistura para cima e para baixo suavemente ou inverter o tubo para dissolver os sólidos.
- Incubar a reacção a 70 ° C com agitação a 300 rpm durante 1 hora, em seguida, colocar o tubo em gelo para arrefecer.
3. Purificação de Análogos de Trealose em bruto Mistura de Reacção enzimática
- Pré-lavar uma unidade de filtração centrífuga (limite de peso molecular nominal (NWML) de 10 kDa), para remover vestígios de glicerol na membrana através da adição de 3 mL de água desionizada à unidade de filtro de centrífuga e centrifugação a 3000 xg até que todo o líquido passa através do filtropara dentro do tubo (aproximadamente 20 min). Repita mais duas vezes. Conclua esta etapa imediatamente antes ou durante a reacção (passo 2.3).
- Após o arrefecimento da mistura de reacção enzimática (obtido a partir do passo 2.3), transferi-la para a unidade de filtro centrífugo pré-lavado. Lavar o tubo de reacção com 1 mL de água deionizada e transferência para a unidade de filtro centrífugo. Repetir a lavagem do tubo de reacção para a recuperação máxima do produto.
- Centrifugar a unidade de filtro de centrífuga a 3000 xg até que todo o líquido passa através do filtro para dentro do tubo (aproximadamente 20 min). Lavar a câmara superior da unidade de filtro centrífugo com 3 ml de água desionizada e centrifugação a 3000 xg até que todo o líquido passa através do filtro para dentro do tubo (aproximadamente 20 min). Repetir a lavagem para a recuperação máxima do produto.
- Descartar a câmara superior da unidade de filtração centrífuga. Adicionar resina de troca iónica de leito misto (3 g) ao filtrado na parte inferior do tubo (vol filtrado típicoume é 8-15 ml, dependendo do número de lavagens). Agita-se à temperatura ambiente durante 1 hora com uma barra de agitação magnética a uma velocidade suficiente para manter as pérolas de resina em suspensão na solução.
- Decantar o sobrenadante e filtra-se para remover a resina. Adicionar 5 mL de água deionizada para enxaguar a resina remanescente. Decantar o sobrenadante e filtra-se que, combinando-o com a solução do produto a partir da primeira decantação. Repetir a lavagem da resina para a recuperação máxima do produto.
- Analisar a reacção por cromatografia em camada fina (TLC) ou por HPLC para determinar se a conversão completa do material de análogo da glicose para o produto trealose análogo de partida foi alcançada. Veja o passo 4.1 para análise TLC e passo 4.2 para análise por HPLC.
- Remover a água por liofilização ou evaporação rotativa para se obter o produto seco. Se não análogo de glucose que não reagiu foi observado durante a análise por HPLC ou TLC, a purificação por cromatografia não é necessária. Pesa-se o produto para se obter a reacção YieLD e executar de ressonância magnética nuclear (RMN) de espectroscopia de análise (passo 4.3) para confirmar a estrutura e a pureza do produto.
- Se análogo de glucose que não reagiu foi observado durante a análise por TLC, separá-lo do análogo trealose utilizando uma coluna de exclusão de tamanho.
- Prepara-se uma coluna de 1 x 100 cm contendo, extra-finas meios P2 poliacrilamida tamanho do grânulo de exclusão desionizada saturada em água de acordo com as instruções do fabricante.
NOTA: A coluna de exclusão de tamanho pode ser reutilizado após lavagem com água desionizada. - Re-dissolve-se o produto da reacção enzimática seco (obtido a partir do passo 3.7) em 0,5 mL de água desionizada. Aplicar a solução de produto para a coluna de exclusão por tamanho ou manualmente usando um adaptador de fluxo em coluna. Lavar o frasco que continha o produto em bruto com mais 0,5 mL de água desionizada, e carregá-lo para a coluna de exclusão de tamanho.
- Eluir o produto com água desionizada por fluxo de gravidade e recolher fracções de cerca de 2 mvolume de L.
- Analisar as fracções por TLC (passo 4.1). Reunir as fracções contendo o análogo de trealose pura.
- Remover a água por liofilização ou evaporação rotativa para se obter o produto seco. Pesa-se o produto para se obter o rendimento da reacção e proceder à análise por RMN (ver passo 4.3).
- Prepara-se uma coluna de 1 x 100 cm contendo, extra-finas meios P2 poliacrilamida tamanho do grânulo de exclusão desionizada saturada em água de acordo com as instruções do fabricante.
4. Análise da trealose analógicos produtos
- Executar a análise por cromatografia em camada fina (TLC) de reacção Tret.
NOTA: Este procedimento também pode ser utilizada para analisar fracções da coluna de exclusão de tamanho. Pode ser necessário para concentrar a mistura reaccional ou fracções da coluna, antes da análise de TLC para observar coloração composto sobre a placa de TLC.- Mark pistas sobre a superfície da placa do TLC com um lápis e aplicar substância (s) e padrão (s) relevante para as pistas apropriadas, incluindo o padrão análogo da glicose, o padrão de trealose analógico (se disponível), a mistura de reacção (ou fracções recolhidas a partir de tamanho epurificação XCLUSÃO coluna), e um co-mancha. Após aplicação de cada amostra para a placa de TLC, permitir que a placa secar.
NOTA: Para análise da reacção, tipicamente 2 ul de amostra é aplicada à placa de TLC. - Desenvolver a placa de TLC usando n-butanol / etanol / água desionizada (5: 3: 2).
- Seca-se a placa de TLC desenvolvido, em seguida, mergulhá-lo em 5% de H 2 SO 4 em etanol (mancha de açúcar) e aquecer numa placa de aquecimento em alta definição, até manchas contendo açúcar pode ser visualizado (tipicamente 5 min).
- Mark pistas sobre a superfície da placa do TLC com um lápis e aplicar substância (s) e padrão (s) relevante para as pistas apropriadas, incluindo o padrão análogo da glicose, o padrão de trealose analógico (se disponível), a mistura de reacção (ou fracções recolhidas a partir de tamanho epurificação XCLUSÃO coluna), e um co-mancha. Após aplicação de cada amostra para a placa de TLC, permitir que a placa secar.
- Realizar a análise por HPLC de misturas reaccionais Tret usando qualquer sistema de HPLC capaz de separar e detectar os hidratos de carbono. Este protocolo envolve a separação de hidratos de carbono usando uma coluna de HPLC usando detecção aminopropilo e índice de refracção.
- Anexar aminopropil coluna (4,6 x 250 mm) contendo um guarda pré-coluna para a CLER.
- Equilibrar aminopropil coluna com 80% acetonitrilo em água desionizada a uma taxa de fluxo de 0,4ml / min.
- Carregar a solução de produto da reacção (ou padrão) na coluna de aminopropilo.
- Elui-se o produto (ou padrão) com 80% de acetonitrilo em água desionizada a uma taxa de fluxo de 0,4 mL / min e uma temperatura de coluna de 50 ° C. Normalmente, o tempo de execução usado é de 40 min.
Nota: O material de partida análogo da glicose e o produto análogo trealose pode ser detectado por índice de refracção, embora outros métodos tais como a detecção de dispersão de luz evaporativo (ELSD) poderia ser utilizado. Usando as condições descritas, análogos de glicose tipicamente eluem entre 10-15 min e trealose análogos eluir entre 15-25 min.
- A análise por RMN de análogos de trealose purificada.
- Dissolver análogo trealose purificada em D 2 O (700 mL) e transferir a solução para um tubo de RMN.
- Adquirir 1 H e 13 C RMN para os espectros de acordo com protocolos de instalações adequadas de RMN.
5. Aplicação de Tret-Trealose sintetizados análogos para a detecção de micobactérias
- Sintetizar, purificar e administrar 6-TreAz a M. smegmatis (Msmeg).
- Adicionar 6-azido-6-desoxi glucopiranose (6-GlcAz, 0,020 mmol, 4,1 mg), UDP-glucose (0,040 mmol, 24,4 mg), e MgCl2 (0,020 mmol, 4,1 mg) a um tubo cónico de 15 mL.
- Adicionar Tret em tampão Tris (obtido a partir do passo 1.5.4) para atingir uma concentração final de enzima de 300 ug / mL e um volume final de 1 mL. Pipetar a mistura para cima e para baixo suavemente ou inverter o tubo para dissolver os sólidos.
- Incubar a reacção a 70 ° C com agitação durante 15 min.
- Dilui-se a mistura de reacção enzimática com 3 mL de água desionizada e transferi-lo para uma unidade de filtração centrífuga pré-lavado (NMWL de 10 kDa). Centrifugar a unidade de filtro a 3000 xg até que a maior parte do líquido passa através do filtro para dentro do tubo, de aproximadamente 10 min.
- th Rejeitare câmara superior da unidade de filtração centrífuga. Adicionar resina de troca iónica de leito misto (0,75 g) para o tubo e agita-se / Agita-se à temperatura ambiente durante 25 min. Decantar o sobrenadante e filtra-se para remover a resina.
NOTA: Os passos 5.1.1-5.1.5 fornecer uma solução aquosa de 6-azido-trealose (6-TreAz) a uma concentração de cerca de 5 mM em menos de 1 hora. A concentração de 5 mM é estimado com base na conversão quantitativa do substrato em produto e a diluição que tem lugar durante os passos de purificação, assumindo uma perda mínima de produto durante estes passos. A solução pode ser esterilizada por filtração antes da adição de uma amostra biológica, se desejado. - Adicionar o volume apropriado da solução do produto 6-TreAz para uma cultura em fase logarítmica de M. smegmatis (Msmeg), tipicamente para atingir um volume de cultura final de 100-1.000 ul e uma concentração final de 6-TreAz de ~ 25? M. Incubar as células a 37 ° C durante o período de tempo desejado, normalmente 60 min.
- Realizar clique química para conjugar um fluoróforo para células marcadas com azida. Neste protocolo, utilize Cu-catalisada cicloadição azida-alcino (CuAAC) para entregar um fluoróforo para azidas de superfície celular em Msmeg.
- Centrifugar as células a 3900 xg durante 5 min, e em seguida, lavar as células com PBS contendo 0,5% de albumina de soro bovino. Repita duas vezes.
- Re-suspender as células peletizadas em 4% para-formaldeído em PBS para corrigi-los. Após incubação durante 10 minutos, repetir o passo 5.2.1 para lavar as células.
- Re-suspender as células peletizadas em 138 mL PBS.
- Adiciona-se 3 mL de uma solução de reserva 1 mM de alcino-carboxirrodamina 110 (alcino-488) em DMSO.
- Adiciona-se 3 mL de uma solução de estoque 60 mM preparada de fresco de ascorbato de sódio em água desionizada.
- Adiciona-se 3 mL de uma solução de estoque de 6,4 mm de Tris [(1-benzil-1H-1,2,3-triazol-4-il) metil] amina (TBTA) em terc-butanol / dimetilsulfóxido (DMSO) 4: 1.
- Adicionar 3 & #956; L de uma solução de estoque 50 mM de CuSO4 em água desionizada.
- Pipetar a suspensão de células para cima e para baixo, em seguida, incuba-se no escuro à temperatura ambiente durante 30 min.
- Repita o passo 5.2.1 para lavar as células. Re-suspender as células em 150 mL PBS.
- Realizar análise de fluorescência celular. Neste protocolo, usar microscopia de fluorescência para visualizar fluorescência celular de Msmeg rotulados.
- Adicionar 10 ul de células bacterianas suspensas em PBS a uma lâmina de microscópio e levemente espalhar o líquido para uma camada fina, com a aresta de uma lamela. Deixar secar ao ar no escuro.
- Adicionar 10 ml de meio de montagem sobre a amostra seca, em seguida, coloque a cobertura desliza sobre a amostra e aplicar o adesivo (por exemplo, unha polonês) para imobilizar.
- Imagem os slides usando um microscópio de fluorescência na ampliação de 100X.
Resultados
T. tenax Tret foi obtido a partir de E. coli com um rendimento de aproximadamente 4 mg / L, utilizando técnicas de expressão e purificação de proteínas padrão. Uma etapa de cromatografia de afinidade de níquel único foi suficiente para purificar Tret a partir de lisados de E. coli (um vestígio de FPLC representativo é mostrado na Figura 4). Tal como estabelecido na nossa publicação inicial no processo de síntese Tret, recombinante ...
Discussão
Análogos trealose têm o potencial de afetar várias áreas, desde a preservação de alimentos e medicamentos para diagnóstico e tratamento de infecções microbianas 6. Existentes métodos de síntese química de várias etapas são úteis para a produção de análogos de trealose complexos com vários locais de modificação (por exemplo, glicolípidos de ocorrência natural micobacterianas complexos). No entanto, estes métodos são invariavelmente demorado e ineficiente, mesmo qu...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Materiais
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Referências
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados