このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
迅速なワンステップ酵素合成とトレハロース類似体のすべての水精製
要約
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
要約
化学的に修飾されたトレハロースのバージョン、またはトレハロース類似体は、他の分野の中で、生物学、バイオテクノロジー、および製薬科学の用途を有します。例えば、検出可能なタグを有するトレハロースアナログは結核菌を検出するために使用されており、結核診断用造影剤としての用途を有することができます。トレハロースの加水分解的に安定したバージョンはまた、ノンカロリー甘味料およびbioprotective剤としての使用のためのそれらの潜在的に追求されています。様々なアプリケーションのための化合物のこのクラスの魅力にもかかわらず、彼らの可能性は、それらの製造のための強固なルートがないために満たされていないままです。ここでは、化学合成に関連する問題を回避トレハロース類似体の迅速かつ効率的な一段階の生体触媒合成のための詳細なプロトコルを報告します。 サーモテナックスから耐熱性トレハロースシンターゼ(TRET)酵素を利用することにより、トレハロースアナログはgeneratすることができグルコース類似体および15から60分で(定量的変換まで)高い収率でウリジン二リン酸グルコースから一工程で編。スピン透析とイオン交換で構成されて簡単かつ迅速な非クロマトグラフィー精製プロトコルは、わずか45として分で水溶液中の濃度が既知の多くのトレハロースの類似体を提供することができます。未反応のグルコース類似体が残る場合には、トレハロースアナログ生成物のクロマトグラフィー精製を行うことができます。全体的に、この方法は効率的で、非化学者にアクセス可能であるトレハロース類似体の迅速合成および精製のための「グリーン」生体触媒のプラットフォームを提供します。この方法の適用を例示するために、我々は、合成、すべての水精製、および1時間未満とマイコバクテリアの有効蛍光検出を取ったそのすべてがマイコバクテリアのトレハロースベースのクリック化学プローブの投与のためのプロトコルについて説明します。今後は、OTHの中で、ということを想定しますERアプリケーションは、このプロトコルは、結核の診断のためのトレハロースベースのプローブの迅速な合成に適用することができます。例えば、短寿命放射性核種修飾トレハロースアナログ( 例えば 、18 F修飾トレハロース)は、陽電子放出断層撮影、コンピュータ断層撮影法(PET-CT)などの高度な臨床イメージング様式を使用することができます。
概要
トレハロースは、1,1-α、αグリコシド結合( 図1A)によって結合された2つのグルコース部分からなる対称な非還元性二糖類です。トレハロースは、ヒトおよび他の哺乳動物には存在しないが、それは、細菌、真菌、植物、無脊椎動物1に一般的に見出されます。ほとんどの生物におけるトレハロースの主な役割は、乾燥1などの環境ストレスから保護することです。また、いくつかのヒト病原体は、細胞エンベロープ生合成のメディエーターとしておよび免疫脂質2の構築のためのビルディングブロックとしてトレハロースを用いる結核を引き起こす結核菌を含む、毒性のためにトレハロースを必要とします。
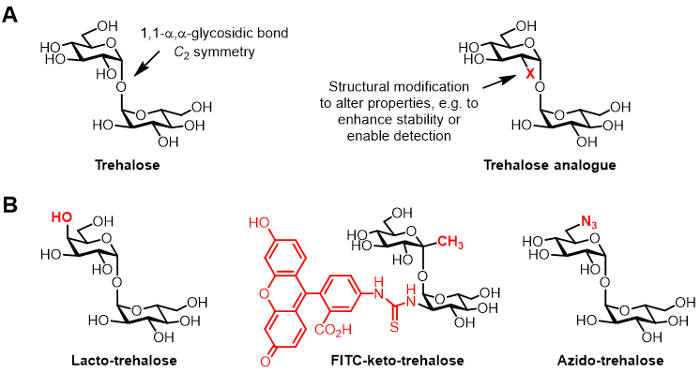
図1: トレハロースとトレハロース類似体。 (Xは構造的な変更であり、天然トレハロースと不自然なトレハロースアナログの)構造。 (B)バイオプリザベーションとバイオイメージングにおける潜在的なアプリケーションを持っている文献に報告トレハロースアナログの例を。
、そのユニークな構造と生理機能に、トレハロースは、バイオ(テクノ)で使用するための論理的および生物医学的応用3を大きな注目を集めています。 nature- 例えばで観察されたトレハロースの保護特性は、その印象的な能力は4 -haveはバイオプリザベーション・アプリケーションでその広範な使用に拍車をかけ極度の脱水を受けた"復活"植物の生活を維持するのに役立ちます。トレハロースは、核酸、タンパク質、細胞、および組織3のような生物学的サンプルの広い配列を保存するために使用されてきました。例えば、トレハロースは、医薬品tの数で安定化添加剤として使用されています帽子は3いくつかの抗癌モノクローナル抗体を含む、市販されています。同様に、トレハロースは、食品業界で甘味料として使用され、それが広く両方食品および化粧品産業における製品の保存のために使用されます。商用アプリケーションのこれらの種類のトレハロースの採用は、当初、天然の供給源から、または合成により純粋なトレハロースの大量を得ることができないことによって制限されていました。しかしながら、澱粉からトレハロースの経済的な生産のための効率的な酵素的方法は、最近、広範な商業的使用に拍車をかけている、開発されています 5。
( 図1Aに示される一般構造、 図1(b)に示すトレハロース類似体の具体例)化学トレハロース類似体と呼ぶ、トレハロース誘導体を改変、様々な用途にますます注目を集めている6。例えば、ラクトトレハロース、ガラクトースで置き換え、そのグルコース単位のいずれかのトレハロースアナログであり、従って、その4位のヒドロキシル基が反転立体化学構成を有しています。ラクトトレハロースはトレハロースと同様の安定化特性を有するが、ノンカロリー食品添加物6,7などが魅力的、腸の酵素による分解に耐性です。
トレハロース類似体における当社グループの持分は、主にマイコバクテリア特異的プローブおよび阻害剤としてのそれらの値に関係します。バリーとデイビス基は蛍光顕微鏡8によりその検出を可能にする、生結核菌の細胞壁を標識代謝することが示されたFITCケトトレハロース命名フルオレセイン共役ケトトレハロースアナログを開発しました。ベルトッツィラボは、代謝、細胞壁にラベルを付け、その後DET可能性が小さいアジドトレハロース(TreAz)類似体を開発しましたクリック化学と蛍光分析9を使用してected。これらの進歩は、結核のための画像診断剤としてトレハロースベースのプローブを使用する可能性を指します。トレハロース類似体はまた、生存率および病原10、11、12のために必須である細菌で経路を破壊するために、それらの潜在的に結核菌の阻害剤として追求されてきました。
これまで、バイオ(テクノ)論理及び生物医学的用途のためにトレハロースアナログを開発する主な障害は、効率的な合成方法がないことです。トレハロースの類似体を製造するには2つの伝統的なルートは、化学合成( 図2)に依存しています。他が適切に官能単糖ビルディングブロックで始まり、に化学的グリコシル化を実行する必要が、一方の経路は、天然トレハロースの非対称化/変更を伴います1,1-α、αグリコシド結合を築きます。最近の総説13、14で議論されてきたこれらのアプローチは、 結核菌 15からそのようなスルホ脂質-1のような複雑なトレハロース含有天然物、少量の多段階合成を達成するために有用であることが判明しました。しかしながら、両方のアプローチは、非化学者に一般的に、時間がかかり、非効率的なアクセス不能であり、そして、さらに、環境に優しいとはみなされません。したがって、トレハロース類似体の特定の種類を合成するため、これらの戦略は理想的ではありません。
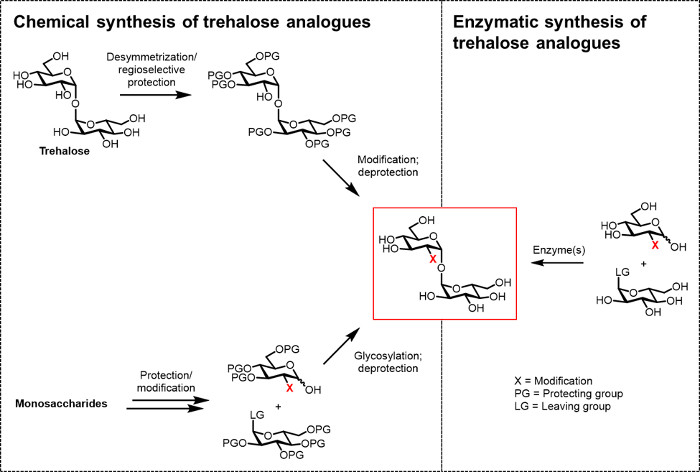
図2: トレハロースアナログ合成へのアプローチ。化学は難しいPROTECを伴う多段階の手順を使用し、左に示し、トレハロースアナログ合成へのアプローチ化/脱保護、非対称化、および/またはグリコシル化のステップ。右側に示す酵素合成は、立体選択的に水溶液中で類似体をトレハロースするための簡単な、保護されていない基質を変換する酵素(複数可)を使用しています。本明細書で報告酵素プロトコルは、単一のステップでトレハロースの類似体へのグルコース類似体およびUDP-グルコースを変換するトレハロース合成酵素(TRET)酵素を使用しています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
トレハロースアナログへの効率的な生体触媒ルートは、製造、評価し、分子のこの有望なクラスの適用を容易にするであろう。トレハロースの生産5用の市販の酵素処理は、それが基質として澱粉を使用しているため類縁体を合成に適応可能ではありませんが、他の生合成経路がありますトレハロースアナログ合成のために利用することができる自然の中での方法。しかし、最近6を検討したこの地域での研究は、制限されています。一つのレポートには、対応するフルオログルコースからの単一フルオロトレハロースアナログにアクセスするには、 大腸菌(Escherichia coli)トレハロース生合成経路に触発されたメソッドを使用していました。しかしながら、このアプローチは、限られた効率と汎用8を有する三酵素系を必要とします。探索された別のアプローチは、原理的にはグルコースアナログおよびグルコース-1-リン酸6、16、17からトレハロース類似体の一段階合成を可能にする逆方向にトレハロースホス(TREP)を使用することです。このアプローチは、将来有望であることができるが、両方の反転と保持TrePs現在アナログ合成のための欠点を有します。例えば、反転TrePsは法外EXPEを持っていますnsiveドナー分子(β-D-グルコース1-リン酸)と保持TrePsが悪い酵素発現収量/安定性と限られた基板の混乱を持っています。 TREP媒介アナログ合成が実用的である前に(酵素工学を介して、例えば )重要な改善が必要とされるであろう。
現時点では、トレハロース類似体の酵素合成のための最も実用的なアプローチは、グルコースおよびウリジン二リン酸(UDP)は、単一のステップ6でトレハロースに-グルコース変換トレハロース合成酵素(TRET)酵素を使用することです。我々は最近、グルコース類似体およびUDP-グルコース( 図3)19からトレハロース類似体を合成-to サーモテナックス TRET、耐熱性および一方向の酵素18の使用を報告しました。この酵素は、合成方向に動作し、TREPのシステムで検出されたトレハロースの劣化の問題を回避できます。このワンステップ反応coul1時間で完了さD、及び(高速液体クロマトグラフィー(HPLC)によって決定されるように> 99%まで)トレハロースアナログの広範な種々の高収率でアクセスされた容易に入手可能なグルコース類似体基質から(代表的な結果の表1を参照セクション)。
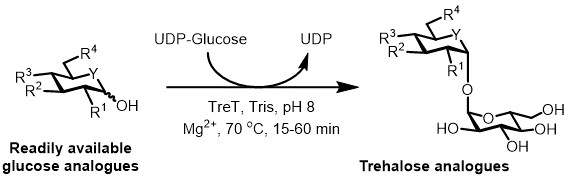
図3: トレハロースアナログのTRET触媒による一段階合成。 T.テナックスからTRET酵素は、立体選択的に1ステップでトレハロースの類似体を形成するために容易に利用可能なグルコース類似体およびUDP-グルコースに参加することができます。 R 1〜R 4 =可変構造変更、例えばアジド、フルオロ、デオキシ、チオ、立体化学、または同位体ラベルの変更のため、 Yは、例えば、酸素または硫黄、または同位体標識されたヘテロための変数のヘテロ原子を=。
ここでは、広告を提供します発現および精製TRETの大腸菌から、最適化されたTRET反応条件、および完全に水性相で行われる改良された精製法を含む、TRET合成処理するためのプロトコルをetailed。この修正されたプロトコルは、セミ分取スケール(10-100 mg)を上の多様なトレハロースアナログの好都合かつ効率的な合成及び精製を可能にします。我々はまた、マイコバクテリア細胞の迅速な蛍光検出を有効にして1時間未満でマイコバクテリアにトレハロースベースのプローブを調製し、投与するために、このプロトコルの使用を実証します。
プロトコル
トップ10 大腸菌から1発現及びTRETの精製
注:TRETを発現する大腸菌株を要求するために、著者に連絡してください(、のpBAD TRETプラスミドをのAraCタンパク質の制御下T.テナックスのTRET遺伝子を含む、トップ10 E.に変換19を 大腸菌 )とそれに付随する材料移転契約。以下のプロトコルは、典型的には、約4 mg / Lでのタンパク質収量を与えます。
- TRET-発現する大腸菌の3 mLの一晩培養物を準備します。
- ストリークトップ10 大腸菌を、100μg/ mLのアンピシリンを含むLB培地(LB)寒天プレート上でのpBAD-TRET発現ベクターで形質転換しました。
- 約37℃で48時間プレートをインキュベート。
- プレートから単一コロニーを採取し、培養チューブに100μg/ mLのアンピシリンを含むLB液体培地3mLのを接種します。
- 37&#振盪インキュベーターにチューブを置きます176; Cは、一晩175回転数をxは。
- TRETを発現するE. coliにおけるタンパク質発現を誘導します。
- 追加750mLのテリフィックブロスは、2800 mLのフェルンバッハ培養フラスコに100μg/ mLのアンピシリンを補充しました。ブランクとして後で使用するためにキュベットにフラスコからの転送を1mLブロス。
- 培養フラスコにステップ1.1.4で生成した3 mLの一晩培養物を追加し、その後、インキュベーターにフラスコを置き、37℃×200 rpmで振とうします。定期的にステップ1.2.1で収集したブランクに対して600nmでの文化の吸光度を確認してください。
- 培養物に1 Mアラビノース溶液(1mMの最終濃度)の750μLを加えることによりTRET発現を誘導する、0.5〜1.0の間に到達した600nmの吸光度を一度。インキュベーターにフラスコを返し、×200 rpmで37℃で一晩振とうします。
- ペレットとTRETを発現する大腸菌細胞を溶解します。
- ポリプロピレンbに文化を転送ottleと4℃で4000×gで15分間遠心操作します。
- 上清を捨て、リン酸緩衝生理食塩水(PBS)15mLの中でペレットを再懸濁。
- 4℃、4,000×gで15分間、50 mLのコニカルチューブと遠心分離機に細胞懸濁液を移します。上清を捨て、いずれかの細胞溶解(ステップ1.3.4)に進むか、-80℃で無期限にペレットを保存します。
- 50 mLコニカルチューブに洗浄緩衝液(50mMのNaH 2 PO 4、500mMのNaCl、20mMのイミダゾール、pH8.0)で20mLに1プロテアーゼ阻害剤ミニタブレットを溶解します。
- ペレットを含むコニカルチューブにプロテアーゼ阻害剤を含む洗浄バッファーを転送します。渦ペレットを再懸濁されるまで。
- (75パーセントの振幅で2分15秒の実行時間とから、45秒で45秒のパルス・シーケンス)を100 mLのビーカーに再懸濁した細胞を移し、超音波処理によって細胞を溶解。
- 50 mLの金属コニカルチューブにライセートを転送しますそして4℃で15,000×gで60分間遠心操作します。
- 50 mLのコニカルチューブに0.2から0.45μmのシリンジフィルターを通過させることにより、溶解物を明確にします。
注:得られた溶解物の典型的な濃度は100 mg / mlです。
- 高速タンパク質液体クロマトグラフィー(FPLC)を用いて、 大腸菌細胞の溶解物からTRETを精製します。
- ニッケルアフィニティーカラム(5mLのベッド容量)でFPLCを設定します。 10mLの脱イオン水または列が任意の汚染物質のきれいになるまでカラムを洗浄。 1mL /分の流速で、洗浄緩衝液の20ミリリットル(50ミリモルのNaH 2 PO 4、500mMのNaCl、20mMのイミダゾール、pHは8.0)を使用してカラムを平衡化。
- (典型的には、洗浄緩衝液の80〜100ミリリットルが必要である)カラムステップ1.3.8から得られた溶解物(20 ml)にロードし、吸光度がバックグラウンドレベルに到達するまで、1mL /分の流速で洗浄緩衝液で、タグなしタンパク質を溶出。
- リニアグラムを使用してHisタグ付きTRETを溶出1mL /分の流速で60分かけて1-100%以上の溶出緩衝液(50mMのNaH 2 PO 4、500mMのNaCl、250mMイミダゾール、pH8.0)をradient。 TRETが溶出していると吸光度がベースラインレベルに達するまで4 mL画分を収集します。
注:典型的には、溶出緩衝液の60 mLのタンパク質を溶出するために必要とされ、そしてタンパク質は60-100%溶出緩衝液の範囲内で溶出します。溶出緩衝液中の純粋なTRETの約10〜15 mLを得ています。 - 溶出緩衝液のブランクに対して280nmでの吸光度を測定することにより、TRETの濃度を決定します。
- 透析によるトリスに交換TRET(ヒドロキシメチル)アミノメタン(トリス)バッファー。
- 製造業者の指示に従って透析チューブを準備した後、脱イオン水、次いでトリス緩衝液(50mMのトリス、300mMのNaCl、pH8.0)で洗浄することによって、それをプライム。
- シリンジと鈍針を使用して、透析チューブにTRETサンプルをロードします。一晩透析トリス緩衝液の2リットルをgainst。
- 透析洗浄から集めブランクに対して、280nmでの吸光度を測定することにより、TRETの濃度を決定します。
- 50 mLのコニカルチューブにTRET液を移し、トレハロースアナログ合成(ステップ2)に進み、または4℃で酵素を格納します。
注:TRETは耐熱性タンパク質です。 TRETは活性の有意な損失を観察することなく、数ヶ月間、4℃でトリス緩衝液中で保存しました。
TRET酵素を用いたトレハロースアナログの2つのステップの合成
注:以下のプロトコルは、反応効率および生成物の分子量に応じてトレハロースアナログの約15-30ミリグラムを提供することができます4 mL容量に基づいて、反応スケールを、説明します。反応成分は、必要に応じて、多かれ少なかれトレハロースアナログを得るためにスケーリングすることができます。
- グルコースアナログ(0.080ミリモル、質量は分子量に依存します)、UDP-グルコース(0を追加します。15 mLのコニカルチューブに160ミリモル、97.6 mg)を、そして(0.080ミリモルのMgCl 2、16.3 mg)を。これらの成分の最終濃度は、それぞれ、20ミリメートル、40ミリメートル、および20mMです。
- (ステップ1.5.4から得られた)のトリス緩衝液中TRETを追加し、必要に応じて、トリス緩衝液の適切な量(50mMのTris、300mMのNaCl、pH8.0)に300 / mlの最終酵素濃度と最終を達成します4ミリリットル。ピペットで上下にそっとまたは固体を溶解し、チューブを反転させ、混合物。
- 冷却するためにチューブを氷上に置き、その後、1時間、300rpmで振盪しながら70℃で反応をインキュベートします。
粗製酵素反応混合物からトレハロースアナログの3精製
- すべての液体がフィルタを通過するまで遠心分離フィルター装置に、脱イオン水3mLを添加し、3,000×gで遠心分離することにより、膜中の微量のグリセロールを除去するために遠心分離フィルターユニット(公称分子量限界(NWML)10キロダルトン)をプレリンスチューブに(約20分)。さらに2回繰り返します。直前に又は反応(ステップ2.3)の間に、この手順を完了します。
- (ステップ2.3から得られた)酵素反応混合物を冷却した後、プレリンス遠心フィルターユニットに転送します。遠心式フィルターユニットの脱イオン水と転送1mLで反応管をすすぎます。製品の最大の回収のために反応管の繰り返しリンス。
- すべての液体がチューブ(約20分)にフィルタを通過するまで、3,000×gで遠心分離フィルターユニットを遠心。すべての液体がチューブ(約20分)にフィルタを通過するまで、3,000×gでの脱イオン水および遠心分離機の3 mLで遠心分離フィルターユニットの上部チャンバーをすすぎます。製品の最大の回収のためにすすぎを繰り返します。
- 遠心式フィルターユニットの上部チャンバーを捨てます。チューブの底に濾液に混合床イオン交換樹脂(3 g)を加える(典型的濾液体積梅は、すすぎの回数に応じて8~15 mL)です。溶液中に懸濁させた樹脂ビーズを保持するのに十分な速度で磁気攪拌棒を室温で1時間撹拌しました。
- 上清を除去し、樹脂を除去し、それをフィルタリングします。残りの樹脂を洗浄するために、脱イオン水5mLを追加します。上清を除去し、それをフィルタリング、最初のデカンテーションからの生成物溶液と組み合わせます。製品の最大の回収のための樹脂の繰り返しリンス。
- トレハロースアナログ製品へのグルコース類似体出発物質の完全な変換が達成されたかどうかを決定するために薄層クロマトグラフィー(TLC)またはHPLCによって反応を分析します。 TLC分析のためのステップ4.1を参照してくださいし、HPLC分析のために4.2ステップ。
- 乾燥した生成物を得、凍結乾燥または回転蒸発によって水を除去します。未反応のグルコース類似体は、TLCまたはHPLC分析の間に観察されなかった場合には、クロマトグラフィーによる精製は不要です。反応yieを得るために、製品を計量生成物の構造と純度を確認するために、核磁気共鳴(NMR)分光分析(ステップ4.3)、LDと行います。
- 未反応のグルコース類似体は、TLC分析で観察された場合は、サイズ排除カラムを用いてトレハロースアナログから分離します。
- 製造業者の指示に従って、脱イオン水で飽和し、極細P2ポリアクリルアミドビーズサイズ排除媒体を含有する1×100センチメートルのカラムを準備します。
注:サイズ排除カラムを脱イオン水で洗浄した後に再使用することができます。 - 再溶解乾燥した酵素反応生成物を脱イオン水0.5mlに(ステップ3.7から得られました)。手動でサイズ排除カラムまたはカラム流量アダプタを使用して、生成物溶液を適用します。別の0.5 mLの脱イオン水で粗生成物を含まバイアルをすすぎ、およびサイズ排除カラムにロードします。
- 重力流によって脱イオン水で生成物を溶出し、約2mの画分を集めLのボリューム。
- TLC(ステップ4.1)によって画分を分析します。純粋なトレハロースアナログを含む画分をプール。
- 乾燥した生成物を得、凍結乾燥または回転蒸発によって水を除去します。反応収率を得て、NMR分析に進むために製品を計量する(ステップ4.3参照)。
- 製造業者の指示に従って、脱イオン水で飽和し、極細P2ポリアクリルアミドビーズサイズ排除媒体を含有する1×100センチメートルのカラムを準備します。
トレハロースアナログ製品の4.分析
- TRET反応の薄層クロマトグラフィー(TLC)分析を行います。
注:この手順は、サイズ排除カラム分画を分析するために使用することができます。 TLCプレート上で化合物の染色を観察するTLC分析の前に反応混合物を、カラム画分を濃縮する必要があるかもしれません。- マークが鉛筆で、TLCプレートの表面にレーンから収集し、適切なグルコースアナログ標準、トレハロースアナログ標準(利用可能な場合)、反応混合物を含むレーン、(または画分に被検体(複数)と関連する規格(s)を適用しますサイズexclusionカラム精製)、および共スポット。 TLCプレートに各サンプルを適用した後、プレートを乾燥させます。
注:反応分析のために、典型的には、試料の2μLをTLCプレートに適用されます。 - Nブタノール /エタノール/脱イオン水を使用して、TLCプレートの開発(5:3:2)。
- 開発したTLCプレートを乾燥させ、糖含有スポットを可視化することができるまで、(典型的には5分)高設定にホットプレート上で5%エタノール中のH 2 SO 4(砂糖染色)と熱でそれを浸し。
- マークが鉛筆で、TLCプレートの表面にレーンから収集し、適切なグルコースアナログ標準、トレハロースアナログ標準(利用可能な場合)、反応混合物を含むレーン、(または画分に被検体(複数)と関連する規格(s)を適用しますサイズexclusionカラム精製)、および共スポット。 TLCプレートに各サンプルを適用した後、プレートを乾燥させます。
- 炭水化物を分離し、検出することができる任意のHPLCシステムを用いTRET反応混合物のHPLC分析を行います。このプロトコルは、屈折率を用いて、アミノプロピルHPLCカラムおよび検出を使用して、炭水化物の分離を含みます。
- HPLCにプレカラムガードを含むアミノプロピルカラム(4.6×250 mm)を取り付けます。
- 0.4の流速で、脱イオン水中の80%アセトニトリルでアミノプロピルカラムを平衡化ml /分。
- アミノプロピルカラムに反応生成物(または標準)の溶液をロードします。
- 0.4 mL /分の流速および50℃のカラム温度で脱イオン水中80%のアセトニトリルで産物(または標準)を溶出します。典型的には、使用される実行時間は40分です。
注:このような蒸発光散乱検出(ELSD)などの他の方法を使用することができるが、グルコース類似体、出発材料およびトレハロースアナログ生成物の両方が、屈折率により検出することができます。記載された条件を用いて、グルコース類似体は、典型的には15-25分の間で溶出する10〜15分とトレハロース類似体との間で溶出します。
- 精製トレハロースアナログのNMR分析。
- D 2 O(700μL)中の精製トレハロースアナログを溶解し、NMRチューブにソリューションを移します。
- 適切NMR施設のプロトコルに従って1 H及び13 C NMRスペクトルを取得します。
5。マイコバクテリアの検出にTRET、合成トレハロース類似体の応用
- 合成、精製、およびM.スメグマチス (Msmeg)に6-TreAzを管理します。
- 15 mLコニカルチューブに6アジド-6-デオキシグルコピラノース(6-GlcAz、0.020ミリモル、4.1 mg)を、UDP-グルコース(0.040ミリモル、24.4 mg)を、およびMgCl 2(0.020ミリモル、4.1 mg)を追加します。
- 300 / mlの最終酵素濃度1 mLの最終容積を達成する(ステップ1.5.4から得られた)のトリス緩衝液中TRETを加えます。ピペットで上下にそっとまたは固体を溶解し、チューブを反転させ、混合物。
- 15分間振とうしながら70℃で反応をインキュベートします。
- 脱イオン水3mLで酵素反応混合物を希釈し、予め洗浄し遠心分離フィルターユニット(NMWL 10kDaの)に移します。液体のほとんどまで遠心分離機3000×gでフィルタユニットは、チューブにフィルターを通して約10分を渡します。
- 目を破棄遠心式フィルターユニットの電子上室。チューブに混合床イオン交換樹脂(0.75グラム)を加え、25分間室温で振とう/撹拌します。上清を除去し、樹脂を除去し、それをフィルタリングします。
注:手順5.1.1-5.1.5 1時間未満で約5 mMの濃度で6-アジドトレハロース(6-TreAz)の水溶液を提供します。 5 mMの濃度は、生成物への基質の定量的な変換し、これらのステップの間に生成物の最小限の喪失を想定し、精製工程の間に場所を取り、希釈に基づいて推定されます。所望であれば、溶液は、生物学的サンプルに添加する前に滅菌濾過することができます。 - 100〜1,000μLの最終培養容量および〜25μMの最終的な6-TreAz濃度を達成するために一般的に、M。スメグマチス (Msmeg)の対数期培養から6 TreAzの生成物溶液の適切な量を追加します。所望の時間、通常は60分間、37℃で細胞をインキュベートします。
- アジド標識された細胞に蛍光団を結合させるために化学をクリックして実行します。このプロトコルでは、Msmegにおける細胞表面アジドに蛍光団を提供するために銅触媒によるアジド-アルキン環(CuAAC)を使用します。
- 5分間、3,900×gで細胞を遠心分離し、次いで、PBS、0.5%ウシ血清アルブミンを含有する細胞を洗浄します。 2回繰り返します。
- 再懸濁PBS中の4%パラホルムアルデヒド中でペレット化した細胞は、それらを修正します。 10分間インキュベートした後、細胞を洗浄するために、ステップ5.2.1を繰り返します。
- 138μLのPBSでペレット化した細胞を再懸濁します。
- DMSO中のアルキンカルボキシ110(アルキン-488)の1 mMのストック溶液3μLを追加します。
- 脱イオン水にアスコルビン酸ナトリウムの新たに調製した60 mMのストック溶液3μLを追加します。
- のtert-ブタノール /ジメチルスルホキシド中のトリス[(1-ベンジル-1H-1,2,3-トリアゾール-4-イル)メチル]アミン(TBTA)の6.4 mMのストック溶液(DMSO)の3μLを追加し4:1。
- 3&#を追加します。956;脱イオン水中のCuSO 4の50mMの原液のL。
- ピペットで上下に細胞懸濁液を、次いで、30分間室温で暗所でインキュベートします。
- 細胞を洗浄するための手順を繰り返し5.2.1。 150μLのPBSで細胞を再懸濁。
- 細胞蛍光分析を実行します。このプロトコルでは、標識されたMsmegの細胞の蛍光を可視化するために、蛍光顕微鏡を使用しています。
- 顕微鏡スライドにPBSに懸濁した細菌細胞の10μLを加え、軽くカバースリップのエッジを使用して薄層に液体を広げます。暗闇の中で空気乾燥することができます。
- 、乾燥した試料の上に取り付け培地10μLを追加し、サンプルの上にカバースリップを配置し、接着剤( 例えば 、マニキュア)を適用する固定化します。
- 画像100Xの倍率で蛍光顕微鏡を用いてスライド。
結果
T.テナックス TRETは、標準的なタンパク質発現および精製技術を使用して、約4ミリグラム/ Lの収量で大腸菌から得ました。単一ニッケルアフィニティークロマトグラフィー工程は、(代表FPLCのトレースを図4に示されている)、大腸菌溶解物からTRETを精製するのに十分でした。 TRET合成プロセスに私たちの最初の出版物に設立されたよ...
ディスカッション
トレハロース類似体は、食品や医薬品の保全から微生物感染症6の診断と治療のために、さまざまな分野に影響を与える可能性を持っています。既存の多段階の化学合成法( 例えば 、天然に複雑なマイコバクテリア糖を生じる)の変形例の複数の部位を有する複雑なトレハロース類似体を製造するために有用です。しかしながら、これらの方法は、比較的簡単な一置?...
開示事項
The authors have nothing to disclose.
謝辞
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
資料
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
参考文献
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved