需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从健康志愿者和它们的迁徙可能通过血清中的影响心脏手术后的内皮祖细胞的分离
摘要
内皮祖细胞(EPCs)的关键参与缺血组织的新血管形成。这个方法描述了从外周血内皮祖细胞的分离,以及它们对心脏手术患者的血清样品洄游潜在的识别。
摘要
内皮祖细胞(EPCs)从像缺氧的病理条件下骨髓招募并关键参与缺血组织的新血管形成。内皮祖细胞的起源,分类和特征是复杂的;尽管如此,两个突出的子类型内皮祖细胞已经建立:所谓"早"内皮祖细胞(后来被称为早期的EPC)和晚期产物内皮祖细胞(后期的EPC)。它们可以通过生物学性质以及通过体外培养过程中其外观进行分类。而"早"内皮祖细胞在EC-特定媒体外周血单个核细胞培养后出现在不到一周的时间,后期生长内皮祖细胞可以2-3周后才会发现。后期长出的EPCs已经识别到直接参与新血管形成,主要是通过其分化成成熟内皮细胞的能力,而"早"内皮祖细胞表达各种血管生成因子如子叶OU的货物以促进血管生成的旁分泌方式。在心肌缺血/再灌注(I / R),各种因素控制的EPC到血管形成区域归位。
巨噬细胞迁移抑制因子(MIF)是一种趋化因子样促炎和遍在表达的细胞因子和最近描述的在生理浓度1起作用内皮祖细胞迁移的关键调节剂。有趣的是,MIF存储在细胞内池,并且可以迅速地被释放到经过刺激血液流( 如心肌梗塞)。
本协议描述了从成人外周血基于与随后的培养在培养基中的使用纤连蛋白涂层板内皮生长因子对血清样本的体外迁移实验CD34阳性选择早期内皮祖细胞的可靠分离培养方法的心脏手术的患者。此外,该MIF对内皮祖细胞的趋化性迁徙的影响力相比其他知名血管生成的细胞因子刺激论证。
引言
内皮祖细胞(EPCs)的循环中的人血和具有分化成血管内皮细胞2的能力。他们参与血管生成,并能够最小化以各种方式3,4引起的炎症和缺血/再灌注(I / R)损伤的损害。例如,内皮祖细胞内展示抗氧化酶过氧化氢酶一样,谷胱甘肽过氧化物酶,锰超氧化物歧化酶(歧化酶)5水平升高。对氧化应激的升高电阻允许内皮祖细胞在缺血性损伤后6升高的活性氧(ROS)的微环境的作用。以前的研究还表明,内皮祖细胞的数目可能是相关的血管修复和循环内皮祖细胞的数目减少预测心血管事件7的发生,类="外部参照"> 8。然而,EPC一个明确的定义还没有找到呢。到现在为止,对于内皮祖细胞没有特定的细胞表面标记物或一致的表型和这些细胞在外周血9非常罕见的。一个人类的EPC应视为以促进受伤内皮和新血管结构的重建能力的循环细胞。
分离和表征内皮祖细胞的一种方式是通过粘附于纤连蛋白。从而,这些细胞的能力被用来显示优异的粘合性纤连蛋白相比1型胶原蛋白,例如3,10,11涂覆菜肴。然而,其他人发现,镀上纤连蛋白包被的培养皿的单核细胞,没有任何先前的或进一步的纯化步骤导致菌落包括骨髓祖细胞,单核细胞和T淋巴细胞12,13,14。此外,在这种情况下,血小板可能污染的单核细胞(MNC)部分和由此质膜蛋白转移到任何贴壁细胞15。
除了通过在体外粘附试验表征,不同的细胞表面标志物的组合被用于描述视为一个EPC细胞类型。在这种情况下,纤连蛋白介导的粘附之后,将细胞进行分析关于其内皮样的属性。在此过程中,两个内皮细胞相关标记物,乙酰化低密度脂蛋白(acLDL)和血管内皮生长因子受体-2(VEGFR-2,KDR),发挥作用。内皮细胞和巨噬细胞已显示出特别占用acLDL在一个被称为"清道夫细胞途径"16的过程。另一个标志物蛋白是KDR作为对内皮主VEGF受体细胞17。然而,如在一般的EPCs在补充有内皮细胞生长因子和胎牛血清的培养基中培养,有可能是巨噬细胞,这可能也已被错误地分离,表现出内皮状标志物谱。如前所示,如果内皮空调的培养基培养,巨噬细胞表达"特定内皮"的蛋白质18。
在一般情况下,有两类更亚型内内皮祖细胞,其可在血液中找到或在体外进行培养。后期产物内皮祖细胞(后期的EPC)2-3周的文化之后。这些细胞被集成快进人脐静脉内皮细胞单层,并能形成毛细管19。此外,所谓的"早期内皮祖细胞"在血液中循环以更无源的方式约一周并充当通过递送血管生成分子,如血管内皮生长因子(VEGF),或CXCL8 19。患者冠状动脉疾病(CAD)显示显著较低的数额早期内皮祖细胞相比,没有CAD 20对照组。有趣的是,相比于对照组相同的组显示出较高量的后期内皮祖细胞。另有研究表明,早期内皮祖细胞分化保护内皮祖细胞凋亡的氧化条件下,在旁分泌方式6。因此,早期内皮祖细胞可能提供通过其他细胞的一个自动或旁分泌的方式外周血内迁移相关的保护作用。
这个协议描述了通过首先分离人外周血的PBMC级分并随后从PBMC级分中分离的 CD34 +细胞以清除不需要的细胞此细胞悬浮液以纯化早期内皮祖细胞的方法。 CD34是一个标记,其用于人类造血干细胞9的隔离。事后,CD34 +细胞是在纤连蛋白包被的组织培养表面进行培养。三天后,将培养基更换,从而失去所有非贴壁细胞。最后,分离的内皮祖细胞进行染色,以验证acLDL的摄取和KDR存在内皮细胞标记物,通过使用荧光激活细胞分选(FACS)。作为额外的标记,我们分析血小板内皮细胞粘附分子(PECAM-1,CD31),其也发生在内皮细胞上。
通过内皮祖细胞的招募增强受损或梗死心肌组织的恢复属于心血管疾病的深入研究治疗策略。然而,实验结果到临床实践的翻译仍然具有挑战性的,因为在各种病理生理条件在人体内的复杂的细胞相互作用。此外,心肌I / R损伤触发各种细胞因子,激素和生长FAC的过度分泌器,它控制内皮祖细胞的归巢到的血管形成13个区域。如已经示出,CXCL8,基质细胞衍生因子1α(SDF-1α,CXCL12),血管内皮生长因子和巨噬细胞迁移抑制因子(MIF)的显著血清样品中的心肌I / R损伤1增加。在这些因素中,MIF是主要具有促炎性特性的多效性趋化因子样细胞因子。相反,它的历史名称,MIF具有促迁移功能,作为对各种细胞类型1,21,22真正的趋化因子。 MIF介导的细胞募集过程已经链接到趋化因子受体CXCR2和CXCR4,其中MIF结合并以非同源方式21激活。值得注意的是,内皮祖细胞同时表达这些受体在它们的表面,在其上附加地成为上调低氧条件下的屁股="外部参照"> 23,24。此外,越来越多的证据表明,MIF中的心脏22,25,26的I / R损伤期间具有总体心脏保护作用。在这种情况下,它已被进一步表明MIF可能缺氧的压力是特别重要的,考虑到受伤的心肌27的有限恢复机制,当在支持新生血管。在临床前小鼠模型先前的体外研究和实验提供了有关MIF在内皮祖细胞募集4的作用第一个证据。值得注意的是,MIF也是内皮祖细胞的一个显着货物的蛋白质可能内皮祖细胞招募中的缺血部位28内发布。然而,与其他(血管)血清细胞因子比较特别的临床研究的设置仍然无法实现。
Access restricted. Please log in or start a trial to view this content.
研究方案
按照当地伦理委员会知情同意后,从健康的志愿者得到血内皮祖细胞的分离。在迁移实验中使用的血清样本来自行常规心脏手术使用体外循环(CPB)的患者。排除标准是紧急行动,已知或怀疑怀孕,patient`s年龄小于18岁,而未能获得知情同意书。血清样品中除了临床常规测量(立即手术之前和之后立即主动脉阻断的心肌再灌注/开口),随后保存于-80℃直至最终分析绘制。该机构审查委员会(伦理委员会,亚琛工业大学)批准了这项研究。患者表现为68.6岁,平均年龄和平均体重81.7公斤。预现有的疾病包括:高血压(65%),慢性肺疾病(19%),额外的心脏动脉(16%),脑功能障碍(6%),不稳定型心绞痛(3%),最近心肌梗塞(90天的28%),慢性肾病(14%),肝脏疾病(2%)和糖尿病(34%)。
1,T75瓶的涂层:
- 制备5毫升纤连蛋白溶液每T75烧瓶(在15毫升的超纯水稀释1毫克的人纤连蛋白)。
- 该解决方案添加到T75烧瓶,等到水蒸发。以避免在隔离过程中由于蒸发的任何不必要的中断,提前执行该过程( 例如 ,过夜)并在室温下。该解决方案提供了4.44微克纤维连接蛋白/厘米2。
- 通过补充与由制造商提供的生长因子补充剂基底MV2介质制备内皮细胞生长培养基MV2。
2.分离60毫升静脉内皮祖细胞(EPC)的:
注:由于CD34阳性选择鸡尾酒第二磁性珠在组合选择试剂盒可商购的,不存在由制造商提供的浓度。然而,约100微升的抗体的足够用于处理达5×10 8个细胞。磁性珠粒在水中稀释,葡聚糖涂覆至约5000倍较小的相比其他市售珠。欲了解更多信息,请参阅生产厂家的说明书。
- 混血(含或不含抗凝剂)1:1 的 Ca 2+ -Mg 2+的 PBS。
- 加入15mL每50毫升管密度梯度的解决方案。欲了解更多信息,请参阅生产厂家的说明书。
- 慢慢层上的密度梯度溶液的顶部的稀释血液。
- 样品离心在2500 XG与缓慢加速和制动没有30分钟。
- 仔细收集用无菌塑料吸管每个管( 图1)的棕黄色涂层,放入另一个管。避免密度梯度解决方案集合。预期的PBMC收率是大约3-4×10 6细胞/ mL的血液。

图1:菲解决方案Bbuffy大衣的密度梯度离心。示出的是在2,500 xg离心的密度梯度溶液30分钟,密度梯度离心的结果。描绘是红细胞和粒细胞(红色),单核细胞部分(白层),等离子体(黄色),和密度梯度溶液(发白)。 请点击此处查看该图的放大版本。
- 稀释外周血单核细胞级分与至少3倍体积的PBS混合。离心机在室温下以200×g的15分钟。
- 重复步骤2.6的两倍。
- 吸在5mL MV2介质的上清,重悬细胞沉淀。
- 加入100μl人CD34抗体(足够用于处理达5×10 8个细胞)每用于血沉棕黄层并旋转,在37℃,5%CO 2的15分钟。
- 添加50微升的每用于血沉棕黄层葡聚糖包被的磁性小珠,并在37℃,5%CO 2的旋转10分钟。
- 温育后,转移悬浮液到FACS管与每个管最多3毫升。更高的量将不会允许与磁铁。
- 插入的FACS管(多个)到磁体(多个),并等待5分钟。
- 弃上清不拉FACS管出来的磁铁。
- 重悬在每个FACS管用3mL MV2培养基中的细胞的磁体之外。
- 重复步骤2.12-2.14两次。
- 拉FACS管出来的磁铁和悬浮在3mL MV2培养基中的细胞。
- 细胞悬液转移到预涂T75˚Flasks并添加每瓶17毫升MV2网上平台。
注:媒体应在3天后被改变。一周后,细胞显示纺锤状结构( 图2),并准备好使用。对于隔离的俯视见图3。
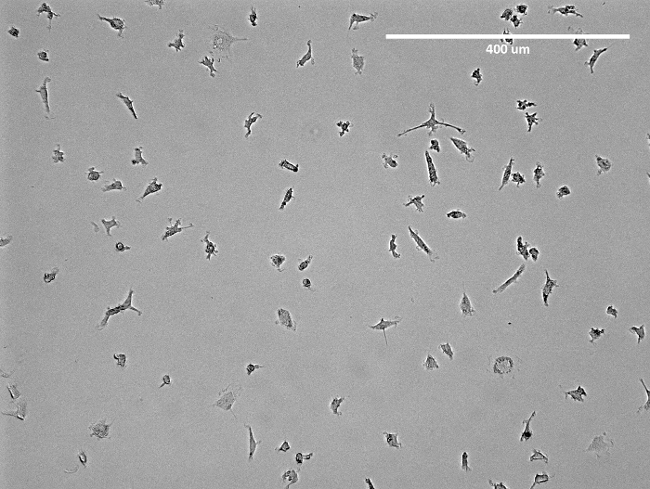
图2:隔离的内皮祖细胞显微图像。示出的是分离的早期内皮祖细胞中之前脱离一个T75烧瓶代表图像。显而易见的是内皮祖细胞的纺锤状结构。 请点击此处查看该图的放大版本。
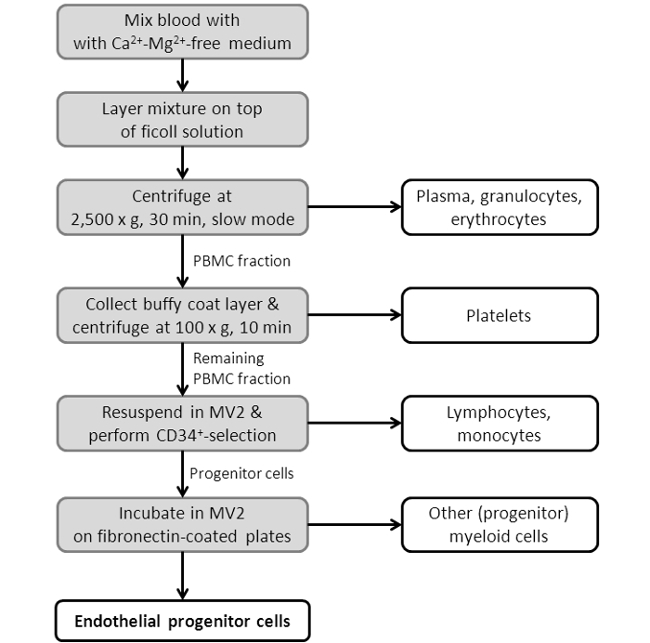
图3:流程图显示了EPC分离过程。描绘的方案,显示ING的EPC隔离协议的单一步骤。对于更详细的协议,看到在协议部分第2节。
3.迁移实验
- 除去从T75烧瓶内皮祖细胞的媒介。
- 通过仔细地摇动用5毫升的PBS洗涤。
- 除去PBS,加入5毫升的商业细胞脱离的解决方案。等待,直至细胞分离(在显微镜下检查)。通过仔细轻敲烧瓶底部加速脱离。
- 当细胞被分离,迅速加入5毫升MV2完全培养基和细胞悬浮液转移到另一个管。
- 离心在2000×g离心5分钟。
- 在2000 xg离心再次重悬在5-10毫升的PBS细胞,离心5分钟。
- 重复步骤3.6。
- 重悬MV2饥饿培养基的细胞沉淀(50,000细胞需要每轮回以及75微升)。
注意:需要哪些迁移系统依赖于细胞类型和测定。有差异 erent孔径和板尺寸(孔数)。对于内皮祖细胞的5微米的96孔系统中的孔径是最佳的。 - 通过将血清样品的235微升准备迁移板(血清稀释1:5的MV2饥饿培养基)到下部腔室( 图4)。
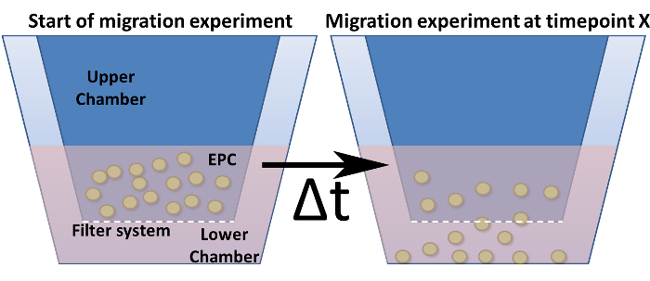
图4:迁移实验在修改后的Boyden小室。示出的是一个改良的Boyden室的一般设计。将细胞培养插入物(=上部腔室)的深蓝色指示和被插入到下腔室。这些刀片的底部(但不是壁)表示过滤器系统,包括的孔隙。 (a)表示在时间点零设置。 (b)在选定的时间点后,将细胞通过朝一个刺激的过滤器迁移。fig4large.jpg"目标="_空白">点击此处查看该图的放大版本。
- 添加插入前不久加入细胞溶液。
- 加入细胞溶液75微升(= 50,000个细胞)到上部室中。
- 让内皮祖细胞迁移在37℃下3小时,5%的CO 2(迁移时间取决于细胞类型和系统)。
- 以避免血清自动荧光伪影,使用半自动化的软件"的ImageJ"通过取的阱图片在显微镜下量化迁移的细胞并计数细胞。
- 拆下上部室(包含所有未迁移细胞)。
- 加入70微升3.6%多聚甲醛溶液,其中包括赫斯特染料(稀释1:1000)。该板可以被存储在37℃和5%的CO 2过夜。
- 离心板不久将得到所有细胞在同一焦平面在2000 XG为1-2分钟。
- 以每W 5图片ELL( 图5和6)用放大100倍。
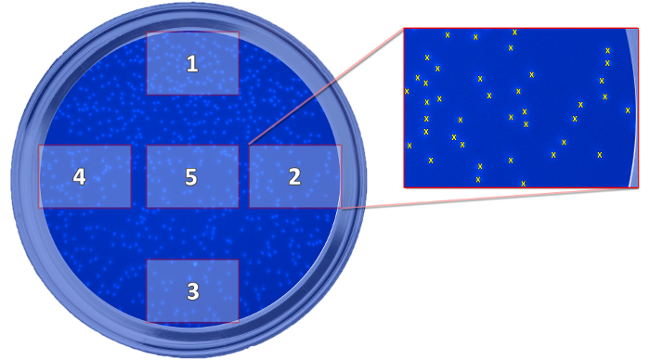
图5:方案显示所拍摄图像的位置。该方案描述了五个拍摄的照片,这是所需要的迁移的细胞的测定,相对于所述井的位置。这些照片被带到细胞计数,计算每一个平均值好。 请点击此处查看该图的放大版本。

图6:细胞定量显微图像。示出的是一个代表图像,将其取为细胞定量。将细胞染色并固定USI吴赫司特染料在3.6%多聚甲醛。这些点代表固定和染色内皮祖细胞。 请点击此处查看该图的放大版本。
- 使用半自动化软件"的ImageJ"的美国国立卫生研究院计数迁移细胞。
Access restricted. Please log in or start a trial to view this content.
结果
隔离内皮祖细胞的表征
首先,acLDL的摄取验证,以及KDR的分离的细胞群的表面上的表达,和CD31。如图7a所示,分离的内皮祖细胞的85.1%,表现出acLDL的摄取和表达CD31。 图7b和7c进一步证明两种标记的均匀分布,虽然似乎有一个较小的种群,负两个标记。在第二步骤中,进行与KDR组合acLDL的FACS?...
Access restricted. Please log in or start a trial to view this content.
讨论
这项研究的第一部分包括从健康志愿者外周血内皮祖细胞的分离,使心脏手术患者的血液进行综合评价。因此,进行密度梯度离心以分离血浆,粒细胞和红细胞PBMC部分。以除去大部分污染的血小板,该细胞级分进行短和慢洗涤步骤29,30。接着,CD34 +细胞是从剩余的成分中分离到的祖细胞从剩余淋巴细胞,和单核细胞中分离出来。最后,将细胞?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者什么都没有透露。
致谢
作者没有确认。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
参考文献
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692(2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502(2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015(2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310(2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206(2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。