Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kalp Damar Cerrahisi sonra serum Örnekleri etkilenerek Sağlıklı Gönüllüler ve Bunların Göçmen Potansiyelden Endotel Ata Hücreleri İzolasyon
Bu Makalede
Özet
Endotelyal Ata Hücreler (EPC'ler) önemlisi, iskemik dokuların neovaskülarizasyonu katılmaktadırlar. Bu yöntem, periferal kandan alınan insan EPC izolasyonunu, hem de kalp cerrahi hastalarında serum örneklerinde karşı göç potansiyelinin belirlenmesi açıklanmaktadır.
Özet
Endotelyal Ata Hücreler (EPC'ler) hipoksi gibi patolojik koşullar altında kemik iliğinden alınırlar ve en önemlisi, iskemik dokuların neovaskülarizasyonu katılmaktadırlar. EPC kökeni, sınıflandırılması ve karakterizasyonu karmaşık; rağmen, EPC iki önemli alt tipleri kurulmuştur: sözde "erken" EPC ve geç akıbet EPC (geç-EPC) (sonradan as-erken EPC anılacaktır). Bu özellikleri sayesinde bu gibi in vitro kültür sırasında görünüşlerine göre sınıflandırılabilir. "Erken" EPC AK özgü medya periferal kandan alınan mononükleer hücrelerin kültürden sonra bir haftadan az görülürken, geç akıbet EPC 2-3 hafta sonra bulunabilir. Geç aşırı büyüme EPC, "erken" EPC endojen gibi çeşitli anjiyojenik faktörler eksprese eder, doğrudan esas olarak olgun endotel hücrelerine dönüştürmek kabiliyetleri sayesinde, neovaskülarizasyon dahil olmak üzere kabul edilmiştirlı kargo parakrin tarzda anjiyojenezi teşvik etmek. miyokardiyal iskemi / reperfüzyon (I / R) sırasında, çeşitli faktörler, kan damarı oluşumunun bölgelere EPC homing kontrol eder.
Makrofaj migrasyon inhibitör faktör (MIF) bir kemokin gibi pro-enflamatuar ve yayg ifade sitokin ve son zamanlarda fizyolojik konsantrasyonlarda 1 de EPC göç gibi önemli düzenleyici işlev tanımlanmıştır. İlginç bir şekilde, MIF hücre havuzları saklanır ve hızlı bir şekilde çok sayıda uyaranlara sonrası kan akımı içine (örneğin, miyokard enfarktüs) serbest bırakılabilir.
Bu protokol, serum örnekleri karşı in vitro göçü tahlillerinde kullanım için fibronektin kaplı plakalar üzerinde endotelyal büyüme faktörlerini ihtiva eden bir ortam içinde daha sonra kültür CD34-pozitif seçime göre yetişkin insan periferal kanından erken EPC güvenilir izolasyonu ve kültürü için bir yöntemi anlatmaktadır kalp cerrahisi hastalarının. Ayrıca,Diğer iyi bilinen bir anjiogenez uyarıcı sitokinler ile karşılaştırıldığında EPC kemotaksis üzerindeki MIF göç etkisi gösterilmiştir.
Giriş
Endotelyal progenitör hücreleri (EPC), insan kanında dolaşan ve endotelyal hücreler, 2 'farklılaşma yetisine sahiptir. Onlar vaskülojenez katılmak ve çeşitli şekillerde 3, 4 inflamasyon ve iskemi / reperfüzyon (İ / R) yaralanmalar yol açtığı hasarı en aza indirmek yeteneğine sahiptirler. Örneğin, EPC katalaz, glutatyon peroksidaz veya manganez süperoksit dismutazlar (MnSOD) 5 gibi hücre içi antioksidan enzimlerin yüksek seviyelerini göstermektedir. Oksidatif strese karşı yüksek direnç EPC iskemik hasar 6 sonra yüksek reaktif oksijen türlerinin (ROS) ile mikroçevrelerde çalışmasını sağlar. Önceki çalışmalarda da, EPC sayısı vasküler onarım ve EPC dolaşan bir azalma sayıda kardiyovasküler olay 7 oluşumunu öngörür ilişkili olabileceğine işaretclass = "xref"> 8. Ancak, bir EPC açık bir tanımı henüz bulunamamıştır. Şimdiye kadar var EPC için özel bir hücre yüzey markörü ya da tutarlı fenotip olup, bu hücreler arasında periferal kan 9'da çok nadirdir. Bir insan EPC yaralı endotel ve yeni vasküler yapıların yeniden inşasına katkıda bulunmak yeteneği ile dolaşan hücre olarak kabul edilmelidir.
izole edilmesi ve EPC karakterize bir yolu, fibronektine yapışma geçer. Böylece, bu hücrelerin kapasitesi Örnek 3, 10, 11, 1 kollajen tip göre kaplı kaplar fibronektine üstün yapışma göstermek için kullanılır. Bununla birlikte, diğer herhangi bir önceki ya da daha fazla saflaştırma aşaması olmadan fibronektin kaplı kaplar üzerinde mononükleer hücreleri kaplama miyeloid progenitör hücreler, monositler ve T lenfositleri 1 de dahil olmak üzere koloniler neden olduğunu buldu2, 13, 14. Ayrıca, bu durumda, trombositler tek çekirdekli hücre (MNC) fraksiyonu kontamine olabilir ve böylece yapışık hücreler 15 plazma zar proteinleri aktarın.
In vitro yapışma tahlilleri ile karakterize Bunun yanı sıra, farklı hücre yüzeyi markerlerinin bir arada EPC olarak kabul hücre türünü tanımlamak için kullanılır. Bu durumda, fibronektin aracılık ettiği yapışma, sonra, hücreler endotel benzeri özelliklerini ilgili analiz edilir. Bu işlem, iki endotelyal hücreye birleşik işaretleri, asetillenmiş düşük yoğunluklu lipoprotein (acLDL) ve vasküler endotelyal büyüme faktörü reseptörü 2 (VEGFR-2, KDR), bir rol oynayabilir. Endotel hücreleri ve makrofajlar özellikle "çöpçü hücre yolu" 16 olarak adlandırılan bir süreçte acLDL almak için gösterilmiştir. Başka bir markör proteinin endotelyal ana VEGF reseptörü olarak KDRHücreler 17. Genel olarak EPC endotelyal büyüme faktörleri ve cenin dana serumu ile takviye edilmiş ortam içinde kültürlenir Ancak, makrofajlar da yanlış, sergi, endotel gibi işaretçi profili izole edilmiştir olabilir mümkündür. Daha önce gösterildiği gibi, endotel klimalı bir ortam içinde kültürlendi, eğer makrofajlar "endotel spesifik" proteinleri 18 ifade eder.
Genel olarak, kanda bulunabilir ya da in vitro kültüre edilmesi daha alt tiplerinin içinde EPC iki kategori vardır. Geç akıbet EPC (geç-EPC) kültür 2-3 hafta sonra ortaya çıkar. Bu hücreler, insan göbek damarı endotelial hücrelerde bir tek tabaka halinde hızlı entegre edilmiştir ve kapiler tüpler 19 oluşturabilir. Bunun yanı sıra, örneğin vasküler endotelyal büyüme sağlayan anjiyojenik moleküller ile pasif bir şekilde yaklaşık bir hafta ile hareket için dolaşıma "erken EPC" olarak adlandırılanfaktörü (VEGF) veya CXCL8 19. Koroner arter hastalığı (KAH) olan hastalar KAH 20 olmadan bir kontrol grubuna göre erken EPC anlamlı derecede düşük miktarlarda gösterdi. İlginç bir şekilde, aynı grup bir kontrol grubu ile karşılaştırıldığında geç EPC yüksek miktarda göstermiştir. Başka bir çalışmada erken EPC parakrin tarzda 6 oksidatif koşullarında apoptozundan farklı EPC korumak olduğunu gösterdi. Bu nedenle erken EPC periferik kandan içinde otomatik veya parakrin şekilde diğer hücrelerin göç yoluyla ilgili koruyucu etki sağlayabilir.
Bu protokol, önce insan periferal kanından elde edilen PBMC fraksiyonu izole edilmesi ve daha sonra istenmeyen hücrelere bu hücre süspansiyonu temizlemek için PBMC-fraksiyondan CD34 + hücreleri izole ederek erken EPC saflaştırmak için bir yöntemi anlatmaktadır. CD34, insan hematopoietik kök hücrelerin 9 izolasyonu için kullanılan bir markeri olan . Daha sonra, CD34 + hücreleri fibronektin kaplı doku kültür yüzeyleri üzerinde kültürlenmiştir. Üç gün sonra, ortam, böylece tüm yapışmayan hücreler kaybederek değiştirilir. Son olarak, izole edilmiş bir EPC acLDL alımını ve floresan aktive hücre sınıflandırma (FACS) kullanılarak endotelyal hücre belirteci olarak KDR varlığını doğrulamak için boyanır. Ek bir işaretleyici olarak, endotel hücreleri üzerinde meydana trombosit endotelyal hücre yapışma molekülü (PECAM-1, CD31), analiz edilmiştir.
EPC gelişmiş işe zarar veya infarkt miyokard dokusunun restorasyonu kardiyovasküler hastalıklarda yoğun olarak araştırılmıştır tedavi stratejileri aittir. Ancak, klinik uygulamaya deney sonuçlarının çeviri çeşitli patofizyolojik koşullar sırasında insan vücudunda kompleks hücresel etkileşimi göz önüne alındığında, hala zordur. Ayrıca, miyokard I / R yaralanmalar çeşitli sitokinler, hormonlar ve büyüme fac aşırı salgılanmasını tetikler kan daman oluşumu 13 bölgelerine EPC homing kontrol ları. Daha önce gösterildiği gibi, CXCL8, stromal hücre türetilmiş faktör 1α (SDF-1α, CXCL12), VEGF ve makrofaj göçü önleme faktörü (MIF) önemli ölçüde miyokardiyal I / R hasarı 1 Aşağıdaki serum örneklerinde artmıştır. Bu faktörler arasında, MIF ağırlıklı olarak pro-enflamatuar özelliklere sahip bir pleiotropik kemokin benzeri bir sitokindir. Tarihsel adı aksine, MIF çeşitli hücre tipleri 1, 21, 22, gerçek bir kemokin olarak hareket Pro-göç fonksiyonları vardır. MIF aracılı hücre işe alım süreçleri MIF bağlanan ve olmayan bir soydaş bir şekilde 21 aktive kemokin reseptörleri CXCR2 ve CXCR4, bağlantılı olmuştur. Dikkat çekici bir şekilde, EPC ek hipoksik koşullar altında yukarı regüle olur kendi yüzeyi üzerinde bu reseptörlerin her ikisi de ekspreseeşek = "xref"> 23, 24. Ayrıca, biriken kanıtlar MIF kalp 22, 25, 26 I / R hasarı sırasında genel bir kardiyo-koruyucu etkiye sahip olduğunu göstermektedir. Bu bağlamda, daha MIF yaralı miyokard 27 sınırlı kurtarmanın göz önüne alındığında, özellikle ilgili olan hipoksik stres sırasında neovaskülarizasyon destekleyebilir gösterilmiştir. Klinik öncesi fare modellerinde Önceki in vitro çalışmalar ve deneyler EPC işe 4 MİF rolü hakkında ilk kanıt sağlamıştır. Not, MIF da iskemik siteleri 28 içinde EPC işe sırasında serbest bırakılabilir EPC önemli bir kargo proteindir. Ancak, diğer (anjiyojenik) serum sitokin ile karşılaştırıldığında, özellikle de klinik ortamlarda yapılan çalışmalar halen mevcuttur.
Protokol
EPC izolasyonu için kan yerel etik kurul uygun aydınlatılmış onam sonra sağlıklı gönüllülerden elde edilmiştir. göç deneylerinde kullanılan serum örnekleri kardiyopulmoner bypass (CPB) kullanımı ile konvansiyonel kalp cerrahisi uygulanan hastalarda elde edildi. Dışlama kriterleri acil işlemleri, bilinen ya da şüphelenilen gebelik vardı, 18 yıldan az yaş ve bilgilendirilmiş onam elde etmek için başarısızlık patient`s. Serum numuneleri rutin klinik ölçümleri (ameliyattan hemen önce ve hemen miyokardiyal reperfüzyon / aort çapraz kelepçenin açılması sonra) ve daha sonra, analiz zamanına kadar -80 ° C'de saklandı ilave olarak çizildi. kurumsal inceleme kurulu (Etik komitesi, RWTH Aachen Üniversitesi) bu çalışmayı onayladı. Hastalar 68,6 yıl ortalama yaşı ve 81.7 kg ortalama ağırlığı gösterdi. Önceden var olan hastalıklar şunlardır: hipertansiyon (% 65), kronik akciğer hastalığı (% 19), ekstra kardiyak arteriopati (% 16), serebral fonksiyon bozukluğu (% 6), stabil olmayan angina (% 3), son miyokard enfarktüsü (90 gün içerisinde% 28), kronik böbrek hastalığı (% 14), karaciğer hastalığı (% 2) ve diyabet (% 34).
T75 Flask 1. Kaplama:
- 5 ml fibronektin çözeltisi T75 şişesi başına (15 mL, aşırı saf su ile seyreltilir, 1 mg insan fibronektin) hazırlayın.
- T75 balona çözüm ekleyin ve su buharlaştırılır kadar bekleyin. Buharlaşma ile yalıtım işlemi sırasında gereksiz kesintileri önlemek için, önceden bu işlemi gerçekleştirmek (örneğin, gece boyunca) ve oda sıcaklığında karıştırılmıştır. Bu çözelti, 4.44 | ig fibronektin / cm 2 verir.
- üretici tarafından sağlanan büyüme faktörü takviyeleri ile bazal MV2 ortamı ilave ile endotel hücre büyüme ortamı mv2 hazırlayın.
60 ml Blood Endotelyal Ata Hücreler (EPC'ler) 2. izolasyonu:
NOT: CD34-pozitif seçim kokteyl a AsND manyetik boncuk üretici tarafından sağlanan herhangi bir yoğun olarak, kombine bir seçim kiti ticari olarak temin edilebilir. Bununla birlikte, antikorun yaklaşık 100 uL, 5 x 10 8 hücrelere kadar işlem için yeterlidir. Manyetik boncuklar su içinde seyreltilir, dekstran-kaplı ve yaklaşık 5,000X küçük olan diğer ticari olarak temin edilebilen boncuklar ile karşılaştırıldığında. Daha fazla bilgi için, imalatçının talimatlarına bakınız.
- Ca 2 + -MG 2 + içermeyen PBS ile 1: (veya antikoagülan olmadan) kan 1 karıştırın.
- 50 ml tüp başına yoğunluk gradyan çözeltisi 15 mL ekleyin. Daha fazla bilgi için, imalatçının talimatlarına bakınız.
- Yavaş yavaş yoğunluk gradyan çözeltisi üzerine seyreltilmiş kan tabaka.
- Santrifüj örnekleri yavaş ivme ile ve fren yapmadan 30 dakika boyunca 2.500 xg'de.
- Dikkatlice steril plastik pipet kullanarak her tüp (Şekil 1) buffy coat tabakası toplamak ve başka tüpe koydu.yoğunluk gradyan çözümün toplamaktan kaçının. Beklenen PBMC verimi yaklaşık 3-4 x 10 6 hücre / ml kan.

Şekil 1: Ficoll Çözüm Bbuffy Coat Yoğunluk Gradient Santrifüj. yoğunluk gradyan çözeltisi ile 30 dakika boyunca 2500 x g'de yoğunluk gradyanlı santrifüj sonucu gösterilmiştir. eritrosit ve granülositler (kırmızı), mononükleer hücre fraksiyonu (beyaz tabaka), plazma (sarı) ve yoğunluk gradyan çözeltisi (beyazımsı) vardır tasvir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- PBS en az 3 hacim periferal kan tek çekirdekli hücre fraksiyonu seyreltin ve karıştırın. 200 x g'de 15 dakika boyunca oda sıcaklığında santrifüje.
- iki adımı tekrarlayın 2.6.
- 5 ml MV2 ortam içinde yüzer ve tekrar süspansiyon hücre pelletini aspire.
- Kullanılan ince beyaz kat başına (5 x 10 8 hücrelere kadar işlemden geçmesi için yeterli) insan CD34 antikoru, 100 uL ilave edin ve% 5 CO2 ile 37 ° C 'de 15 dakika boyunca döner.
- Kullanılan ince beyaz kat başına dekstran-kaplı manyetik boncuklar 50 ul ekleyin ve% 5 CO2 ile 37 ° C 'de 10 dakika süre ile döner.
- İnkübasyondan sonra, her bir tüp içinde 3 ml maksimum FACS tüpler süspansiyon aktarın. Yüksek miktarlar mıknatıslı izin olmayacaktır.
- Mıknatıs (lar) FACS tüpü (ler) ini ve 5 dakika bekleyin.
- mıknatıs üzerinden FACS tüpleri çekmeden süpernatant atın.
- mıknatısın dış 3 mL MV2 ortamı her FACS tüpü içinde tekrar süspansiyon hücreleri.
- Tekrarlayın kez 2.12-2.14 adımları.
- mıknatıslar dışında FACS tüpleri çekin ve 3 mL MV2 orta hücreleri tekrar süspansiyon.
- Önceden kaplanmış T75 f içine hücre süspansiyonu aktarınlasks ve şişe başına 17 mL MV2 orta ekleyin.
NOT: orta 3 gün sonra değiştirilmelidir. Bir hafta sonra, hücreler iğ benzeri yapılar (Şekil 2) göstermek ve kullanıma hazırdır. Izolasyon bir overlook için, bakınız Şekil 3.
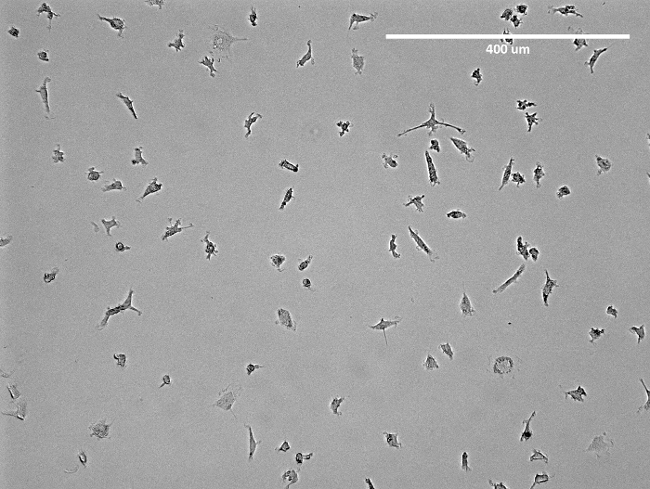
Şekil 2: İzole EPC mikroskobik görüntü. dekolmanı önce T75 şişesi içinde izole erken EPC bir temsili görüntüsüdür. Görünen EPC iğ gibi bir yapıdır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
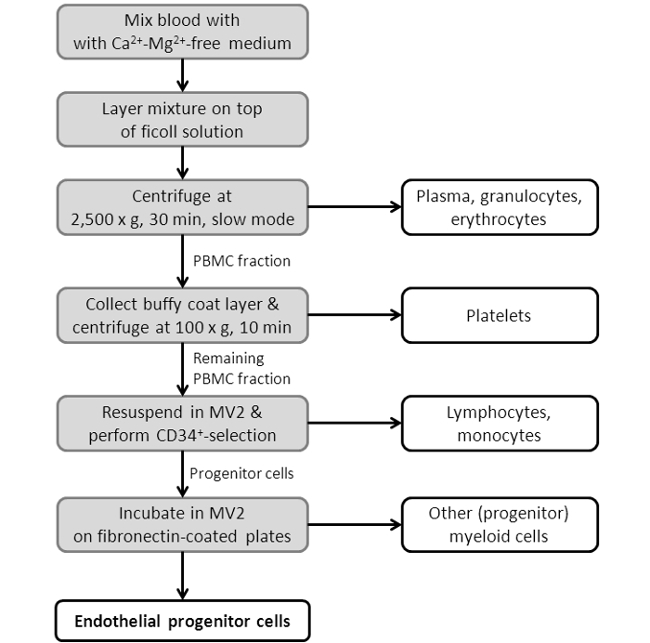
Şekil 3: Akış Şeması EPC İzolasyon Prosedürü gösteriliyor. Tasvir bir program, showEPC izolasyon protokolü tek adımları ing. Daha ayrıntılı bir protokol için protokol bölümündeki Bölüm 2'ye bakınız.
3. Yer değiştirme tahlili
- T75 şişesi içinde EPC orta çıkarın.
- dikkatli bir şekilde sallayarak 5 ml PBS ile yıkayın.
- PBS çıkarın ve 5 ml ticari hücre dekolmanı çözüm ekleyin. Hücreler müstakil kadar (mikroskop altında kontrol edin) bekleyin. dikkatlice şişenin dibine vurarak dekolmanı hızlandırın.
- Hücreler müstakil zaman, hızlı bir şekilde MV2 tam orta 5 ml ilave edilir ve bir tüp içine hücre süspansiyonu aktarın.
- 5 dakika boyunca 2,000 x g'de santrifüjleyin.
- 5 dakika boyunca 2,000 x g hızında tekrar 5-10 ml PBS içinde hücreleri ve santrifüj yeniden süspanse edin.
- Adımı tekrarlayın 3.6.
- MV2 hasret ortamda hücre pelet (hicret kuyu başına 75 uL ihtiyaç vardır 50.000 hücreleri) süspanse edin.
NOT: Gerekli olan göç sistemi hücre tipine ve tahlil bağlıdır. fark var erent gözenek çapları ve plaka boyutları (kuyuların sayısı). EPC 96 de sisteminde 5 um'lik bir gözenek büyüklüğü en uygunudur. - Alt bölme (Şekil 4) içine serum örneğinin 235 uL ekleyerek göç tabak hazırlayın (mv2 hasret orta 5 serum 1 seyreltilmiş).
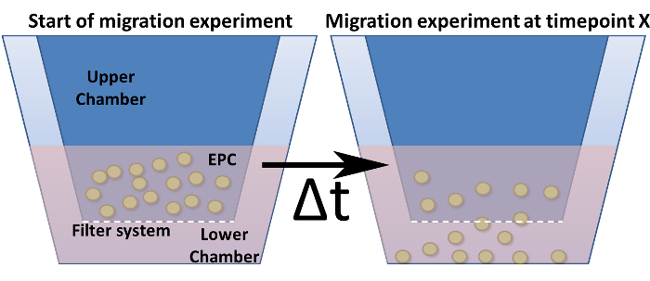
Şekil 4: Modifiye Boyden Odası Göç Testi. modifiye edilmiş Boyden odasının genel tasarım gösterilmektedir. Hücre kültür ekleri (= üst bölme), koyu mavi olarak ve alt bölme içine yerleştirilir. Bu ekler alt (ama duvarlar) gözenekler dahil filtre sistemini temsil etmektedir. (A) bir zaman noktasında sıfır kurulum gösterir. (B) seçilen zaman noktadan sonra, hücreler bir uyarıcı doğru filtre üzerinden geçirilir.fig4large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
- kısa bir süre önce, hücre çözeltisi eklenerek ekleme ekleyin.
- Üst bölme içine hücre çözeltisinin 75 uL (= 50.000 hücre) ekleyin.
- EPC 2 (göç zamanı hücre tipine ve sistemine bağlıdır) 37 ° C'de 3 saat ve% 5 CO için göç edelim.
- Serum otomatik floresan eserler önlemek için, yarı-otomatik yazılım "ImageJ" kullanarak hücrelerin mikroskop altında iyi fotoğraf çekimi ile göç hücreleri ölçmek ve saymak.
- Üst bölme (bütün olan, taşınmayan hücreler ihtiva eder) çıkarın.
- (: 1,000 1 seyreltilmiş) Hoechst boyası dahil, 70 uL% 3.6 paraformaldehid çözüm ekleyin. Plaka 37 ° C ve% 5 CO2 gece boyunca saklanabilir.
- 1-2 dakika boyunca 2.000 xg'de aynı odak düzlemi içine tüm hücreleri elde etmek için kısa bir süre plaka santrifüj.
- w başına 5 fotoğraf çekmekell (Şekil 5 ve 6), bir 100x büyütme.
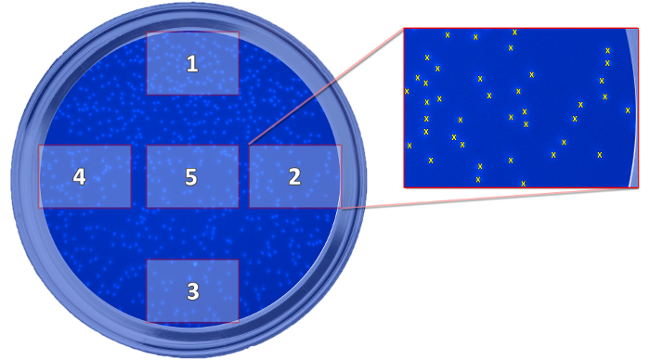
Şekil 5: Alınan Resimlerin Konumunu gösteriliyor Programı. Şema oyuk ile ilgili olarak, geçirilmiş hücrelerin saptanması için ihtiyaç duyulan beş alınan resim, konumunu göstermektedir. Resimler hücrelerin sayısı ve de her bir ortalama değeri hesaplamak için alınır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 6: Hücre Niceleme için mikroskobik görüntü. Hücre ölçümü için alınan bir temsili görüntü, olduğunu göstermiştir. Hücreler, lekeli ve USI sabitlendi% 3.6 paraformaldehid içinde ng Hoechst boyası. noktalar sabit ve endotelyal progenitör hücre lekeli temsil eder. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Ulusal Sağlık Enstitüsü tarafından yarı otomatik yazılımlar "ImageJ" seçeneğini kullanarak, göç hücreleri saymak.
Sonuçlar
İzole Endotel Ata Hücreleri Karakterizasyonu
İlk olarak, acLDL alımı doğrulanmıştır, hem de izole edilmiş hücre popülasyonunun yüzeyinde KDR sentezlenmesi ve CD31. Şekil 7a görüldüğü gibi, izole EPC% 85.1 acLDL bir alımını gösterdi ve CD31 dile getirdi. Her iki belirteçleri negatif küçük bir nüfus, var gibi görünüyor olsa da Şekiller 7b ve 7c ayrı...
Tartışmalar
Bu çalışmanın ilk bölümü kalp cerrahisi hastalarının kan kapsamlı bir değerlendirmesini sağlamak için sağlıklı gönüllülerin periferik kandan insan EPC izolasyonunu dahil. Bu nedenle, bir yoğunluk gradyan santrifüj plazma granülosit ve eritrositlerden PBMC fraksiyonu ayırmak için yapılmıştır. Kirletici trombosit en çıkarmak için, hücre fraksiyonu, kısa tabi tutuldu ve yavaş yıkama, 30 29 adım. Daha sonra, CD34 + hüc...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Yazarlar hiçbir onayları var.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Referanslar
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır