Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение эндотелиальных клеток-предшественников от здоровых добровольцев и их миграционном потенциал Под влиянием Образцы сыворотки после кардиохирургии
В этой статье
Резюме
Эндотелиальные клетки-предшественники (ЕРС) имеют решающее участие в неоваскуляризации ишемических тканей. Этот метод описывает выделение человека ЕРС из периферической крови, а также выявление их миграционного потенциала в отношении образцов сыворотки хирургических больных сердечными.
Аннотация
Эндотелиальные клетки-предшественники (ЕРС) набираются из костного мозга при патологических состояниях, как гипоксии и в решающей степени участвуют в неоваскуляризации ишемических тканей. Происхождение, классификация и характеристика ЕРС являются сложными; Несмотря на это, два известных подтипов ЕРС были созданы: так называемые "ранние" ЕРС (впоследствии называют раннего EPCs) и поздним вырост ЕРС (позднего EPCs). Они могут быть классифицированы по биологическим свойствам, а также по их внешнему виду в процессе культивирования в лабораторных условиях . В то время как "ранние" ЕРС появляются в менее чем через неделю после того, как культуры периферических мононуклеарных клеток крови, полученных в ЕС конкретных средств массовой информации, в конце-отросток ЕРС можно найти через 2-3 недели. Поздний вырост ЕРС были признаны непосредственно участвовать в неоваскуляризации, в основном за счет их способности дифференцироваться в зрелые эндотелиальные клетки, в то время как "ранние" ЕРС выражают различные ангиогенные факторы, как эндогенныхOUs грузов для содействия ангиогенеза в паракринной образом. Во время ишемии миокарда / реперфузии (I / R), различные факторы управления хоминг ЕРС в регионах формирования кровеносных сосудов.
Макрофагами фактор ингибирования миграции (MIF) представляет собой хемокин подобный провоспалительных и повсеместно экспрессируется цитокин и недавно был описан функционировать в качестве ключевого регулятора миграции ЕРС при физиологических концентрациях 1. Интересно отметить , что MIF хранится в внутриклеточных пулов и может быстро высвобождаться в кровоток после нескольких раздражителей (например , инфаркт миокарда).
Этот протокол описан способ надежной изоляции и культуры раннего ЕРС от взрослых периферической крови человека на основе CD34-позитивной селекции с последующей культуры в среде , содержащей эндотелиальные факторы роста на покрытой фибронектином пластин для использования в ин витро миграции анализов против образцов сыворотки хирургических больных сердечными. Кроме того,мигрирующий влияние MIF на хемотаксис ЕРС по сравнению с другими известными ангиогенеза-стимулирующего цитокинов продемонстрирована.
Введение
Эндотелиальные клетки - предшественники (ЕРС) циркулируют в крови человека и обладают способностью дифференцироваться в эндотелиальные клетки 2. Они участвуют в васкулогенезе и способны минимизировать повреждения , вызванные воспалением и ишемии / реперфузии (I / R) травм различными способами 3, 4. Например, ЕРС показывают повышенные уровни внутриклеточных антиоксидантных ферментов , таких как каталазы, глутатионпероксидазы или марганца супероксиддисмутаза (MnSOD) 5. Повышенная устойчивость к окислительному стрессу позволяет ЕРС функционировать в микросреды с повышенными активных форм кислорода (ROS) после ишемического повреждения 6. Предыдущие исследования также показали , что количество ЕРС может быть соотнесена с сосудистой ремонта и что снижается количество циркулирующих ЕРС предсказывает возникновение сердечно - сосудистых событий 7,класс = "Xref"> 8. Однако четкое определение EPC еще не найден. До сих пор нет никакой конкретной клеточной поверхности маркер или последовательным фенотип для ЕРС и эти клетки очень редки в периферической крови 9. У человека EPC следует рассматривать как циркулирующей клетки с возможностью способствовать восстановлению поврежденного эндотелия и новых сосудистых структур.
Один из способов выделения и характеризующий ЕРС через адгезию к фибронектина. Таким образом, пропускная способность этих клеток используется , чтобы показать превосходную адгезию с фибронектином посуду с покрытием по сравнению с 1 типа коллагена, например , 3, 10, 11. Тем не менее, другие обнаружили , что покрытие мононуклеаров на покрытой фибронектином блюда без предварительной или последующей стадии очистки приводит к колонии в том числе миелоидных клеток - предшественников, моноцитов и Т - лимфоцитов 12, 13, 14. К тому же , в этом случае, тромбоциты могут контаминировать мононуклеарных клеток (МНК) фракции и , таким образом , передача белков плазматической мембраны в каких - либо прилипшие клетки 15.
Помимо определения характеристик с помощью анализов адгезии в пробирке, сочетание различных маркеров клеточной поверхности используется для описания типа клеток рассматривается как EPC. В этом случае, после того, как фибронектин-опосредованной адгезии, клетки проанализированных в отношении их эндотелий как атрибуты. В этом процессе две эндотелиальных клеток-ассоциированных маркеров, липопротеин ацетилированный-низкой плотности (AcLDL) и сосудистый эндотелиальный фактор роста рецептора 2 (VEGFR-2, KDR), играют определенную роль. Эндотелиальные клетки и макрофаги было показано, в частности , занимают AcLDL в процессе , называемом "поглотитель клеток путь" 16. Другой маркер белок KDR в качестве основного рецептора VEGF на эндотелиальные17 клетки. Тем не менее, в качестве ЕРС в целом, культивируют в среде с эндотелиальными факторами роста и фетальной сыворотки теленка, то возможно, что макрофаги, которые, возможно, также были ошибочно изолированы, проявляют профиль маркера эндотелиальной типа. Как было показано ранее, если культивировали в эндотелиальной-кондиционированной среды, макрофаги экспресс "эндотелиальные специфические белки" 18.
В общем, есть две категории ЕРС в рамках более подтипов, которые могут быть найдены в крови или быть выращены в лабораторных условиях . Поздние-вырост ЕРС (позднего ЕРС) появляются через 2-3 недели культуры. Эти клетки интегрируются быстрее в монослой эндотелиальных клеток пупочной вены человека и могут образовывать капиллярные трубки 19. К тому же, так называемый "ранний-ЕРС" циркулируют в крови в течение приблизительно одной недели и действовать более пассивным способом посредством доставляющих ангиогенных молекул, таких, как сосудистый эндотелиальный ростфактор (VEGF), или CXCL8 19. У пациентов с ишемической болезнью сердца (ИБС) показали значительно меньшее количество раннего ЕРС по сравнению с контрольной группой без CAD 20. Интересно отметить, что та же группа исследователей показала более высокие количества позднемагматического ЕРС по сравнению с контрольной группой. Другое исследование показало , что раннее-ЕРС защитить дифференцированные ЕРС от апоптоза в окислительных условиях в паракринной образом 6. Таким образом, ранние ЕРС могли бы обеспечить соответствующие защитные эффекты через миграцию других клеток в авто- или паракринной образом в периферической крови.
Этот протокол описывает метод для очистки раннего ЕРС сначала выделением РВМС фракции из периферической крови человека , а затем выделения клеток CD34 + из РВМС фракции , чтобы очистить эту суспензию клеток от нежелательных клеток. CD34 представляет собой маркер, который используется для выделения человеческих гемопоэтических стволовых клеток 9 . Затем, CD34 + клетки культивировали на покрытой фибронектином поверхностей для культивирования тканей. Через три дня, среда изменяется, тем самым теряя все, не прилипшие клетки. И, наконец, изолированные ЕРС окрашивают, чтобы проверить поглощение AcLDL и присутствие KDR как эндотелиальные клетки-маркера с помощью флуоресцентной-Активированный сортировки клеток (FACS). В качестве дополнительного маркера, мы проанализировали тромбоцитов эндотелиальной молекулы клеточной адгезии (РЕСАМ-1, CD31), который также имеет место на эндотелиальных клетках.
Восстановление поврежденных или инфарктом миокарда ткани повышенной вербовке ЕРС относится к интенсивно изучаемых стратегий лечения в сердечно-сосудистых заболеваний. Тем не менее, перевод экспериментальных результатов в клиническую практику до сих пор сложной задачей, учитывая сложный клеточный взаимодействие в организме человека в процессе различных патофизиологических условиях. Кроме того, инфаркт I / травмы R вызывают чрезмерную секрецию различных цитокинов, гормонов и FAC роста торы, которые контролируют хоминг ЕРС в районы формирования кровеносных сосудов 13. Как уже было показано, CXCL8, стромальных клеток , полученных фактор 1α (SDF-1α, CXCL12), VEGF и фактор , ингибирующий миграцию макрофагов (MIF) значительно увеличены в образцах сыворотки после инфаркта I / R травмы 1. Среди этих факторов, MIF является плейотропных хемокин-цитокина с преимущественно провоспалительных характеристиками. В отличие от своего исторического названия, MIF имеет про-миграционные функции, действуя как истинный хемокина на различных типах клеток 1, 21, 22. MIF-опосредованные процессы подбора кадров клеток были связаны с рецепторов хемокинов CXCR2 и CXCR4, который MIF связывается и активирует в не родственным образом 21. Следует отметить, что ЕРС выражают оба этих рецепторов на их поверхности, что дополнительно становятся повышающей регуляции в условиях гипоксиипопка = "Xref"> 23, 24. Кроме того, накапливая данные свидетельствуют о том, что MIF имеет общую кардио-защитный эффект в течение I / R повреждения сердца 22, 25, 26. В этом контексте было далее показано , что MIF может поддерживать неоваскуляризации во время гипоксического стресса , что имеет особое значение при рассмотрении вопроса ограниченные механизмы восстановления травмированной миокарда 27. Предыдущие исследования в пробирке и эксперименты в доклинических моделях мышей при условии , первые свидетельства о роли MIF в ЕРС наборе 4. Следует отметить, что MIF также является видным грузовой белок ЕРС , которые могут быть освобождены в ходе ЕРС набора в пределах ишемических участков 28. Тем не менее, исследования в клинических условиях, в частности, по сравнению с другими (ангиогенеза) в сыворотке крови цитокинов остаются неуловимыми.
протокол
Кровь для выделения ЕРС был получен от здоровых добровольцев после информированного согласия в соответствии с местным комитетом по этике. Образцы сыворотки, используемые в анализах миграции были получены от пациентов, которые перенесли обычную кардиохирургии с использованием искусственного кровообращения (CPB). Критерии исключения чрезвычайных операций, известных или подозреваемых беременности, patient`s возраст менее 18 лет, а также невозможность получения информированного согласия. Образцы сыворотки были разработаны в дополнение к клинической практике измерений (непосредственно перед операцией и сразу после реперфузии миокарда / открытия аортального поперечного зажима), а затем хранили при -80 ° С до окончательного анализа. Институциональный наблюдательный совет (Комитет по этике, Университет Аахена) одобрил данное исследование. Пациенты показали, средний возраст 68,6 лет, и средний вес 81,7 кг. Предварительно существующие заболевания относятся: артериальная гипертензия (65%), хронические заболевания легких (19%), дополнительные сердца артериопатия (16%), церебральной дисфункции (6%), нестабильная стенокардия (3%), недавно перенесенный инфаркт миокарда (28% в течение 90 D), хронические заболевания почек (14%), заболевания печени (2%) и сахарный диабет (34%).
1. Покрытие T75 Настой:
- Приготовьте 5 мл раствора фибронектина (1 мг человеческого фибронектина, разбавленного в 15 мл сверхчистой воды) в расчете на колбу Т75.
- Добавьте раствор в колбу Т75 и подождать, пока вода не испарится. Для того, чтобы избежать каких - либо ненужных перерывов во время процесса выделения из - за испарения, выполнить этот процесс заранее (например , на ночь) и при комнатной температуре. Это решение дает 4,44 мкг фибронектина / см 2.
- Приготовьте эндотелиальной роста клеток среды MV2 путем дополнения базальную MV2 среду с добавками фактора роста, предоставляемых производителем.
2. Выделение эндотелиальных клеток-предшественников (ЭПК) в диапазоне от 60 мл крови:
Примечание: В качестве CD34-позитивной селекции коктейлюе магнитные шарики коммерчески доступны в комбинированном наборе выбора, нет концентрации, предоставленные изготовителем. Тем не менее, около 100 мкл антител достаточно для обработки до 5 х 10 8 клеток. Магнитные шарики, разведенные в воде, покрытой декстраном и около 5,000x меньше по сравнению с другими коммерчески доступными бусинок. Для получения дополнительной информации см указания производителя.
- Смешайте кровь (с или без антикоагулянтов) 1: 1 с Ca 2+ -Mg 2+ -Free PBS.
- Добавить 15 мл плотности раствора градиента на 50 мл пробирку. Для получения дополнительной информации см указания производителя.
- Медленно слой разбавленного кровь на верхней части раствора в градиенте плотности.
- Центрифуга образцов при 2500 мкг в течение 30 мин с медленным ускорением и без торможения.
- Осторожно собрать охристые пальто слой каждой трубы (рисунок 1) с использованием стерильной пластиковой пипетки и поместить его в другую пробирку.Избегайте сбора раствора в градиенте плотности. Ожидаемый выход РВМС составляет примерно 3-4 × 10 6 клеток / мл крови.

Рисунок 1: Плотность Градиент Центрифугирование Bbuffy Coat на Ficoll Solution. Показанный результат градиента плотности центрифугирования при 2500 х г в течение 30 мин на растворе с градиентом плотности. Изображенный являются Эритроциты и гранулоциты (красный), фракцию мононуклеарных клеток (белый слой), плазму (желтый) и раствор градиента плотности (беловатый). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Развести фракции мононуклеарных клеток периферической крови, по меньшей мере, 3 объемами PBS и перемешать. Центрифуга при комнатной температуре в течение 15 мин при 200 х г.
- Повторите шаг 2,6 раза.
- Аспирируйте осадок клеток супернатант и ресуспендируют в 5 мл среды MV2.
- Добавьте 100 мкл антитела CD34 человека ( в достаточном для обработки до 5 х 10 8 клеток) в используемой лейкоцитарной пленки и вращаться в течение 15 мин при температуре 37 ° С с 5% CO 2.
- Добавить 50 мкл покрытого декстраном магнитных шариков на используемый лейкоцитарной пленки и вращаться в течение 10 мин при температуре 37 ° С с 5% CO 2.
- После инкубации перенести суспензию до FACS труб с максимум 3 мл в каждую пробирку. Более высокие количества не будут допустимы с магнитом.
- Вставьте FACS трубку (ы) в магнит (ы) и ждать в течение 5 мин.
- Удалите супернатант без потянув трубки FACS из магнита.
- Ресуспендируют клеток в каждой пробирке FACS с 3 мл MV2 среды за пределами магнита.
- Повторите шаги 2.12-2.14 дважды.
- Протяните трубы FACS из магнитов и ресуспендирования клеток в 3 мл MV2 среды.
- Передача клеточной суспензии в предварительно покрытых T75 Flasks и добавляют 17 мл MV2 среды в колбу.
Примечание: Среда должна быть изменена после того, как 3-х дней. Через одну неделю клетки показывают шпиндель-подобные структуры (рисунок 2) и готовы к использованию. Для смотровой вычленения смотри рисунок 3.
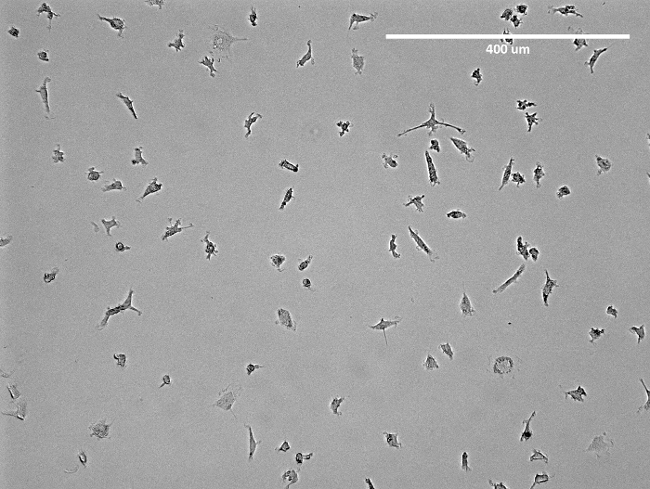
Рисунок 2: микроскопическое изображение изолированных ЕРС. Показан представитель изображение изолированных раннего ЕРС в T75 колбу предварительного отслоения. Видимое является шпиндель, как структура ЕРС. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
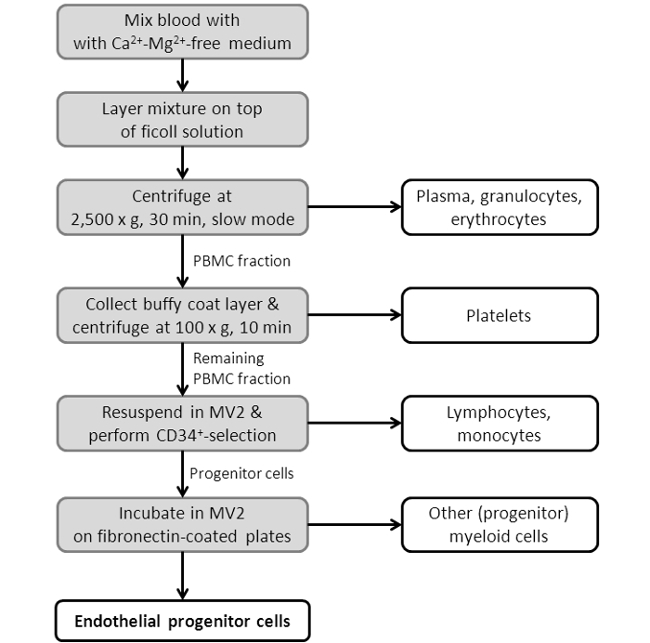
Рисунок 3: Отображение Flowchart Процедура EPC изоляции. Изображенные представляет собой схему, шоуИнг Отдельные стадии протокола изоляции EPC. Для более детального протокола смотрите Раздел 2 в разделе протокола.
3. Анализ миграции
- Извлеките носитель из ЕРС в T75 колбу.
- Мытье с 5 мл PBS, осторожно встряхивая.
- Удалить PBS и добавьте 5 мл раствора коммерческого открепления клеток. Подождите, пока клетки отделяются (проверить под микроскопом). Ускорение отряд осторожно нажав на нижнюю часть колбы.
- Когда клетки отделяют, быстро добавляют 5 мл полной среды MV2 и передачи клеточной суспензии в другую пробирку.
- Центрифуга при 2000 х г в течение 5 мин.
- Ресуспендируют клеток в 5-10 мл PBS и центрифуга снова при 2000 мкг в течение 5 мин.
- Повторите шаг 3.6.
- Ресуспендируют осадок клеток в MV2 голодали среде (50000 клеток в 75 мкл на лунку переселения необходимы).
Примечание: Какая система миграции необходима, зависит от типа клеток и анализа. Есть Diff диаметры пор и различны размеры пластин (количество скважин). Для ЕРС размер пор 5 мкм в 96-луночный система оптимальна. - Подготовьте миграционную пластину путем добавления 235 мкл образца сыворотки (сыворотку разводили 1: 5 в MV2 голодали среды) в нижнюю камеру (рисунок 4).
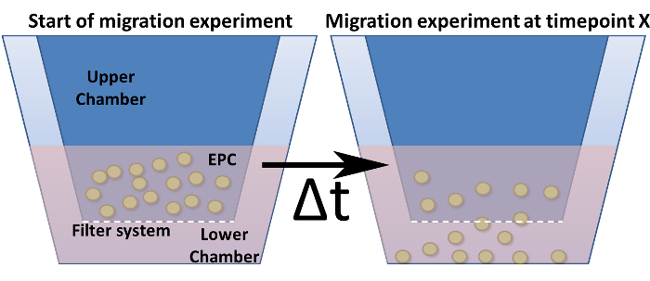
Рисунок 4: Анализ миграции в модифицированном Бойденом палате. Показана общая конструкция модифицированного Бойденом камеры. Вставки для культивирования клеток (= верхняя палата) обозначены темно-синим цветом и вставляются в нижнюю камеру. Дно (но не стены) из этих вставок представляет собой систему фильтрации, включая поры. (А) показана установка в нулевой момент времени. (Б) После того, как выбранный момент времени, клетки мигрируют через фильтр в направлении стимула.fig4large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
- Добавить вставку незадолго перед добавлением раствора клеток.
- Добавьте 75 мкл раствора клеточного (= 50000 клеток) в верхнюю часть камеры.
- Пусть ЕРС мигрируют в течение 3 ч при температуре 37 ° С и 5% CO (зависит от типа клеток и системы время миграции) 2.
- Чтобы избежать сыворотки автофлуоресценции артефактов, количественно мигрировавших клеток путем фотографирования скважины под микроскопом и подсчет клеток с использованием полуавтоматического программного обеспечения "ImageJ".
- Снимите верхнюю камеру (содержащую все неперемещенных клетки).
- Добавить 70 мкл 3,6% раствора параформальдегида, в том числе красителя Hoechst (разбавленное 1: 1000). Пластину можно хранить при температуре 37 ° С и 5% CO 2 в течение ночи.
- Центрифуга пластину вскоре, чтобы получить все клетки в той же фокальной плоскости при 2000 мкг в течение 1-2 мин.
- Возьмите 5 кадров в жELL (рисунки 5 и 6) с 100 - кратном увеличении.
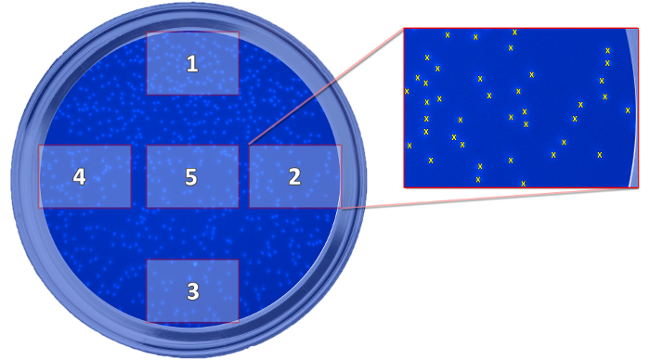
Рисунок 5: Схема Отображение Положение после съемки. Схема изображает положение пяти выполненных снимков, которые необходимы для определения мигрировавших клеток, по отношению к колодцу. Сфотографированы для подсчета клеток и вычислить среднее значение для каждой скважины. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6: Микроскопическое изображение для сотовых Количественное. Показанный является представителем образ, который был взят для клеток количественной оценки. Клетки окрашивали и фиксировали USIнг Hoechst красителя в 3,6% параформальдегида. Точки представляют фиксировали и окрашивали эндотелиальные клетки-предшественники. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Граф мигрировавших клеток с помощью полуавтоматического программного обеспечения "ImageJ" Национальным институтом здравоохранения.
Результаты
Характеристика изолированных эндотелиальных клеток-предшественников
Во-первых, поглощение AcLDL верифицирован, а также выражение KDR, и CD31 на поверхности популяции клеток изолированной. Как показано на фиг.7А, 85,1% из выде...
Обсуждение
Первая часть этого исследования включали в себя изоляцию человека ЕРС из периферической крови здоровых добровольцев, чтобы дать всестороннюю оценку крови больных кардиохирургии. Таким образом, градиент плотности проводили центрифугирование для отделения фракции РВМС из плазмы, гра?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы не имеют никаких подтверждений.
Материалы
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Ссылки
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены