Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von endothelialen Vorläuferzellen von gesunden Freiwilligen und ihre Migratory Potential Beeinflusst von Serumproben nach einer Herzoperation
In diesem Artikel
Zusammenfassung
Endothelialen Vorläuferzellen (EPCs) sind entscheidend in der Neovaskularisation von ischämischen Geweben beteiligt. Dieses Verfahren beschreibt die Isolierung von menschlichem EPCs aus peripherem Blut sowie die Identifizierung ihres Migrationspotential gegen Serumproben von Herzchirurgiepatienten.
Zusammenfassung
Endothelialen Vorläuferzellen (EPCs) aus dem Knochenmark unter pathologischen Bedingungen wie Hypoxie rekrutiert und sind in der Neovaskularisation von ischämischem Gewebe entscheidend beteiligt. Die Herkunft, Klassifizierung und Charakterisierung von EPCs sind komplex; Trotz zwei prominente Untertypen von EPCs festgelegt wurden: die so genannte "early" EPCs und spät Auswuchs EPCs (late-EPCs) (nachfolgend als Early-EPCs bezeichnet). Sie können während der in vitro - Kultur sowie durch ihr Aussehen durch biologische Eigenschaften klassifiziert werden. Während "früh" EPCs in weniger als einer Woche nach der Kultur der peripheren Blut stammenden mononukleären Zellen in EC-spezifischen Medien erscheinen, können Spät Auswuchs EPCs nach 2-3 Wochen gefunden werden. Spät Auswuchs EPCs wurden erkannt direkt in Neovaskularisation beteiligt zu sein, vor allem durch ihre Fähigkeit, sich zu reifen Endothelzellen zu differenzieren, während "früh" EPCs verschiedene angiogene Faktoren als endogen exprimierenous Ladung Angiogenese in einem parakrine Weise zu fördern. Während myokardialen Ischämie / Reperfusion (I / R), steuern verschiedene Faktoren, die die Homing von EPCs in Regionen von Blutgefäßbildung.
Makrophagen - Migration hemmenden Faktor (MIF) ist ein Chemokin-ähnliche pro-inflammatorischen und ubiquitär exprimiert Zytokin und wurde kürzlich als Schlüsselregulator der EPCs Migration funktionieren bei physiologischen Konzentrationen 1 beschrieben. Interessanterweise wird MIF in intrazelluläre Pools gespeichert und können schnell in den Blutstrom nach mehreren Stimuli (zB Myokardinfarkt) freigegeben werden.
Dieses Protokoll beschreibt ein Verfahren für die zuverlässige Isolierung und Kultivierung von Früh EPCs aus adultem menschlichem peripherem Blut basierend auf CD34-positive Selektion mit anschließender Kultur in Medium endotheliale Wachstumsfaktoren auf Fibronectin-beschichteten Platten für den Einsatz in in vitro Migrationsassays gegen Serumproben enthalten , von herzchirurgischen Patienten. Weiterhin ist dieMigrations Einfluss von MIF auf Chemotaxis von EPCs im Vergleich zu anderen bekannten Angiogenese-stimulierenden Zytokinen demonstriert.
Einleitung
Endotheliale Vorläuferzellen (EPCs) im menschlichen Blut zirkulierende und haben die Fähigkeit , sich in Endothelzellen zu differenzieren 2. Sie nehmen an der Vaskulogenese und sind in der Lage , den Schaden durch eine Entzündung und Ischämie / Reperfusions (I / R) Verletzungen auf verschiedene Weisen 3, 4 verursacht minimieren. Zum Beispiel zeigen EPCs erhöhten Mengen an intrazellulärem antioxidative Enzyme wie Katalase, Glutathionperoxidase oder Mangan - Superoxid - Dismutasen (MnSOD) 5. Die erhöhte Beständigkeit gegenüber oxidativem Stress ermöglicht EPCs 6 in Mikroumgebungen mit erhöhten reaktiven Sauerstoffspezies (ROS) nach ischämischer Verletzung zu funktionieren. Frühere Studien zeigten auch , dass die Anzahl von EPCs könnte vaskulären Reparatur korreliert werden , und dass eine reduzierte Anzahl von EPCs zirkulierende das Auftreten kardiovaskulärer Ereignisse vorhersagt 7,class = "xref"> 8. Allerdings hat eine klare Definition eines EPC noch nicht gefunden worden. Bis jetzt gibt es keine spezifische Zelloberflächenmarker oder konsistenten Phänotyp für EPCs und diese Zellen sind sehr selten im peripheren Blut 9. Eine menschliche EPC sollte als Umlaufzelle mit der Fähigkeit, in Betracht gezogen werden, um die Rekonstruktion des verletzten Endothel und neue Gefßstrukturen beizutragen.
Ein Weg zur Isolierung und Charakterisierung von EPCs ist durch Adhäsion an Fibronektin. Dadurch wird die Kapazität dieser Zellen verwendet , um eine bessere Haftung zu zeigen beschichteten Schalen an Fibronectin im Vergleich zu Typ 1 - Kollagen, beispielsweise 3, 10, 11. Jedoch fand andere , dass Zellen auf Fibronektin-beschichteten Schalen ohne vorherige oder weiteren Reinigungsschritt führt zu Kolonien einschließlich myeloiden Vorläuferzellen, Monozyten und T - Lymphozyten mononukleären Plattieren 12, 13, 14. Darüber hinaus wird in diesem Fall die Thrombozyten die mononukleären Zellen (MNC) Fraktion verunreinigen und somit die Plasmamembranproteine auf alle anhaftenden Zellen 15 übertragen.
Neben der Charakterisierung durch in vitro Adhäsionsassays, wird eine Kombination von verschiedenen Zelloberflächenmarker verwendet , um einen Zelltyp als EPC betrachtet zu beschreiben. In diesem Fall wird nach Fibronectin vermittelten Adhäsion werden die Zellen ihre endothelial-ähnlichen Eigenschaften analysiert betreffen. In diesem Verfahren werden die beiden endothelialen zellassoziierten Markern, acetylierte-low density lipoprotein (acLDL) und vaskulären endothelialen Wachstumsfaktor-Rezeptor 2 (VEGFR-2, KDR), eine Rolle spielen. Endothelial - Zellen und Makrophagen wurden "Scavenger - Zellen - Weg" 16 genannt gezeigt , speziell acLDL in einem Prozess in Anspruch nehmen. Ein weiterer Markerprotein ist KDR als Haupt VEGF-Rezeptor auf EndothelzellenZellen 17. Wie jedoch EPCs im allgemeinen kultiviert werden in Medien mit endothelialen Wachstumsfaktoren und fötalem Kälberserum ergänzt, ist es möglich, dass Makrophagen, die auch eine Endothel-ähnlichen Marker könnte wurden Profil irrtümlicherweise isoliert, zeigen. Wie zuvor gezeigt, kultiviert , wenn in einem Endothel-konditioniertes Medium, exprimieren Makrophagen "Endothel-spezifischen" Proteine 18.
Im allgemeinen gibt es zwei Kategorien von EPCs in mehrere Subtypen, die im Blut gefunden werden kann oder in vitro kultiviert werden. Spät Auswuchs EPCs (late-EPCs) erscheinen nach 2-3 Wochen der Kultur. Diese Zellen sind integriert schneller in eine Monoschicht aus menschlichen Nabelvenen - Endothelzellen und kann Kapillarröhrchen 19 bilden. Außerdem "early-EPCs" so genannte etwa eine Woche und handeln in einer passiven Weise durch Bereitstellung von angiogenen Molekülen, wie vaskulären endothelialen Wachstums im Blut zirkulierenFaktor (VEGF) oder CXCL8 19. Patienten mit koronarer Herzkrankheit (KHK) , zeigten eine signifikant geringere Mengen an early-EPCs im Vergleich zu einer Kontrollgruppe ohne CAD 20. Interessanterweise zeigte die gleiche Gruppe höhere Mengen an late-EPCs im Vergleich zu einer Kontrollgruppe. Eine andere Studie zeigte , dass eine frühe-EPCs differenzierte EPCs von Apoptose unter oxidativen Bedingungen in einer parakrinen Weise 6 schützen. Deshalb ist der frühe EPCs könnten relevante Schutzwirkungen durch die Migration von anderen Zellen in einer Auto- oder parakrine Weise im peripheren Blut zur Verfügung stellen.
Dieses Protokoll beschreibt ein Verfahren early-EPCs zu reinigen , indem zuerst die PBMC-Fraktion aus menschlichem peripherem Blut isoliert und anschließend Isolieren von CD34 + Zellen aus der PBMC-Fraktion von unerwünschten Zellen dieser Zellsuspension zu entfernen. CD34 ist ein Marker, der für die Isolierung von humanen hämatopoetischen Stammzellen verwendet wird 9 . Danach werden CD34 + Zellen, die auf Fibronectin-beschichteten Gewebekulturoberflächen. Nach drei Tagen wird das Medium gewechselt, wobei alle nicht-adhärente Zellen zu verlieren. Schließlich werden isoliert EPCs gefärbt, um die Aufnahme von acLDL und die Anwesenheit von KDR als Endothelzell-Marker zu verifizieren durch fluoreszenzaktivierte Zellsortierung (FACS). Als zusätzlicher Marker, wir plättchen endothelial cell adhesion molecule (PECAM-1, CD31) analysiert, die auf Endothelzellen tritt auch auf.
Wiederherstellung von beschädigten oder myokardialen Gewebe durch verstärkte Rekrutierung von EPCs infarzierte gehört zu den intensivsten untersuchten Behandlungsstrategien bei kardiovaskulären Erkrankungen. Allerdings ist die Übersetzung von experimentellen Ergebnisse in die klinische Praxis immer noch eine Herausforderung, die komplexe zelluläre Wechselwirkungen im menschlichen Körper bei verschiedenen pathophysiologischen Bedingungen gegeben. Darüber hinaus löst der myokardialen I / R-Verletzungen eine übermäßige Sekretion verschiedener Zytokine, Hormone und Wachstums fac toren, die das Homing von EPCs in Regionen von Blutgefäßbildung 13 steuern. Wie bereits gezeigt, CXCL8, stromal cell-derived Faktor 1α (SDF-1α, CXCL12), VEGF und Makrophagen migration inhibitory factor (MIF) werden in Serumproben nach Myokard - I / R Schädigung 1 signifikant erhöht. Unter diesen Faktoren ist ein pleiotroper MIF Chemokin-ähnliche Cytokine mit überwiegend proinflammatorischen Eigenschaften. Im Gegensatz zu seinem historischen Namen, hat MIF pro-Migrationsfunktionen, als eine echte Chemokin auf verschiedenen Zelltypen handeln 1, 21, 22. MIF-vermittelten Zelleinstellungsverfahren haben zur Chemokin - Rezeptoren CXCR4 und CXCR2 in Verbindung gebracht worden, die MIF bindet an und aktiviert in einem nicht-verwandtes Weise 21. Bemerkens exprimieren EPCs beide dieser Rezeptoren auf ihrer Oberfläche, die zusätzlich unter hypoxischen Bedingungen nach oben reguliert werden,ass = "xref"> 23, 24. Darüber hinaus schlägt Ansammeln Hinweise darauf , dass MIF hat eine Gesamt Herz-schützende Wirkung während des I / R Verletzung des Herzens 22, 25, 26. In diesem Zusammenhang hat es sich ferner gezeigt , dass MIF die Neovaskularisation bei hypoxischen Stress unterstützen kann , die von besonderer Bedeutung ist, wenn die begrenzte Wiederherstellungsmechanismen des verletzten Myokard 27 berücksichtigen. Zurück in - vitro - Studien und Experimente in der präklinischen Mausmodellen 4 erste Erkenntnisse über die Rolle von MIF in EPCs Rekrutierung zur Verfügung gestellt. Zu beachten ist , MIF ist auch ein prominentes Fracht - Protein von EPCs , die 28 innerhalb ischämischen Stellen während EPCs Rekrutierung freigesetzt werden können. Doch Studien im klinischen Umfeld insbesondere im Vergleich zu anderen (angiogene) Serum Zytokine bleiben schwer zu fassen.
Protokoll
Blut für die Isolierung von EPCs wurde von gesunden Freiwilligen nach Einverständniserklärung in Übereinstimmung mit der lokalen Ethikkommission erhalten. Serumproben in den Migrationsassays verwendet wurden von Patienten erhalten, die konventionelle Herzchirurgie mit der Verwendung von kardiopulmonalen Bypass (CPB) unterzog. Ausschlusskriterien Notoperationen waren, bekannten oder vermuteten Schwangerschaft, Patienten `Alter unter 18 Jahren, und fehlende informierte Zustimmung erhalten. Die Serumproben wurden zusätzlich zu den klinischen Routinemessungen gezogen (unmittelbar vor der Operation und unmittelbar nach der myokardialen Reperfusion / Öffnung der Aorten-Kreuzklemme) und anschließend bei -80 ° C bis zur endgültigen Analyse gespeichert. Die Institutional Review Board (Ethikkommission, RWTH Aachen) genehmigte diese Studie. Die Patienten zeigten eine Durchschnittsalter 68,6 Jahre, und ein Durchschnittsgewicht von 81,7 kg. Vorerkrankungen enthalten: Hypertonie (65%), chronische Lungenerkrankung (19%), extra Herz Arteriopathie (16%), zerebrale Dysfunktion (6%), instabile Angina pectoris (3%), den letzten Myokardinfarkt (28% innerhalb von 90 d), chronischer Nierenerkrankung (14%), Lebererkrankungen (2%) und Diabetes (34%).
1. Beschichtung von T75-Flasche:
- Bereiten Sie 5 ml Fibronektin-Lösung (1 mg humanem Fibronektin, verdünnt in 15 ml Reinstwasser) pro T75-Flasche.
- Fügen Sie die Lösung auf eine T75-Flasche und warten, bis das Wasser verdampft ist. Um alle unnötigen Unterbrechungen während des Isolationsprozesses zu vermeiden aufgrund der Verdampfung, führen Sie diesen Prozess im Voraus (zB über Nacht) und bei Raumtemperatur. Diese Lösung gibt 4,44 ug Fibronektin / cm 2.
- Bereiten Sie die endotheliale Medium MV2 Zellwachstum durch die basale MV2 Medium mit den Wachstumsfaktor ergänzt durch den Hersteller zu ergänzen.
2. Isolierung von endothelialen Vorläuferzellen (EPCs) aus 60 ml Blut:
Hinweis: Da die CD34-positive Selektion Cocktail einnd die magnetischen Beads sind im Handel erhältlich in einer kombinierten Auswahl-Kit gibt es keine Konzentrationen vom Hersteller zur Verfügung gestellt. Jedoch etwa 100 & mgr; l des Antikörpers reichen für bis 5 x 10 8 Zellen Verarbeitung auf. Die magnetischen Kügelchen werden in Wasser verdünnt, Dextran-beschichtet und etwa 5.000-facher kleiner im Vergleich zu anderen im Handel erhältlichen Perlen. Für weitere Informationen siehe Herstellerangaben.
- Mischen Sie Blut (mit oder ohne Antikoagulantien) 1: 1 mit Ca 2+ -Mg 2+ -freier PBS.
- 15 ml Dichtegradient-Lösung pro 50 ml-Röhrchen. Für weitere Informationen siehe Herstellerangaben.
- Das verdünnte Blut auf der Oberseite der Dichtegradient-Lösung langsam Schicht.
- Zentrifuge Proben bei 2.500 xg für 30 min bei langsamer Beschleunigung und ohne Bremsen.
- Vorsichtig sammeln die Leukozytenfilmschicht jedes Rohr (Abbildung 1) eine sterile Plastikpipette und in ein anderes Röhrchen gegeben.Vermeiden Sammlung der Dichtegradient-Lösung. Die erwartete PBMC Ausbeute beträgt ca. 3-4 x 10 6 Zellen / ml Blut.

Abbildung 1: Dichtegradientenzentrifugation von Bbuffy Mantel auf Ficoll - Lösung. Gezeigt, ist das Ergebnis der Dichte-Gradienten-Zentrifugation bei 2.500 xg für 30 min auf der Dichtegradient-Lösung. Dargestellt sind Erythrozyten und Granulozyten (rot), die mononukleäre Zellfraktion (weiße Schicht), Plasma (gelb), und der Dichtegradient-Lösung (weißlich). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Verdünne die peripheren mononukleären Zellfraktion mit mindestens 3 Volumina PBS und mischen. Zentrifuge bei Raumtemperatur für 15 min bei 200 x g.
- Wiederholen Sie Schritt 2.6 zweimal.
- Den Überstand aspirieren und resuspendieren Zellpellet in 5 ml MV2 Medium.
- Füge 100 & mgr; l des menschlichen CD34 - Antikörper (ausreichend für die Verarbeitung von bis zu 5 x 10 8 Zellen) pro verwendet buffy coat und dreht 15 min bei 37 ° C mit 5% CO 2.
- Werden 50 & mgr; l Dextran-beschichteten magnetischen Kügelchen pro verwendet buffy coat und dreht 10 min bei 37 ° C mit 5% CO 2.
- Nach der Inkubation übertragen die Suspension auf FACS-Röhrchen mit einem Maximum von 3 ml in jedes Röhrchen. Höhere Mengen werden nicht mit dem Magneten zulässig.
- Einfügen FACS Röhre (n) in den Magnet (en) und für 5 min warten.
- Überstand verwerfen, ohne die FACS-Röhrchen aus dem Magneten ziehen.
- Resuspendieren der Zellen in jeder FACS-Röhrchen mit 3 ml MV2 Medium außerhalb des Magneten.
- Wiederholen Sie die Schritte 2,12-2,14 zweimal.
- Ziehen die FACS-Röhrchen aus den Magneten und die Zellen in 3 ml Medium, MV2 resuspendieren.
- Übertragen die Zellsuspension in vorbeschichteten T75 flasks und 17 ml MV2 Medium pro Kolben hinzufügen.
HINWEIS: Das Medium sollte nach 3 Tagen gewechselt werden. Nach einer Woche zeigen Zellen spindelartigen Strukturen (Figur 2) und sind gebrauchsfertig. Siehe einem Aussichtspunkt der Isolierung 3.
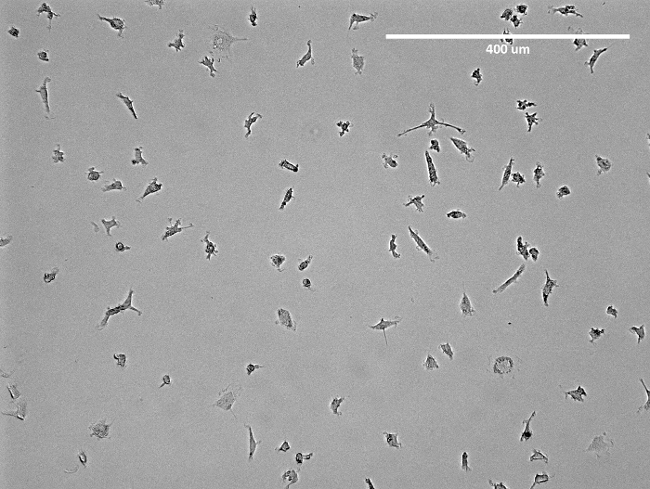
Abbildung 2: Mikroskopische Aufnahme von isolierten EPCs. Dargestellt ist ein repräsentatives Bild der isolierten frühen EPCs in einer T75-Flasche vor der Ablösung. Scheinbare ist die spindelartige Struktur der EPCs. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
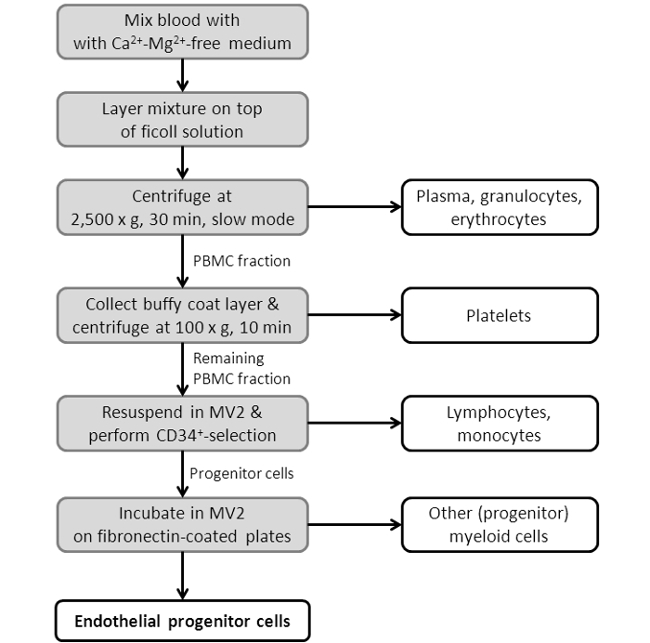
Abbildung 3: Flussdiagramm des EPC Isolierungsverfahren werden angezeigt. Abgebildet ist ein Schema, Showing die einzelnen Schritte des EPC-Isolierungsprotokoll. Für eine detailliertere Protokoll finden Sie in Abschnitt 2 im Abschnitt Protokoll.
3. Migration Assay
- Entfernen Sie das Medium von EPCs in der T75-Flasche.
- Waschen mit 5 ml PBS durch vorsichtiges Schütteln.
- Entfernen PBS und 5 mL kommerzielle Zellablösung Lösung. Warten Sie, bis die Zellen abgelöst werden (überprüfen Sie unter einem Mikroskop). Beschleunigen Sie die Ablösung durch sorgfältig den Boden des Kolbens tippen.
- Wenn die Zellen abgelöst werden, fügen Sie schnell 5 ml MV2 Komplettmedium und Transfer in ein anderes Rohr die Zellsuspension.
- Zentrifuge bei 2.000 xg für 5 min.
- Die Zellen in 5-10 ml PBS und zentrifugiert erneut bei 2.000 xg für 5 min.
- Wiederholen Sie Schritt 3.6.
- Zellpellet in MV2 ausgehungert Medium (50.000 Zellen in 75 & mgr; l pro Trans gut gebraucht werden).
HINWEIS: Welche Migrationssystem wird auf dem Zelltyp und Assay benötigt wird, hängt. Es gibt diff Erent Porendurchmesser und Plattengrößen (Anzahl der Brunnen). Für EPCs eine Porengröße von 5 & mgr; m in 96-Well-System ist optimal. - Bereiten Sie die Migration Platte durch Zugabe von 235 ul der Serumprobe (Serum 1: 5 verdünnt in MV2 ausgehungert Medium) in die untere Kammer (Abbildung 4).
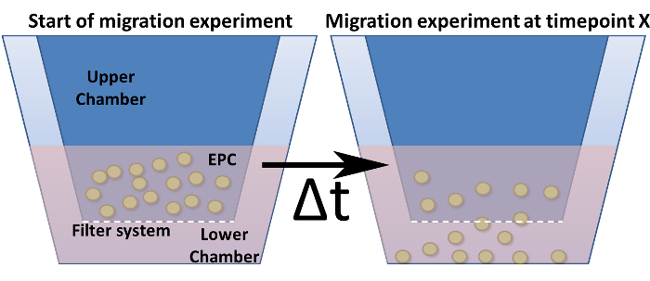
Abbildung 4: Migration Assay in einer modifizierten Boyden - Kammer. Dargestellt ist die allgemeine Gestaltung einer Kammer Boyden modifiziert. Die Zellkultur-Einsätze (= obere Kammer) sind in dunkelblau angezeigt und sind in die untere Kammer eingeführt. Der Boden (aber nicht die Wände) dieser Einsätze stellt das Filtersystem mit den Poren. (A) zeigt den Aufbau zum Zeitpunkt Null. (B) nach einer gewählten Zeitpunkt werden die Zellen durch das Filter auf einen Reiz migriert.fig4large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
- Fügen Sie den Einsatz kurz vor Zugabe der Zelllösung.
- Hinzuzufügen 75 ul der Zelllösung (= 50.000 Zellen) in die obere Kammer.
- Lassen Sie die EPCs bei 37 ° C für 3 h migrieren und 5% CO 2 (Migrationszeit hängt vom Zelltyp und System).
- Um Serum Autofluoreszenz Artefakte zu vermeiden, zu quantifizieren gewanderten Zellen durch Bilder des Bohrlochs unter einem Mikroskop zu nehmen und die Zellen zählen, um die halbautomatische Software "ImageJ" verwenden.
- Entfernen Sie die obere Kammer (alle nicht migrierten Zellen enthält).
- In 70 & mgr; l 3,6% Paraformaldehydlösung, einschließlich Hoechst-Farbstoff (verdünnt 1: 1000). Die Platte kann bei 37 ° C und 5% CO 2 über Nacht gelagert werden.
- Zentrifugieren Sie die Platte kurz alle Zellen in die gleiche Brennebene bei 2.000 × g für 1-2 Minuten zu bekommen.
- Nehmen Sie 5 Bilder pro well (5 und 6) mit einer 100 - facher Vergrößerung.
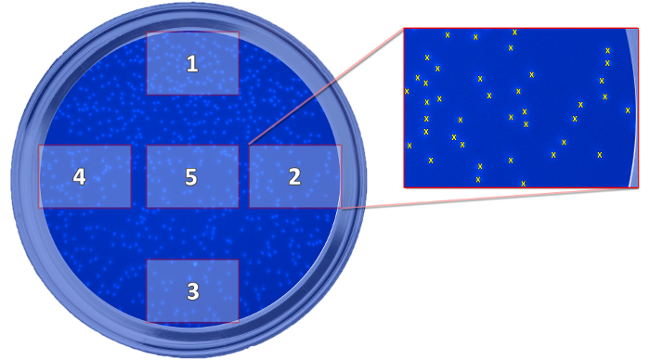
Abbildung 5: Schema der Position des aufgenommenen Bilder werden angezeigt. Das Schema zeigt die Position der fünf aufgenommenen Bilder, die für die Bestimmung von migrierten Zellen benötigt werden, in Bezug auf den Brunnen. Die Bilder werden ergriffen, um die Zellen zu zählen und einen Mittelwert für jeden gut berechnen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6: Mikroskopische Aufnahme für Zell Quantifizierung. Gezeigt wird ein repräsentatives Bild, das für die Zell Quantifizierung genommen wurde. Die Zellen wurden gefärbt und fixiert using Hoechst-Farbstoff in 3,6% Paraformaldehyd. Die Punkte stehen für feste und endothelialen Vorläuferzellen gefärbt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Zählen Sie die migrierten Zellen unter Verwendung des halbautomatischen Software "ImageJ" durch das National Institute of Health.
Ergebnisse
Die Charakterisierung der isolierten Endothelvorläuferzellen
Zunächst wurde die Aufnahme von acLDL überprüft, sowie die Expression von KDR und CD31 auf der Oberfläche der isolierten Zellpopulation. Wie in Abbildung 7a zeigt, 85,1% der isolierten EPCs zeigte eine Aufnahme von acLDL und ausgedrückt CD31. Figuren 7b und 7c weiterhin eine homogene Verteilung beider Marker nachw...
Diskussion
Der erste Teil dieser Studie umfasste die Isolierung von humanen EPCs aus dem peripheren Blut von gesunden Probanden, eine umfassende Bewertung des Blutes der Herzchirurgie-Patienten zu ermöglichen. Daher wurde eine Dichtegradientenzentrifugation geführt, um die PBMC-Fraktion aus Plasma, Granulozyten und Erythrozyten zu trennen. Für die meisten der verunreinigenden Blutplättchen zu entfernen, wurde diese Zellfraktion zu kurz ausgesetzt und langsam Waschschritte 29,
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren haben keine Bestätigungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Referenzen
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten