Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de células progenitoras endoteliales de voluntarios sanos y su potencial migratorio influenciado por las muestras de suero después de cirugía cardiaca
En este artículo
Resumen
células progenitoras endoteliales (CPE) participan de manera crucial en la neovascularización de los tejidos isquémicos. Este método describe el aislamiento de EPCs humanos de sangre periférica, así como la identificación de su potencial migratorio contra muestras de suero de pacientes de cirugía cardíaca.
Resumen
células progenitoras endoteliales (EPC) son reclutados de la médula ósea en condiciones patológicas como la hipoxia y son de crucial participan en la neovascularización de los tejidos isquémicos. El origen, clasificación y caracterización de las CPE son complejos; no obstante, se han establecido dos prominentes subtipos de las CPE: la llamada "temprana" CPE (en lo sucesivo también como principios-EPC) y CPE-finales de derivación (tarde-EPC). Se pueden clasificar por propiedades biológicas, así como por su aspecto durante el cultivo in vitro. Mientras que las CPE "primeros" aparecen en menos de una semana después del cultivo de células mononucleares derivadas de la sangre periférica en los medios de comunicación a la CE específica, las CPE tarde en la excrecencia se pueden encontrar después de 2-3 semanas. CPE tarde en la excrecencia han sido reconocidos como involucrados directamente en la neovascularización, principalmente a través de su capacidad para diferenciarse en células endoteliales maduras, mientras que "temprano" CPE expresan diversos factores angiogénicos como endógenocarga ous para promover la angiogénesis de una manera paracrina. Durante el infarto de isquemia / reperfusión (I / R), varios factores controlan el homing de CPE a las regiones de formación de vasos sanguíneos.
Macrófagos, factor inhibidor de la migración (MIF) es una citoquina pro-inflamatoria y la expresión ubicua de quimioquinas similar y recientemente fue descrita para funcionar como regulador clave de la migración de las CPE a concentraciones fisiológicas 1. Curiosamente, MIF se almacena en piscinas intracelulares y rápidamente puede ser liberada en el torrente sanguíneo después de varios estímulos (por ejemplo, infarto de miocardio).
Este protocolo describe un método para el aislamiento fiable y la cultura de principios del CPE a partir de sangre periférica humana de adultos basado en la selección CD34-positivo con el cultivo posterior en medio que contiene factores de crecimiento endoteliales en placas recubiertas de fibronectina para el uso en los ensayos de migración in vitro frente a muestras de suero de los pacientes quirúrgicos cardíacos. Además, elinfluencia migratoria del MIF sobre la quimiotaxis de las CPE en comparación con otras citocinas que estimulan la angiogénesis conocidos se demuestra.
Introducción
Células progenitoras endoteliales (CPE) están circulando en la sangre humana y tienen la capacidad de diferenciarse en células endoteliales 2. Participan en la vasculogénesis y son capaces de reducir al mínimo el daño causado por la inflamación y las lesiones por isquemia / reperfusión (I / R) de varias maneras 3, 4. Por ejemplo, EPCs muestran niveles elevados de las enzimas antioxidantes intracelulares como catalasa, glutatión peroxidasa o superóxido dismutasa de manganeso (MnSOD) 5. La elevada resistencia contra el estrés oxidativo permite CPE funcionar en microambientes con especies elevadas de oxígeno reactivo (ROS) después de la lesión isquémica 6. Estudios anteriores también indicaron que el número de CPE puede ser correlacionada con la reparación vascular y que un número reducido de circulación EPCs predice la ocurrencia de eventos cardiovasculares 7,class = "xref"> 8. Sin embargo, una definición clara de un EPC no se ha encontrado todavía. Hasta ahora, no hay ningún marcador de superficie celular específico o fenotipo consistente para EPCs y estas células son muy raros en la sangre periférica 9. Un EPC humano debe considerarse como una célula de circulación con la capacidad de contribuir a la reconstrucción del endotelio lesionado y nuevas estructuras vasculares.
Una forma de aislar y caracterizar las CPE es a través de la adhesión a la fibronectina. De este modo, la capacidad de estas células se utiliza para mostrar una adhesión superior a la fibronectina platos recubiertos comparación con el tipo 1 de colágeno, por ejemplo 3, 10, 11. Sin embargo, otros encontraron que placas células mononucleares en los platos recubiertos de fibronectina sin ninguna etapa de purificación anterior o además conduce a colonias incluyendo las células progenitoras mieloides, monocitos, y linfocitos T 12, 13, 14. Por otra parte, en este caso, las plaquetas pueden contaminar la fracción de células mononucleares (MNC) y de ese modo la transferencia de las proteínas de membrana de plasma de las células adherentes 15.
Además de la caracterización por medio de ensayos de adhesión in vitro, una combinación de diferentes marcadores de superficie celular se utiliza para describir un tipo de célula considerada como un EPC. En este caso, después de la adhesión a fibronectina mediada, las células se analizaron preocupantes sus atributos similares a las endoteliales. En este proceso, los dos marcadores asociados a las células endoteliales, lipoproteína acetilada-baja densidad (acLDL) y vascular del receptor del factor de crecimiento endotelial 2 (VEGFR-2, KDR), juegan un papel. Las células endoteliales y macrófagos se ha demostrado que abordará de manera específica acLDL en un proceso llamado "vía celular del tesoro" 16. Otra proteína marcador es KDR como el principal receptor de VEGF en endotelial17 células. Sin embargo, como EPCs en general se cultivan en medio suplementado con factores de crecimiento endotelial y suero de ternera fetal, es posible que los macrófagos, que también podría haber sido aislado por error, exhiben un perfil de marcador endotelial-similares. Como se indica anteriormente, si se cultivan en un medio endotelial acondicionado, los macrófagos expresan proteínas "-endoteliales específica" 18.
En general, hay dos categorías de EPCs dentro de más subtipos, que se pueden encontrar en la sangre o ser cultivados in vitro. EPC-finales de derivación (late-EPC) aparecen después de 2-3 semanas de cultivo. Estas células se integran más rápido en una monocapa de células endoteliales de la vena umbilical humana y pueden formar tubos capilares 19. Además, los llamados "principios del EPCs" circular en la sangre durante aproximadamente una semana y actuar de una manera más pasiva a través de moléculas angiogénicas, tales como la entrega de crecimiento endotelial vascularfactor de (VEGF), o CXCL8 19. Los pacientes con enfermedad arterial coronaria (CAD) mostraron cantidades significativamente menores de principios de los CPE en comparación con un grupo control sin 20 CAD. Curiosamente, el mismo grupo mostró una mayor cantidad de finales de los EPCs comparación con un grupo control. Otro estudio mostró que los principios del CPE CPE proteger diferenciadas de la apoptosis en condiciones oxidantes, de una manera paracrina 6. Por lo tanto, los primeros EPCs pueden proporcionar efectos protectores relevantes a través de la migración de las otras células de una manera automática o paracrina dentro de la sangre periférica.
Este protocolo describe un método para purificar principios de los EPCs aislando primero el PBMC-fracción a partir de sangre periférica humana y, posteriormente, el aislamiento de células CD34 + de las PBMC-fracción para borrar esta suspensión de células a partir de células no deseadas. CD34 es un marcador, que se utiliza para el aislamiento de células madre hematopoyéticas humanas 9 . Después, las células CD34 + se cultivan en superficies de cultivo de tejidos recubiertas de fibronectina. Después de tres días, se cambia el medio, perdiendo de ese modo todas las células no adherentes. Finalmente, EPCs aislados se tiñeron para verificar la absorción de acLDL y la presencia de KDR como de células endoteliales-marcador mediante el uso de células activadas por fluorescencia (FACS). Como un marcador adicional, se analizaron las plaquetas molécula de adhesión celular endotelial (PECAM-1, CD31), que también se produce en las células endoteliales.
Restauración de tejido miocárdico dañado o infartado por el reclutamiento mejorada de EPCs pertenece a las estrategias de tratamiento intensamente investigados en las enfermedades cardiovasculares. Sin embargo, la traducción de los resultados experimentales en la práctica clínica es todavía difícil, dada la compleja interacción celular en el cuerpo humano durante diversas condiciones fisiopatológicas. Por otra parte, el infarto de I / R lesiones desencadenar una excesiva secreción de diversas citoquinas, hormonas de crecimiento y fac res, que controlan el homing de CPE a las regiones de formación de vasos sanguíneos 13. Como ya se ha mostrado, CXCL8, factor derivado de células estromales 1α (SDF-1α, CXCL12), VEGF y el factor inhibidor de la migración de macrófagos (MIF) se incrementó significativamente en muestras de suero después de una lesión miocárdica E / R1. Entre estos factores, MIF es una citoquina pleiotrópica quimiocina similar con características predominantemente pro-inflamatorias. En contraste con su nombre histórico, MIF tiene funciones pro-migratorias, actuando como un verdadero quimiocina en diversos tipos de células 1, 21, 22. Procesos de reclutamiento celular mediada por MIF se han relacionado con la receptores de quimioquinas CXCR2 y CXCR4, que se une a MIF y activa de una manera no afines 21. Es de destacar que las CPE expresan ambos receptores en su superficie, que, además, se convierten hasta reguladas en condiciones de hipoxiaculo = "xref"> 23, 24. Por otra parte, la acumulación de evidencia sugiere que el FOMIN tiene un efecto general cardioprotector durante la Primera R lesión / del corazón 22, 25, 26. En este contexto, se ha demostrado, además, que el FOMIN puede apoyar la neovascularización durante el estrés hipóxico que es de especial relevancia, al considerar los mecanismos de recuperación limitadas del miocardio lesionado 27. Anteriores estudios y experimentos in vitro en modelos de ratón en pre-clínicos proporcionados primera evidencia sobre el papel de MIF en las CPE reclutamiento 4. Es de destacar que FOMIN también es una proteína de carga prominente de CPE que puede ser puesto en libertad durante el reclutamiento CPE dentro de los sitios isquémicos 28. Sin embargo, los estudios en el ámbito clínico, en particular, en comparación con otros (angiogénicos citoquinas séricas) siendo difícil de alcanzar.
Protocolo
La sangre para el aislamiento de las CPE se obtuvo de voluntarios sanos después de consentimiento informado de acuerdo con el comité de ética local. Las muestras de suero utilizadas en los ensayos de migración fueron obtenidas de pacientes sometidos a cirugía cardiaca convencional con el uso de circulación extracorpórea (CEC). Los criterios de exclusión fueron las operaciones de emergencia, embarazo conocido o sospechado, patient`s edad inferior a 18 años, y la imposibilidad de obtener el consentimiento informado. Las muestras de suero se extrajeron además de mediciones de rutina clínicos (inmediatamente antes de la cirugía e inmediatamente después de la reperfusión de miocardio / apertura de pinzamiento aórtico) y posteriormente se almacena a -80 ° C hasta el análisis final. La junta de revisión institucional (Comité de Ética de la Universidad RWTH Aachen) aprobó este estudio. Los pacientes mostraron una edad media de 68,6 años y un peso promedio de 81,7 kg. enfermedades pre-existentes incluyen: hipertensión (65%), la enfermedad pulmonar crónica (19%), arteriopatía cardiaco extra (16%), disfunción cerebral (6%), angina inestable (3%), infarto de miocardio reciente (28% dentro de 90 d), enfermedad renal crónica (14%), enfermedad hepática (2%) y diabetes (34%).
1. Recubrimiento de T75 Frasco:
- Preparar la solución 5 ml de fibronectina (fibronectina humana 1 mg diluidos en 15 ml de agua ultrapura) por matraz T75.
- Añadir la solución a un matraz T75 y esperar hasta que se evapore el agua. Para evitar interrupciones innecesarias durante el proceso de aislamiento debido a la evaporación, lleve a cabo este proceso con antelación (por ejemplo, durante la noche) y a temperatura ambiente. Esta solución da 4,44 g de fibronectina / cm 2.
- Preparar el crecimiento de células endoteliales medio MV2 suplementando el medio basal MV2 con los suplementos de factores de crecimiento proporcionadas por el fabricante.
2. Aislamiento de células progenitoras endoteliales (EPC) de 60 ml de sangre:
NOTA: A medida que el CD34-positivo cóctel de selección de unand las perlas magnéticas están disponibles comercialmente en un kit de selección combinado, no hay concentraciones proporcionadas por el fabricante. Sin embargo, alrededor de 100 l de anticuerpo son suficientes para el procesamiento de hasta 5 x 10 8 células. Las perlas magnéticas se diluyen en agua, revestido con dextrano y sobre 5.000x menor en comparación con otras perlas disponibles en el mercado. Para más información, consulte las instrucciones del fabricante.
- Mezclar la sangre (con o sin anticoagulantes) 1: 1 con Ca 2 + Mg 2 + libre de PBS.
- Añadir 15 ml de solución de gradiente de densidad por un tubo de 50 ml. Para más información, consulte las instrucciones del fabricante.
- capa lentamente la sangre diluida en la parte superior de la solución de gradiente de densidad.
- Centrifugar las muestras a 2.500 xg durante 30 min con una aceleración lenta y sin frenado.
- Recoger con cuidado la capa leucocitaria de cada tubo (Figura 1) con una pipeta de plástico estéril y ponerlo en otro tubo.Evitar la colección de la solución de gradiente de densidad. El rendimiento esperado de PBMC es de aproximadamente 3-4 x 10 6 células / ml de sangre.

Figura 1: La centrifugación por gradiente de densidad de la capa de solución de Ficoll Bbuffy. Se muestra el resultado de la centrifugación en gradiente de densidad a 2.500 xg durante 30 min en la solución de gradiente de densidad. Se representan los eritrocitos y granulocitos (rojo), la fracción de células mononucleares (capa blanca), plasma (amarillo), y la solución de gradiente de densidad (blanquecino). Haga clic aquí para ver una versión más grande de esta figura.
- Diluir la fracción de células mononucleares de sangre periférica con al menos 3 volúmenes de PBS y mezclar. Centrifugar a temperatura ambiente durante 15 min a 200 x g.
- Repita el paso 2.6 en dos ocasiones.
- Aspirar el sedimento celular sobrenadante y resuspender en 5 ml de medio MV2.
- Añadir 100 ml de anticuerpo CD34 humano (suficiente para el procesamiento de hasta 5 x 10 8 células) por capa leucocitaria utilizado y girar durante 15 minutos a 37 ° C con 5% de CO2.
- Añadir 50 l de perlas magnéticas recubiertas de dextrano por capa leucocitaria utilizado y girar durante 10 minutos a 37 ° C con 5% de CO 2.
- Después de la incubación, la transferencia de la suspensión a tubos FACS con un máximo de 3 ml en cada tubo. Cantidades más altas no serán permisible con el imán.
- Introduzca el tubo (s) FACS dentro del imán (s) y esperar 5 minutos.
- Desechar el sobrenadante sin tirar de los tubos de FACS fuera del imán.
- Resuspender las células en cada tubo de FACS con 3 ml de medio MV2 fuera del imán.
- Repita los pasos 2.12 a 2.14 veces.
- Tire de los tubos de FACS de los imanes y resuspender las células en 3 ml de medio MV2.
- Transferir la suspensión celular en pre-recubierto T75 flasks y añadir 17 ml de medio MV2 por matraz.
NOTA: El medio debe ser cambiado después de 3 días. Después de una semana, las células muestran estructuras de tipo huso (Figura 2) y están listos para usar. Para un mirador del aislamiento véase la Figura 3.
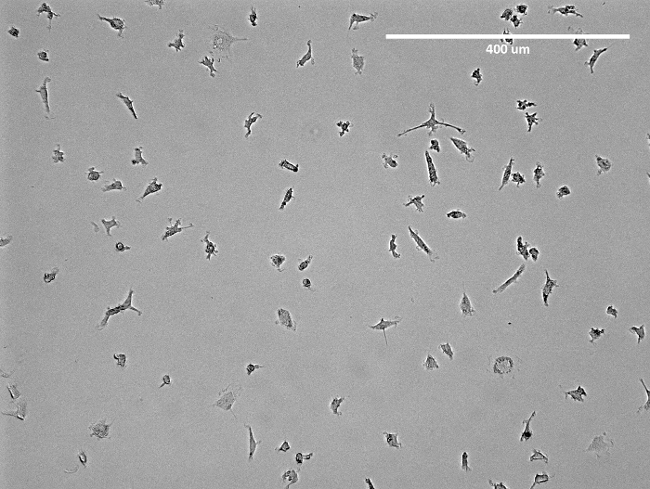
Figura 2: Imagen microscópica de las CPE aisladas. Se muestra una imagen representativa de aislados de principios del CPE en un matraz T75 antes de la separación. Aparente es la estructura de tipo huso de la CPE. Haga clic aquí para ver una versión más grande de esta figura.
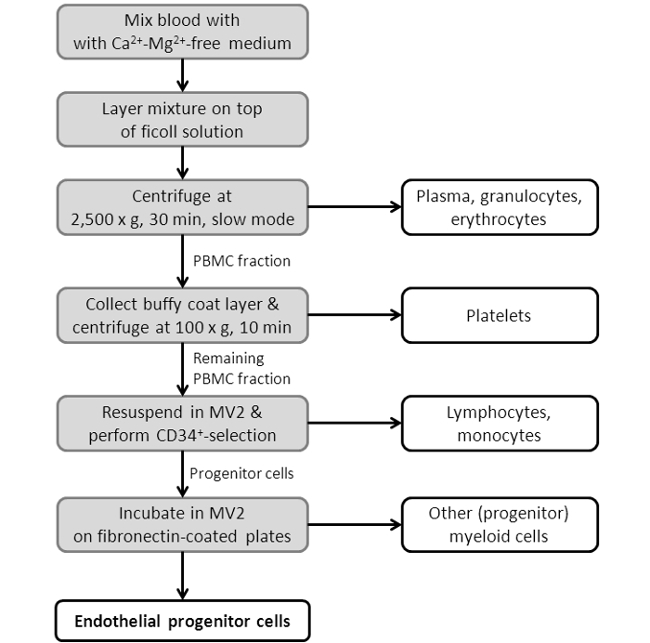
Figura 3: Diagrama de flujo que muestra el procedimiento de aislamiento de EPC. Representado es un esquema, espectáculoing los pasos individuales del protocolo de aislamiento EPC. Para un protocolo más detallado, véase la Sección 2 de la sección del protocolo.
3. Ensayo de Migración
- Retire el medio de EPC en el matraz T75.
- Se lava con 5 ml de PBS agitando con cuidado.
- Retirar PBS y añadir 5 solución de desprendimiento celular comercial ml. Espere hasta que se separan las células (marque con un microscopio). Acelerar el desprendimiento tocando con cuidado el fondo del matraz.
- Cuando se separan las células, añadir rápidamente 5 ml de medio completo MV2 y transferir la suspensión celular a otro tubo.
- Se centrifuga a 2.000 g durante 5 min.
- Resuspender las células en 5 a 10 ml de PBS y centrifugar de nuevo a 2000 xg durante 5 min.
- Repita el paso 3.6.
- Resuspender el sedimento celular en medio muerto de hambre MV2 (50.000 células en se necesitan 75 l por pocillo transmigración).
NOTA: ¿Qué sistema de migración que se necesita depende del tipo de células y ensayo. Hay diff diámetros de poro Erent y tamaños de placas (número de pozos). Para EPCs un tamaño de poro de 5 micras en el sistema 96 también es óptima. - Preparar la placa de la migración mediante la adición de 235 l de la muestra de suero (suero diluido 1: 5 en MV2 medio muerto de hambre) en la cámara inferior (Figura 4).
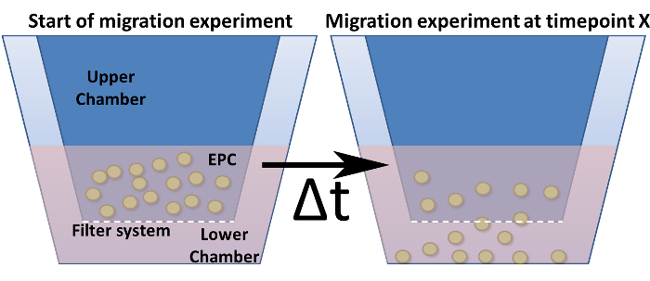
Figura 4: Ensayo de migración en una cámara de Boyden modificada. Se muestra el diseño general de una cámara de Boyden modificada. Los insertos de cultivo celular (= cámara superior) se indican en azul oscuro y se insertan en la cámara inferior. La parte inferior (pero no las paredes) de estos insertos representa el sistema de filtro que incluye los poros. (A) muestra la configuración en el punto de tiempo cero. (B) Después de un punto de tiempo elegido, las células se migran a través del filtro hacia un estímulo.fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Añadir el inserto poco antes de la adición de la solución de células.
- Añadir 75 l de la solución de células (= 50.000 células) en la cámara superior.
- Que el EPCs migrar durante 3 horas a 37 ° C y CO 2 al 5% (tiempo de migración depende del tipo de célula y del sistema).
- Para evitar artefactos de auto-fluorescencia de suero, cuantificar células migraron al tomar fotografías del bien bajo un microscopio y contar las células usando el software semiautomatizado "ImageJ".
- Retire la cámara superior (que contiene todas las células no migradas).
- Añadir 70 l solución de paraformaldehído al 3,6%, incluyendo Hoechst colorante (diluido 1: 1000). La placa se puede almacenar a 37 ° C y 5% de CO 2 durante la noche.
- Se centrifuga la placa en breve para obtener todas las células en el mismo plano focal a 2.000 xg durante 1-2 minutos.
- Tomar 5 imágenes por well (Figuras 5 y 6) con un aumento de 100X.
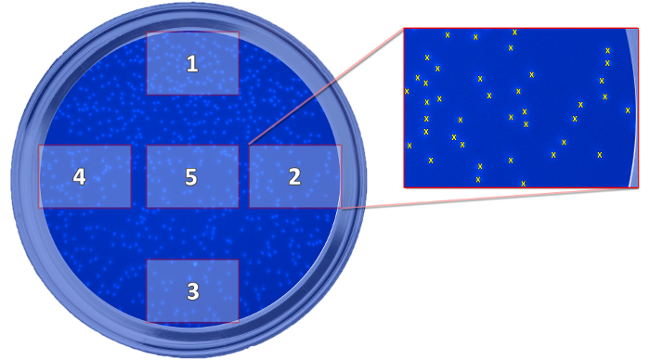
Figura 5: Esquema que muestra la posición de las fotos tomadas. El esquema representa la posición de las cinco imágenes tomadas, que son necesarios para la determinación de células migradas, en relación con el pozo. Las imágenes se tomaron para contar las células y calcular un valor medio para cada bien. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Imagen microscópica para la cuantificación de la célula. Se muestra una imagen representativa, que fue tomada para la cuantificación de células. Las células se tiñeron y USI fijosng de colorante Hoechst en el 3,6% de paraformaldehído. Los puntos representan fijaron y tiñeron las células progenitoras endoteliales. Haga clic aquí para ver una versión más grande de esta figura.
- Contar las células migradas usando el software semiautomatizado "ImageJ" por el Instituto Nacional de Salud.
Resultados
Caracterización de las células progenitoras endoteliales aisladas
En primer lugar, la absorción de acLDL se verificó, así como la expresión de KDR y CD31 en la superficie de la población de células aislada. Como muestra la Figura 7a, el 85,1% de los aislados CPE mostró una absorción de acLDL y expresa CD31. Las figuras 7b y 7c muestran, además, una distribución homog?...
Discusión
La primera parte de este estudio incluyó el aislamiento de las CPE humanos de la sangre periférica de voluntarios sanos para permitir una evaluación completa de la sangre de los pacientes sometidos a cirugía cardíaca. Por lo tanto, una centrifugación en gradiente de densidad se realizó para separar la fracción de PBMC a partir de plasma, granulocitos y eritrocitos. Para eliminar la mayor parte de las plaquetas contaminantes, esta fracción de células se sometió a corto y lavado lento los pasos
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores no tienen reconocimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Referencias
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados