このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
健康なボランティアからの内皮前駆細胞の単離および心臓手術後の血清試料の影響を受け彼らの渡り鳥の可能性
要約
内皮前駆細胞(EPC)が決定的に虚血組織の血管新生に関与しています。この方法は、末梢血由来のヒトEPCの単離、ならびに心臓手術患者の血清サンプルに対する彼らの渡り鳥の可能性の同定を記載します。
要約
内皮前駆細胞(EPC)は、低酸素症のような病理学的条件の下で骨髄から動員されると決定的に虚血組織の血管新生に関与しています。 EPCの起源、分類および特徴付けは複雑です。かかわらず、EPCの2顕著なサブタイプが確立されている:いわゆる「初期」のEPC(その後、早けれ-のEPCと呼ぶ)と後期成長のEPC(後期のEPCを)。これらは、生物学的特性によってだけでなく、in vitro培養中にそれらの外観によって分類することができます。 「初期」のEPCは、EC-特定のメディアにおける末梢血由来の単核細胞の培養後一週間も経たないうちに見えるが、後期成長EPCは2-3週間後に見つけることができます。 「初期」のEPCはENDOGENなど様々な血管新生因子を発現するのに対し、後期成長EPCは、主に成熟内皮細胞に分化する能力を介して、直接、血管新生に関与することが認められていますパラクリン方法で血管新生を促進するための組織単位(OU)貨物。心筋虚血/再灌流(I / R)の間に、様々な要因は、血管形成の領域へのEPCのホーミングを制御します。
マクロファージ遊走阻止因子(MIF)は、ケモカイン様炎症誘発性であり、普遍的にサイトカインを発現し、最近では生理的濃度1でのEPCの移行の重要な調節因子として機能するように説明しました。興味深いことに、MIFは、細胞内プールに格納され、急速に、いくつかの刺激( 例えば 、心筋梗塞)後に血流中に放出することができます。
このプロトコルは、血清サンプルに対するインビトロ遊走アッセイで使用するためのフィブロネクチンでコーティングされたプレート上で内皮細胞増殖因子を含む培地中でその後の培養でCD34陽性選択に基づいて、成人ヒト末梢血からの早期-EPCの信頼性の単離および培養のための方法を説明し心臓手術患者の。また、他のよく知られた血管新生を刺激するサイトカインと比較して、EPCの走化性に対するMIFの回遊影響が実証されています。
概要
内皮前駆細胞(EPC)は、ヒト血液中を循環し、内皮細胞2に分化する能力を有しています。これらは、脈管形成に関与する様々な方法3,4における炎症および虚血/再灌流(I / R)傷害によって引き起こされる損傷を最小限にすることが可能です。例えば、EPCはカタラーゼ、グルタチオンペルオキシダーゼまたはマンガンスーパーオキシドジスムターゼ(のMnSOD)5のような細胞内の抗酸化酵素のレベルの上昇を示しています。酸化ストレスに対する上昇した耐性はEPCのは、虚血性傷害6の後に上昇した活性酸素種(ROS)と微小環境で機能することを可能にします。以前の研究ではまた、EPCの数は、血管の修復に相関したEPCの循環数の減少は、心血管イベント7の発生を予測することをされるかもしれないことを示しましたクラス= "外部参照"> 8。しかし、EPCの明確な定義はまだ発見されていません。これまで、そこのEPCのための特異的な細胞表面マーカーまたは一貫性の表現型はなく、これらの細胞は、末梢血9において非常に稀です。人間のEPCが負傷内皮および新血管構造の再構築に貢献する能力を有する循環細胞として考慮されるべきです。
単離したEPCを特徴付ける一つの方法は、フィブロネクチンへの接着を介してです。これにより、これらの細胞の能力は、実施例3、10、11のために、1型コラーゲンと比較して被覆された皿をフィブロネクチンへの優れた接着性を示すために使用されます。しかし、他のものは以前のまたはさらなる精製工程なしで、フィブロネクチンでコーティングされた皿上で単核細胞をプレーティングする骨髄前駆細胞、単球、およびTリンパ球1を含むコロニーをもたらすことを見出しました2、13、14。また、この場合には、血小板は、単核細胞(MNC)画分を汚染する可能性があり、それにより、任意の接着細胞15に原形質膜タンパク質を移します。
インビトロ接着アッセイを介して特性決定に加えて、別の細胞表面マーカーの組み合わせは、EPCと考え細胞型を記述するために使用されます。この場合には、フィブロネクチン媒介接着後、細胞は、内皮細胞のような属性について分析されます。このプロセスでは、二つの内皮細胞関連マーカー、アセチル化低密度リポタンパク質(acLDL)および血管内皮増殖因子受容体2(VEGFR-2、KDR)が、役割を果たしています。内皮細胞およびマクロファージは、具体的には、「スカベンジャー細胞経路」16と呼ばれるプロセスでacLDLを取ることが示されています。別のマーカータンパク質は、内皮の主なVEGFレセプターのようなKDRでありますセル17。一般的に、EPCは、内皮成長因子およびウシ胎児血清を補充した培地で培養したようしかし、また、誤って単離されている可能性があるマクロファージ、内皮様マーカープロファイルを示すことが可能です。先に示したように内皮馴化培地で培養した場合、マクロファージは、「内皮特異的」タンパク質18を発現します 。
一般的には、血液中に見つけることができるか、 インビトロで培養する以上のサブタイプ、内EPCの2つのカテゴリがあります。後期成長のEPC(後期-EPCは)文化の2-3週間後に表示されます。これらの細胞は、より速く、ヒト臍帯静脈内皮細胞の単層に組み込まれており、毛細管19を形成することができます。また、いわゆる「早期-EPCは、「このような血管内皮増殖として、血管新生分子を送達を通じてより受動的な方法で、約1週間、行動のための血液中を循環します因子(VEGF)、又はCXCL8 19。冠動脈疾患(CAD)を有する患者は、CAD 20ない対照群と比較して、初期EPCの有意に低い量を示しました。興味深いことに、同じグループは、対照群と比較して、後期EPCのより高い量を示しました。別の研究では、早期のEPCは、パラクリン様式6に酸化条件下でアポトーシスから分化したEPCを保護することが示されました。したがって、初期のEPCは、末梢血中に自動またはパラクリン様式で他の細胞の遊走を通じ、関連する保護効果を提供するかもしれません。
このプロトコルは、最初のヒト末梢血からPBMC画分を単離し、その後、不要な細胞からこの細胞懸濁液をクリアするには、PBMC-画分からCD34 +細胞を単離することにより、早期のEPCを精製する方法を説明しています。 CD34は、ヒト造血幹細胞の単離のために使用されるマーカーであり、9 。その後、CD34 +細胞は、フィブロネクチンでコーティングした組織培養表面上で培養されます。三日後、培地を、それによって全ての非接着細胞を失って、変更されます。最後に、単離されたEPCは、acLDLの取り込みおよび蛍光活性化セルソーティング(FACS)を用いて、内皮細胞マーカーとしてのKDRの存在を確認するために染色されます。追加のマーカーとして、我々はまた、内皮細胞上で起こる血小板内皮細胞接着分子(PECAM-1、CD31)を、分析しました。
EPCの強化動員によって損傷または梗塞心筋組織の修復は、心血管疾患における集中的に調べた治療戦略に属します。しかし、臨床診療への実験結果の翻訳は、様々な病態生理学的状態の間に人間の体内で複雑な細胞相互作用を考えると、まだ困難です。さらに、心筋のI / R傷害は種々のサイトカイン、ホルモンおよび成長FACの過剰分泌を誘発します血管形成13の地域にEPCのホーミングを制御ター、。既に示したように、CXCL8、間質細胞由来因子1α(SDF-1α、CXCL12)は、VEGFおよびマクロファージ遊走阻止因子(MIF)は、有意に心筋のI / R損傷の1以下の血清サンプルにおいて増加しています。これらの要因のうち、MIFは、主に炎症誘発性特性を有する多面的なケモカイン様サイトカインです。その歴史的な名前とは対照的に、MIFは、種々の細胞タイプ1、21、22上の真のケモカインとして作用し、プロ渡り鳥の機能を有しています。 MIF媒介性の細胞動員プロセスは、MIFがに結合し、非同族の方法21で活性化するケモカイン受容体CXCR2及びCXCR4にリンクされています。注目すべきは、EPCはさらに、低酸素条件下で上方調節なるそれらの表面上のこれらの受容体の両方を発現しますお尻= "外部参照"> 23、24。また、蓄積した証拠は、MIFが心臓22、25、26のI / R傷害の間に全体的な心臓保護効果を有することを示唆しています。この文脈においては、さらに、MIFは、損傷した心筋27の制限された回復メカニズムを考慮すると、特に関連性がある低酸素ストレスの間に血管新生をサポートすることができることが示されています。前臨床マウスモデルにおいて前のin vitro試験と実験はEPCを動員4におけるMIFの役割についての最初の証拠を提供しました。注目すべきは、MIFはまた、虚血性サイト28内のEPCの動員中に放出される可能性がEPCの著名な貨物のタンパク質です。しかし、他の(血管新生)血清サイトカインと比較して特に臨床現場での研究は、とらえどころのないまま。
Access restricted. Please log in or start a trial to view this content.
プロトコル
EPCの単離のための血液は、地元の倫理委員会に従ったインフォームドコンセントの後に健康なボランティアから得ました。遊走アッセイで使用される血清試料は、心肺バイパス(CPB)を用いて、従来の心臓手術を受けた患者から得ました。除外基準は、緊急操作、知られているか、または疑われる妊娠、patient`s年齢18歳未満、およびインフォームドコンセントを得るために失敗しました。血清サンプルを、(直ちに手術前と直ちに大動脈クロスクランプの心筋再灌流/開封後)は、臨床ルーチンの測定に加えて描画し、その後、最終的な分析まで-80℃で保存しました。施設内倫理委員会(倫理委員会、アーヘン工科大学)は、この研究を承認しました。患者は68.6年の平均年齢と81.7キロの平均重量を示しました。既存の疾患が含まれる:高血圧(65%)、慢性肺疾患(19%)、余分な心臓動脈疾患(16%)、脳機能障害(6%)、不安定狭心症(10%)、最近の心筋梗塞(90 D内の28%)、慢性腎疾患(14%)、肝疾患(2%)および糖尿病(34%)。
T75フラスコの1コーティング:
- 5 mLのフィブロネクチン溶液をT75フラスコあたり(15 mLの超純水で希釈した1mgのヒトフィブロネクチン)を準備します。
- T75フラスコにソリューションを追加し、水が蒸発するまで待ちます。蒸発による分離プロセスの間に不要な中断を避けるために、事前にこのプロセスを実行する( 例えば、一晩)、室温で。このソリューションは、4.44μgのフィブロネクチン/ cm 2とを与えます。
- 製造業者によって提供成長因子サプリメントと基礎MV2培地を補充することによって、内皮細胞増殖培地MV2を準備します。
60 mLの血液から内皮前駆細胞(EPC)の2単離:
注:CD34陽性選択カクテルAとしてND磁気ビーズは、メーカーが提供するいかなる濃度が存在しない、複合選択キットで市販されています。しかし、抗体の約100μL、5×10 8細胞までの処理のために十分です。磁気ビーズは、水、デキストラン被覆および他の市販のビーズと比較して約5,000x小さい中で希釈されています。詳細については、manufacturer's説明書を参照してください。
- Ca 2+ -Mg 2+フリーPBSで1:(付きまたは抗凝固剤なしで)血1を混ぜます。
- 50mLのチューブあたり密度勾配溶液15mlを加えます。詳細については、manufacturer's説明書を参照してください。
- ゆっくり密度勾配溶液の上に希釈された血液層。
- 緩加速で30分間ブレーキなしで2500×gで遠心分離サンプル。
- 慎重に滅菌プラスチックピペットを用いて、すべてのチューブ( 図1)のバフィーコート層を収集し、別のチューブに入れて。密度勾配液の収集を避けます。予想されるPBMCの収量は約3-4×10 6細胞/ mLの血液です。

図1:フィコールソリューションにBbuffyコートの密度勾配遠心。密度勾配溶液で30分間、2,500×gでの密度勾配遠心分離の結果が示されています。赤血球および顆粒球(赤色)、単核細胞分画(白層)、プラズマ(黄色)、および密度勾配溶液(白っぽい)が示されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- PBSの少なくとも3容量の末梢血単核細胞画分を希釈し、混合します。 200×gで15分間、室温で遠心分離します。
- 二回繰り返しステップ2.6。
- 上清を吸引し、5mL MV2培地で細胞ペレットを再懸濁します。
- 使用軟膜あたり(5×10 8細胞までの処理のために十分な)ヒトCD34抗体の100μLを加え、5%CO 2で37℃で15分間回転させます。
- 使用軟膜あたりデキストラン被覆磁性ビーズの50μLを加え、5%CO 2で37℃で10分間回転させます。
- インキュベーション後、各チューブ内の3ミリリットルの最大でFACSチューブにサスペンションを移します。より多くの量は、磁石と、許容されません。
- 磁石(複数可)にFACSチューブ(複数可)を挿入し、5分間待ちます。
- 磁石のうち、FACSチューブを引っ張ることなく、上清を捨てます。
- 磁石の外側に3 mLのMV2媒体を各FACSチューブ中の細胞を再懸濁します。
- 繰り返し二回2.12から2.14までを繰り返します。
- 磁石のうち、FACSチューブを引き、3 mLのMV2培地で細胞を再懸濁します。
- プレコーティングされたT75 Fに細胞懸濁液を転送しますlasksとは、フラスコ当たり17 mLのMV2媒体を追加します。
注:培地を3日後に変更する必要があります。 1週間後、細胞は紡錘状の構造( 図2)を表示し、使用する準備が整いました。分離の見落としについては、 図3を参照してください。
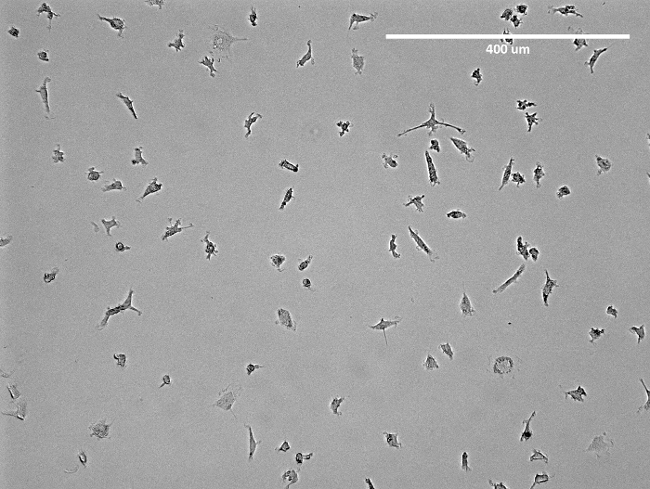
図2:単離されたEPCの顕微鏡画像。剥離する前にT75フラスコ中で単離された初期のEPCの代表画像が示されています。見かけはEPCの紡錘状の構造です。 この図の拡大版をご覧になるにはこちらをクリックしてください。
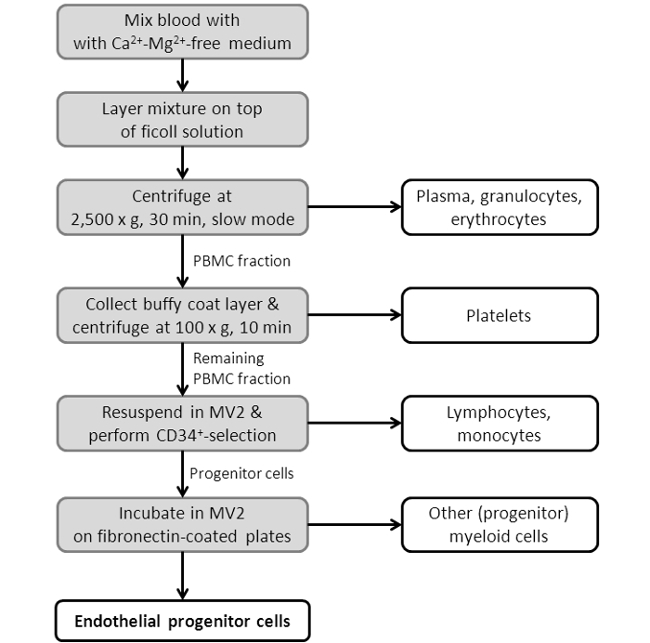
図3:フローはEPC単離手順を示します。スキーム、ショーは描かれていますEPC単離プロトコールの単一ステップをる。より詳細なプロトコルのプロトコルセクションの第2章を参照してください。
3.移動アッセイ
- T75フラスコ中のEPCからメディアを削除します。
- 慎重にそれを揺することによって5mLのPBSで洗浄します。
- PBSを削除し、5 mLの市販の細胞の剥離液を追加します。細胞が分離されるまで待ちます(顕微鏡で確認してください)。慎重にフラスコの底をタップすることで剥離を加速します。
- 細胞が分離されると、すぐにMV2完全培地の5ミリリットルを追加し、別のチューブに細胞懸濁液を転送します。
- 5分間、2000×gで遠心分離します。
- 5分間2000×gで再び5〜10 mLのPBSと遠心で細胞を再懸濁します。
- 繰り返し手順3.6。
- (遊出ウェルあたり75μLで50,000個の細胞が必要とされる)MV2飢えた培地中で細胞ペレットを再懸濁します。
注:必要とされる移行システムは、細胞型およびアッセイに依存します。 diffはあります erentの細孔径とプレートサイズ(ウェルの数)。 EPCを96ウェル方式で5ミクロンの孔サイズが最適です。 - 下部チャンバー( 図4)に:血清サンプルの235μLを(MV2飢えた培地で5血清が1に希釈)を添加することにより、移行プレートを準備します。
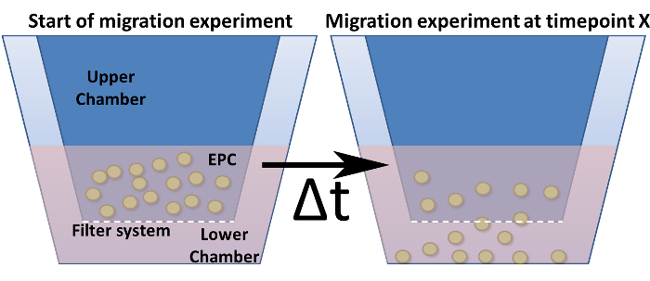
図4:変更されたボイデンチャンバー内遊走アッセイ。修正されたBoydenチャンバーの一般的な設計が示されています。細胞培養インサート(=上部チャンバー)が濃い青色で表示され、下部チャンバーに挿入されています。これらのインサートの底面(ただし、壁)の細孔を含むフィルタシステムを表します。 (a)の時点ゼロでセットアップを表示します。 (b)は選択された時点の後、細胞は、刺激に向かってフィルタを介して移行されます。fig4large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
- 細胞溶液を加える直前にインサートを追加します。
- 上室に細胞溶液を75μL(= 50,000個の細胞)を追加します。
- EPCは、(移動時間は、細胞の種類やシステムに依存)、37℃で3時間、5%CO 2のために移行しましょう。
- 血清自家蛍光アーチファクトを回避するために、半自動化ソフトウェア「ImageJの "を使用して、細胞を顕微鏡下で井戸の写真を撮ることによって遊走した細胞を定量化し、カウントされます。
- 上部チャンバーを取り外します(すべての非遊走細胞を含みます)。
- (:1,000 1に希釈)Hoechst色素を含む、70μLの3.6%パラホルムアルデヒド溶液を追加します。プレートを37℃、5%CO 2で一晩保存することができます。
- 1-2分間、2000×gで同じ焦点平面にすべてのセルを取得するためにすぐにプレートを遠心します。
- ワットあたり5写真を撮ります100X倍率エル( 図5および6)。
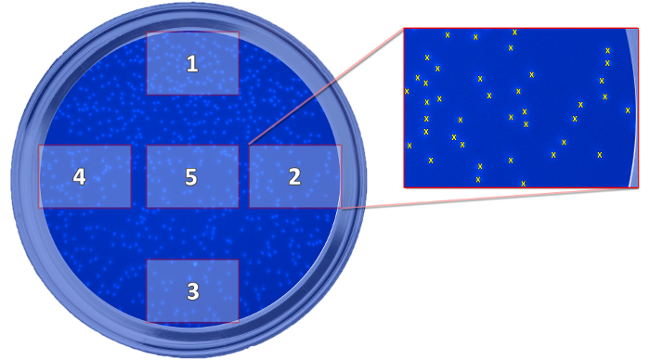
図5:スキームは、撮影した画像の位置を表示しています。スキームは、十分に関連して、移動した細胞の決意に必要とされる5撮影した画像の位置を示します。画像は、細胞をカウントし、すべてのウェルの平均値を計算するために取られます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6:細胞の定量化のための顕微鏡画像。細胞定量のために採取した代表画像が、示されています。細胞を染色し、USIを固定し、3.6%パラホルムアルデヒド中でngのヘキスト染料。ドットは、固定し染色した内皮前駆細胞を表します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 国立衛生研究所によって半自動化ソフトウェア「ImageJの "を使用して移動した細胞を数えます。
Access restricted. Please log in or start a trial to view this content.
結果
単離された内皮前駆細胞のキャラクタリゼーション
まず、acLDLの取り込みが確認されただけでなく、単離された細胞集団の表面上のKDRの発現、およびCD31。 図7aが示すように 、分離されたEPCの85.1パーセントはacLDLの取り込みを示し、CD31を発現しました。両方のマーカーのための負の小さい人口、があ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この研究の最初の部分は、心臓手術患者の血液の総合評価を可能にするために、健康なボランティアの末梢血からのヒトEPCの単離が含まれていました。したがって、密度勾配遠心分離は、血漿、顆粒球及び赤血球からPBMC画分を分離するために行きました。混入した血小板の大部分を除去するには、この細胞画分は短いと低速洗浄は29、30ステップに...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もありません。
謝辞
著者は何の確認応答がありません。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
参考文献
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692(2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502(2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015(2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310(2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206(2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved