Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement de cellules progénitrices endothéliales de volontaires sains et de leur potentiel migratoire Influencé par échantillons de sérum après chirurgie cardiaque
Dans cet article
Résumé
des cellules progénitrices endothéliales (EPCs) sont fondamentalement impliqués dans la néovascularisation des tissus ischémiques. Cette méthode décrit l'isolement de EPCs humains provenant du sang périphérique, ainsi que l'identification de leur potentiel migratoire avec des échantillons de sérum de patients de chirurgie cardiaque.
Résumé
les cellules progénitrices endothéliales (EPC) sont recrutés dans la moelle osseuse dans des conditions pathologiques comme l'hypoxie et sont fondamentalement impliqués dans la néovascularisation des tissus ischémiques. L'origine, la classification et la caractérisation des EPCs sont complexes; nonobstant, deux sous-types importants de EPCs ont été établis: soi-disant «précoce» EPCs (par la suite appelés premiers-EPCs) EPCs et tardive excroissance (fin-EPCs). Ils peuvent être classés par propriétés biologiques, ainsi que par leur apparition au cours de la culture in vitro. Alors que EPCs «précoces» apparaissent en moins d'une semaine après la culture de cellules mononucléaires dérivés du sang périphérique dans les médias communautaires spécifiques, EPCs tardive excroissance se trouvent au bout de 2-3 semaines. EPCs tardive excroissance ont été reconnus pour être directement impliqués dans la néovascularisation, principalement par le biais de leur capacité à se différencier en cellules endothéliales matures, alors que «précoce» EPCs expriment divers facteurs angiogéniques comme endogencargaison ous pour promouvoir l'angiogenèse d'une manière paracrine. Au cours de l'infarctus ischémie / reperfusion (I / R), divers facteurs contrôlent le homing des PEC à des régions de formation des vaisseaux sanguins.
Macrophage facteur inhibiteur de la migration (MIF) est une cytokine pro-inflammatoire et ubiquitaire chimiokine-like et a récemment été décrit pour fonctionner comme régulateur clé de la migration EPCs à des concentrations physiologiques 1. Fait intéressant, le MIF est stocké dans les piscines intracellulaires et peut rapidement être libéré dans la circulation sanguine après plusieurs stimuli (par exemple , infarctus du myocarde).
Ce protocole décrit un procédé pour l'isolement fiable et la culture précoce EPCs à partir de sang périphérique humain adulte basé sur la sélection de cellules CD34-positives à la culture subséquente dans un milieu contenant des facteurs de croissance endothéliaux sur des plaques revêtues de fibronectine pour une utilisation dans des essais in vitro de migration dans contre des échantillons de sérum des patients de chirurgie cardiaque. En outre, lainfluence migratoire de MIF sur la chimiotaxie de EPCs par rapport à d'autres cytokines de l'angiogenèse stimulant bien connu est démontrée.
Introduction
Les cellules progénitrices endothéliales (EPC) circulent dans le sang humain et ont la capacité de se différencier en cellules endothéliales 2. Ils participent à la vasculogenèse et sont capables de minimiser les dommages causés par l' inflammation et l' ischémie / reperfusion (I / R) , les blessures de diverses manières 3, 4. Par exemple, EPCs montrent des niveaux élevés d'enzymes antioxydantes intracellulaires comme la catalase, la glutathion peroxydase ou superoxyde dismutase manganèse (MnSOD) 5. La résistance élevée contre le stress oxydatif permet EPCs de fonctionner dans des micro - environnements avec des espèces élevées réactives de l' oxygène (ROS) après une lésion ischémique 6. Des études antérieures ont également indiqué que le nombre de CPE peut être corrélée à la réparation vasculaire et qu'un nombre réduit de faire circuler EPCs prédit la survenue d'événements cardiovasculaires 7,class = "xref"> 8. Cependant, une définition claire d'un EPC n'a pas encore été trouvé. Jusqu'à présent, il n'y a pas de marqueur de surface cellulaire spécifique ou phénotype cohérent pour EPCs et ces cellules sont très rares dans le sang périphérique 9. Un EPC humain doit être considérée comme une cellule de circulation avec la possibilité de contribuer à la reconstruction de l'endothélium blessé et de nouvelles structures vasculaires.
Une façon d'isoler et de caractériser EPCs est par adhérence à la fibronectine. De ce fait, la capacité de ces cellules est utilisé pour montrer une adhérence supérieure à la fibronectine boîtes revêtues par rapport au collagène de type 1, par exemple 3, 10, 11. Cependant, d' autres ont constaté que le placage des cellules mononucléées sur des boîtes revêtues de fibronectine , sans aucune étape de purification précédente ou encore conduit à des colonies comprenant des cellules progénitrices myéloïdes, les monocytes et les lymphocytes T 12, 13, 14. En outre, dans ce cas, les plaquettes peuvent contaminer les cellules mononucléaires (MNC) et transférer ainsi la fraction des protéines de membrane de plasma de toutes les cellules adhérentes 15.
En plus de la caractérisation par des essais in vitro d'adhérence, une combinaison de différents marqueurs de la surface cellulaire est utilisée pour décrire un type cellulaire considéré comme une CPE. Dans ce cas, après l'adhésion de la fibronectine à médiation, les cellules sont analysées concernant leurs attributs endothéliales-like. Dans ce procédé, les deux marqueurs associés aux cellules endothéliales, acétylée lipoprotéine de basse densité (acLDL) et vasculaire, récepteur du facteur de croissance endothelial 2 (VEGFR-2, KDR), jouent un rôle. On a montré que les cellules et les macrophages endothéliales de prendre spécifiquement en acLDL dans un processus appelé «voie cellulaire au trésor" 16. Une autre protéine marqueur est KDR comme le principal récepteur du VEGF sur endothéliale17 cellules. Cependant, comme EPCs en général sont cultivées dans un milieu supplémenté en facteurs de croissance endothéliaux et sérum de veau foetal, il est possible que les macrophages, qui aurait également pu être à tort, isolé, présentent un profil de marqueur endothélial-like. Comme on le voit plus haut, si cultivées dans un milieu conditionné endothéliale, les macrophages expriment des protéines «spécifiques» 18 endotheliales.
En général, il existe deux catégories de EPCs au sein de plusieurs sous - types, qui peuvent être trouvés dans le sang ou être cultivées in vitro. EPCs Late-excroissance (fin-EPCs) apparaissent après 2-3 semaines de culture. Ces cellules sont intégrées plus rapidement dans une monocouche de cellules endothéliales de la veine ombilicale humaine et peuvent former des tubes capillaires 19. D'ailleurs, soi-disant «début-EPCs" circuler dans le sang pendant environ une semaine et d'agir d'une manière plus passive grâce à la prestation des molécules angiogéniques, comme la croissance de l'endothélium vasculairefactor (VEGF), ou 19 CXCL8. Les patients atteints de maladie coronarienne (CAD) ont montré des quantités significativement plus faibles des premiers-EPCs par rapport à un groupe témoin sans 20 CAD. Fait intéressant, le même groupe a montré des quantités élevées de fin des EPCs par rapport à un groupe témoin. Une autre étude a montré que les premiers-EPCs protéger EPCs différenciées de l' apoptose dans des conditions oxydantes de manière paracrine 6. Par conséquent, les premiers EPCs peuvent fournir des effets protecteurs appropriés par le biais de la migration des autres cellules d'une façon automatique ou paracrine au sein du sang périphérique.
Ce protocole décrit un procédé pour purifier du début des EPCs en isolant d' abord la fraction de PBMC à partir de sang périphérique humain et on isole ensuite les cellules CD34 + à partir de la fraction de PBMC pour effacer cette suspension cellulaire à partir de cellules non désirées. CD34 est un marqueur qui est utilisé pour l'isolement de cellules souches hématopoïétiques humaines 9 . Par la suite, les cellules CD34 + sont cultivées sur des surfaces de culture de tissu revêtu de fibronectine. Au bout de trois jours, le milieu est changé, perdant ainsi toutes les cellules non-adhérentes. Enfin, EPCs isolées sont colorées pour vérifier l'absorption de acLDL et la présence de KDR comme marqueur des cellules endotheliales en utilisant des cellules activées par fluorescence (FACS). En tant que marqueur supplémentaire, nous avons analysé la molécule endothéliale plaquettaire d'adhésion cellulaire (PECAM-1, CD31), qui se produit également sur les cellules endothéliales.
Restauration du tissu myocardique endommagé ou infarci par un renforcement de recrutement de EPCs fait partie des stratégies de traitement intensivement étudiés dans les maladies cardiovasculaires. Cependant, la traduction des résultats expérimentaux dans la pratique clinique est toujours difficile, compte tenu de l'interaction cellulaire complexe dans le corps humain au cours de diverses conditions physiopathologiques. En outre, le I myocardique / R blessures déclenchent une sécrétion excessive de diverses cytokines, des hormones de croissance et fac teurs, qui contrôlent la tête chercheuse de EPCs à des régions de formation de vaisseaux sanguins 13. Comme cela a déjà montré, CXCL8, 1α facteur dérivé des cellules stromales (SDF-1α, CXCL12), le VEGF et la migration des macrophages facteur d'inhibition (CMI) est significativement augmenté dans les échantillons de sérum après un infarctus du I / R 1 blessure. Parmi ces facteurs, le MIF est une cytokine de chimiokines comme pléiotropique ayant des caractéristiques principalement pro-inflammatoires. Contrairement à son nom historique, MIF a des fonctions pro-migratoires, agissant comme un véritable chimiokine sur les différents types de cellules 1, 21, 22. Les processus de recrutement cellulaire à médiation par du MIF ont été liés aux récepteurs de chimiokine CXCR4 et CXCR2, qui se lie au MIF et active d'une manière non 21 apparenté. Il faut noter que EPCs expriment à la fois de ces récepteurs sur leur surface, qui deviennent de plus régulée à la hausse dans des conditions hypoxiquesass = "xref"> 23, 24. En outre, accumulation de preuves suggère que MIF a un effet global de cardio-protecteur pendant I R blessures / du cœur 22, 25, 26. Dans ce contexte, il a été en outre montré que MIF peut soutenir la néovascularisation au cours du stress hypoxique qui est particulièrement pertinent, lors de l' examen des mécanismes de récupération limités du myocarde blessé 27. Des études antérieures in vitro et des expériences dans des modèles de souris pré-cliniques fournis première preuve sur le rôle de MIF dans EPCs recrutement 4. À noter, le MIF est également une protéine de cargaison importante de EPCs qui peut être libéré lors du recrutement EPCs dans les sites ischémiques 28. Cependant, les études en milieu clinique, en particulier par rapport aux autres (angiogéniques) cytokines sériques demeurent insaisissables.
Protocole
Du sang pour l'isolement des EPCs a été obtenu à partir de volontaires sains après consentement éclairé en conformité avec le comité d'éthique local. Des échantillons de sérum utilisés dans les tests de migration ont été obtenus chez des patients ayant subi une chirurgie cardiaque classique avec l'utilisation d'un pontage cardio-pulmonaire (CPB). Les critères d'exclusion étaient les opérations d'urgence, la grossesse connue ou soupçonnée, patient`s âge de moins de 18 ans, et l'impossibilité d'obtenir un consentement éclairé. Des échantillons de sérum ont été tirées en plus des mesures de routine clinique (immédiatement avant l'intervention chirurgicale et immédiatement après la reperfusion myocardique / ouverture de l'aorte clampage) et ensuite stockés à -80 ° C jusqu'à l'analyse finale. Le comité d'examen institutionnel (Comité d'éthique, Université RWTH Aachen) a approuvé cette étude. Les patients ont un âge moyen de 68,6 ans et un poids moyen de 81,7 kg. Maladies préexistantes incluses: hypertension (65%), la maladie pulmonaire chronique (19%), artériopathie cardiaque supplémentaire (16%), d'un dysfonctionnement cérébral (6%), de l'angine de poitrine instable (3%), de l'infarctus du myocarde récent (28% dans les 90 d), une maladie rénale chronique (14%), les maladies du foie (2%) et le diabète (34%).
1. Revêtement de T75 Flask:
- Préparer la solution de fibronectine 5 ml (1 mg de fibronectine humaine dilué dans 15 mL d'eau ultrapure) par flacon T75.
- Ajouter la solution à un flacon T75 et attendre jusqu'à ce que l'eau soit évaporée. Pour éviter les interruptions inutiles au cours du processus d'isolement en raison de l'évaporation, effectuer ce processus à l' avance (par exemple la nuit) et à la température ambiante. Cette solution donne 4,44 pg fibronectine / cm 2.
- Préparer la croissance de cellules endotheliales milieu MV2 en complétant le milieu de base MV2 avec les suppléments de facteurs de croissance fournies par le fabricant.
2. Isolement des cellules progénitrices endothéliales (EPC) à partir de 60 ml de sang:
NOTE: Comme le CD34-positif sélection cocktail unnd les billes magnétiques sont disponibles dans le commerce dans un kit de sélection combinée, il n'y a pas de concentration fournies par le fabricant. Cependant, environ 100 ul de l'anticorps sont suffisants pour traiter jusqu'à 5 x 10 8 cellules. Les billes magnétiques sont dilués dans de l'eau, le dextran-enduit et environ 5000 x plus petit par rapport aux autres perles disponibles dans le commerce. Pour plus d'informations, voir les instructions Référence rechange.
- Mélanger le sang (avec ou sans anticoagulants) 1: 1 avec Ca 2+ Mg 2+ -free PBS.
- Ajouter 15 ml de solution à gradient de densité par 50 ml tube. Pour plus d'informations, voir les instructions Référence rechange.
- couche lentement le sang dilué au-dessus de la solution de gradient de densité.
- Centrifuger les échantillons à 2500 xg pendant 30 min avec une accélération lente et sans freinage.
- Recueillir soigneusement la couche leucocytaire de chaque tube (Figure 1) à l' aide d' une pipette en plastique stérile et le mettre dans un autre tube.Éviter la collecte de la solution de gradient de densité. Le rendement PBMC attendu est d' environ 3-4 x 10 6 cellules / mL de sang.

Figure 1: gradient de densité Centrifugation de Coat Bbuffy sur Ficoll Solution. On a représenté le résultat de la centrifugation en gradient de densité à 2 500 g pendant 30 minutes sur de la solution de gradient de densité. Sont représentés les erythrocytes et les granulocytes (rouge), la fraction de cellules mononucléaires (couche blanche), le plasma (jaune) et la solution de gradient de densité (blanchâtre). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Diluer la fraction de cellules mononucléaires du sang périphérique avec au moins 3 volumes de PBS et mélanger. Centrifuger à température ambiante pendant 15 min à 200 x g.
- Répétez l'étape 2.6 à deux reprises.
- Aspirer le surnageant et remettre le culot cellulaire dans 5 milieu MV2 mL.
- Ajouter 100 ul d'anticorps anti-CD34 humain (suffisant pour traiter jusqu'à 5 x 10 8 cellules) par la couche leucocytaire et utilisé en rotation pendant 15 min à 37 ° C avec 5% de CO 2.
- Ajouter 50 ul de billes magnétiques revêtues de dextrane par la couche leucocytaire et utilisé en rotation pendant 10 min à 37 ° C avec 5% de CO 2.
- Après incubation, transférer la suspension dans des tubes FACS avec un maximum de 3 ml dans chaque tube. Des quantités plus élevées ne seront pas admissibles à l'aimant.
- Insérer le tube (s) FACS dans l'aimant (s) et attendre 5 min.
- Rejeter le surnageant sans tirer les tubes FACS sur l'aimant.
- Resuspendre les cellules dans chaque tube FACS avec 3 milieu MV2 mL à l'extérieur de l'aimant.
- Répétez les étapes deux fois de 2,12 à 2,14.
- Tirer les tubes FACS sur des aimants et remettre les cellules en 3 milieu MV2 mL.
- Transférer la suspension cellulaire dans pré-enduit T75 flasks et ajouter 17 mL MV2 moyen par flacon.
NOTE: Le milieu doit être changé au bout de 3 jours. Après une semaine, les cellules montrent des structures de broche-like (figure 2) et sont prêts à utiliser. Pour un belvédère de l'isolement voir la figure 3.
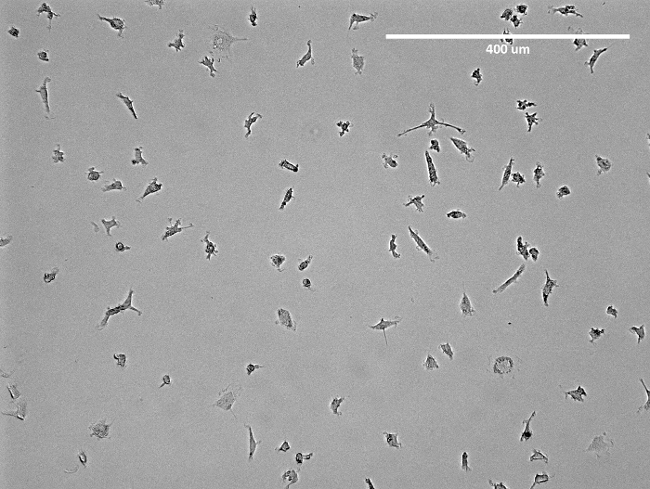
Figure 2: Image microscopique des EPCs isolés. Montré est une image représentative de isolé précoce EPCs dans un flacon T75 avant détachement. Apparent est la structure de broche-like de l'EPC. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
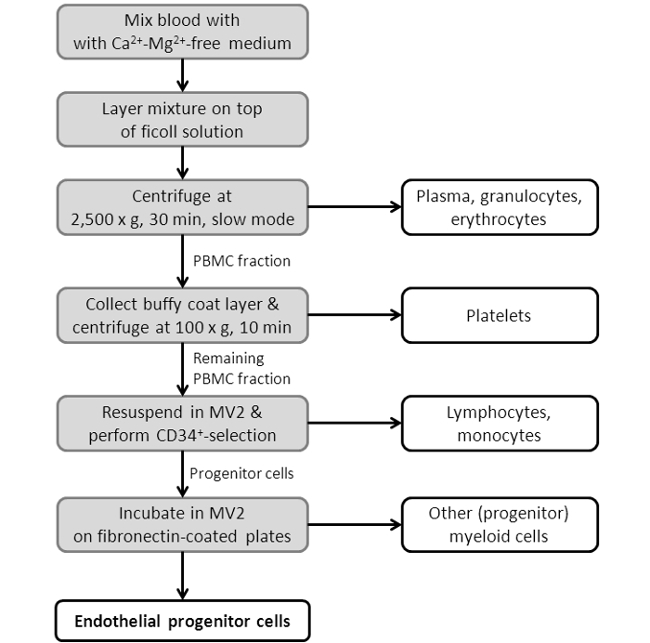
Figure 3: Organigramme Afficher la procédure EPC d'isolement. Représenté est un schéma, spectaclement les étapes individuelles du protocole d'isolement de l'EPC. Pour un protocole plus détaillée, voir la section 2 de la section de protocole.
3. Migration Assay
- Éliminer le milieu de EPCs dans le flacon T75.
- Laver avec 5 ml de PBS en agitant soigneusement.
- Retirer PBS et ajouter ml solution à 5 détachement cellulaire commercial. Attendez jusqu'à ce que les cellules sont détachées (vérifier sous un microscope). Accélérer le détachement en tapant soigneusement le fond du flacon.
- Lorsque les cellules sont décollées, ajouter rapidement 5 ml de milieu complet et MV2 transférer la suspension de cellules dans un autre tube.
- Centrifuger à 2000 xg pendant 5 min.
- Remettre en suspension les cellules dans du PBS et 5 à 10 ml centrifuge à nouveau à 2000 g pendant 5 min.
- Répétez l'étape 3.6.
- Remettre en suspension le culot cellulaire dans MV2 milieu affamé (50.000 cellules dans 75 ul par transmigration bien sont nécessaires).
REMARQUE: Quel système de migration est nécessaire dépend du type de cellule et le dosage. Il existe diff diamètres érents des pores et des tailles de plaques (nombre de puits). Pour EPCs une taille de pores de 5 um de 96 puits système est optimal. - Préparer la plaque de migration en ajoutant 235 pi de l'échantillon de sérum (sérum dilué 1: 5 dans MV2 de milieu affamé) dans la chambre inférieure (figure 4).
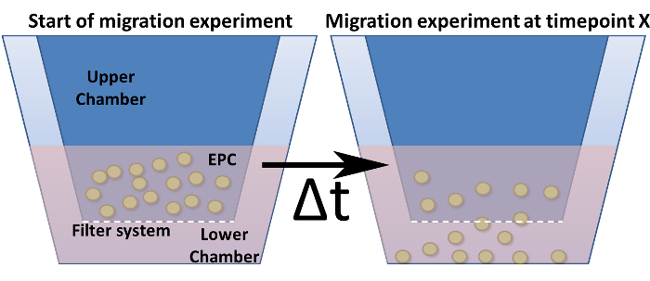
Figure 4: Migration Assay dans une chambre de Boyden modifiée. Montré est la conception générale d'une chambre de Boyden modifiée. Les inserts de culture cellulaire (= chambre haute) sont indiqués en bleu foncé et sont insérés dans la chambre inférieure. Le fond (mais pas les murs) de ces inserts représente le système de filtre comprenant des pores. (A) Affiche la configuration au point zéro de temps. (B) Après un point de temps choisi, les cellules sont migrés à travers le filtre vers un stimulus.fig4large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Ajouter l'insert, peu avant l'ajout de la solution de la cellule.
- Ajouter 75 ul de la solution de cellules (= 50.000 cellules) dans la chambre supérieure.
- Laissez le EPCs migrer pendant 3 heures à 37 ° C et 5% de CO 2 (temps de migration dépend du type et du système cellulaire).
- Pour éviter sérum artefacts auto-fluorescence, de quantifier les cellules migrées en prenant des photos du puits sous un microscope et compter les cellules en utilisant le logiciel semi-automatisé "ImageJ".
- Retirer la chambre supérieure (contenant toutes les cellules non-migrés).
- Ajouter 70 uL solution de paraformaldéhyde de 3,6%, y compris le colorant Hoechst (dilué 1: 1000). La plaque peut être conservée à 37 ° C et 5% de CO 2 pendant une nuit.
- Centrifuger la plaque peu pour obtenir toutes les cellules dans le même plan focal à 2000 xg pendant 1-2 min.
- Prendre 5 photos par wEll (figures 5 et 6) avec un grossissement de 100x.
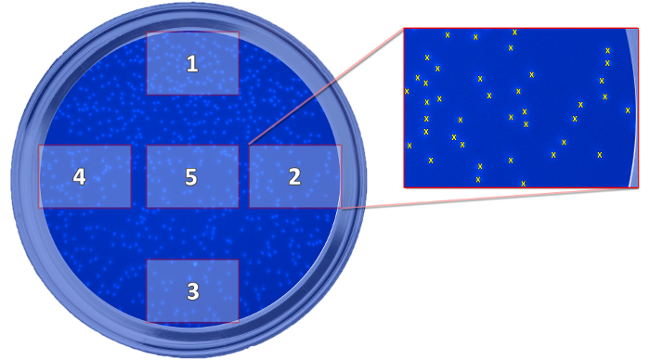
Figure 5: Schéma montrant la position des images prises. Le schéma représente la position des cinq images prises, qui sont nécessaires pour la détermination de cellules ayant migré par rapport au puits. Les photos sont prises pour compter les cellules et calculer une valeur moyenne pour chaque bien. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6: Image microscopique pour la cellule Quantification. Montré est une image représentative, qui a été prise pour la quantification des cellules. Les cellules ont été colorées et fixées using Hoechst colorant dans 3,6% de paraformaldehyde. Les points représentent fixées et colorées des cellules progénitrices endothéliales. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Compter les cellules migrées en utilisant le logiciel semi-automatisé "ImageJ" par l'Institut national de la santé.
Résultats
Caractérisation des cellules progénitrices endothéliales isolées
Tout d'abord, l'absorption de acLDL a été vérifiée, ainsi que l'expression de KDR, et CD31 sur la surface de la population cellulaire isolée. Comme la figure 7a montre, 85,1% des EPCs isolés a montré une absorption de acLDL et exprimé CD31. Les figures 7b et 7c montrent en outre une répartit...
Discussion
La première partie de cette étude a porté sur l'isolement des EPCs humains du sang périphérique de volontaires sains afin de permettre une évaluation complète du sang de patients de chirurgie cardiaque. Par conséquent, une centrifugation à gradient de densité a été effectuée pour séparer la fraction de PBMC à partir du plasma, des granulocytes et des globules rouges. Pour supprimer la plupart des plaquettes contaminantes, cette fraction cellulaire a été soumis à court et à laver lente étapes
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs ont pas accusés de réception.
matériels
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Références
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon