需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
量化睡眠小鼠的光谱功率和心率的慢速动力学
摘要
在这里,我们提出实验和分析程序来描述小鼠非REM睡眠的神经和心脏变量的时间动力学,其调节对声学刺激的睡眠反应性。
摘要
三个警戒状态主导哺乳动物生命:觉醒,非快速眼动(非REM)睡眠和REM睡眠。随着更多的神经行为相关性在自由移动的动物中被识别,这种三重细分变得太简单了。在觉醒期间,全球和局部皮质活动的整体以及外周参数,如瞳孔直径和交感神经平衡,定义了不同程度的唤醒。睡眠还形成大脑状态的连续体的程度尚不清楚,其中对感觉刺激和兴奋性的恢复力以及可能的其他睡眠功能的程度逐渐变化,以及外周生理状态如何共同变化。研究推进睡眠中监测多个参数的方法以及归因于这些功能属性的星座,是将我们对睡眠理解作为一个多功能过程的核心,在此过程中许多有益效果必须由executed。识别表征睡眠状态的新颖参数将为睡眠障碍中的新型诊断途径开辟机会。
我们提出了一种通过使用标准多导睡眠记录技术组合监测和分析脑电图(EEG)/电皮质图(ECoG),肌电图(EMG)和心电图(ECG))信号来描述小鼠非REM睡眠状态的动态变化的过程。使用这种方法,我们发现小鼠非REM睡眠被组织成协调的神经和心脏振荡的周期,其产生对外部刺激的高和低脆性的连续的25-s间隔。因此,中枢神经系统和自主神经系统被协调以在整合的非REM睡眠期间形成行为上独特的睡眠状态。我们提供多导睡眠图( 即 EEG / EMG结合ECG)监测的手术操作,以便在自由睡觉的小鼠中跟踪这些周期,对量化分析他们的动力学和声学刺激方案来评估他们在醒来的可能性中的作用。我们的方法已经扩展到人类的睡眠,并承诺解除哺乳动物非REM睡眠状态的共同组织原则。
引言
哺乳动物睡眠是一种行为休息状态,对环境的刺激有弹性。尽管这种明显的均匀性,多导睡眠图和自主神经参数表明睡眠在不同的时间和空间尺度上在定性和定量不同的神经和体细胞状态之间移动1 。超过几分钟到几十分钟,就会发生非REM和REM睡眠之间的切换。非REM睡眠伴随着EEG中的大振幅,低频活动,频谱峰值约为0.5-4Hz,而REM睡眠在θ波段(6-10Hz)中显示出常规的EEG活性,连同肌肉atonia 2 。在非REM睡眠中,人类通过光(S2)和深度慢波睡眠(SWS)循环。作为它们的命名表明,这两个阶段显示较低和较高分别觉醒阈值3, 图4,以及它们在低frequ的密度主要区别en皮质脑电图,称为慢波活动(SWA; 0.75-4Hz)。非均匀性仍然存在整个上minute-子第二时间表S2和SWS的个别发作,如广泛地SWA超过一个回合5,6的过程中可变存在的记载,但也通过EEG和场电位的节奏在更高的频率,包括在所述Σ带(10-15赫兹)和γ节律主轴波(80 - 120赫兹)(对于综述,参见图7,8,9,10)。
这些变化并不是微妙的,而是将人类的睡眠皮质状态转移到光谱的极端。对于非REM睡眠,这些范围从SWA的优势到类似于唤醒状态的状态,因为它们包含相当大比例的高频分量11 , 12 。在啮齿动物和猫中,虽然非REM睡眠不再分为阶段,但在REM睡眠发作之前出现称为中间睡眠(IS)的简短时期13 。期间,REM睡眠功能,如海马THETA活性和脑桥geniculo枕波发起,而非REM睡眠签名,如主轴波和SWA,仍然存在,这表明在两个睡眠之间的混合状态14,15。然而,IS可以在功能上是不同的,因为它由抗抑郁药16调节并且通过在之前的醒来期间17中的新颖的对象呈现,并且它有助于设定觉醒阈值18 。此外,自由移动的大鼠的EEG和EMG参数的状态空间图显示了在非REM睡眠,REM睡眠和觉醒之间连续的点14的簇。也有在SWA零星下降,没有一个统一的非REM睡眠周期14,19,20期间进入清醒状态或REM睡眠,这导致在低和高频率成分的相对存在的大幅度波动。最后,非REM睡眠期间SWA和更高频率节律的可变比例不仅发生在时间上,而且还显示皮质区域之间的振幅和同步区域的区域19 。
哺乳动物非REM睡眠远远不统一。然而,这种不均匀性是否导致功能和行为属性不同的状态不清楚。在几种类型的睡眠障碍中,连续睡眠被自发觉醒和不适当的运动行为所破坏。此外,频谱分析显示EEG 21中较高频率的相对存在的变化以及自主神经参数,如呼吸频率和心脏跳动22 。因此,稳定睡眠状态的有序序列受到干扰,皮质和/或自主神经元的元素以不受控制的方式侵入。因此,了解睡眠状态的连续性与疾病有关。此外,城市环境中的环境噪声引起的睡眠扰动与一般健康风险有关,使得识别睡眠中脆弱性增加的时刻至关重要23 。
睡眠人群中的行为觉醒实验表明,从SWA主导的非REM睡眠(S3期)醒来是最难的,而轻度非REM睡眠(S2期)和REM睡眠显示可比较和较低的唤醒阈值4 。短声刺激的皮层处理在REM睡眠S2和S3 24之间变化很大,25 ,表明状态特异性皮质活动模式调节感觉处理的第一阶段。用于人类非REM睡眠,倾向唤醒响应于噪声与主轴波和α节奏在EEG 26,27,28的存在而变化。心轴中的皮质心律失常伴随着丘脑和皮质水平的增强的突触抑制,这被认为有助于感觉加工的衰减7 。
时间上如何组织抗噪声和易受伤害的时期,它们的决定因素是什么?在小鼠和人类中,我们最近在神经节律中确定了一个低速,0.02Hz的振荡。根据这种0.02Hz振荡的相位,小鼠对外部刺激显示出可变的反应性,可以唤醒或睡眠gh的噪音。有趣的是,这种振荡与心跳的速度相关,表明自主神经系统参与调节睡眠对外部刺激的脆弱性1 。记忆相关的海马节律也被组织在这个节奏之内,最令人惊奇的是,其力量与人类记忆巩固的质量相关。因此,0.02Hz振荡似乎是啮齿动物和人类非REM睡眠的组织原理,其调节对环境的敏感性和内部记忆处理。这再次强调需要多参数和持续评估睡眠状态以识别其功能并识别潜在漏洞的位置。
在这里,我们提出一个提取这些动态波形的程序,包括用于组合EEG / ECoG和EMG-ECG测量的小鼠的手术植入,暴露于感觉刺激,and分析程序。该过程提供了将睡眠视为连续变化但高度组织的警惕状态的基础,在此期间依次执行不同的基本睡眠功能。更一般来说,该程序适用于旨在在睡眠期间在健康和疾病状态下提取行为结果之前的光谱和自主特征的方法。
研究方案
所有的实验程序都是根据洛桑大学动物保护委员会和沃尔沃广播电台服务机构进行的。
EEG / EMG-ECG记录手术
- 动物住房和选择。
- 在12:12-h黑暗/光照循环中,单独放置动物(C57Bl / 6J,7- 9周,25-30g),并在标准条件(40%湿度,22℃))下用食物和水随意提供 。
- 仅使用男性受试者避免激素周期对睡眠的所有影响。
- 电极的制备
- 使用约0.5cm长的金丝(75%Au,13%Ag,12%Cu;直径:0.2mm)构建EEG / ECoG电极(在步骤1.3.11中使用),每个焊接在金的顶部镀银钢螺钉(3毫米的长度,直径在基部1.1毫米;参见FIGURe 1)。每只动物准备2个EEG电极,并在70%乙醇中清洗。
- 准备3 - 4厘米长的金线(75%Au,13%Ag,12%Cu;直径:0.2毫米)的EMG-ECG电极。将电线从一端弯曲90°角1厘米,并在另一端准备一个线圈(1-2毫米ø)( 图1 )。在两端之间弯曲导线以产生对应于小脑和λ之间骨骼表面轮廓的小曲率。
- 每只动物准备2个EMG-ECG电极。
- 准备一个6通道母头对头连接器(光栅:2.54 mm x 2.54 mm,尺寸:5 mm x 8 mm x 9 mm,针脚尺寸:5 mm; 见图1 )。
- 用胶带将两个母针和母针的底座上的连接器盖住。
- 在6个公针中的4个尖端添加少量焊丝,以帮助手术中EEG和EMG-ECG电极的焊接(见步骤1.3.16)。
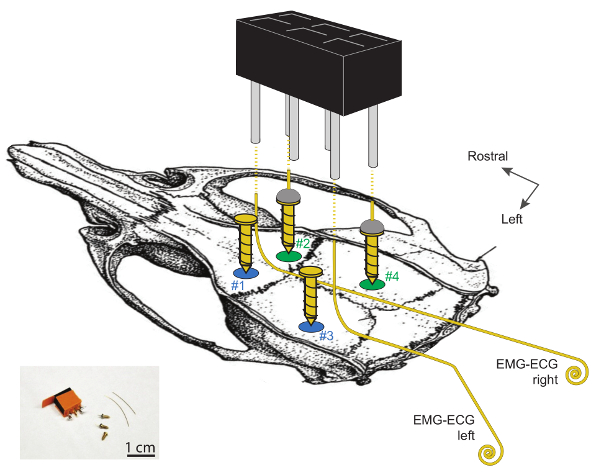
图1 。 EEG和EMG电极植入在鼠标头骨上的示意图显示。
颅骨切开术#1和#2位于中线侧面〜2毫米的侧面,〜2毫米的鼻子到腋窝。颅骨切开术#3和#4位于〜2毫米的鼻子到λ,并分别为中线的4和2毫米。通过将金线焊接到镀金钢螺丝(#2和#4)的顶部制成的两个EEG电极位于右半球。 2把左螺丝(#1和#3)用作支撑。请注意,EMG-ECG电极不应与这两个支撑螺丝接触。 EMG-ECG电极是3 - 4厘米长的金线,在其头端部以1厘米角度以90度角弯曲,并在尾端卷绕(1-2毫米ø)。 2 EEG和2 EMG电极通过将一根导线焊接到一个角销上连接到2 x 3通道头连接器,如虚线所示。可以找到关于这些电极及其植入的更多详细信息 在29 。 请点击此处查看此图的较大版本。
- 植入手术。
- 麻醉动物在异氟烷诱导室(4 - 5%异氟烷+ O 2在1 - 2 L / min,历经3 - 4分钟)。在立体定向固定之前,从室中取出小鼠时,腹膜内(ip)注射5μg/ g卡洛芬。
- 按照标准程序将鼠标固定在立体定位设备上。通过防毒面具维持异氟烷麻醉(3%异氟烷+ O 2以1L / min固定)。在37°C的使用范围内保持整个手术的体温ga加热垫。
- 用维生素A软膏保护眼睛免受干燥。通过测试爪子撤回反射来检查动物的手术容忍程度。
- 通过定位与他们的钝颅骨耳棒固定头部,相反的结束,而不是他们的秘诀(不进入耳道)29。将嘴巴定位(照常)以确保头部的水平度。
注意:固定最小化对耳朵的损伤,这对于声音唤醒实验很重要(参见本程序的第4部分)。 - 监测动物的呼吸过程中,应保持在2-3次呼吸/ 2秒。如有必要,调整气体分配器中的异氟烷浓度;手术期间应逐渐减少,固定期间3%至手术结束时的1.0〜1.5%。
- 每小时用一个超细的绝缘注入100μL的0.9%NaCl ipn注射器保持动物水合。
- 确保动物的头部被明亮的光源照亮。
- 用70%乙醇和碘消毒剂清洁该区域(湿毛防止毛发进入外科窗口)。
- 用Adson镊子将颅骨中心的皮肤提起,然后用细剪刀轻轻的将颈部的上部,从颈部的顶部到眼睛的中线,将皮肤的抬起部分轻轻地切开。取出头皮(约1厘米前后,约0.5厘米至0.8厘米)。
- 确保窗户足够大(朝向两侧),以清楚地看到胭脂红色和lambda裂。用牛头犬serfinines修复两侧的皮肤,以确保进入骨骼。
- 通过用手术刀仔细划伤去除结膜组织(骨膜)。用碘消毒剂清洁该区域,并用防腐拭子干燥颅骨。
- 使用锋利的手术刀刀片(15号),划伤s以获得清洁和软化的骨表面。仅使用手术刀尖,划伤网格网格,槽之间距离为1-2mm。
注意:在步骤1.3.15,这改善了双组分环氧树胶与头骨的连接。 - 使用1/005钻头的微型钻头在特定位置的头骨中执行4个开颅手术(约0.7 mmø)( 图1 ;也见步骤1.3.11.3)。使用巴斯德吸管吹掉骨灰,并用防腐拭子清洁任何出血。
- 如果发生出血,请确保在恢复过程之前完全停止。使用止血海绵加速止血。
- 使用右半球的两个开颅手术插入螺丝电极(开颅手术#2和#4)。
- 使用左半球的两个开颅手术插入固定植入物的固定螺钉(开颅手术#1和#3)。
注意:增加se稳定性,多达4个锚定螺丝已被使用29 。
注意:精确的立体坐标是:距离两个半球的中线距离2mm,距离腋窝(颅骨切开术#1和#2)2毫米,距离λ的2毫米和中线左侧4毫米(开颅手术3号)距离λ的2毫米辐射线和从中线(开颅#4)侧向右侧2mm。参见图1 。
- 在左半球,通过开颅手术器将两个镀金的螺丝拧上来支撑。
- 将螺钉固定在止血钳中,并将其垂直地保持在开颅手术的上方。仔细接近开颅顶部螺钉的底部。在不偏离垂直位置的情况下旋转。
注意:只有1.5转就足以获得良好的机械稳定性和高质量的信号,同时使下层组织25的压力最小化。 - 在右边,拧上前通过开颅手术,制备极好的电极(如步骤1.2.1。所述)。
- 将螺钉固定在止血钳中,并将其垂直地保持在开颅手术的上方。仔细接近开颅顶部螺钉的底部。在不偏离垂直位置的情况下旋转。
- 在镊子的帮助下,小心地从颈部肌肉提起皮肤的边界。插入EMG-ECG电线,线圈末端在肌肉内(左和右)。将中间部分粘贴到颅骨,使得左侧EMG-ECG出现在左后锚定螺钉旁边,而右EMG-ECG位于左前固定螺钉旁边。
- 要在睡眠期间从心脏检测ECG信号,请确保将EMG-ECG电线插入到肌肉中至0.8-1厘米的深度,使其环路尽可能远离彼此。
- 使用双组分环氧胶覆盖的刮刀将胶水施加到螺钉之间和周围的颅骨上。让它在光线下干燥,但保护动物的眼睛免受过度的闪电。
注意:必须覆盖螺丝的基部,只有导线可以接近,出现胶水。 - 确保胶水填充从表面延伸的两个EMG-ECG电极之间的空间,使得它们与支撑螺钉之间没有电接触。谨慎小心不要将皮肤粘到头骨上;皮肤应该保持自由地在胶水周围移动。
- 切割EEG和EMG-ECG电线,使其从胶水中达到约0.5毫米。焊接在步骤1.2.3中准备的连接器角落处的四个引脚。到胶水出现的四根线( 图1 )。
- 尝试将连接器针脚尽可能靠近以最小化植入物的高度;使用连接到立体定向保持器上的小鳄鱼夹,其保持连接器的位置。最小化与焊接头接触的时间,因为这会快速加热螺丝。
- 用牙科水泥填充胶水和连接器之间的空间以覆盖焊接部件。创建smoo并避免可能伤害动物的尖锐边缘。此外,避免接触皮肤,因为这会导致瘙痒。
- 删除牛头犬serfinines。如果需要,使用连接器前后的无菌缝合线(可吸收缝合纤维)封闭伤口,创建简单的中断封闭图案和两个方形结(5-0 FS-3针,45厘米长丝)。
- 监视动物直至完全清醒。在手术后称重动物,并将其返回其家笼以恢复。
- 术后护理和与系统的连接。
- 每天监视动物一周。寻找体重减轻,活动减少或异常以及感染迹象。遵循兽医当局制定的评分程序。
- 手术后5-6天,将记录电缆连接到动物的头部连接器上,将其留在家中的笼子里。在开车前再等待4 - 5天叮叮ing。。。。。。。。。。。。。。。。
EEG / EMG-ECG数据的基本评分用于警惕状态测定
- 用商业多导睡眠记录软件( 例如, Somnologica,SleepSign或Sirenia)在48小时内记录EEG和EMG-ECG数据。使用典型设置,如2,000倍增益;采集时采用2000 Hz的采样率,采集后下降为200 Hz;和用于EEG的0.7 Hz高通滤波器和用于EMG-ECG的10 Hz高通滤波器。
- 以".edf"文件格式导出数据。
- 使用自定义( 例如,在Matlab中)打开".edf"文件,该软件将每4秒的时期半自动分类为清醒,非REM睡眠,REM睡眠和相应的人工制品。
注意:或者,有几个半自动评分软件可用。此过程描述了设置评分时必须完成的一些基本步骤这里使用的评分软件;其他半自动评分系统可能基于其他参数。 - 使用该软件,将".edf"文件分成4次12小时的录音。
- 删除从存在于所述EEG信号或从无法分配的行为状态1,29 EMG -ECG活动出现伪影。
- 分别计算来自EEG和EMG-ECG踪迹的记录的12小时内的绝对EEG(EEG 平均值 )和EMG(EMG 平均值 )的平均值。
- 确定每个4-s纪元(EEG Epoch / EMG Epoch )的平均EEG / EMG值。
- 当EEG Epoch > EEG 均值和EMG Epoch 均值时,EEG Epoch 均值和EMG Epoch > EMG 意义和"非REM睡眠"时,划分为"唤醒" 。
- 分类不是的时代使用基于前面和后续历元的校正算法来确定这些标准。
- 当EEG Epoch 均值和EMG Epoch 均值时,将时期划分为REM睡眠。
- 优化关键点,如非REM睡眠过渡到唤醒,REM睡眠时期,以及非REM睡眠期间的微觉醒。目测打分,以确保适当的警惕状态确定29,30。
注意:始终执行最终目视检查和验证评分。
3.脑电图和心跳的慢速振荡分析
- 对于此分析,仅选择持续≥96秒的非REM睡眠开始( 即至少24个时期4秒); 见图2 。
注意:可根据要求提供定制的例程1 。

图2 。在非干扰非REM睡眠期间确定Sigma功率动力学。
( A )在一只小鼠的轻相的前100分钟期间,顶部,EEG(黑色)和EMG-ECG(灰色)迹线。警惕状态由原始痕迹顶部的彩色条指示。连续(> 96秒)非REM睡眠回合的中间典型示例。底部,随机选择,16秒的间隔,说明细分为4-s的时期。分析的以下步骤只显示了这四个时期,但它对于回合中包含的每个时期都是有效的。 ( B )顶部,从A的底部面板中所示的4-s纪元产生的四个连续的FFT。西带(10-15Hz)以红色阴影。右上角,从最后一个时期的1秒插入,显示存在于平方的EMG-ECG信号中的R波。底部,时间过程西格玛功率从上述相应的频谱提取。虚线示出了在选择用于显示的四个非REM突发之前和之后的功率值的延续。 ( C )归一化的西格玛功率(红色)和心跳(BPM)(灰色)时程,其中(B)所示的部分位于垂直虚线之间。以下是sigma频带(10 - 15 Hz)中相应的过滤的EEG信号。 ( D )在(C)所示的Σ功率时间过程上计算的FFT的结果,表明在0.016Hz的主峰。 请点击此处查看此图的较大版本。
- 提取使用快速傅立叶变换的计算4-S箱( 图2 A 和B)对西格玛频带(10-15赫兹)的光谱功率的功率值(FFT)"> 1。
- 通过对所有非REM睡眠时期的每个频率仓中的值进行平均,计算非REM睡眠的基线光谱功率(伪像和警戒状态之间的过渡时期从该平均值中排除)。在感兴趣的时间段内,在非REM睡眠期间将每个时期的西格玛功率值归一化为西格玛频带的平均功率。随着时间的流逝( 图 2C )。
- 计算所述Σ功率时间过程的FFT与汉明窗口以显示功率动力学的振荡频率分量( 图2 D)1。
- 注意,由于非REM睡眠开始具有不同的持续时间,所得到的FFT具有不同的频率分辨率。插值以将分辨率调整到从最长的非REM睡眠周期中获得的最高分辨率,并平均所有开始的FFT。
- 继续这些分析描述EEG和ECG信号的动力学之间的相位关系。
- 在30 Hz高通滤波后,从平方的EMG-ECG信号中提取心跳数据,使用R波峰检测的适当程序。
注意:将两个连续R波之间的最小时间间隔限制到80 ms有助于避免由于肌肉抽搐而引起偶尔的畸形峰值1 。 - 测量RR间隔,并计算每4秒小时的每分钟心跳(BPM)的平均心率( 图 2B和C )。
4.暴露于噪音
- 通过定制的软件产生噪音(即白噪声)。将持续时间设置为20秒,强度设置为90 dB SPL(在笼内测量)。通过标准有源音箱播放噪音1 。
- 在手术之后,在习惯性的时候到recor丁条件,发挥随机实验噪音,多次在白天和在不同的时刻1。
- 在实验条件(记录EEG / EMG / ECG数据时),在轻度发作(ZT0)的前100分钟内伪随机播放噪声。要发挥噪音,满足以下条件1 :
- 确保鼠标已经进入非REM睡眠> 40秒。
- 确保以前的暴露超过4分钟。
注意:这会导致每个会话约15次曝光。
- 标记录制时间的开始和每个噪音暴露的开始。在实验过程中,使实验者对非REM睡眠的光谱组成无视。
- 收购与多导睡眠图软件1,29的所有数据。
5.基于行为结果的睡眠回顾性分析暴露于噪音
- 以4秒分辨率手动评分EEG / EMG -ECG轨迹,不知道噪声暴露时间1 。
- 使用自定义的脚本来提取EEG / EMG -ECG /噪声暴露数据1 。
- EEG和EMG信号在噪声暴露期间保持不变时,作为睡眠评分( 图3A )。考虑到当EEG振幅降低并且EEG频率增加时结合EMG-ECG电极上检测到的肌肉活动( 图3B )唤醒。
- 放弃在刺激前期间或前4秒的噪音暴露中动物醒来的试验( 图3D )。
- 将唤醒成功率定义为所有试验中的唤醒试验的比例("唤醒"和"睡眠")。
- 在所有包括的试验中,检查西格玛力量的动态e刺激前期( 图3 E ) 1 。

图3 。响应噪声的行为成果发生:从分析中保留或排除的代表性结果。
( AD )噪声开始前40秒和20秒噪声期间,由蓝色阴影区域表示的EEG(黑色)的原始轨迹和相应的EMG-ECG(灰色)信号。警戒状态用颜色代码表示。为了说明分析中包含的数据,显示了代表性的"睡眠"( A )和"唤醒"( B )事件。被丢弃的结果包含过渡到REM睡眠( C )和早熟的"唤醒"反应( D )。插图显示了一个广告EEG和EMG-ECG踪迹的部分特征为REM睡眠。 ( E )在"睡眠"(左)和"唤醒"(右)事件发生噪声之前的40秒窗口中的σ功率动力学的典型示例。上面显示了用于西格玛频段的原始EEG轨迹带通滤波。蓝色区域表示噪音开始。 请点击此处查看此图的较大版本。
结果
图 2A (上图 )显示了通过如所述植入的多导睡眠记录电极( 见图1 )记录的100分钟自发睡眠 - 醒觉行为。非REM睡眠发作时EEG和EMG振幅的增减是清晰可见的。间歇性REM睡眠被标记为EEG振幅的降低,并且EMG音调的进一步降低在该压缩时间刻度上是不可见的。放大一个非REM睡眠回合显示脑电图中?...
讨论
在这里,我们展示如何建立整合EEG,EMG和ECG变量的非REM睡眠的连续时间特征。这是开发鼠标睡眠综合描述的第一步,这有助于识别以前无法识别的时间尺度,在非REM睡眠期间组织高和低的抗噪声能力1 。类似的时间结构也通过类似分析1描述在人类非REM睡眠中。
这里提出的程序实现了两个目标。首先,我们引起注意,多导睡眠图技术可以在?...
披露声明
作者宣称他们没有竞争的经济利益。
致谢
我们感谢所有实验室成员对撰写和仔细阅读本手稿的贡献。我们非常感谢保罗·弗兰肯(Paul Franken)刺激讨论,GisèleFerrand博士对手术方案进行了有用的评论,Jean-Yves Chatton博士提供了原始的Labview可执行文件,用于噪音暴露。资助由瑞士国家科学基金会(Grants 31003A_146244和31003A_166318)和Etat de Vaud提供。
材料
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3 x 2-channels | ENA AG | 2.316 | Raster 2.54 x 2.54 mm; size 5 x 8 x 9 mm; pin size 5 mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
参考文献
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。