Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung der infra-langsamen Dynamik der spektralen Kraft und der Herzfrequenz bei schlafenden Mäusen
In diesem Artikel
Zusammenfassung
Hier stellen wir experimentelle und analytische Verfahren vor, um die zeitliche Dynamik der neuronalen und kardialen Variablen des Nicht-REM-Schlafes bei Mäusen zu beschreiben, die die Schlafreaktion auf akustische Reize modulieren.
Zusammenfassung
Drei Wachsamkeitsstaaten dominieren das Leben der Säugetiere: Wakefulness, nicht-schnelle Augenbewegung (Nicht-REM) Schlaf und REM-Schlaf. Da mehr neuronale Korrelate des Verhaltens in frei bewegten Tieren identifiziert werden, wird diese dreifache Unterteilung zu einfach. Während der Wachsamkeit definieren Ensembles der globalen und lokalen kortikalen Aktivitäten zusammen mit peripheren Parametern wie Pupillendurchmesser und sympathovagalem Gleichgewicht verschiedene Grade der Erregung. Es bleibt unklar, inwieweit der Schlaf auch ein Kontinuum von Hirnzuständen bildet, in dem der Grad der Widerstandsfähigkeit gegenüber sensorischen Reizen und Erregbarkeit und vielleicht anderen Schlaffunktionen allmählich variiert und wie sich die peripheren physiologischen Zustände zusammenhängen. Die Forschung, die die Methoden zur Überwachung mehrerer Parameter während des Schlafes vorantreibt, sowie die Zuordnung zu den Konstellationen dieser funktionalen Attribute, ist von zentraler Bedeutung, um unser Verständnis des Schlafes als multifunktionalen Prozess zu verfeinern, in dem viele vorteilhafte Effekte ex sein müssenEcuted Die Identifizierung von neuartigen Parametern, die Schlafzustände charakterisieren, eröffnet Chancen für neuartige diagnostische Wege bei Schlafstörungen.
Wir zeigen ein Verfahren zur Beschreibung von dynamischen Variationen von Maus-Nicht-REM-Schlafzuständen über die kombinierte Überwachung und Analyse von Elektroenzephalogramm (EEG) / Elektrokortikogramm (ECoG), Elektromyogramm (EMG) und Elektrokardiogramm (EKG) unter Verwendung von standardpolysomnographischen Aufzeichnungsverfahren. Mit diesem Ansatz fanden wir, dass der Maus-Nicht-REM-Schlaf in Zyklen von koordinierten neuralen und kardialen Oszillationen organisiert ist, die aufeinanderfolgende 25-s-Intervalle von hoher und niedriger Zerbrechlichkeit zu externen Reizen erzeugen. Daher werden zentrale und autonome Nervensysteme koordiniert, um verhaltensbedingte Schlafzustände während des konsolidierten Nicht-REM-Schlafes zu bilden. Wir präsentieren chirurgische Manipulationen für polysomnographische ( dh EEG / EMG kombinierte mit EKG) Überwachung, um diese Zyklen in der frei schlafenden Maus, die Analyse zu quanti zu verfolgenIhre Dynamik und die akustischen Stimulationsprotokolle, um ihre Rolle in der Wahrscheinlichkeit des Aufwachens zu beurteilen. Unser Ansatz wurde bereits auf den menschlichen Schlaf ausgedehnt und verspricht, gemeinsame organisatorische Prinzipien von Nicht-REM-Schlafzuständen bei Säugetieren aufzuklären.
Einleitung
Säugetier-Schlaf ist ein Verhaltenszustand der Ruhe und der Resilienz gegenüber Umweltreizen. Trotz dieser scheinbaren Homogenität, Polysomnographie und vegetative Parameter zeigen , dass die Schlaf bewegt sich zwischen qualitativ und quantitativ unterschiedliche neuronale und somatische Zustände auf verschiedenen räumlichen und zeitlichen Skalen 1. Über Minuten bis zu zehn Minuten tritt der Wechsel zwischen Nicht-REM und REM-Schlaf auf. Nicht-REM-Schlaf wird von einer großampligen, niederfrequenten Aktivität im EEG mit einem spektralen Peak um ~ 0,5 - 4 Hz begleitet, während REM-Schlaf eine regelmäßige EEG-Aktivität im Theta-Band (6 - 10 Hz) aufweist Muskel atonia 2 Innerhalb des Nicht-REM-Schlafes radeln die Menschen durch Licht (S2) und tiefen Langsamwellen-Schlaf (SWS). Wie ihre Benennung zeigt, zeigen diese beiden Stufen niedrigere und höhere Erregungsschwellen 3 , 4 , und sie unterscheiden sich primär in der Dichte von NiedrighäutenEn-kortikale EEG-Leistung, die als langsame Aktivität (SWA; 0,75 - 4 Hz) bezeichnet wird. Die Ungleichförmigkeit bleibt während der einzelnen Kämpfe von S2 und SWS auf der Minute-zu-Sub-Sekunde-Zeitskala bestehen, die durch die variable Präsenz von SWA im Laufe eines Kampfes 5 , 6 , aber auch durch EEG- und Feldpotential-Rhythmen ausführlich dokumentiert wird Höhere Frequenzen, einschließlich Spindelwellen im Sigma-Band (10-15 Hz) und Gamma-Rhythmen (80 - 120 Hz) (für eine Überprüfung siehe 7 , 8 , 9 , 10 ).
Anstatt subtil zu sein, verschieben diese Variationen den schlafenden kortikalen Zustand beim Menschen auf die Extreme des Spektrums. Für Nicht-REM - Schlaf, diese reichen von einer Dominanz von SWA zu Staaten , dass ungefähre wake-artiger Aktivität , weil sie 11 einen wesentlichen Anteil an Hochfrequenzkomponenten enthalten , 12 Bei Nagetieren und Katzen, obwohl Nicht-REM-Schlaf nicht in Stufen unterteilt ist, tritt eine kurze Periode, die Zwischenschlaf (IS) genannt wird, vor dem REM-Schlaf-Beginn 13 auf . Während des IS werden REM-Schlaf-Features wie Hippocampal-Theta-Aktivität und Ponto-Geniculo-Okzipital-Wellen initiiert, während Nicht-REM-Schlafsignaturen wie Spindelwellen und SWA noch vorhanden sind, was auf eine Mischung zwischen den beiden Schlafzuständen 14 , 15 hinweist. Dennoch könnte IS funktionell unterschiedlich sein, weil es durch Antidepressiva 16 moduliert wird und durch neuartige Objektpräsentation während des vorigen Aufwachens 17 , und es trägt zur Einstellung der Erregungsschwelle 18 bei . Weiterhin zeigen die Zustandsflächen von EEG- und EMG-Parametern frei beweglicher Ratten eine Gruppe von Punkten 14 , die zwischen Nicht-REM-Schlaf, REM-Schlaf und Wachsamkeit kontinuierlich ist. Es gibt auch sporadische Abnahmen in der SWA, ohne in den Wach- oder REM-Schlaf einzutreten, was zu erheblichen Schwankungen der relativen Präsenz der nieder- und hochfrequenten Komponenten während eines konsolidierten Nicht-REM-Schlafkampfes 14 , 19 , 20 führt . Schließlich treten variable Verhältnisse von SWA und höherfrequenten Rhythmen während des Nicht-REM-Schlafes nicht nur zeitlich auf, sondern zeigen auch regionale Unterschiede in der Amplitude und Synchronisation zwischen den kortikalen Bereichen 19 .
Säugetier Nicht-REM-Schlaf ist weit von Uniform. Ob diese Ungleichförmigkeit jedoch zu Zuständen führt, die sich in Funktions- und Verhaltensattributen unterscheiden, ist nicht klar. Bei verschiedenen Arten von Schlafstörungen wird der kontinuierliche Schlaf durch spontane Erwachungen und unangemessenes motorisches Verhalten gestört. Darüber hinaus zeigen Spektralanalysen Veränderungen in der relativen Präsenz höherer Frequenzen im EEG 21Und in autonomen Parametern wie Atemnoten und Herzschlag 22 . Die geordnete Abfolge von stabilen Schlafzuständen ist also gestört, und Elemente der kortikalen und / oder autonomen Erregung dringen unkontrolliert ein. Daher ist das Verständnis des Kontinuums der Schlafzustände für Krankheiten von Bedeutung. Darüber hinaus ist die Störung des Schlafes durch Umgebungslärm in städtischen Umgebungen mit allgemeinen Gesundheitsrisiken verbunden, was es entscheidend macht, Momente der erhöhten Verwundbarkeit während des Schlafes zu identifizieren 23 .
Verhaltenserregung Versuche beim Menschen Schlaf zeigen an, dass es am schwersten ist aus aufzuwecken SWA dominierten Nicht-REM - Schlaf (Stufe S3), während Licht nicht-REM - Schlaf (Stufe S2) und REM - Schlaf zeigen vergleichbare und unteren Erregungsschwellen 4. Die kortikale Verarbeitung von kurzen Schallreizen variiert im wesentlichen zwischen REM-Schlaf, S2 und S3 24 ,25 , was anzeigt, dass staatsspezifische kortikale Aktivitätsmuster die ersten Stadien der sensorischen Verarbeitung modulieren. Für Nicht-REM-Schlaf beim Menschen variiert die Neigung zum Aufwachen als Reaktion auf Lärm mit dem Vorhandensein von Spindelwellen und Alpha-Rhythmen im EEG 26 , 27 , 28 . Thalamokortikalen rhythmicity während Spindeln wird durch verbesserte synaptische Hemmung bei beiden thalamischen und kortikalen Ebenen begleitet, die auf die Dämpfung der sensorischen Verarbeitung 7 beitragen gedacht wird.
Wie sind geräuschresistente und verwundbare Zeiträume in der Zeit organisiert und was sind ihre Determinanten? Bei Mäusen und Menschen haben wir vor kurzem eine infra-langsame, 0,02-Hz-Oszillation in neuronalen Rhythmen identifiziert. Abhängig von der Phase dieser 0,02-Hz-Oszillation zeigten Mäuse eine variable Reaktivität gegenüber externen Reizen, entweder aufwachen oder schlafenGh das Geräusch Interessanterweise war diese Oszillation mit der Rate des Herzschlags korreliert, was darauf hinweist, dass das autonome Nervensystem an der Modulation der Anfälligkeit des Schlafes an äußere Reize beteiligt ist 1 . Gedächtnisbezogene hippocampale Rhythmen wurden auch in diesem Rhythmus organisiert, und am auffallendsten war seine Stärke mit der Qualität der Gedächtniskonsolidierung beim Menschen korreliert. Die 0,02-Hz-Oszillation scheint also ein organisatorisches Prinzip des Nagetier- und menschlichen Nicht-REM-Schlafes zu sein, das sowohl die Empfindlichkeit für die Umwelt als auch die interne Speicherverarbeitung moduliert. Dies unterstreicht erneut die Notwendigkeit von multiparametrischen und kontinuierlichen Einschätzungen von Schlafzuständen, um ihre Funktionalität zu erkennen und Orte von potentieller Verwundbarkeit zu identifizieren.
Hier präsentieren wir ein Verfahren zur Extraktion der Wellenform dieser Dynamik, einschließlich der chirurgischen Implantation von Mäusen für kombinierte EEG / ECoG- und EMG-EKG-Messungen, Exposition gegenüber sensorischen Reizen, aAnalyseanalyse. Diese Prozedur stellt eine Grundlage für die Betrachtung des Schlafes als ein kontinuierlich variierender, aber stark organisierter Vigilanzzustand dar, während dessen verschiedene grundlegende Schlaffunktionen sequentiell ausgeführt werden. Allgemeiner ist das Verfahren auf Ansätze anwendbar, die darauf abzielen, die spektralen und autonomen Merkmale zu extrahieren, die einem Verhaltensergebnis während des Schlafes sowohl im Gesundheits- als auch im Krankheitszustand vorausgehen.
Protokoll
Alle experimentellen Verfahren wurden in Übereinstimmung mit dem Tierarztausschuss der Universität Lausanne und dem Service de la Consommation et des Affaires Vétérinaires des Kantons Vaud durchgeführt.
1. Chirurgie für EEG / EMG-EKG-Aufnahmen
- Tierhaltung und Auswahl.
- Halten Sie Tiere (C57Bl / 6J, 7 - 9 Wochen, 25 - 30 g) in einem 12: 12-h dunklen / leichten Zyklus, einzeln untergebracht und unter Standardbedingungen (40% Feuchtigkeit, 22 ° C), mit Nahrung und Wasser Verfügbare ad libitum .
- Verwenden Sie nur männliche Probanden, um alle Einflüsse des Hormonzyklus im Schlaf zu vermeiden.
- Vorbereitung der Elektroden
- EEG / ECoG-Elektroden (verwendet in Schritt 1.3.11) unter Verwendung von ~ 0,5 cm langen Golddrahtstücken (75% Au, 13% Ag und 12% Cu, Durchmesser: 0,2 mm), die jeweils auf einem Gold aufgelötet wurden (3 mm Länge, 1,1 mm Durchmesser am Sockel, siehe FigurE 1). 2 EEG-Elektroden pro Tier vorbereiten und in 70% Ethanol reinigen.
- Vorbereitung von EMG-EKG-Elektroden mit 3 - 4 cm langen Golddrähten (75% Au, 13% Ag und 12% Cu, Durchmesser: 0,2 mm). Biegen Sie die Drähte in einem Winkel von 90 ° 1 cm von einem Ende und bereiten Sie eine Spule (1 - 2 mm ø) am anderen Ende vor ( Abbildung 1 ). Zwischen den beiden Enden biegen Sie den Draht, um eine kleine Krümmung zu erzeugen, die dem Oberflächenprofil des Knochens zwischen dem Kleinhirn und dem Lambda entspricht.
- 2 EMG-EKG-Elektroden pro Tier vorbereiten.
- Bereiten Sie einen 6-Kanal-Innengewinde-Stecker vor (Raster: 2,54 mm x 2,54 mm, Größe: 5 mm x 8 mm x 9 mm, Stiftgröße: 5 mm, siehe Abbildung 1 ).
- Decken Sie den Stecker an der Basis von weiblichen und männlichen Pins mit Klebeband.
- Fügen Sie eine kleine Menge von Lötdraht zu den Spitzen von 4 der 6 männlichen Stifte, um mit dem Löten der EEG und EMG-EKG-Elektroden während der Operation zu helfen(Siehe Schritt 1.3.16).
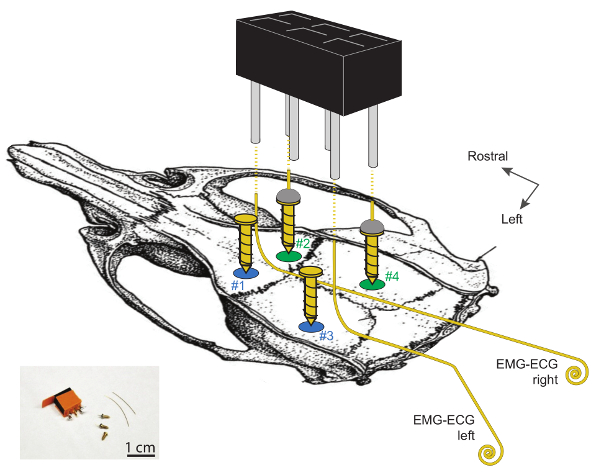
Abbildung 1. Schematische Darstellung der Standorte für EEG und EMG Elektrodenimplantation am Schädel der Maus.
Craniotomien # 1 und # 2 befinden sich ~ 2 mm seitlich zur Mittellinie und ~ 2 mm rostral bis bregma. Die Kraniotomien Nr. 3 und Nr. 4 befinden sich ~ 2 mm rostral bis lambda und sind jeweils 4 und 2 mm seitlich zur Mittellinie. Die beiden EEG-Elektroden, die aus dem Löten eines Golddrahtes an der Oberseite einer vergoldeten Stahlschraube (# 2 und # 4) hergestellt sind, befinden sich auf der rechten Halbkugel. Die 2 linken Schrauben (# 1 und # 3) dienen als Stützen. Beachten Sie, dass EMG-EKG-Elektroden nicht mit diesen 2 Stützschrauben in Berührung kommen sollten. EMG-EKG-Elektroden sind 3 - 4 cm lange Golddrähte, die bei 90 ° -Winkeln über 1 cm an ihren rostralen Enden gebogen und an den kaudalen Enden gewickelt sind (1 - 2 mm ø). Die 2 EEG und 2 EMG ElektrodeS sind mit dem 2 x 3-Kanal-Kopfstecker verbunden, indem man einen Draht an einen Eckzapfen löst, wie durch die gestrichelten Linien dargestellt. Weitere detaillierte Informationen zu diesen Elektroden und deren Implantation finden Sie hier In 29 Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Implantationschirurgie.
- Anästhesieren des Tieres in einer Isofluran-induzierenden Kammer (4 - 5% Isofluran + O 2 bei 1 - 2 L / min über 3 - 4 min). 5 μg / g Carprofen intraperitoneal (ip) injizieren, wenn man die Maus aus der Kammer entfernt, vor der stereotaktischen Fixierung.
- Befolgen Sie die Standardverfahren, um die Maus auf das stereotaxische Gerät zu fixieren. Halten Sie die Isofluran-Anästhesie durch eine Gasmaske (3% Isofluran + O 2 während der Fixierung bei 1 l / min). Halten Sie die Körpertemperatur während der Operation bei 37 ° C usinGa Heizkissen.
- Schützen Sie die Augen vor dem Austrocknen durch Anwendung von Vitamin A Salbe. Überprüfen Sie den Grad der chirurgischen Toleranz des Tieres durch Testen des Pfote-Rückzugsreflexes.
- Fixieren Sie den Kopf, indem Sie die Ohrbügel am Schädel mit ihren stumpfen, umgekehrten Enden anstatt ihren Spitzen positionieren (ohne in die Gehörgänge einzutreten) 29 . Positionieren Sie den Mundstab (wie üblich), um die Horizontalität des Kopfes zu gewährleisten.
HINWEIS: Die Fixierung minimiert die Ohren, was für die akustischen Erregungsexperimente wichtig ist (siehe Abschnitt 4 dieses Verfahrens). - Überwachen Sie die Atmung des Tieres während des Eingriffs, die bei ~ 2 - 3 Atemzügen / 2 s bleiben sollte. Bei Bedarf die Isoflurankonzentration im Gasspender einstellen; Es sollte nach und nach während der Operation abnehmen, von 3% bei der Fixierung auf 1,0 - 1,5% gegen Ende des Verfahrens.
- 100 μl 0,9% NaCl ip einmal pro Stunde mit einem ultrafeinen Insuli injizierenN Spritze, um das Tier hydratisiert zu halten.
- Stellen Sie sicher, dass der Kopf des Tieres von einer hellen Lichtquelle beleuchtet wird.
- Reinigen Sie den Bereich mit 70% EtOH und Iod-basiertem Desinfektionsmittel (Nasspelz verhindert das Eindringen von Haaren in das chirurgische Fenster).
- Heben Sie die Haut in die Mitte des Schädels mit Adson Pinzette und schneiden Sie sanft den angehobenen Teil der Haut entlang der Mittellinie, von der Oberseite des Halses bis zum Niveau der Augen, mit feinen Scheren. Entfernen Sie die Kopfhaut (~ 1 cm anteroposterior, ~ 0,5 - 0,8 cm lateral).
- Stellen Sie sicher, dass das Fenster groß genug ist (zu beiden Seiten), um das Bregma und die Lambda-Fissuren des Schädels deutlich zu sehen. Fix die Haut auf beiden Seiten mit Bulldog Serrefines, um den Zugang zu den Knochen zu gewährleisten.
- Das Konjunktivgewebe (Periost) durch sorgfältiges Kratzen mit einem Skalpell entfernen. Reinigen Sie den Bereich mit Iod-basiertem Desinfektionsmittel und trocknen Sie den Schädel mit einem antiseptischen Tupfer.
- Mit einem scharfen Skalpell Klinge (Größe 15), kratzen die sKull, um eine gereinigte und mattierte Knochenoberfläche zu erhalten. Verwenden Sie nur die Skalpellspitze, kratzen Sie ein gitterartiges Maschenwerk von Rillen mit einem Abstand von ~ 1 - 2 mm zwischen den Rillen.
HINWEIS: Dies verbessert die Befestigung des Zweikomponenten-Epoxidklebstoffs an den Schädel in Schritt 1.3.15. - Benutzen Sie einen Mikrobohrer mit einer Länge von 1/005, um 4 Kraniotomien (~ 0,7 mm ø) im Schädel an bestimmten Stellen durchzuführen ( Abbildung 1 , siehe auch Schritt 1.3.11.3). Den Knochenstaub mit einer Pasteurpipette wegblasen und mit Bluthochdruck bluten lassen.
- Wenn Blutungen auftreten, stellen Sie sicher, dass es vollständig gestoppt wird, bevor Sie den Prozess wieder aufnehmen. Verwenden Sie einen hämostatischen Schwamm, um die Hämostase zu beschleunigen.
- Benutze die beiden Kraniotomien auf der rechten Halbkugel, um die Schneckenelektroden (Kraniotomien # 2 und # 4) einzusetzen.
- Verwenden Sie die beiden Kraniotomien auf der linken Hemisphäre, um Verankerungsschrauben einzusetzen, die das Implantat stabilisieren (Kraniotomien Nr. 1 und Nr. 3).
HINWEIS: Um zu erhöhenSe Stabilität, bis zu 4 Verankerungsschrauben wurden verwendet 29 .
HINWEIS: Die präzisen stereotaktischen Koordinaten sind: 2 mm von der Mittellinie auf beiden Hemisphären und 2 mm rostralen aus Bregma (Kraniotomien # 1 und # 2), 2 mm rostral aus Lambda und 4 mm seitlich links von der Mittellinie (Kraniotomie # 3), 2 mm rostral von lambda und 2 mm lateral - rechts von midline (craniotomy # 4). Siehe Abbildung 1 .
- Auf der linken Hemisphäre schrauben Sie zwei vergoldete Schrauben durch die Kraniotomien zur Unterstützung.
- Befestigen Sie die Schraube in einer hämostatischen Klemme und halten Sie sie vertikal über der Kraniotomie. Sorgfältig an die Unterseite der Schraube auf der Oberseite der Kraniotomie. Drehen Sie es, während es nicht von der senkrechten Position abweicht.
HINWEIS: Nur 1,5 Umdrehungen ausreichend sind , zu erhalten eine gute mechanische Stabilität und qualitativ hochwertige Signale , während der Druck minimiert auf das darunter liegende Gewebe 25. - Auf der rechten Seite schrauben Sie die vorLeicht hergestellten Elektroden (beschrieben in Schritt 1.2.1) durch die Kraniotomien.
- Befestigen Sie die Schraube in einer hämostatischen Klemme und halten Sie sie vertikal über der Kraniotomie. Sorgfältig an die Unterseite der Schraube auf der Oberseite der Kraniotomie. Drehen Sie es, während es nicht von der senkrechten Position abweicht.
- Mit Hilfe der Pinzette, heben Sie die Grenze der Haut vorsichtig von den Nackenmuskeln an. Setzen Sie die EMG-EKG-Drähte mit den gewickelten Enden in die Muskeln ein (links und rechts). Kleben Sie die Mittelteile an den Schädel, so dass das linke EMG-EKG neben der hinteren linken Verankerungsschraube herauskommt, während das rechte EMG-EKG neben der vorderen linken Verankerungsschraube steht.
- Um EKG-Signale aus dem Herzen während des Schlafes zu erkennen, stellen Sie sicher, dass die EMG-EKG-Drähte in den Muskel bis zu einer Tiefe von ~ 0,8 - 1 cm eingesetzt werden, wobei ihre Schlaufe so weit wie möglich voneinander entfernt ist.
- Verwenden Sie einen Spatel, der mit Zweikomponenten-Epoxidklebstoff bedeckt ist, um den Kleber auf den Schädel zwischen und um die Schrauben aufzutragen. Lass es im Licht trocknen, aber die Augen des Tieres vor übermäßigem Blitz schützen.
HINWEIS: Die Sockel der Schrauben müssen abgedeckt werden, und nur die Drähte sollten zugänglich seinOm der Kleber - Achten Sie darauf, dass der Leim den Raum zwischen den beiden EMG-EKG-Elektroden aus der Oberfläche füllt, so dass kein elektrischer Kontakt zwischen ihnen und den Stützschrauben besteht. Sich sorgfältig darauf achten, die Haut nicht an den Schädel zu kleben; Die Haut sollte frei bleiben, um den Leim zu bewegen.
- Schneiden Sie die EEG- und EMG-EKG-Drähte so, dass sie ~ 0,5 mm aus dem Leim heraus erreichen. Löten Sie die vier Stifte an der in Schritt 1.2.3 hergestellten Ecke des Steckers. Zu den vier Drähten, die aus dem Leim austreten ( Abbildung 1 ).
- Versuchen Sie, die Steckerstifte so genau wie möglich zu platzieren, um die Höhe des Implantats zu minimieren. Verwenden Sie eine kleine Krokodilklemme, die an dem stereotaktischen Halter befestigt ist, der die Position des Verbinders beibehält. Minimieren Sie die Zeit in Kontakt mit der Lötspitze, da dies schnell die Schrauben erwärmt.
- Füllen Sie den Raum zwischen dem Leim und dem Verbinder mit Dentalzement, um die gelöteten Teile zu bedecken. Erstellen Sie SmooTh Gesichter und vermeiden scharfe Kanten, die das Tier verletzen könnte. Vermeiden Sie es, die Haut zu berühren, da dies zu Juckreiz führt.
- Entfernen Sie die Bulldogge serrefines. Wenn nötig, schließen Sie die Wunde mit einem sterilen Nahtfaden (resorbierbare Nahtfaser) vorne und hinter dem Verbinder, wodurch einfache, unterbrochene Verschlussmuster und zwei quadratische Knoten (5-0 FS-3 Nadel, 45 cm Filament) entstehen.
- Überwachen Sie das Tier, bis es ganz wach ist. Wiegen Sie das Tier nach der Operation und bringen Sie es in seinen Hauskäfig zur Verwertung zurück.
- Postoperative Pflege und Anbindung an das System.
- Überwachen Sie das Tier jeden Tag für eine Woche. Suchen Sie nach Gewichtsverlust, reduzierte oder abnorme Aktivität und Anzeichen von Infektionen. Folgen Sie dem von Ihren Veterinärbehörden festgelegten Bewertungsverfahren.
- 5-6 Tage nach der Operation, verbinden Sie das Aufnahmekabel mit dem Kopfstecker auf dem Tier und lassen es in seinem Hauskäfig. Warten Sie weitere 4 - 5 Tage vor dem Start des RecorSo dass das Tier in den Zustand gewohnt ist und natürlich schläft.
2. Grundlegende Bewertung der EEG / EMG-EKG-Daten zur Vigilanz-Zustandsermittlung
- Aufzeichnung von EEG- und EMG-EKG-Daten über 48 h mit einer handelsüblichen polysomnographischen Software ( zB Somnologica, SleepSign oder Sirenia). Verwenden Sie typische Einstellungen, wie zB 2.000x Verstärkung; Eine Abtastrate von 2.000 Hz bei Erfassung, nach der Erfassung auf 200 Hz abgetastet; Und ein 0,7-Hz-Hochpassfilter für EEG und ein 10-Hz-Hochpaßfilter für EMG-EVG.
- Exportieren Sie die Daten im Dateiformat ".df".
- Öffnen Sie die ".edf" -Dateien mit einer benutzerdefinierten ( zB in Matlab) Software, die jede 4-s-Epoche als wach, nicht-REM-Schlaf, REM-Schlaf und entsprechende Artefakte halbautomatisch klassifiziert.
HINWEIS: Alternativ gibt es mehrere halbautomatisierte Scoring-Software. Dieses Verfahren beschreibt einige der grundlegenden Schritte, die getan werden müssen, um das Scoring w einzurichtenMit der hier verwendeten Scoring-Software; Andere halbautomatische Scoring-Systeme könnten auf anderen Parametern basieren. - Mit der Software trennen Sie die ".edf" Dateien in 4 mal 12 h Aufnahmen.
- Entfernen von Artefakten, die aus der im EEG-Signal vorhandenen EMG -ECG-Aktivität oder aus einem nicht zuweisbaren Verhaltenszustand 1 , 29 entstehen .
- Berechnen Sie den Mittelwert des absoluten EEG (EEG mean ) und der EMG (EMG mean ) Werte über die 12 h Aufnahmen aus dem EEG bzw. den EMG-EKG Spuren.
- Identifizieren Sie die mittleren EEG / EMG-Werte jeder 4-s-Epoche (EEG Epoch / EMG Epoch ).
- Klassifizieren Sie die Epochen als "Wake", wenn EEG Epoch bedeuten und EMG Epoch > EMG bedeuten und als "Non-REM-Schlaf", wenn EEG Epoch > EEG bedeuten und EMG Epoch bedeuten.
- Klassifizieren Sie die Epochen, die nicht s Befolgen diese Kriterien mit einem Korrekturalgorithmus auf der Grundlage früherer und nachfolgender Epochen.
- Klassifizieren Sie die Epochen als REM-Schlaf, wenn EEG Epoch bedeutet und EMG Epoch bedeutet .
- Verfeinern Sie die kritischen Punkte, wie Übergänge von Nicht-REM-Schlaf zu Wecken, REM-Schlaf-Epochen und Mikro-Erreger während Nicht-REM-Schlaf. Sichtprüfung der Scoring, um eine ordnungsgemäße Vigilanzzustandsbestimmung zu gewährleisten 29 , 30 .
HINWEIS: Immer eine abschließende visuelle Inspektion und Validierung des Scoring durchführen.
3. Analyse der Infra-Slow-Oszillation für EEG und Heartbeats
- Für diese Analyse wählen Sie nur Nicht-REM-Schlafkämpfe mit einer Dauer von ≥ 96 s ( dh mindestens 24 Epochen von 4 s); Siehe Abbildung 2 .
HINWEIS: Kundenspezifische Routinen sind auf Anfrage erhältlich 1 .

Abbildung 2. Ermittlung der Sigma-Leistungsdynamik bei ungestörtem Nicht-REM-Schlaf.
( A ) Top, EEG (schwarz) und EMG-EKG (grau) Spuren während der ersten 100 min der Lichtphase in einer Maus. Vigilanzzustände werden durch den farbigen Balken oben auf den Rohspuren angezeigt. Mittleres typisches Beispiel für einen kontinuierlichen (> 96-s) Nicht-REM-Schlafkampf. Unten, ein zufällig ausgewähltes 16-s-Intervall, das die Unterteilung in 4-s-Epochen veranschaulicht. Der folgende Schritt der Analyse wird nur für diese vier Epochen gezeigt, aber es gilt für jede im Kampf enthaltene Epoche. ( B ) Top, vier aufeinanderfolgende FFTs, die aus den 4-s-Epochen im unteren Panel von A erzeugt wurden. Das Sigma-Band (10-15 Hz) ist rot markiert. Oben rechts, 1-s-Einfügung aus der letzten Epoche mit den R-Wellen, die im quadratischen EMG-EKG-Signal vorhanden sind. Unten, Zeitverlauf der Sigma-Leistung aus dem entsprechenden Spektrum extrahiert. Die gestrichelten Linien veranschaulichen die Fortsetzung der Leistungswerte vor und nach den vier nicht-REM-Kämpfen, die für die Anzeige ausgewählt wurden. ( C ) Normalisierte Sigma-Leistung (rot) und Herzschlag (in BPM) (grau) Zeitkurse, wobei der in (B) dargestellte Teil zwischen den vertikalen gestrichelten Linien liegt. Darunter befindet sich das entsprechende gefilterte EEG-Signal im Sigma-Band (10 - 15 Hz). ( D ) Ergebnis der FFT, berechnet auf dem in (C) gezeigten Sigma-Leistungszeitverlauf, was einen dominanten Peak bei 0,016 Hz zeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Extrahieren Sie die Leistungswerte für die Sigma-Frequenzband (10-15 Hz) spektrale Leistung in 4-s-Bins ( Abbildung 2 A und B ) unter Verwendung von Berechnungen von Fast-Fourier-Transformationen (FFT)"> 1
- Berechnen Sie die Baseline-Spektralleistung für Nicht-REM-Schlaf durch Mittelung der Werte in jedem Frequenz-Bin für alle Nicht-REM-Schlaf-Epochen (Artefakte und Epochen des Übergangs zwischen Vigilanz-Zuständen sind von dieser Mittelung ausgeschlossen). Normalisieren Sie die Sigma-Leistungswerte jeder Epoche auf die mittlere Potenz des Sigma-Bandes während des Nicht-REM-Schlafs über den Zeitraum von Interesse. Plot gegen die Zeit ( Abbildung 2 C ).
- Berechnen Sie die FFT des Sigma-Leistungszeitverlaufs mit Hamming-Fenster, um die oszillatorischen Frequenzkomponenten der Leistungsdynamik zu zeigen ( Abbildung 2 D ) 1 .
- Beachten Sie, dass die resultierenden FFTs unterschiedliche Frequenzauflösungen haben, da die Nicht-REM-Schlafkämpfe unterschiedliche Laufzeiten aufweisen. Interpolieren Sie, um die Auflösung auf die höchste zu setzen, die aus dem längsten Nicht-REM-Schlafkampf erhalten wurde, und durchschnittlich die FFTs aller Kämpfe.
- Fortsetzen Sie diese AnalysenUm die Phasenbeziehungen zwischen der Dynamik von EEG- und EKG-Signalen zu beschreiben.
- Extrahieren Sie die Heartbeat-Daten aus dem quadrierten EMG-EKG-Signal nach einer 30-Hz-Hochpassfilterung mit geeigneten Routinen für die Peak-Detektion der R-Welle.
HINWEIS: Das Einschränken des minimalen Zeitintervalls zwischen zwei aufeinanderfolgenden R-Wellen auf 80 ms hilft, die Einbeziehung von gelegentlichen artefaktischen Spitzen durch Muskelzucken zu vermeiden 1 . - Messen Sie die RR-Intervalle und berechnen Sie die mittlere Herzfrequenz in Beats pro Minute (BPM) alle 4-s-Bin ( Abbildung 2 B und C ).
4. Lärmschutz
- Erzeugen Sie Geräusche (dh weißes Rauschen) durch eine benutzerdefinierte Software. Stellen Sie die Dauer auf 20 s und die Intensität auf 90 dB SPL (gemessen im Käfig). Spielen Sie die Geräusche durch Standard-Aktivlautsprecher 1 .
- Nach der Operation, während der Gewöhnung an den RekorderDing Zustand, spielen experimentelle Geräusche zufällig, mehrmals während des Tages und in verschiedenen Momenten 1 .
- Im experimentellen Zustand (während der Aufzeichnung von EEG / EMG / EKG-Daten) spielen Sie das Pseudo zufällig während der ersten 100 min bei Lichteinstellung (ZT0). Um den Lärm zu spielen, erfüllen die folgenden Bedingungen 1 :
- Vergewissern Sie sich, dass sich die Maus im Nicht-REM-Schlaf für> 40 s befindet.
- Stellen Sie sicher, dass die vorherige Exposition mehr als 4 min vor.
HINWEIS: Dies führt zu ~ 15 Belichtungen pro Sitzung.
- Markieren Sie den Beginn der Aufnahmezeit und den Beginn der Lärmbelastung. Halten Sie den Experimentator blind auf die spektrale Zusammensetzung des Nicht-REM-Schlafes während des Verfahrens.
- Erwerben Sie alle Daten mit polysomnographischer Software 1 , 29 .
5. Retrospektive Analyse des Schlafes basierend auf dem Verhaltensverhalten währendLärmschutz
- Manuelles Erfassen von EEG / EMG -ECG-Spuren in einer 4-s-Auflösung, ohne Kenntnis der Lärmbelastungszeiten 1 .
- Verwenden Sie ein benutzerdefiniertes Skript, um die EEG / EMG-ECG / Lärmbelastungsdaten 1 zu extrahieren.
- Ergebnis als Schlaf-Durchgang, wenn sowohl EEG- als auch EMG-Signale während der Lärmexposition unverändert bleiben ( Abbildung 3A ). Betrachten Sie eine Wake-up, wenn die EEG-Amplitude abnimmt und die EEG-Frequenz in Kombination mit der erkannten Muskelaktivität auf der EMG-EKG-Elektrode zunimmt ( Abbildung 3B ).
- Verwerfungsversuche, bei denen Tiere während der Vorstimulusperiode oder in den ersten 4 s der Lärmexposition aufgewacht wurden ( Abbildung 3D ).
- Definieren Sie die Erregungserfolgsrate als Anteil der Weckversuche in allen eingeschlossenen Versuchen ("Wake-up" und "Sleep-Through").
- In allen enthaltenen Studien, untersuchen die Dynamik der Sigma Macht während thE Vorreizperiode ( Abbildung 3 E ) 1 .

Abbildung 3. Behavioral Outcomes in Response to Noise Onset: Repräsentative Ergebnisse, die von der Analyse beibehalten oder ausgeschlossen wurden.
( AD ) Rohspuren des EEG (schwarz) und entsprechende EMG-EKG (grau) Signale für 40 s vor Rauschbeginn und während der 20 s Rauschen, dargestellt durch den blau-schattierten Bereich. Vigilanzzustände sind im Farbcode angegeben. Um Daten zu veranschaulichen, die in die Analyse aufgenommen wurden, werden repräsentative "Sleep-Through" ( A ) und "Wake-up" ( B ) Ereignisse gezeigt. Ergebnisse, die verworfen wurden, enthielten Übergänge zu REM-Schlaf ( C ) und eine frühreife "Wake-up" -Antwort ( D ). Die Einfügung zeigt eine ErweiterungDed Teil von EEG und EMG-EKG-Spuren charakteristisch für REM-Schlaf. ( E ) Typische Beispiele für Sigma-Leistungsdynamik im 40-s-Fenster vor Rauschbeginn während eines "Sleep-Through" (links) und eines "Wake-up" (rechts) Ereignisses. Die rohe EEG-Trace-Bandpass-gefiltert für das Sigma-Band ist oben gezeigt. Der blaue Bereich stellt den Rauschen dar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ergebnisse
Abbildung 2 A (obere Platte) zeigt 100-minütige Abschnitte des spontanen Schlaf-Wach-Verhaltens, aufgezeichnet durch polysomnographische Elektroden, die wie beschrieben implantiert wurden (siehe Abbildung 1 ). Die Erhöhungen und Abnahmen der EEG- und EMG-Amplitude bei Nicht-REM-Schlafbeginn sind deutlich sichtbar. Der intermittierende REM-Schlaf ist durch eine Abnahme der EEG-Amplitude und eine weitere Abnahme...
Diskussion
Hier zeigen wir, wie ein kontinuierliches zeitliches Profil des Nicht-REM-Schlafes aufgebaut wird, der EEG-, EMG- und EKG-Variablen integriert. Dies ist ein erster Schritt zur Entwicklung einer integrativen Beschreibung des Mausschlafes, die dazu beitragen kann, die bisher nicht erkannte Zeitskala zu identifizieren, über die bei Nicht-REM-Schlaf 1 hohe und geringe Geräuscharmität organisiert wird. Eine ähnliche zeitliche Struktur wurde auch im menschlichen Nicht-REM-Schlaf durch eine analoge ...
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Wir danken allen Labormitgliedern für ihren Beitrag zum Schreiben und sorgfältigen Lesen dieses Manuskripts. Wir danken Paul Franken für die Anregung von Diskussionen, Dr. Gisèle Ferrand für hilfreiche Kommentare zum chirurgischen Protokoll und Dr. Jean-Yves Chatton für die Bereitstellung der Original Labview ausführbaren Dateien für die Lärmbelastung. Die Finanzierung erfolgte durch den Schweizerischen Nationalfonds (Stipendien 31003A_146244 und 31003A_166318) und den Etat de Vaud.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3 x 2-channels | ENA AG | 2.316 | Raster 2.54 x 2.54 mm; size 5 x 8 x 9 mm; pin size 5 mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
Referenzen
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten