Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка инфра-медленной динамики спектральной мощности и частоты сердечных сокращений у спящих мышей
В этой статье
Резюме
Здесь мы представляем экспериментальные и аналитические процедуры для описания временной динамики нейронных и сердечных переменных не-REM-сна у мышей, которые модулируют реакцию сна на акустические стимулы.
Аннотация
Три состояния бдительности доминируют над жизнью млекопитающих: бодрствование, неточное движение глаз (non-REM) и REM-сон. По мере того, как у свободно перемещающихся животных выявляются больше нейронных коррелятов поведения, это трехкратное подразделение становится слишком упрощенным. Во время бодрствования ансамбли глобальной и местной кортикальной активности вместе с периферическими параметрами, такими как диаметр зрачков и симпатовагиальный баланс, определяют различные степени возбуждения. Остается неясным, в какой степени сон также образует континуум состояний мозга, в пределах которого степень устойчивости к сенсорным стимулам и возбудимости и, возможно, другие функции сна, постепенно меняются и как периферические физиологические состояния меняются. Исследования, продвигающие методы мониторинга нескольких параметров во время сна, а также приписывание созвездий этих функциональных атрибутов, имеют решающее значение для совершенствования нашего понимания сна как многофункционального процесса, в течение которого многие положительные эффекты должны бытьecuted. Идентификация новых параметров, характеризующих состояние сна, откроет возможности для новых диагностических путей при нарушениях сна.
Мы представляем процедуру описания динамических изменений состояния сна, не относящихся к REM, посредством комбинированного мониторинга и анализа сигналов электроэнцефалограммы (ЭЭГ) / электрокортикограммы (ЭКГО), электромиограммы (ЭМГ) и электрокардиограммы (ЭКГ) с использованием стандартных методов полисомнографической записи. Используя этот подход, мы обнаружили, что мышь без REM-сна организована в циклы координированных нейронных и сердечных колебаний, которые генерируют последовательные 25-секундные интервалы высокой и низкой хрупкости внешним стимулам. Поэтому центральные и вегетативные нервные системы координируются, чтобы сформировать поведенчески различные состояния сна во время консолидированного сна без REM. Мы представляем хирургические манипуляции для мониторинга полисомнографического ( т. Е. ЭЭГ / ЭМГ в сочетании с ЭКГ) для отслеживания этих циклов в свободной спящей мышце, анализ на квантыИх динамику и протоколы акустической стимуляции для оценки их роли в вероятности пробуждения. Наш подход уже был распространен на человеческий сон и обещает распутать общие принципы организации не-REM-состояний сна у млекопитающих.
Введение
Сон млекопитающих является поведенческим состоянием покоя и стойкостью к экологическим стимулам. Несмотря на очевидную однородность, полисомнографические и вегетативные параметры указывают на то, что сон перемещается между качественными и количественно различными нервными и соматическими состояниями в различных временных и пространственных масштабах 1 . От минут до десятков минут происходит переключение между не-REM и REM-сном. Не-REM-сон сопровождается высокоамплитудной низкочастотной активностью в ЭЭГ со спектральным пиком около 0,5-4 Гц, тогда как сон REM показывает регулярную активность ЭЭГ в тета-диапазоне (6-10 Гц) вместе с Мышечная атония 2 . В течение не-REM-сна люди проходят через свет (S2) и глубокий медленный спад (SWS). Как показывает их обозначение, эти две стадии показывают более низкие пороги возбуждения 3 , 4 соответственно, и они отличаются в основном плотностью низкочастотныхКодируют мощность коры EEG, называемую медленной активностью (SWA, 0,75-4 Гц). Неравномерность сохраняется во всех индивидуальных приступах S2 и SWS в момент времени до второй секунды, как широко документировано переменным присутствием SWA в течение боя 5 , 6 , но также с помощью ЭЭГ и ритмов потенциала поля при Более высокие частоты, включая волны шпинделя в сигма-диапазоне (10-15 Гц) и гамма-ритмах (80-120 Гц) (обзор см. В 7 , 8 , 9 , 10 ).
Вместо того, чтобы быть тонким, эти изменения сдвигают спящее кортикальное состояние у людей до крайностей спектра. Для не-REM-сна они варьируются от преобладания SWA до состояний, которые являются приблизительной волновой деятельностью, поскольку они содержат значительную долю высокочастотных компонентов 11 , 12 . У грызунов и кошек, хотя не-REM-сон не подразделяется на стадии, короткий период, называемый промежуточным сном (IS), возникает до начала REM-сна 13 . Во время ИБ возникают функции REM-сна, такие как тэта-активность гиппокампа и волны понто-геникуло-затылочных, в то время как не-REM-сигнатуры сна, такие как волны шпинделя и SWA, все еще присутствуют, указывая на смесь между двумя состояниями сна 14 , 15 . Тем не менее, ИС может быть функционально отличным, поскольку он модулируется антидепрессантами 16 и посредством представления новых объектов во время предшествующего пробуждения 17 , и это способствует установлению порога пробуждения 18 . Кроме того, состояния пространственных графиков параметров ЭЭГ и ЭМГ свободно движущихся крыс показывают группу точек 14, которая непрерывна между не-REM-сном, REM-сном и бодрствованием, Есть также спорадические снижения в SWA, не вступая в бодрствование или REM-сон, что приводит к существенным колебаниям относительного присутствия низко- и высокочастотных компонентов во время объединенного сна без повторного сна 14 , 19 , 20 . Наконец, переменные отношения SWA и высокочастотных ритмов во время не-REM-сна происходят не только во времени, но также показывают региональные различия в амплитуде и синхронизации между кортикальными областями 19 .
Безвременный сон млекопитающих далеко не единообразный. Однако неясно, не ясно ли такое неравномерность приводит к состояниям, которые отличаются функцией и поведенческими атрибутами. При различных типах нарушений сна непрерывный сон нарушается спонтанными пробуждениями и неправильным двигательным поведением. Кроме того, спектральный анализ показывает изменения относительного присутствия более высоких частот в ЭЭГ 21И в вегетативных параметрах, таких как показатели дыхания и сердечного избиения 22 . Таким образом, упорядоченная последовательность стабильных состояний сна возмущена, а элементы кортикального и / или вегетативного возбуждения вторгаются неконтролируемым образом. Поэтому понимание континуума состояний сна может иметь важное значение для болезни. Кроме того, возмущение сна из-за шума окружающей среды в городских условиях связано с общими рисками для здоровья, что делает его крайне важным для выявления моментов повышенной уязвимости во время сна 23 .
Экспериментальные эксперименты по пробуждению у спящих людей показывают, что наиболее тяжело пробудиться от сна, не связанного с ОВО (этап S3), в то время как легкий не-REM-сон (этап S2) и сон REM показывают сравнимые и меньшие пороги возбуждения 4 . Корковая обработка коротких звуковых раздражителей существенно различается между REM-сном, S2 и S3 24 ,25 , что указывает на то, что специфические для кортикальной структуры активности модулируют первые этапы сенсорной обработки. Для не-REM-сна у людей склонность к пробуждению в ответ на шум зависит от наличия волн шпинделя и альфа-ритмов в ЭЭГ 26 , 27 , 28 . Таламокортикальная ритмичность во время шпинделей сопровождается усилением синаптического торможения как на уровне таламуса, так и на кортикальном уровне, что, как считается, способствует ослаблению сенсорной обработки 7 .
Как организованы во времени шумопонижающие и уязвимые периоды сна и каковы их детерминанты? Как у мышей, так и у человека, мы недавно определили инфра-медленное колебание 0,02 Гц в нервных ритмах. В зависимости от фазы этого колебания 0,02 Гц мыши проявляли переменную реактивность на внешние раздражители, либо просыпались, либо спалиGh шум. Интересно, что это колебание коррелировало со скоростью сердцебиения, что указывает на то, что вегетативная нервная система участвует в модуляции уязвимости сна к внешним стимулам 1 . В этом ритме также были организованы ритмы гиппокампа, связанные с памятью, и, что наиболее поразительно, его сила коррелировала с качеством консолидации памяти у людей. Таким образом, осцилляция 0.02 Гц представляет собой организующий принцип грызуна и человеческого не-REM-сна, который модулирует как чувствительность к окружающей среде, так и обработку внутренней памяти. Это снова подчеркивает необходимость многопараметрической и непрерывной оценки состояний сна, чтобы признать их функциональность и идентифицировать сайты потенциальной уязвимости.
Здесь мы приводим процедуру извлечения формы волны этой динамики, включая хирургическую имплантацию мышей для комбинированных измерений ЭЭГ / ЭКГО и ЭМГ-ЭКГ, воздействие сенсорных раздражителей,Й анализ. Эта процедура обеспечивает основу для просмотра сна как непрерывно изменяющегося, но высоко организованного состояния бдительности, в ходе которого последовательно выполняются различные основные функции сна. В более общем плане, эта процедура применима к подходам, направленным на извлечение спектральных и автономных признаков, которые предшествуют поведенческому исходу во время сна как в состояниях здоровья, так и в болезнях.
протокол
Все экспериментальные процедуры были выполнены в соответствии с Комитетом по лечению животных Лозанны и Службой по связям с общественностью и департаментами по делам кантона де Во.
1. Хирургия для записей ЭЭГ / ЭМГ-ЭКГ
- Жилье и выбор животных.
- Держите животных (C57Bl / 6J, 7-9 недель, 25-30 г) в 12: 12-часовом темном / световом цикле, отдельно и в стандартных условиях (40% влажность, 22 ° C), с пищей и водой Доступный ad libitum .
- Используйте только мужчин, чтобы избежать всех влияний гормонального цикла на сон.
- Подготовка электродов.
- Постройте электроды EEG / ECoG (используемые на шаге 1.3.11) с использованием кусков золотой проволоки длиной ~ 0,5 см (75% Au, 13% Ag и 12% Cu, диаметр: 0,2 мм), каждый из которых припаян поверх золота Стальной винт (длина 3 мм, диаметр 1,1 мм у основания, см. FigurE 1). Подготовьте 2 электрода ЭЭГ на одно животное и очистите их в 70% этаноле.
- Подготовьте электроды ЭКГ-ЭКГ с золотыми проводами длиной 3 - 4 см (75% Au, 13% Ag и 12% Cu, диаметр 0,2 мм). Согните провода под углом 90 ° на 1 см от одного конца и подготовьте катушку (1 - 2 мм ø) на другом конце ( рис. 1 ). Между двумя концами согните провод, чтобы создать небольшую кривизну, соответствующую профилю поверхности кости между мозжечком и лямбдой.
- Подготовьте 2 электрода ЭКГ-ЭКГ на животное.
- Подготовьте 6-канальный разъем для гнездовой головки (растровый: 2,54 мм x 2,54 мм, размер: 5 мм x 8 мм x 9 мм, размер штифта: 5 мм, см. Рисунок 1 ).
- Закройте соединитель в основании как женских, так и штыревых контактов с помощью ленты.
- Добавьте небольшое количество паяльной проволоки к кончикам 4 из 6 штырей, чтобы помочь при пайке электродов ЭЭГ и ЭМГ-ЭКГ во время операции(См. Шаг 1.3.16).
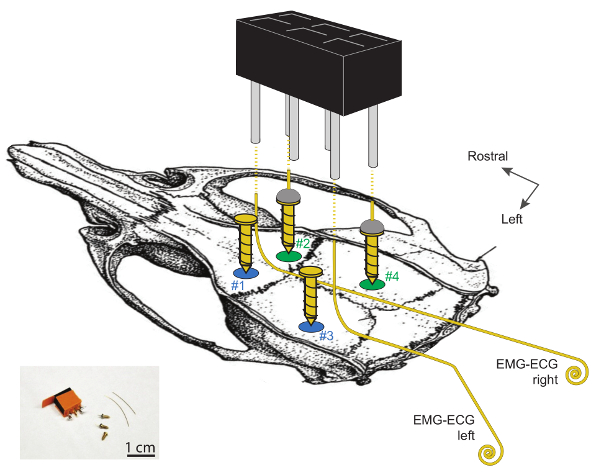
Рисунок 1 . Схематическое изображение участков для ЭЭГ и имплантации электрода ЭМГ на черепе мыши.
Краниотомии № 1 и № 2 расположены на расстоянии ~ 2 мм от средней линии и 2 мм от рострала до брегмы. Краниотомии № 3 и № 4 расположены на расстоянии 2 мм от рострала до лямбда и, соответственно, 4 и 2 мм поперечно к средней линии. Два электрода ЭЭГ, изготовленные из пайки золотой проволоки на вершине позолоченного стального винта (№ 2 и № 4), находятся в правом полушарии. В качестве опор служат 2 левых винта (# 1 и # 3). Обратите внимание, что электроды ЭМГ-ЭКГ не должны контактировать с этими двумя опорными винтами. Электроды ЭМГ-ЭКГ представляют собой золотые провода длиной 3 - 4 см, изогнутые под углом 90 ° на 1 см на их ростральных концах и свернутые (1 - 2 мм ø) на хвостовых концах. Электроны 2 ЭЭГ и 2 ЭМГS подключаются к 2 x 3-канальному разъему головки путем пайки одного провода на один угловой штырь, как показано пунктирными линиями. Более подробную информацию об этих электродах и их имплантации можно найти В 29 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Имплантационная хирургия.
- Анестезируйте животное в камере, индуцирующей изофлуран (4-5% изофлуран + O 2 при 1 - 2 л / мин в течение 3 - 4 мин). Внедрить 5 мкг / г carprofen внутрибрюшинно (ip) при удалении мыши из камеры до стереотаксической фиксации.
- Следуйте стандартным процедурам для фиксации мыши на стереотаксическом аппарате. Поддерживать изофлурановую анестезию через противогаз (3% изофлуран + O 2 во время фиксации при 1 л / мин). Поддерживайте температуру тела во время операции при 37 ° C.Ga грелка.
- Защитите глаза от высыхания, применяя мазь витамина А. Проверьте уровень хирургической толерантности животного, проверив рефлекс отмены лапы.
- Закрепите головку, поместив уши в череп с их тупыми, обратными концами, а не своими кончиками (без входа в ушные каналы). 29 . Расположите полость рта (как обычно), чтобы обеспечить горизонтальность головы.
ПРИМЕЧАНИЕ. Фиксация минимизирует повреждение ушей, что важно для экспериментов по акустическому пробуждению (см. Раздел 4 этой процедуры). - Контролируйте дыхание животного во время процедуры, которое должно оставаться на 2-3 дыхания / 2 с. При необходимости отрегулируйте концентрацию изофлюрана в газовом распределителе; Он должен постепенно уменьшаться во время операции, от 3% при фиксации до 1,0-1,5% к концу процедуры.
- Внедрить 100 мкл 0,9% NaCl ip один раз в час с использованием ультратонких инсулиновN шприц, чтобы держать животное гидратированным.
- Убедитесь, что голова животного освещена ярким источником света.
- Очистите область с помощью 70% EtOH и дезинфицирующего средства на основе йода (мокрый мех предотвращает попадание волос в хирургическое окно).
- Поднимите кожу в центре черепа с помощью щипцов Adson и аккуратно отрежьте поднятую часть кожи вдоль средней линии, от верхней части шеи до уровня глаз, используя тонкие ножницы. Удалите скальп (~ 1 см переднезадней, ~ 0,5 - 0,8 см в поперечном направлении).
- Убедитесь, что окно достаточно большое (по обе стороны), чтобы четко видеть брегму и лямбда-трещины черепа. Закрепите кожу с обеих сторон бульдогными серфинами, чтобы обеспечить доступ к кости.
- Удалите конъюнктивную ткань (надкостницу), тщательно царапая скальпелем. Очистите область с помощью дезинфицирующего средства на основе йода и высушите череп антисептическим мазком.
- Используя острое лезвие скальпеля (размер 15), поцарапайте sKull для получения очищенной и матированной поверхности кости. Используя только наконечник скальпеля, почистите сетчатую сетку канавок с расстоянием ~ 1 - 2 мм между канавками.
ПРИМЕЧАНИЕ. Это улучшает прикрепление двухкомпонентного эпоксидного клея к черепу на шаге 1.3.15. - Используйте микротребус с размером сверла 1/005 для выполнения 4 черепах (~ 0,7 мм ø) в черепе в определенных местах ( рис. 1 , также см. Шаг 1.3.11.3.). Удалите костную пыль с помощью пипетки Пастера и очистите любое кровотечение антисептическими тампонами.
- Если происходит кровотечение, убедитесь, что он полностью остановлен, прежде чем возобновлять процесс. Используйте гемостатическую губку для ускорения гемостаза.
- Используйте две краниотомии в правом полушарии, чтобы вставить винт-электроды (краниотомии № 2 и № 4).
- Используйте две краниотомии в левом полушарии, чтобы вставить крепежные винты, которые стабилизируют имплантат (краниотомии № 1 и № 3).
ПРИМЕЧАНИЕ. Чтобы увеличитьБыла установлена до 4 крепежных винтов 29 .
ПРИМЕЧАНИЕ: Точные стереотаксические координаты: 2 мм от средней линии на обоих полушариях и 2 мм ростраль от брегмы (краниотомии № 1 и № 2), 2 мм ростраль от лямбда и 4 мм латерально-левого от средней линии (краниотомия № 3), 2 мм ростраль от лямбда и 2 мм латерально-правого от средней линии (краниотомия № 4). См. Рис. 1 .
- В левом полушарии закрутите два позолоченных винта через краниотомию для поддержки.
- Закрепите винт в гемостатическом зажиме и держите его вертикально над краниотомией. Тщательно подойти к нижней части винта поверх краниотомии. Поверните его, не отклоняясь от вертикального положения.
ПРИМЕЧАНИЕ. Для получения хорошей механической стабильности и высококачественных сигналов при минимальном давлении на подстилающую ткань 25 достаточно только 1,5 оборотов. - Справа винт(Описанные на шаге 1.2.1) через краниотомию.
- Закрепите винт в гемостатическом зажиме и держите его вертикально над краниотомией. Тщательно подойти к нижней части винта поверх краниотомии. Поверните его, не отклоняясь от вертикального положения.
- С помощью щипцов осторожно поднимите границу кожи с мышц шеи. Вставьте провода ЭМГ-ЭКГ, со спиральными концами внутри мышц (влево и вправо). Приклейте средние части к черепу, чтобы левая ЭКГ-ЭКГ появилась рядом с задним левым анкерным винтом, а правая ЭМГ-ЭКГ была расположена рядом с передним левым анкерным винтом.
- Чтобы обнаружить сигналы ЭКГ от сердца во время сна, убедитесь, что провода ЭМГ-ЭКГ вставляются в мышцу на глубину ~ 0,8-1 см, а петля заканчивается как можно дальше друг от друга.
- Используйте шпатель, покрытый двухкомпонентным эпоксидным клеем, для нанесения клея на череп между винтами и вокруг них. Дайте ему высохнуть на свету, но защитите глаза животного от чрезмерной молнии.
ПРИМЕЧАНИЕ. Основания винтов должны быть закрыты, и только провода должны быть доступны, возникающие frОм клей. - Убедитесь, что клей заполняет пространство между двумя электродами ЭМГ-ЭКГ, простирающимися от поверхности, так что между ними и опорными винтами нет электрического контакта. Будьте осторожны, не склеивайте кожу с черепом; Кожа должна оставаться свободной для перемещения по клею.
- Отрежьте провода ЭЭГ и ЭМГ-ЭКГ, чтобы они достигали ~ 0,5 мм от клея. Припаяйте четыре штыря к углу разъема, подготовленному на шаге 1.2.3. К четырем проводам, выходящим из клея ( рис. 1 ).
- Постарайтесь как можно ближе поместить контакты разъема, чтобы свести к минимуму высоту имплантата; Используйте небольшой крестообразный зажим, прикрепленный к стереотаксическому держателю, который поддерживает положение разъема. Минимизируйте время контакта с паяльником, так как это быстро нагревает винты.
- Заполните пространство между клеем и коннектором зубным цементом, чтобы покрыть припаянные детали. Создать smooГо лица и избегать острых краев, которые могут повредить животное. Кроме того, не прикасайтесь к коже, так как это приводит к зуду.
- Удалите бульдог serrefines. При необходимости закройте рану, используя стерильную нить (абсорбируемое шовное волокно) спереди и сзади соединителя, создавая простые, прерывистые укупорочные узоры и два квадратных узла (5-0 игла FS-3, нить 45 см).
- Следите за животным, пока он не проснется полностью. Взвесьте животное после операции и верните его в свою домашнюю клетку для выздоровления.
- Послеоперационный уход и подключение к системе.
- Следите за животными каждый день в течение недели. Ищите потерю веса, уменьшенную или ненормальную активность и признаки инфекций. Следуйте процедуре подсчета баллов, установленной вашими ветеринарными органами.
- Через 5-6 дней после операции подключите кабель для записи к разъему головки животного, оставив его в своей домашней клетке. Подождите еще 4 - 5 дней до начала рекордераЧтобы животное привыкло к этому состоянию и естественно спалось.
2. Базовая оценка данных ЭЭГ / ЭМГ-ЭКГ для определения состояния бдительности
- Запишите данные ЭЭГ и ЭМГ-ЭКГ за 48 ч с помощью коммерческого полисомнографического программного обеспечения ( например, Somnologica, SleepSign или Sirenia). Используйте типичные настройки, например, увеличение в 2000x; Частота дискретизации 2000 Гц при получении, вниз с дискретизацией до 200 Гц после ее приобретения; И высокочастотный фильтр 0,7 Гц для ЭЭГ и фильтр верхних частот 10 Гц для ЭМГ-ЭКГ.
- Экспортируйте данные в формате файла .edf.
- Откройте «.edf» файлы с помощью специально написанного ( например, в Matlab) программного обеспечения, которое автоматически автоматически классифицирует каждую 4-ю эпоху как активный, не-REM-сон, REM-сон и соответствующие артефакты.
ПРИМЕЧАНИЕ. В качестве альтернативы доступно несколько полуавтоматических программ. Эта процедура описывает некоторые из основных шагов, которые необходимо выполнить для настройки забивания wС использованием программного обеспечения для подсчета очков; Другие полуавтоматические системы подсчета очков могут основываться на других параметрах. - Используя программное обеспечение, отделяйте файлы «.edf» в 4 раза за 12 часов записи.
- Удалите артефакты, которые возникают из-за активности EMG -ECG, присутствующей в сигнале ЭЭГ, или из неприемлемого поведенческого состояния 1 , 29 .
- Вычислить среднее значение абсолютной ЭЭГ ( среднее значение ЭЭГ) и ЭМГ ( среднее значение ЭМГ) в течение 12 ч записей из ЭЭГ и следов ЭМГ-ЭКГ, соответственно.
- Определите средние значения ЭЭГ / ЭМГ для каждой 4-й эпохи (ЭЭГ Эпоха / ЭМГ Эпоха ).
- Классифицировать эпохи , как "Wake" , когда EEG Epoch среднего и EMG Epoch> ЭМГ означают и как "Non-REM сна" , когда EEG Epoch> EEG среднего и EMG Epoch виду.
- Классифицируйте эпохи, которые не Устраняя эти критерии с помощью алгоритма корректировки, основанного на предшествующих и последующих эпохах.
- Классифицируйте эпохи как REM-сон, когда EEG Epoch mean и EMG Epoch mean .
- Уточните критические моменты, такие как переходы от не-REM-сна до следа, эпохи сна REM и микро-пробуждения во время сна без REM. Визуально осмотрите счет, чтобы обеспечить правильное определение состояния бдительности 29 , 30 .
ПРИМЕЧАНИЕ. Всегда выполняйте окончательный визуальный осмотр и проверку результатов.
3. Анализ инфра-медленного колебания для ЭЭГ и сердечных сокращений
- Для этого анализа выберите только не-REM спящие поединки длительностью ≥ 96 с ( т. Е. Не менее 24 эпох 4 с); См. Рисунок 2 .
ПРИМЕЧАНИЕ. Индивидуальные подпрограммы доступны по запросу 1 .

Рисунок 2 . Определение динамики сигма-мощности во время невозбужденного сна без REM.
( A ) Верхняя, EEG (черная) и EMG-ECG (серая) трассы в течение первых 100 минут световой фазы у одной мыши. Состояние бдительности обозначается цветной полосой поверх исходных трасс. Средний, типичный пример непрерывного (> 96-секундного) сна без повторного сна. Внизу - случайный, 16-секундный интервал, который иллюстрирует разбиение на 4-х эпохи. Следующий шаг анализа показан только для этих четырех эпох, но он действителен для каждой эпохи, содержащейся в бою. ( B ) Верхний, четыре последовательных БПФ, сформированных из 4-х эпох, показанных на нижней панели А. Сигма-диапазон (10-15 Гц) затенен красным. Верхний правый, 1-й вставка из последней эпохи, показывающая R-волны, присутствующие в квадрате сигнала ЭМГ-ЭКГ. Нижняя граница времени Сигма, выделенная из соответствующего выше спектра. Пунктирные линии иллюстрируют продолжение значений мощности до и после четырех бонусов без REM, выбранных для отображения. ( C ) Нормированная сигма (красный) и пульс (в ВРМ) (серый), а часть, изображенная на (B), расположена между вертикальными пунктирными линиями. Ниже представлен соответствующий отфильтрованный сигнал ЭЭГ в сигма-диапазоне (10-15 Гц). ( D ) Результат БПФ, вычисленный по времени сигма-мощности, показанный в (C), демонстрирующий доминирующий пик при 0,016 Гц. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Извлеките значения мощности для спектральной мощности сигма-полосы (10-15 Гц) в 4-х ячейках ( рис. 2А и В ), используя вычисления быстрых преобразований Фурье (БПФ)"> 1.
- Вычислить спектральную мощность базовой линии для не-REM-сна путем усреднения значений в каждом частотном бункере для всех не-REM-периодов сна (артефакты и эпохи перехода между состояниями бдительности исключаются из этого усреднения). Нормализовать значения сигма-мощности каждой эпохи на среднюю мощность сигма-диапазона во время не-REM-сна за интересующий период времени. График против времени ( рисунок 2 C ).
- Вычислите БПФ времени сигма-мощности с окном Хэмминга, чтобы выявить колебательные частотные составляющие динамики мощности ( рисунок 2 D ) 1 .
- Обратите внимание, что, так как бит сна без REM имеет разные длительности, результирующие FFT имеют разные частотные разрешения. Интерполируйте, чтобы отрегулировать разрешение до самого высокого, полученное из самого длинного боя сна без REM, и усреднить БПФ всех боев.
- Продолжайте эти анализыEs для описания фазовых соотношений между динамикой ЭЭГ и сигналов ЭКГ.
- Извлечь данные сердечного ритма из квадрата сигнала ЭМГ-ЭКГ после 30-Гц фильтрации верхних частот, используя соответствующие процедуры для пикового обнаружения волны R.
ПРИМЕЧАНИЕ. Ограничение минимального интервала времени между двумя последовательными R-волнами до 80 мс помогает избежать включения случайных артефактивных пиков из-за мышечного подергивания 1 . - Измерьте интервалы RR и рассчитайте среднее значение сердечного ритма в ударах в минуту (BPM) каждые 4-х лунок ( рисунок 2 B и C ).
4. Воздействие шума
- Генерировать шумы (т. Е. Белый шум) через специализированное программное обеспечение. Установите продолжительность до 20 с и интенсивность до 90 дБ SPL (измеряется внутри клетки). Воспроизведение шумов через стандартные активные громкоговорители 1 .
- После операции, во время привыкания к рекордуДинь, произвольно воспроизводить экспериментальные шумы, несколько раз в течение дня и в разные моменты времени 1 .
- В экспериментальном состоянии (при записи данных ЭЭГ / ЭМГ / ЭКГ) шум воспроизведения псевдонаучно в течение первых 100 мин при начале света (ZT0). Чтобы воспроизвести шум, выполните следующие условия: 1 :
- Убедитесь, что мышь находилась в режиме без повторного сна в течение> 40 с.
- Убедитесь, что предыдущая экспозиция произошла более 4 минут.
ПРИМЕЧАНИЕ. Это приводит к ~ 15 экспозициям за сеанс.
- Отметьте начало времени записи и начало каждой помехи. Следите за тем, чтобы экспериментатор не следил за спектральным составом не-REM-сна во время процедуры.
- Приобретите все данные с помощью полисомнографического программного обеспечения 1 , 29 .
5. Ретроспективный анализ сна на основе поведенческих результатов во времяВоздействие шума
- Вручную оценивайте трассировку EEG / EMG -ECG с разрешением 4 с без знания времени экспозиции шума 1 .
- Используйте специально написанный сценарий для извлечения данных об экспонировании EEG / EMG -ECG / noise 1 .
- Оценка как сна, когда сигналы ЭЭГ и ЭМГ остаются неизменными во время воздействия шума ( рис. 3А ). Рассмотрим пробуждение при уменьшении амплитуды ЭЭГ и увеличении частоты ЭЭГ в сочетании с обнаруженной мышечной активностью на ЭМГ-ЭКГ-электроде ( рис. 3В ).
- Откажитесь от испытаний, в которых животные проснулись во время периода предварительного стимула или в первые 4 с воздействия шума ( рисунок 3D ).
- Определите коэффициент успешности возбуждения как долю пробуждений во всех включенных в него исследованиях («Пробуждение» и «Сон через»).
- Во всех включенных исследованиях исследуйте динамику сигма-силы во времяE период предварительного стимула ( рисунок 3 E ) 1 .

Рисунок 3 . Поведенческие результаты в ответ на шум: представительские результаты, которые были оставлены или исключены из анализа.
( AD ) Сырые следы ЭЭГ (черный) и соответствующие сигналы ЭМГ-ЭКГ (серый) в течение 40 с до начала шума и в течение 20 с шума, представленного синей заштрихованной областью. Состояние бдительности указывается в цветовом коде. Чтобы проиллюстрировать данные, которые были включены в анализ, показаны типичные события «Спящий» ( A ) и «Wake-up» ( B ). Результаты, которые были отброшены, содержали переходы в сон REM ( С ) и ранний ответ «пробуждения» ( D ). Вставка показывает расширениеВыделенной части EEG и EMG-ЭКГ, характерных для REM-сна. ( E ) Типичные примеры динамики сигма-мощности в 40-секундном окне до появления шума во время «сна» (слева) и события «пробуждения» (справа). Показанная выше необработанная полоса пропускания ЭЭГ для сигма-диапазона показана выше. Синяя область представляет собой шум. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Рисунок 2 A (верхняя панель) показывает 100-минутные отрезки спонтанного поведения во время сна, записанные через полисомнографические электроды, имплантированные, как описано (см. Рис. 1 ). Наблюдается заметное увеличение и умень...
Обсуждение
Здесь мы покажем, как установить непрерывный временный профиль не-REM-сна, который объединяет переменные ЭЭГ, ЭМГ и ЭКГ. Это первый шаг к разработке интегративного описания спящего режима мыши, который может помочь идентифицировать ранее непризнанный временной шкал, по которому организ...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы благодарим всех членов лаборатории за их вклад в письмо и тщательное прочтение этой рукописи. Мы благодарны Полю Франкену за стимулирование дискуссий, доктор Гизель Ферран за полезные комментарии к хирургическому протоколу и д-р Жан-Ив Чаттон за предоставление оригинальных исполняемых файлов Labview для воздействия шума. Финансирование предоставило Швейцарский национальный научный фонд (гранты 31003A_146244 и 31003A_166318) и Etat de Vaud.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3x2-channels | ENA AG | 2.316 | Raster 2.00 x 2.00 mm; size 5x8x9 mm; pin size 5mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
Ссылки
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены