Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación de la dinámica infrarroja de la potencia espectral y la frecuencia cardíaca en ratones dormidos
En este artículo
Resumen
Aquí, presentamos procedimientos experimentales y analíticos para describir la dinámica temporal de las variables neuronales y cardíacas del sueño no REM en ratones, que modulan la respuesta del sueño a los estímulos acústicos.
Resumen
Tres estados de vigilancia dominan la vida de los mamíferos: vigilia, sueño no rápido del movimiento ocular (no REM) y sueño REM. A medida que se identifican más correlatos neuronales del comportamiento en animales que se mueven libremente, esta subdivisión triple se vuelve demasiado simplista. Durante la vigilia, los conjuntos de actividades corticales globales y locales, junto con parámetros periféricos como el diámetro pupilar y el equilibrio simpatovagal, definen varios grados de excitación. Todavía no está claro hasta qué punto el sueño también forma un continuo de estados cerebrales -en el que el grado de resistencia a los estímulos sensoriales y la capacidad de despertar, y tal vez otras funciones del sueño- varían gradualmente y cómo los estados fisiológicos periféricos varían. La investigación que avanza los métodos para vigilar múltiples parámetros durante el sueño, así como atribuir a las constelaciones de estos atributos funcionales, es fundamental para perfeccionar nuestra comprensión del sueño como un proceso multifuncional durante el cual muchos efectos beneficiosos deben ser exEcuted La identificación de parámetros novedosos que caracterizan los estados de sueño abrirá oportunidades para nuevas vías diagnósticas en los trastornos del sueño.
Presentamos un procedimiento para describir las variaciones dinámicas de los estados de sueño no REM del ratón mediante la monitorización y el análisis combinados de señales de electroencefalograma (EEG) / electrocorticograma (ECoG), electromiograma (EMG) y electrocardiograma (ECG) usando técnicas estándar de grabación polisomnográfica. Utilizando este enfoque, encontramos que el sueño no REM del ratón se organiza en ciclos de oscilaciones neurales y cardíacas coordinadas que generan sucesivos intervalos de 25 s de alta y baja fragilidad a estímulos externos. Por lo tanto, los sistemas nerviosos centrales y autónomos están coordinados para formar estados de sueño conductuales distintos durante el sueño consolidado no REM. Presentamos las manipulaciones quirúrgicas para monitorización polisomnográfica ( es decir, EEG / EMG combinado con ECG) para rastrear estos ciclos en el ratón libremente dormido, el análisis a cuantiFy su dinámica, y los protocolos de estimulación acústica para evaluar su papel en la probabilidad de despertar. Nuestro enfoque ya se ha extendido al sueño humano y promete desentrañar los principios comunes de organización de los estados de sueño no REM en los mamíferos.
Introducción
El sueño de los mamíferos es un estado conductual de descanso y de resistencia a los estímulos ambientales. A pesar de esta aparente uniformidad, los parámetros polisomnográficos y autonómicos indican que el sueño se mueve entre los estados neural y somático cualitativamente y cuantitativamente diferentes en varias escalas temporales y espaciales 1 . En cuestión de minutos a decenas de minutos, se produce el cambio entre el sueño REM y REM. El sueño no REM se acompaña de una actividad de gran amplitud y baja frecuencia en el EEG, con un pico espectral alrededor de ~ 0,5-4 Hz, mientras que el sueño REM muestra actividad EEG regular en la banda teta (6-10 Hz), junto con Atonia muscular 2 . Dentro del sueño no REM, los seres humanos circulan a través de la luz (S2) y el sueño profundo de onda lenta (SWS). Como su nombre lo indica, estas dos etapas muestran un menor y más alto umbral de excitación 3 , 4 , respectivamente, y difieren principalmente en la densidad de baja frecuenciaEnergía de EEG cortical, denominada actividad de onda lenta (SWA, 0,75-4 Hz). La no uniformidad persiste a lo largo de los episodios individuales de S2 y SWS en la escala de tiempo minuto a sub-segundo, como está ampliamente documentado por la presencia variable de SWA en el transcurso de un combate 5 , 6 , pero también por EEG y ritmos potenciales de campo en Frecuencias más altas, incluyendo ondas de huso en la banda sigma (10-15 Hz) y ritmos gamma (80-120 Hz) (para una revisión, ver 7 , 8 , 9 , 10 ).
En lugar de ser sutiles, estas variaciones cambian el estado cortical del sueño en los seres humanos hasta los extremos del espectro. Para el sueño no REM, estos van desde un predominio de SWA a estados que se aproximan a la actividad de despertar porque contienen una proporción sustancial de componentes de alta frecuencia 11 , 12 . En roedores y gatos, aunque el sueño no REM no se subdivide en etapas, un breve período llamado sueño intermedio (IS) emerge antes del inicio del sueño REM 13 . Durante IS, características REM del sueño, tales como la actividad del hipocampo theta y las ondas de iniciar, mientras firmas sueño no REM, como las ondas de husillo y SWA, todavía están presentes ponto-geniculo-occipital, lo que indica una mezcla entre los dos estados de sueño 14, 15. Sin embargo, la IS puede ser funcionalmente distinta porque está modulada por los antidepresivos 16 ya través de la presentación de nuevos objetos durante el despertar previo 17 , y contribuye a establecer el umbral de excitación 18 . Además, las gráficas espaciales de los parámetros EEG y EMG de las ratas que se mueven libremente muestran un grupo de puntos 14 que es continuo entre el sueño no REM, el sueño REM y la vigilia. También hay declinaciones esporádicas en SWA, sin entrar en la vigilia o el sueño REM, lo que conduce a fluctuaciones sustanciales en la presencia relativa de los componentes de baja y alta frecuencia durante un consolidado no sueño REM 14 , 19 , 20 . Finalmente, las proporciones variables de SWA y ritmos de mayor frecuencia durante el sueño no REM se producen no sólo en el tiempo, pero también muestran diferencias regionales en la amplitud y la sincronización entre las áreas corticales [ 19] .
El sueño no REM de los mamíferos está lejos de ser uniforme. Sin embargo, si tal no uniformidad conduce a estados que difieren en funciones y atributos de comportamiento no está claro. En varios tipos de trastornos del sueño, el sueño continuo es interrumpido por despertares espontáneos y comportamiento motor inapropiado. Además, los análisis espectrales muestran alteraciones en la presencia relativa de frecuencias más altas en el EEG 21Y en los parámetros autonómicos, como las tasas de respiración y latidos cardíacos [ 22] . La secuencia ordenada de estados de sueño estables es así perturbada, y los elementos de excitación cortical y / o autónoma se introducen de manera incontrolada. Por lo tanto, la comprensión del continuo de los estados de sueño es de posible relevancia para la enfermedad. Además, la perturbación del sueño por el ruido ambiental en ambientes urbanos se asocia con riesgos generales para la salud, lo que hace crucial para identificar los momentos de mayor vulnerabilidad durante el sueño 23 .
Los experimentos de excitación conductual en seres humanos durmientes indican que es más difícil despertarse del sueño no REM dominado por SWA (estadio S3), mientras que el sueño ligero no REM (etapa S2) y el sueño REM muestran umbrales de excitación comparables y menores 4 . El procesamiento cortical de los estímulos sonoros cortos varía sustancialmente entre el sueño REM, S2 y S3 24 ,25 , indicando que los patrones de actividad cortical específicos del estado modulan las primeras etapas del procesamiento sensorial. Para el sueño no REM en los seres humanos, la propensión a despertar en respuesta al ruido varía con la presencia de ondas de huso y los ritmos alfa en el EEG 26 , 27 , 28 . La ritmicidad talamocortical durante los husos se acompaña de una mayor inhibición sináptica en ambos niveles talámico y cortical, que se cree que contribuyen a la atenuación del proceso sensorial [ 7] .
¿Cómo se organizan los períodos de sueño resistentes al ruido y vulnerables en el tiempo y cuáles son sus determinantes? Tanto en ratones como en seres humanos, recientemente identificamos una oscilación infra-lenta de 0,02 Hz en los ritmos neurales. Dependiendo de la fase de esta oscilación de 0,02 Hz, los ratones mostraron reactividad variable a estímulos externos, ya sea despertando o durmiendoGh el ruido. Curiosamente, esta oscilación se correlacionó con la tasa de latidos cardíacos, lo que indica que el sistema nervioso autónomo participa en la modulación de la vulnerabilidad del sueño a estímulos externos [ 1] . Ritmos hipocampales relacionados con la memoria también se organizaron dentro de este ritmo, y, lo más sorprendente, su fuerza correlacionada con la calidad de la consolidación de la memoria en los seres humanos. La oscilación de 0,02 Hz, por lo tanto, parece ser un principio organizador de roedores y el sueño humano no REM que modula la sensibilidad al medio ambiente y el procesamiento de la memoria interna. Esto nuevamente resalta la necesidad de evaluaciones multiparamétricas y continuas de estados de sueño para reconocer su funcionalidad e identificar sitios de potencial vulnerabilidad.
Aquí presentamos un procedimiento para extraer la forma de onda de estas dinámicas, incluyendo la implantación quirúrgica de ratones para mediciones combinadas EEG / ECoG y EMG-ECG, exposición a estímulos sensoriales,Nd rutinas de análisis. Este procedimiento proporciona una base para ver el sueño como un estado de vigilancia continuamente variable pero altamente organizado durante el cual diferentes funciones de sueño fundamentales se ejecutan secuencialmente. De manera más general, el procedimiento es aplicable a enfoques que buscan extraer las características espectrales y autonómicas que preceden a un resultado conductual durante el sueño tanto en estados de salud como en estados de enfermedad.
Protocolo
Todos los procedimientos experimentales se realizaron de acuerdo con el Comité de Cuidado de Animales de la Universidad de Lausana y el Servicio de la Consommación y de los Asuntos Vétérinaires del Cantón de Vaud.
1. Cirugía para grabaciones de EEG / EMG-ECG
- Vivienda y selección de animales.
- Mantenga los animales (C57Bl / 6J, 7 - 9 semanas, 25 - 30 g) en un ciclo de oscuridad / luz de 12:12 h, alojados individualmente y bajo condiciones estándar (40% de humedad, 22ºC), con alimentos y agua Disponible ad libitum .
- Use sólo sujetos masculinos para evitar todas las influencias del ciclo hormonal en el sueño.
- Preparación de electrodos.
- Construir electrodos EEG / ECoG (usados en el paso 1.3.11) usando trozos de alambre de oro de 0,5 cm de largo (75% Au, 13% Ag y 12% Cu, diámetro: 0,2 mm), soldados cada uno tornillo de acero -plated (3 mm de longitud, diámetro de 1,1 mm en la base; ver FigurE 1). Preparar 2 electrodos EEG por animal y limpiarlos en etanol al 70%.
- Preparar electrodos EMG-ECG con hilos de oro de 3 a 4 cm de longitud (75% Au, 13% Ag y 12% Cu, diámetro: 0,2 mm). Doble los cables a un ángulo de 90 ° a 1 cm de un extremo y prepare una bobina (1 - 2 mm ø) en el otro extremo ( Figura 1 ). Entre los dos extremos, doblar el alambre para crear una pequeña curvatura que corresponde al perfil de la superficie del hueso entre el cerebelo y el lambda.
- Prepare 2 electrodos EMG-ECG por animal.
- Prepare un conector hembra a macho de 6 canales (ráster: 2,54 mm x 2,54 mm, tamaño: 5 mm x 8 mm x 9 mm, tamaño de la clavija: 5 mm, ver figura 1 ).
- Cubra el conector en la base de las clavijas hembra y macho con cinta adhesiva.
- Añadir una pequeña cantidad de alambre de soldadura a las puntas de 4 de los 6 pines macho para ayudar con la soldadura de los electrodos EEG y EMG-ECG durante la cirugía(Véase el paso 1.3.16).
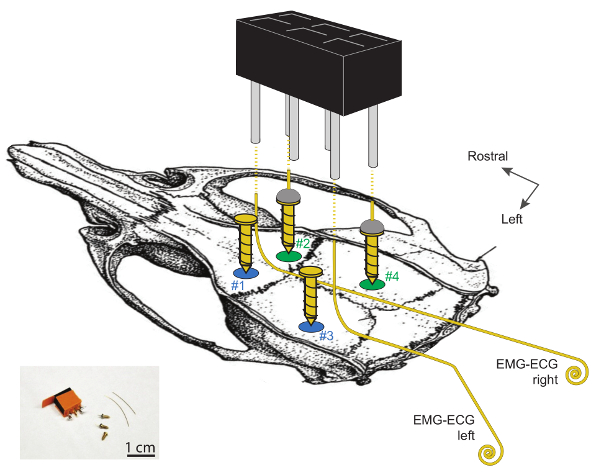
Figura 1 . Visualización esquemática de los sitios para la implantación de electrodos EEG y EMG en el cráneo del ratón.
Las craniotomías # 1 y # 2 se localizan ~ 2 mm laterales a la línea media y ~ 2 mm rostrales a bregma. Las craniotomías # 3 y # 4 se localizan ~ 2 mm rostral a lambda y son, respectivamente, 4 y 2 mm laterales a la línea media. Los dos electrodos EEG, hechos de soldar un alambre de oro a la parte superior de un tornillo de acero chapado en oro (# 2 y # 4) están en el hemisferio derecho. Los 2 tornillos de la izquierda (# 1 y # 3) sirven como soportes. Tenga en cuenta que los electrodos EMG-ECG no deben estar en contacto con estos 2 tornillos de soporte. Los electrodos EMG-ECG son hilos de oro de 3 a 4 cm de longitud, doblados en ángulos de 90 ° en sus extremos rostrales y enrollados (1 - 2 mm ø) en los extremos caudales. El electrodo 2 EEG y 2 EMGS están conectados al conector de cabeza de 2 x 3 canales soldando un alambre a un pin curvado, como se muestra en las líneas de trazos. Se puede encontrar más información detallada sobre estos electrodos y su implantación En 29 . Haga clic aquí para ver una versión más grande de esta figura.
- Cirugía de implante.
- Anestesiar al animal en una cámara inductora de isoflurano (4 - 5% isoflurano + O 2 a 1 - 2 L / min durante 3 - 4 min). Inyectar 5 μg / g de carprofeno intraperitonealmente (ip) al retirar el ratón de la cámara, antes de la fijación estereotáctica.
- Siga los procedimientos estándar para fijar el ratón en el aparato estereotáxico. Mantener la anestesia con isoflurano a través de una máscara de gas (3% de isoflurano + O 2 durante la fijación a 1 L / min). Mantener la temperatura corporal a lo largo de la cirugía a 37 ° C usinGa calefacción almohadilla.
- Proteja los ojos de la sequedad mediante la aplicación de ungüento de vitamina A. Compruebe el nivel de tolerancia quirúrgica del animal mediante la prueba del reflejo de retirada de la pata.
- Fije la cabeza colocando las barras del oído en el cráneo con sus extremos romos, invertidos en lugar de sus puntas (sin entrar en los conductos auditivos) 29 . Coloque la barra de la boca (como de costumbre) para asegurar la horizontalidad de la cabeza.
NOTA: La fijación minimiza el daño a los oídos, lo que es importante para los experimentos de excitación acústica (ver sección 4 de este procedimiento). - Vigile la respiración del animal durante el procedimiento, que debe permanecer a ~ 2 - 3 respiraciones / 2 s. Ajuste la concentración de isoflurano en el dispensador de gas si es necesario; Debe disminuir poco a poco durante la cirugía, de 3% durante la fijación a 1,0 - 1,5% hacia el final del procedimiento.
- Inyectar 100 μl de 0,9% de NaCl ip una vez por hora utilizando un ultra-fino insuliN para mantener el animal hidratado.
- Asegúrese de que la cabeza del animal está iluminada por una fuente de luz brillante.
- Limpie el área con EtOH al 70% y desinfectante a base de yodo (la piel húmeda impide que el pelo entre en la ventana quirúrgica).
- Levante la piel en el centro del cráneo con fórceps de Adson y corte suavemente la porción elevada de la piel a lo largo de la línea media, desde la parte superior del cuello hasta el nivel de los ojos, usando unas tijeras finas. Quitar el cuero cabelludo (~ 1 cm anteroposterior, ~ 0,5 - 0,8 cm lateral).
- Asegúrese de que la ventana es lo suficientemente grande (hacia ambos lados) para ver claramente el bregma y las fisuras lambda del cráneo. Fijar la piel en ambos lados con bulldog serrefines para asegurar el acceso al hueso.
- Retire el tejido conjuntivo (periostio) rascándose cuidadosamente con un bisturí. Limpie el área con desinfectante a base de yodo y seque el cráneo con un hisopo antiséptico.
- Utilizando una cuchilla afilada del bisturí (tamaño 15),Kull para obtener una superficie ósea limpia y mate. Utilizando sólo la punta del bisturí, rasque una red de malla de ranuras, con una distancia de ~ 1 - 2 mm entre las ranuras.
NOTA: Esto mejora la fijación del pegamento epoxi de dos componentes al cráneo en el paso 1.3.15. - Utilice un microdrill con un tamaño de taladro de 1/005 para realizar 4 craniotomías (~ 0.7 mm ø) en el cráneo en localizaciones específicas ( Figura 1 , véase también el paso 1.3.11.3.). Limpie el polvo de hueso con una pipeta Pasteur y limpie cualquier sangrado con hisopos antisépticos.
- Si se produce sangrado, asegúrese de que se detiene completamente antes de reanudar el proceso. Use una esponja hemostática para acelerar la hemostasia.
- Utilice las dos craniotomías en el hemisferio derecho para insertar los electrodos de tornillo (craneotomías # 2 y # 4).
- Utilice las dos craneotomías en el hemisferio izquierdo para insertar tornillos de anclaje que estabilizarán el implante (craniotomías # 1 y # 3).
NOTA: Para incrementarSe han utilizado hasta 4 tornillos de anclaje 29 .
NOTA: Las coordenadas estereotáxicas precisas son: 2 mm de la línea media en ambos hemisferios y 2 mm rostral de bregma (craniotomías # 1 y # 2), 2 mm rostral de lambda y 4 mm lateral-izquierda de la línea media (craneotomía # 3) 2 mm rostral de lambda y 2 mm lateral-derecha desde la línea media (craneotomía # 4). Vea la Figura 1 .
- En el hemisferio izquierdo, atornille dos tornillos chapados en oro a través de las craniotomías para apoyo.
- Fijar el tornillo en una abrazadera hemostática y mantenerlo verticalmente por encima de la craneotomía. Cuidadosamente enfoque la parte inferior del tornillo en la parte superior de la craneotomía. Gírela sin desviarse de la posición vertical.
NOTA: Sólo 1,5 rotaciones son suficientes para obtener una buena estabilidad mecánica y señales de alta calidad mientras se minimiza la presión sobre el tejido subyacente 25 . - A la derecha, atornille el(Descritos en el paso 1.2.1.) A través de las craneotomías.
- Fijar el tornillo en una abrazadera hemostática y mantenerlo verticalmente por encima de la craneotomía. Cuidadosamente enfoque la parte inferior del tornillo en la parte superior de la craneotomía. Gírela sin desviarse de la posición vertical.
- Con la ayuda de fórceps, levante cuidadosamente el borde de la piel de los músculos del cuello. Inserte los cables EMG-ECG, con los extremos en espiral dentro de los músculos (izquierda y derecha). Pegue las partes medias al cráneo, de manera que el EMG-ECG izquierdo salga junto al tornillo de anclaje posterior izquierdo, mientras que el EMG-ECG derecho se posiciona junto al tornillo de anclaje anterior izquierdo.
- Para detectar señales de ECG desde el corazón durante el sueño, asegúrese de que los cables EMG-ECG se insertan en el músculo a una profundidad de ~ 0,8 - 1 cm, con sus extremos de lazo lo más alejados posible.
- Use una espátula cubierta con pegamento epoxi de dos componentes para aplicar el pegamento al cráneo entre los tornillos y alrededor de ellos. Dejar que se seque en la luz, pero proteger los ojos del animal contra el relámpago excesivo.
NOTA: Las bases de los tornillos deben estar cubiertas, y solo los cables deben ser accesibles, emergiendo frOm el pegamento. - Asegúrese de que el pegamento llene el espacio entre los dos electrodos EMG-ECG que se extienden desde la superficie, de tal manera que no hay contacto eléctrico entre ellos y los tornillos de soporte. Preste atención meticulosa a no pegar la piel al cráneo; La piel debe permanecer libre de moverse alrededor del pegamento.
- Cortar los cables EEG y EMG-ECG de modo que alcancen a ~ 0,5 mm del pegamento. Soldar los cuatro pines en la esquina del conector preparado en el paso 1.2.3. A los cuatro cables que salen de la cola ( Figura 1 ).
- Trate de colocar los pines del conector lo más cerca posible para minimizar la altura del implante; Utilice una pequeña abrazadera de cocodrilo unida al soporte estereotáctico que mantiene la posición del conector. Minimice el tiempo en contacto con la punta de soldadura, ya que esto calienta rápidamente los tornillos.
- Llene el espacio entre el pegamento y el conector con cemento dental para cubrir las partes soldadas. Crear smooY evitar los bordes afilados que podrían lastimar al animal. Por otra parte, evitar el contacto con la piel, ya que esto conduce a picazón.
- Eliminar los bulldog serrefines. Si es necesario, cierre la herida con un hilo de sutura estéril (fibra de sutura absorbible) delante y detrás del conector, creando patrones de cierre simples e interrumpidos y dos nudos cuadrados (aguja FS-3 de 5-0, filamento de 45 cm).
- Vigile al animal hasta que esté completamente despierto. Pesar el animal después de la cirugía y devolverlo a su jaula de hogar para su recuperación.
- Atención postoperatoria y conexión al sistema.
- Vigile al animal todos los días durante una semana. Busque pérdida de peso, actividad reducida o anormal, y signos de infecciones. Siga el procedimiento de puntuación establecido por las autoridades veterinarias.
- 5-6 días después de la cirugía, conecte el cable de grabación al conector de cabeza del animal, dejándolo en su jaula de casa. Espere un adicional de 4 a 5 días antes del inicio de la grabaciónDing para que el animal está habituado a la condición y duerme naturalmente.
2. Puntuación básica de los datos de EEG / EMG-ECG para la Determinación del Estado de Vigilancia
- Registre datos EEG y EMG-ECG durante 48 h con un software polisomnográfico comercial ( por ejemplo, Somnologica, SleepSign o Sirenia). Utilice ajustes típicos, como una ganancia de 2.000 veces; Una frecuencia de muestreo de 2.000 Hz a la adquisición, muestreada a 200 Hz después de la adquisición; Y un filtro de paso alto de 0,7 Hz para EEG y un filtro de paso alto de 10 Hz para EMG-ECG.
- Exporte los datos en el formato de archivo ".edf".
- Abra los archivos ".edf" con un software personalizado ( por ejemplo, en Matlab) que clasifica de forma semiautomática cada época de 4 s como sueño despierto, no REM, sueño REM, y artefactos correspondientes.
NOTA: Alternativamente, hay varios programas de puntuación semi-automatizados disponibles. Este procedimiento describe algunos de los pasos básicos que se deben hacer para establecer puntuación wCon el software de puntuación utilizado aquí; Otros sistemas de puntuación semiautomáticos pueden basarse en otros parámetros. - Usando el software, separe los archivos ".edf" en 4 veces 12 h de grabaciones.
- Eliminar los artefactos que surgen de la actividad EMG-ECG presente en la señal EEG o de un estado de comportamiento no asignable 1 , 29 .
- Calcular la media de los valores absolutos de EEG ( media EEG) y EMG ( media EMG) durante las 12 h de las grabaciones de los registros EEG y EMG-ECG, respectivamente.
- Identificar los valores medios de EEG / EMG de cada época de 4 s (EEG Epoch / EMG Epoch ).
- Clasificar las épocas como "despertador" cuando EEG Época media y EMG Epoch> EMG significan y como "el sueño no-REM" cuando EEG Epoch> significa EEG y EMG Época significa.
- Clasificar las épocas que no s Satisfacer estos criterios con un algoritmo de corrección basado en épocas anteriores y subsiguientes.
- Clasifique las épocas como el sueño REM cuando EEG Epoc mean y EMG Epoc mean .
- Refinar los puntos críticos, como las transiciones desde el sueño no REM hasta el despertar, las épocas de sueño REM y las micro-excitaciones durante el sueño no REM. Inspeccione visualmente la puntuación para asegurar la determinación adecuada del estado de vigilancia 29 , 30 .
NOTA: Realice siempre una inspección visual final y la validación de la puntuación.
3. Análisis de la oscilación infrarroja para el EEG y los latidos cardiacos
- Para este análisis, seleccione sólo los episodios de sueño no REM que duren ≥ 96 s ( es decir, al menos 24 épocas de 4 s); Véase la figura 2 .
NOTA: Rutinas personalizadas están disponibles bajo petición 1 .

Figura 2 . Determinación de la dinámica de la energía Sigma durante el sueño no-perturbado no perturbado.
( A ) Superior, EEG (negro) y EMG-ECG (gris) durante los primeros 100 min de la fase de luz en un ratón. Los estados de vigilancia están indicados por la barra coloreada sobre los trazos crudos. Medio, ejemplo típico de un combate de sueño continuo (> 96-s). En la parte inferior, un intervalo elegido al azar de 16 s que ilustra la subdivisión en 4-s épocas. El paso siguiente del análisis se muestra para estas cuatro épocas solamente, pero es válido para cada época contenida en el combate. ( B ) Top, cuatro FFTs sucesivas generadas a partir de las 4 e épocas mostradas en el panel inferior de A. La banda sigma (10-15 Hz) está sombreada en rojo. Arriba a la derecha, inserción de 1 s de la última época que muestra las ondas R presentes en la señal cuadrada de EMG-ECG. Inferior, el tiempo del curso Sigma extraído del espectro correspondiente anterior. Las líneas de puntos ilustran la continuación de los valores de potencia antes y después de los cuatro episodios no REM seleccionados para la visualización. ( C ) Cursos normalizados sigma power (rojo) y heartbeat (en BPM) (gris), con la porción ilustrada en (B) ubicada entre las líneas verticales discontinuas. A continuación se muestra la señal EEG filtrada correspondiente en la banda sigma (10 - 15 Hz). ( D ) Resultado de la FFT calculada sobre el curso del tiempo de potencia sigma mostrado en (C), demostrando un pico dominante a 0,016 Hz. Haga clic aquí para ver una versión más grande de esta figura.
- Extraer los valores de potencia de la banda de frecuencias sigma (10-15 Hz) de potencia espectral en 4 s contenedores ( Figura 2 A y B ) utilizando cálculos de transformadas de Fourier rápidas (FFT)"> 1.
- Calcule la potencia espectral de la línea base para el sueño no REM calculando el promedio de los valores de cada intervalo de frecuencia para todas las épocas de sueño no REM (artefactos y épocas de transición entre estados de vigilancia están excluidos de este promedio). Normalizar los valores de potencia sigma de cada época a la potencia media de la banda sigma durante el sueño no REM durante el periodo de tiempo de interés. Trama contra el tiempo ( Figura 2 C ).
- Calcular el FFT del curso de tiempo de potencia sigma con ventana de Hamming para revelar los componentes de frecuencia oscilatoria de la dinámica de potencia ( Figura 2 D ) 1 .
- Tenga en cuenta que dado que los episodios de sueño no REM tienen diferentes duraciones, los FFT resultantes tienen diferentes resoluciones de frecuencia. Interpolar para ajustar la resolución a la más alta obtenida de la pelea de sueño no REM más larga y el promedio de FFT de todos los episodios.
- Continuar estos análisisEs para describir las relaciones de fase entre la dinámica de las señales EEG y ECG.
- Extraiga los datos de los latidos del corazón de la señal cuadrada de EMG-ECG después del filtrado de paso alto de 30 Hz, utilizando rutinas apropiadas para la detección de pico de la onda R.
NOTA: Limitar el intervalo de tiempo mínimo entre dos ondas R sucesivas a 80 ms ayuda a evitar la inclusión de picos artefactuales ocasionales debidos a espasmos musculares 1 . - Medir los intervalos RR y calcular la frecuencia cardíaca media en latidos por minuto (BPM) cada 4 s bin ( Figura 2 B y C ).
4. Exposición al ruido
- Generar ruidos (es decir, ruido blanco) a través de un software personalizado. Ajuste la duración a 20 sy la intensidad a 90 dB SPL (medida dentro de la jaula). Reproducir los ruidos a través de altavoces activos estándar 1 .
- Después de la cirugía, durante la habituación al recorDing condición, jugar ruidos experimentales al azar, varias veces durante el día y en diferentes momentos 1 .
- En la condición experimental (mientras se graban datos EEG / EMG / ECG), se reproduce el ruido pseudoaleatoriamente durante los primeros 100 min al inicio de la luz (ZT0). Para reproducir el ruido, cumpla las siguientes condiciones 1 :
- Asegúrese de que el ratón ha estado en un sueño no REM durante> 40 s.
- Asegúrese de que la exposición anterior ocurrió más de 4 minutos antes.
NOTA: Esto resulta en ~ 15 exposiciones por sesión.
- Marque el comienzo del tiempo de grabación y el inicio de cada exposición al ruido. Mantenga el experimentador ciego a la composición espectral del sueño no REM durante el procedimiento.
- Adquirir todos los datos con software polisomnográfico 1 , 29 .
5. Análisis retrospectivo del sueño basado en el resultado del comportamiento duranteExposición al ruido
- Marca manualmente los trazos EEG / EMG -ECG en una resolución de 4 s, sin conocer los tiempos de exposición al ruido 1 .
- Utilice un script personalizado para extraer los datos de exposición EEG / EMG -ECG / noise 1 .
- La puntuación como sueño cuando las señales EEG y EMG permanecen inalteradas durante la exposición al ruido ( Figura 3A ). Considere un despertar cuando la amplitud EEG disminuye y la frecuencia EEG aumenta, en combinación con la actividad muscular detectada en el electrodo EMG-ECG ( Figura 3B ).
- Descartar los ensayos en los que los animales se despertaron durante el período de pre-estímulo o en los primeros 4 s de exposición al ruido ( Figura 3D ).
- Defina la tasa de éxito de la excitación como la proporción de ensayos de despertar en todos los ensayos incluidos ("Wake-up" y "Sleep-through").
- En todos los ensayos incluidos, examinar la dinámica de la potencia sigma durante elE período pre-estímulo ( Figura 3 E ) 1 .

Figura 3 . Resultados conductuales en respuesta a la aparición del ruido: Resultados representativos que fueron retenidos o excluidos del análisis.
( AD ) Rastros crudos de las señales EEG (negro) y EMG-ECG (gris) correspondientes durante 40 s antes del inicio del ruido y durante los 20 s de ruido, representados por el área sombreada en azul. Los estados de vigilancia están indicados en el código de color. Para ilustrar los datos que se incluyeron en el análisis, se muestran los eventos representativos "Sleep-through" ( A ) y "Wake-up" ( B ). Los resultados que se descartaron contenían transiciones al sueño REM ( C ) y una respuesta "Wake-up" precoz ( D ). El cuadro muestra un expanDel EEG y EMG-ECG rasgos característicos para el sueño REM. ( E ) Ejemplos típicos de la dinámica de potencia sigma en la ventana de 40 s antes del inicio del ruido durante un evento "Sleep-through" (izquierda) y un evento "Wake-up" (derecha). El paso bruto de paso de EEG filtrado por paso para la banda sigma se muestra anteriormente. El área azul representa el comienzo del ruido. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Figura 2 A (panel superior) muestra estiramientos de 100 minutos de comportamiento espontáneo de sueño-vigilia, registrados a través de electrodos polisomnográficos implantados como se describe (ver Figura 1 ). Los aumentos y disminuciones de la amplitud de EEG y EMG en el inicio de sueño no REM son claramente visibles. El sueño REM intermitente está marcado por una disminución de la amplitud del EEG y u...
Discusión
Aquí, mostramos cómo establecer un perfil temporal continuo de sueño no REM que integre las variables EEG, EMG y ECG. Este es un primer paso hacia el desarrollo de una descripción integradora del sueño del ratón, que puede ayudar a identificar la escala de tiempo previamente no reconocida sobre la cual se organizan resiliencia alta y baja al ruido durante el sueño no REM 1 . Una similar estructura temporal también se describe en el sueño humano no REM a través de un análisis análogo [...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Agradecemos a todos los miembros del laboratorio por su contribución a la escritura y la lectura cuidadosa de este manuscrito. Estamos agradecidos a Paul Franken por las discusiones estimulantes, la Dra. Gisèle Ferrand por los comentarios útiles sobre el protocolo quirúrgico, y el Dr. Jean-Yves Chatton por proporcionar los archivos ejecutables Labview originales para la exposición al ruido. La financiación fue proporcionada por la Fundación Nacional Suiza de Ciencia (Subvenciones 31003A_146244 y 31003A_166318) y el Estado de Vaud.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3 x 2-channels | ENA AG | 2.316 | Raster 2.54 x 2.54 mm; size 5 x 8 x 9 mm; pin size 5 mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
Referencias
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados