このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
睡眠中のマウスにおけるスペクトルパワーおよび心拍数の低速ダイナミクスの定量化
要約
ここでは、聴覚刺激に対する睡眠応答性を調節するマウスにおける非レム睡眠の神経および心臓変数の時間的ダイナミクスを記述するための実験的および分析的手順を提示する。
要約
覚醒、非眼球運動(非REM)睡眠、およびレム睡眠の3つの警戒状態が哺乳動物の生活を支配する。行動の神経相関が自由に動く動物で同定されるにつれて、この3つの細分はあまりにも単純化する。覚醒時には、瞳孔径や交感神経のバランスなどの周辺パラメータとともに、大域的および局所的な皮質活動のアンサンブルが様々な程度の覚醒を定義する。感覚刺激および覚醒、およびおそらく他の睡眠機能に対する回復の程度が徐々に変化し、末梢の生理状態がどのように変化するかという点で、睡眠が脳状態の連続体を形成する程度は不明のままである。睡眠中の複数のパラメータをモニターする方法を進歩させ、これらの機能的属性の配置に帰属する研究は、睡眠の理解を、多くの有益な効果が存在しなければならない多機能プロセス生きる睡眠状態を特徴づける新規パラメータを特定することは、睡眠障害における新規な診断手段の機会を開くであろう。
我々は、標準的な睡眠ポリグラフ記録技術を用いて脳波(EEG)/電気コルチコグラム(ECoG)、筋電図(EMG)、および心電図(ECG)信号の組み合わせ監視および分析を介してマウス非REM睡眠状態の動的変化を記述する手順を提示する。このアプローチを使用して、我々は、マウス非REM睡眠が、外部刺激に対する高低の脆弱性の連続的な25秒の間隔を生成する調整された神経振動および心臓振動の周期に組織化されることを見出した。したがって、統合された非レム睡眠中に、中枢および自律神経系が協調して行動的に異なる睡眠状態を形成する。我々は、自由に眠っているマウスのこれらのサイクルを追跡するために、睡眠ポリグラフ( すなわち、 EEG / EMGとECGとの組み合わせ)モニタリングのための手術操作を提示し、それらのダイナミクス、および覚醒の可能性におけるそれらの役割を評価するための音響刺激プロトコルを含む。私たちのアプローチはすでに人間の睡眠にまで拡張されており、哺乳動物の非レム睡眠状態の共通の組織原理を解明することを約束しています。
概要
哺乳動物の睡眠は、環境刺激に対する休息と回復力の行動状態である。このような見かけ上の一様性にもかかわらず、睡眠ポリグラフおよび自律神経パラメータは、様々な時間的および空間的スケールで質的および量的に異なる神経および体性状態間で睡眠が移動することを示している1 。数分から数十分にわたり、非REMとレム睡眠との間の切り替えが起こる。非レム睡眠は、脳波の大振幅、低周波活動を伴い、〜0.5〜4Hz付近のスペクトルピークを伴い、レム睡眠はシータバンド(6〜10Hz)において規則的なEEG活動を示し、筋肉atonia 2 。非レム睡眠では、人間は光(S2)と深いスローウェーブスリープ(SWS)を繰り返します。そのネーミングが示すように、これら2つの段階が低く示し、より高い覚醒は、それぞれ、4、3閾値、及びそれらが低frequの密度に主に異なりますスロー波活動(SWA; 0.75〜4Hz)と呼ばれる大脳皮質の脳波のパワー。不均一性は、として広く試合5,6にわたってだけでなく、EEGによってSWAの可変存在によって文書化電位リズムをフィールド、サブセカンドタイムスケールにminute-上S2及びSWSの個々の発作を通して持続しますシグマバンド(10-15 Hz)で、ガンマリズムにスピンドル波を含む高い周波数(80から120ヘルツ)(レビューのために、7、8、9、10を参照されたいです)。
微妙ではなく、これらのバリエーションは人間の睡眠中の皮質状態をスペクトルの極端にシフトさせます。ノンレム睡眠のために、SWAの優位性から、その近似覚醒様活性状態へのこれらの範囲、それらが高周波成分11の実質的な割合が含まれているため、 12 。ノンレム睡眠は段階に細分化されていないが、げっ歯類や猫では、中間睡眠(IS)と呼ばれる短い期間は、REM睡眠開始13前に出てきます。このようなスピンドル波とSWA非REM睡眠の署名が、依然として存在している間IS中に、そのような海馬のシータ活性としてレム睡眠機能と先斗-geniculo-後頭部波は15、14 2つのスリープ状態のミックスを示す、開始します。それにもかかわらず、ISは、それが抗うつ薬16によって変調され、前の覚醒17の間に新規の物体提示によって変調され、覚醒閾値18の設定に寄与するので、機能的に異なる可能性がある。さらに、自由に動くラットのEEGおよびEMGパラメータの状態空間プロットは、非REM睡眠、REM睡眠および覚醒状態の間で連続する点14のクラスタを示す。 SWAにおける散発的減少は、連結非REM睡眠期間14、19、20の間に低および高周波数成分の相対的な存在下で実質的な変動につながる覚醒またはREM睡眠を入力せずに、またあります。最後に、非レム睡眠時のSWAと高周波数リズムの変化率は、時間的にのみならず、大脳皮質領域間の振幅と同期の地域差も示している19 。
哺乳類の非レム睡眠は一様ではありません。しかし、そのような不均一性が、機能および行動の属性が異なる状態につながるかどうかは不明である。いくつかのタイプの睡眠障害において、連続的な睡眠は、自発的な覚醒および不適切な運動行動によって中断される。また、スペクトルは、EEG 21に高い周波数の相対的な存在でshow変化を解析します呼吸数や心拍数などの自律的なパラメータが含まれます22 。したがって、安定した睡眠状態の秩序のあるシーケンスは撹乱され、皮質および/または自律神経覚醒の要素は制御されない方法で侵入する。したがって、睡眠状態の連続性を理解することは、疾患に関連する可能性がある。さらに、都市環境における環境騒音による睡眠の混乱は、一般的な健康リスクと関連しており、睡眠時の脆弱性が増す瞬間を特定することが重要です23 。
ヒトの睡眠における行動覚醒実験は光非REM睡眠(段階S2)とREM睡眠ショー同等と下覚醒に対し4閾値、SWA-支配非REM睡眠(段階S3)からウェイクアップするために最も困難なことがあることを示しています。短い音刺激の皮質処理は、REM睡眠、S2、およびS3 24の間で実質的に変化し、25、状態固有の皮質活動パターンが感覚処理の最初の段階を調節することを示します。ヒトにおけるノンレム睡眠のために、ノイズに応答してウェイクアップする傾向がEEG 26、27、28にスピンドル波とアルファリズムの存在によって変化します。スピンドルの視床皮質の律動性は、視床および皮質の両方のレベルでシナプスの抑制が増強され、これが知覚処理の減弱に寄与すると考えられている7 。
どのように騒音に耐えられ、脆弱な睡眠期間が時間内に整理され、その決定要因は何ですか?マウスおよびヒトの両方において、我々は最近、神経リズムにおける低速、0.02Hzの振動を同定した。この0.02Hzの振動の位相に依存して、マウスは、覚醒または睡眠のいずれかの外部刺激に対して可変反応性を示した雑音gh。興味深いことに、この振動は心拍数と相関し、自律神経系が睡眠の外部刺激に対する脆弱性の調節に関与することを示している1 。記憶関連の海馬リズムもこのリズムの中で組織されており、その強さは人間の記憶強化の質と相関していた。したがって、0.02Hzの振動は、環境に対する感受性と内部記憶処理の両方を調節するげっ歯類およびヒト非REM睡眠の組織原理であるようである。これは、睡眠状態のマルチパラメトリックかつ継続的な評価の必要性を再度強調し、その機能を認識し、潜在的な脆弱性の部位を特定する。
ここでは、これらの動態の波形を抽出する手順を提示します。これには、EEG / ECoGとEMG-ECG測定、感覚刺激への曝露、分析ルーチン。この手順は、異なる基本的な睡眠機能が連続的に実行される間、絶えず変化するが高度に組織化された警戒状態として睡眠を見るための基礎を提供する。より一般的には、この手順は、健康状態および疾患状態の両方において睡眠中の行動転帰に先行するスペクトルおよび自律神経の特徴を抽出することを目的とするアプローチに適用可能である。
プロトコル
全ての実験手順は、ローザンヌ動物飼育委員会と、ヴォー洞のケルン・デ・ヴォーのサービス・デ・ラ・コンソーメーション・デ・エデイ・アフェアレ・ヴェテイネリエールに従って実施した。
1. EEG / EMG-ECGレコーディングのための手術
- 動物の住宅と選択。
- 12:12時間の暗/明サイクルで、単独で飼育し、標準状態(湿度40%、22℃)で、食物と水で動物(C57Bl / 6J、7-9週間、25-30g)利用可能な任意の広告 。
- ホルモンサイクルが睡眠に与える影響をすべて避けるためには、男性被験者だけを使用してください。
- 電極の準備。
- 金の上にはんだ付けされた0.5cm長の金ワイヤー(75%Au、13%Ag、および12%Cu;直径0.2mm)を用いてEEG / ECoG電極(ステップ1.3.11で使用)を構築する。めっきが施さ鋼ねじ(3mmの長さは、基部の1.1ミリメートル直径、Figur参照e 1)。動物あたり2 EEG電極を準備し、70%エタノールで洗浄する。
- EMG-ECG電極を3〜4cmの長さの金ワイヤー(75%Au、13%Ag、および12%Cu;直径0.2mm)で準備する。ワイヤを一方の端から90°の角度に曲げ、もう一方の端にコイル(1 - 2mmφ)を用意します ( 図1 )。 2つの端の間で、小脳とラムダの間の骨の表面プロファイルに対応する小さな曲率を作るようにワイヤを曲げる。
- 動物あたり2つのEMG-ECG電極を準備する。
- 6チャネルメス - オスヘッドコネクタ(ラスタ2.54 mm x 2.54 mm、サイズ5 mm x 8 mm x 9 mm、ピンサイズ5 mm、 図1参照)を用意します。
- 雌ピンと雄ピンの両方の基端にあるコネクタをテープでカバーします。
- 手術中のEEGとEMG-ECG電極のはんだ付けを助けるために、6本の雄ピンのうちの4本の先端に少量のはんだ付け用ワイヤを追加してください(ステップ1.3.16参照)。
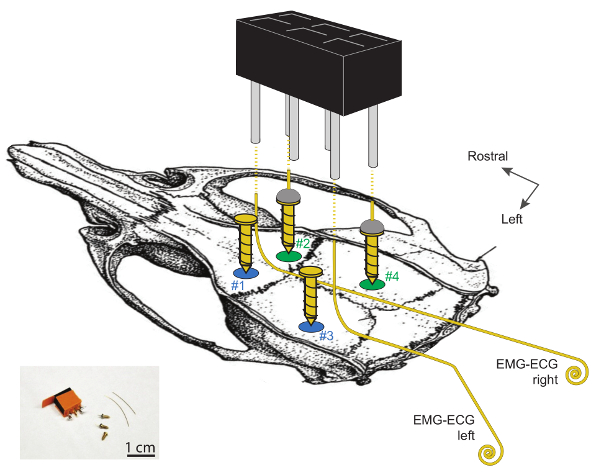
図1 。マウスの頭蓋骨上のEEGおよびEMG電極移植のための部位の模式的表示。
頭蓋切開術#1および#2は、正中線から2mm外側およびブレグマから2mm吻側に位置する。頭蓋切開鉗子#3および#4は、ラムダから吻側に2mm〜2mmの位置にあり、それぞれ正中線の4および2mmの横方向にある。ゴールドワイヤーを金メッキスチールスクリュー(#2と#4)の上部にはんだ付けして作られた2つのEEG電極は右半球にあります。 2本の左ネジ(#1と#3)はサポートとして機能します。 EMG-ECG電極は、これらの2本の支持ネジと接触しないように注意してください。 EMG-ECG電極は、3〜4cmの長さの金線であり、吻側端部に1cm以上90°の角度で曲げられ、尾側端部にはコイル状(1〜2mmφ)に巻かれている。 2つのEEGと2つのEMG電極破線で示すように、一方のワイヤを一方の角の付いたピンに半田付けすることによって、2 x 3チャネルヘッドコネクタに接続されます。これらの電極およびそれらの埋め込みに関するさらに詳細な情報は、 29で 。 この図の拡大版を見るには、ここをクリックしてください。
- 移植手術。
- イソフルラン誘発チャンバー(4〜5%イソフルラン+ 1〜2L /分で3〜4分のO 2)で動物を麻酔する。定位固定の前に、チャンバーからマウスを除去するときに5μg/ gのcarprofenを腹腔内(腹腔内)に注入する。
- 標準的な手順に従って、定位固定装置にマウスを固定します。ガスマスク(1L /分での固定中、イソフルラン+ O 2 3%)を介してイソフルラン麻酔を維持する。 37°Cで手術中体温を維持する暖房パッド。
- ビタミンA軟膏を塗布することにより、目が乾燥するのを防ぎます。足逃避反射を試験することにより、動物の外科的耐容性のレベルをチェックする。
- それらの平滑末端で頭蓋骨に耳バーを配置することによってヘッドを固定する、逆29(外耳道に入ることなく)むしろそれらの先端よりも終了します。ヘッドの水平性を確保するために、マウスバーを(通常どおり)配置します。
注記:固定は、耳への損傷を最小限に抑えます。これは音響覚醒実験にとって重要です(この手順のセクション4を参照)。 - 処置中の動物の呼吸を監視する。呼吸は2〜3回/ 2秒のままでなければならない。必要に応じてガスディスペンサーのイソフルラン濃度を調整する。手術中に少しずつ減少し、固定時の3%から手術終了時に1.0〜1.5%に減少するはずである。
- 超微細インスリンを使用して、1時間に1回、100μLの0.9%NaClを腹腔内注射する。動物を水和状態に保つためのシリンジ。
- 動物の頭が明るい光源で照らされていることを確認してください。
- 70%EtOHとヨウ素ベースの消毒剤で拭き取ってください(濡れた毛皮は髪の毛が手術窓に入るのを防ぎます)。
- Adsonの鉗子で頭蓋骨の中心にある皮膚を持ち上げ、細いはさみを使用して、首の上から目の高さまで、正中線に沿って皮膚の持ち上げた部分を静かに切断します。頭皮を取り除く(前後1 cm、横0.5 cm〜0.8 cm)。
- 窓が十分に大きく(両側に)、頭蓋骨のブレグマとラムダ裂をはっきりと見えるようにしてください。骨にアクセスできるように、ブルドッグセルフリーンで両側の皮膚を固定します。
- メスで注意深く引っ掻いて、結膜組織(骨膜)を除去する。ヨウ素をベースにした消毒剤でその区域を掃除し、消毒綿棒で頭蓋を乾燥させる。
- 鋭いメスの刃(サイズ15)を使用して、骨表面を清浄化して塊状にする。メスの先端のみを使用して、溝のグリッド状の網目を刻み、溝の間に約1〜2mmの距離をおいてください。
注:これはステップ1.3.15で頭蓋骨への二成分エポキシ接着剤の付着を改善する。 - 特定の位置の頭蓋骨に4つの頭蓋切開術(約0.7mmφ)を行うには、ドリルサイズ1/005のマイクロドリルを使用します( 図1 、ステップ1.3.11.3も参照)。パスツールピペットを使用して骨の埃を吹き飛ばし、消毒綿棒で出血をきれいにします。
- 出血が発生した場合は、プロセスを再開する前に完全に停止していることを確認してください。止血スポンジを使用して止血を促進します。
- 右半球の2つの頭蓋切開術を使用して、ねじ電極(頭蓋切開術#2および#4)を挿入する。
- 左半球の2つの頭蓋切開術を使用して、インプラント(craniotomies#1と#3)を安定させる固定ネジを挿入します。
注:増分するには最大4つの固定ネジが使用されています29 。
注:正確な定位座標は、両半球の正中線から2mm、ブレグマ(頭蓋骨#1および#2)からの2mmの吻側、ラムダから2mmの吻側、および正中線からの左右4mm(開頭#3)ラムダから2mmの吻側、および正中線から2mmの側方右(開頭術#4)。 図1を参照してください。
- 左半球で、金メッキされた2本のネジを頭蓋骨に通してサポートします。
- 止血クランプにねじを固定し、それを頭蓋切開の上に垂直に保持する。慎重に、craniotomyの上にネジの底に近づけます。垂直位置から外れないように回転させます。
注:優れた機械的安定性と高品質の信号を得るには、わずか1.5回転で十分ですが、下にある組織25の圧力を最小限に抑えます。 - 右側には、開頭手術を通して電極を準備した(ステップ1.2.1に記載)。
- 止血クランプにねじを固定し、それを頭蓋切開の上に垂直に保持する。慎重に、craniotomyの上にネジの底に近づけます。垂直位置から外れないように回転させます。
- 鉗子の助けを借りて、慎重に頸部の筋肉から皮膚の境界線を持ち上げてください。 EMG-ECGワイヤーをコイル状の端を筋肉の内側(左右)に挿入します。中央の部分を頭蓋骨に接着して、左のEMG-ECGが左のアンカーねじの隣に出てくるようにし、右のEMG-ECGを左のアンカーねじの隣に配置する。
- 睡眠中の心臓からのECG信号を検出するには、EMG-ECGワイヤーを筋肉に〜0.8-1 cmの深さまで挿入してください。
- 2つのコンポーネントのエポキシ接着剤で覆われたスパチュラを使用して、ねじの間および周囲の頭蓋骨に接着剤を塗布します。それは光の中で乾燥させるが、過度の雷から動物の目を保護する。
注記:ネジの基部は覆われていなければならず、ワイヤのみがアクセス可能でなければならず、新しくfrオムは接着剤。 - 接着剤が、表面から伸びる2つのEMG-ECG電極の間の空間を満たしていることを確認して、それらと支持ネジとの間に電気的接触がないようにします。頭蓋骨に肌を接着させないよう細心の注意を払う;皮膚は接着剤の周りを自由に動くべきである。
- EEGとEMG-ECGワイヤーを接着剤から約0.5 mmまで切断します。手順1.2.3で準備したコネクタの角に4本のピンを半田付けします。接着剤から出てくる4本のワイヤに接続します ( 図1 )。
- インプラントの高さを最小限に抑えるために、コネクタピンを可能な限り近づけて配置してください。コネクターの位置を維持する定位ホルダーに取り付けられた小さなクロコダイルクランプを使用してください。はんだ付け先端に接触する時間を最小限に抑えます。これは、ねじを急速に加熱するためです。
- はんだ付けされた部品をカバーするために、接着剤とコネクタの間のスペースを歯科用セメントで満たしてください。 smooを作成する動物を傷つける可能性のある鋭い縁を避けてください。また、皮膚に触れないようにしてください。痒みにつながります。
- ブルドッグのセラムを取り除く。必要に応じて、コネクタの前後に滅菌縫合糸(吸収可能な縫合繊維)を使用して創傷を閉鎖し、閉鎖パターンと2つの正方形の結び目(5-0 FS-3針、45cmフィラメント)を作成します。
- 完全に目が覚めるまで動物を監視する。手術後に動物の重さを量り、回復のためにそれをホームケージに戻す。
- 術後ケアおよびシステムへの接続。
- 動物を毎日毎日監視してください。体重減少、減少したまたは異常な活動、および感染の徴候を探す。あなたの獣医当局によって確立された採点手順に従ってください。
- 手術の5-6日後に、動物の頭部コネクタに記録ケーブルを接続し、ホームケージに残す。レコーダーの開始前にさらに4〜5日お待ちください動物が病状に慣れ、自然に眠るようにする。
2.警戒状態判定のためのEEG / EMG-ECGデータの基本スコアリング
- 市販の睡眠ポリグラフのソフトウェア( 例えば、ソムノロジカ(Somnologica)、スリープサイン(Sysnnia)、またはサイレンシア(Sirenia))を用いて、48時間にわたってEEGおよびEMG-ECGデータを記録する。 2,000倍のゲインなどの一般的な設定を使用します。捕捉時に2000Hzのサンプリングレート、捕捉後に200Hzにサンプリングされたダウン、 EEG用の0.7Hzのハイパスフィルタと、EMG-ECG用の10Hzのハイパスフィルタとを備えている。
- データを ".edf"ファイル形式でエクスポートします。
- 目覚め、非レム睡眠、レム睡眠、および対応する人工物として4つのエポックを半自動的に分類する、カスタム書込み( 例えば、 Matlabの)ソフトウェアで「.edf」ファイルを開きます。
注:あるいは、いくつかの半自動スコアリングソフトウェアが利用可能です。この手順では、得点を設定するために実行する必要がある基本的な手順のいくつかについて説明します。iここで使用されるスコアリングソフトウェア。他の半自動スコアリングシステムは、他のパラメータに基づくことができる。 - ソフトウェアを使用して、4時間12時間の録画で ".edf"ファイルを分離します。
- EEG信号又は割り当て不能行動状態1、29から現在EMG -ECG活性から生じるアーチファクトを取り除きます。
- EEGおよびEMG-ECGトレースからの記録の12時間にわたる絶対的なEEG(EEG 平均 )およびEMG(EMG 平均 )値の平均をそれぞれ計算する。
- 各4秒のエポック(EEG エポック / EMG エポック )の平均EEG / EMG値を特定する。
- EEG エポック 平均およびEMG エポック > EMGの平均時には「覚醒」として、EEG エポック > EEG 平均およびEMG エポック 平均時には「非REM睡眠」として分類する。
- sではないエポックを分類するこれらの基準を前後のエポックに基づく補正アルゴリズムで解消する。
- EEG エポック 平均およびEMG エポック 平均の場合、エポックをレム睡眠として分類する 。
- 非レム睡眠から起床までの遷移、レム睡眠のエポック、および非レム睡眠中のマイクロ覚醒などの臨界点を改善する。視覚的に適切な警戒状態決意29,30を確実にするためにスコアリングを点検。
注記:スコアリングの最終的な目視検査と検証を必ず実行してください。
3.脳波および心拍のための低速振動の解析
- この分析では、96秒以上持続する非レム睡眠発作( すなわち、少なくとも4エポック4秒)のみを選択する; 図2を参照してください。
注:カスタマイズされたルーチンは、要求に応じて利用できます1 。

図2。 妨害されていない非REM睡眠中のシグマ力ダイナミクスの決定。
1つのマウスの軽い相の最初の100分間の( A )上、EEG(黒)およびEMG-ECG(灰色)トレース。警戒状態は、生の痕跡の上にカラーバーで示されます。連続的な(> 96-s)非REM睡眠のミドルの典型的な例。 Bottomはランダムに選択された16秒間隔で、4秒のエポックに細分化されています。分析の次のステップは、これら4つのエポックのみについて示されていますが、試合に含まれるすべてのエポックで有効です。 ( B )Aの下のパネルに示されている4つのエポックから生成されたトップの4つの連続したFFTsシグマバンド(10-15 Hz)は赤で網掛けされています。右上は、EMG-ECG信号の二乗に現れるR波を示す最後のエポックからの1-s挿入図です。ボトム、タイムコース上記の対応するスペクトルから抽出されたシグマパワー。点線は、表示のために選択された4つの非REM試合の前後の出力値の継続を示す。 ( C )正規化されたシグマパワー(赤)および心拍(BPM)(灰色)の時間経過、(B)に示される部分は垂直破線の間に位置する。以下は、シグマバンド(10〜15Hz)に対応するフィルタ処理されたEEG信号です。 ( D )(C)に示すシグマパワータイムコースで計算したFFTの結果、0.016Hzで支配的なピークを示します。 この図の拡大版を見るには、ここをクリックしてください。
- 高速フーリエ変換(FFT)の計算を使用して、4ビン( 図 2A およびB )におけるシグマ周波数帯域(10-15Hz)スペクトル電力のパワー値を抽出する。"> 1。
- すべての非レム睡眠時代(アーチファクトおよび警戒状態間の遷移のエポックはこの平均化から除外される)について、各周波数ビンの値を平均化することによって、非レム睡眠のベースラインスペクトルパワーを計算する。関心のある期間にわたる非レム睡眠中のシグマバンドの平均パワーに各エポックのシグマパワー値を正規化する。時間に対してプロットする( 図 2C )。
- パワーダイナミクスの振動周波数成分を明らかにするために、Hamming windowingを用いてシグマパワー時間経過のFFTを計算する( 図 2D ) 1 。
- 非REMスリープ発作は異なる持続時間を有するので、結果として生じるFFTは異なる周波数分解能を有することに留意されたい。補間を行い、最も長い非レム睡眠試合から得られた最高のものに解像度を調整し、すべての試合のFFTを平均する。
- これらの分析を続けるEEGの動態とECG信号との間の位相関係を記述すること。
- R波のピーク検出に適切なルーチンを使用して、30Hzのハイパスフィルタリングの後、二乗EMG-ECG信号から心拍データを抽出します。
注:2つの連続するR波の間の最小時間間隔を80 msに制限すると、筋肉の痙攣による時折アーチファクトのピークが含まれるのを防ぐのに役立ちます1 。 - RR間隔を測定し、4秒ごとのビンごとの平均心拍数(BPM)を計算する( 図 2BおよびC )。
4.騒音への曝露
- 独自に作成したソフトウェアを使用してノイズ(ホワイトノイズ)を生成します。期間を20秒に設定し、強度を90 dB SPL(ケージ内で測定)に設定します。標準のアクティブスピーカーでノイズを再生する1 。
- 手術後、レコーダーへの慣れの間にランダムに、 1日を通して数回、異なる瞬間に実験的な騒音を演奏する。
- 実験条件(EEG / EMG / ECGデータを記録している間)で、軽い発声(ZT0)で最初の100分間に擬似ランダムにノイズを再生する。ノイズを再生するには、以下の条件を満たす必要があります。1 :
- マウスが非REMスリープ状態に40秒以上入っていることを確認してください。
- 以前の曝露が4分以上前に起こったことを確認してください。
注:この結果、セッションあたり約15回のエクスポージャが発生します。
- 録音時間の開始と各ノイズの暴露の開始をマークします。手順中に実験者が非レム睡眠のスペクトル組成に盲目を保つ。
- 睡眠ポリグラフソフトウェア1、29のすべてのデータを取得します。
5.行動経過に基づく睡眠の遡及分析騒音への露出
- 騒音暴露時間を知らずに、4秒の分解能でEEG / EMG -ECGトレースを手動で採点する1 。
- EEG / EMG-ECG /ノイズ暴露データを抽出するには、カスタムスクリプトを使用します1 。
- ノイズ曝露中にEEGおよびEMG信号の両方が変化しないままである場合の睡眠経過としてのスコア( 図3A )。 EMG-ECG電極( 図3B )上で検出された筋肉活動と組み合わせて、EEG振幅が減少し、EEG周波数が増加するときの起床を考慮する。
- 前刺激期間または騒音曝露の最初の4秒で動物が目を覚ました試行を捨てる( 図3D )。
- 覚醒成功率を、含まれているすべての試験(「覚醒」および「睡眠中」)における覚醒試験の割合として定義する。
- 含まれているすべての試行で、thの間のシグマパワーのダイナミクスを調べるeプレ刺激期間( 図 3E ) 1 。

図3。 騒音発生に応答した行動成果:分析から保持または除外された代表的な結果。
( AD )ノイズが始まる前とノイズの20秒間の40秒間の青色影の領域で表されるEEG(黒色)とそれに対応するEMG-ECG(グレー)信号の未加工のトレース。警戒状態はカラーコードで示されます。分析に含まれたデータを説明するために、代表的な「Sleep-through」( A )および「Wake-up」( B )イベントが示されています。捨てられた結果には、REM睡眠への移行( C )および早熟な「覚醒(Wake-up)」反応( D )が含まれていた。挿入図には広がりが見られますREM睡眠に特徴的なEEGおよびEMG-ECGのトレース部分を示す。 ( E ) "Sleep-through"(左)と "Wake-up"(右)イベントの間にノイズが発生する前の40秒間のウィンドウにおけるシグマ・パワー・ダイナミクスの典型例。シグマバンド用にバンドパスフィルタされた生のEEGトレースは上に示されている。青い部分はノイズの発生を表します。 この図の拡大版を見るには、ここをクリックしてください。
結果
図 2A (上のパネル)は、説明したように埋め込まれた睡眠ポリグラフ電極を介して記録された自発睡眠 - 覚醒行動の100分のストレッチを示す( 図1参照)。非レム睡眠発症時のEEGおよびEMG振幅の増減ははっきりとわかる。断続的なレム睡眠は、EEG振幅の減少と、この圧縮された時間スケールでは見えないEMGト?...
ディスカッション
ここでは、EEG、EMG、およびECG変数を統合する非レム睡眠の連続時間プロファイルを確立する方法を示します。これは、ノイズに対して高及び低反発非REM睡眠1中編成され、その上、以前に認識されていないタイムスケールを識別するのに役立つことができ、マウスの睡眠の統合的記述を、開発に向けた最初のステップです。同様の時間的構造も、類似の分析1を
開示事項
著者らは、競合する財務的関心がないと宣言している。
謝辞
私たちは、この原稿の執筆と慎重な読書への貢献について、すべてのラボメンバーに感謝します。外科手術プロトコールに関する有益なコメントをいただいたGisèleFerrand博士と騒音暴露のためのオリジナルのLabview実行ファイルを提供してくださったJean-Yves Chatton氏に感謝の意を表します。資金は、スイス国立科学財団(Grants 31003A_146244および31003A_166318)とEtat de Vaudによって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3 x 2-channels | ENA AG | 2.316 | Raster 2.54 x 2.54 mm; size 5 x 8 x 9 mm; pin size 5 mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
参考文献
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved