Method Article
成人果蝇脑内蘑菇体和感光神经元的解剖和荧光染色
摘要
本协议描述了成人果蝇脑组织的解剖和免疫。具体地说, 该协议强调了使用果蝇蘑菇体和感光神经元作为神经元子集的例子, 可以准确地用来揭示神经发育的许多方面的一般原则。
摘要
神经系统的发展涉及一系列的事件, 由几个信号通路和监管网络协调。在这些通路中所涉及的许多蛋白质是哺乳动物和其他真核生物之间的进化守恒, 如果蝇果蝇, 表明在这些过程中存在类似的组织原则。生物.重要的是,果蝇已被广泛用于识别哺乳动物所需的细胞和分子机制, 包括神经发生、分化、轴突引导和突。苍蝇也被成功地用于模拟各种人类神经发育疾病。在这里, 我们描述了一个协议的 step-by 一步的显微解剖, 固定和荧光定位的蛋白质在成人果蝇脑。本议定书的重点是两个例子的神经元种群, 蘑菇体神经元和视网膜光, 并包括可选的步骤, 以跟踪个别蘑菇体神经元使用镶嵌分析与阻遏细胞标记 (MARCM) 技术。示例数据来自野生类型和突变的大脑, 并显示了一个简单的描述的评分标准的轴突引导缺陷。虽然这项协议突出了两个行之有效的抗体来调查蘑菇体和感光神经元的形态, 其他的果蝇脑区和蛋白质在其他脑区的定位也可以使用此协议进行调查。
引言
虽然果蝇神经系统比人类和啮齿类动物要小, 但它的复杂性提供了一个强大的、平易近人的模型来更好地理解其脊椎动物的对应。在许多情况下, 脊椎动物和苍蝇的基因组编码非常相似的蛋白质, 支配神经系统发育的机制。事实上, 在脊椎动物神经系统发育所需的许多基因中, 有基因在苍蝇中, 包括那些参与控制模式、神经形成和轴突引导的信号通路1,2,3 ,4,5。例如, 淳是哺乳动物轴突引导所需的配体和四腹果蝇6、7、8。虽然淳最初是从胚胎鸡脑组织6中分离出来的, 但随后的研究表明, 淳在果蝇8的胚胎中枢神经系统 (CNS) 发育过程中起到了保守作用。其他研究在胚胎的果蝇中枢神经系统中使用了遗传屏幕, 以确定在果蝇和脊椎动物9中寻所需的保守配体和受体。
虽然在过去广泛使用的胚胎飞行中枢神经系统, 以确定配体, 受体和细胞内信号蛋白所需的轴突引导8,9, 最近的工作研究了许多方法这些蛋白质也控制寻的决定在发展的后期阶段。具体地说, 对蘑菇体 (MB) 和视网膜感光神经元发育的研究 (图 1) 提供了对控制寻、突触形成、轴突修剪和神经元的其他几个方面的机制的洞察力。开发10,11,12,13,14,15,16,17。感光神经元将苍蝇视网膜连接到被称为椎板和髓质的成人大脑区域, 对于将视觉信息传递到大脑是至关重要的 (通过18,19查看), 而蘑菇体神经元位于飞脑中央, 是学习和记忆所需的20,21。光感受神经元和蘑菇体的固有神经元, 称为肯扬细胞, 利用进化保守的扩散和依赖关系的轴突引导机制, 找到他们的后目标。除了在成人果蝇中可见外, 感光细胞和 MB 神经元还可以直接在幼虫和蛹中进行可视化, 抗体或报告基因22,23,24,25。在不同的发育时间点, 能够很容易地将这两组神经元形象化, 这促进了它们作为神经发育的许多方面的高超模型的使用。
除了被用来作为一个模型来了解正常神经系统的发展机制, 最近的研究表明, 苍蝇也可以作为准确的模型的各种人类疾病, 包括脆性 X 综合征 (单口)26, 智力残疾 (ID)27,28,29,30,31, 以及其他32。例如, 为了研究最近与人类智力残疾相关的基因 ZC3H14 的分子功能, 我们用苍蝇 ZC3H14 同源的空等位基因建立了一个 ID 飞行模型, 称为 Nab230。缺乏 Nab2 的苍蝇有严重的记忆损伤和扩展聚 (A) 尾, 综述在人类患者或患者的细胞系中观察到的东西33,34。重要的是, 苍蝇缺乏 Nab2 也显示严重的大脑形态学缺陷在他们的成年蘑菇体34, 类似的是什么观察到苍蝇缺乏单口综合征基因, FMR135。因此, 苍蝇可以作为一个重要的模型有机体, 研究正常的大脑发育和疾病, 扰乱它。
最后, 可访问的高吞吐量方法来监测行为, 结合大量可用的遗传工具, 使果蝇的模型有机体的选择, 以确定大脑区域, 控制复杂的行为, 如学习和记忆, 睡眠, 求爱, 干渴, 和其他36,37,38,39。一个特别有用的工具, 是在飞行遗传学家的 "工具箱" 的中心是 GAL4/UAS 系统 (图 2)。此系统40,41使用 Gal4 转录激活剂的组织特异性表达, 以增加上游激活序列 (无人操作系统) 的基因或转基因下游的表达。这一系统的修改使得研究人员能够精确控制特定神经元的兴奋性42,43, 过度或击倒特定的感兴趣的基因44, 45, 分析 real-time 钙动力学体内46, 并表达报告基因标记神经元谱系41。GAL4/UAS 系统与有丝分裂重组的结合也允许创建镶嵌分析与阻遏细胞标记 (MARCM) 系统12,47。MARCM 已广泛应用于单神经元追踪, 以确定轴突制导所需的蜂窝信号元件12,47。虽然这些和其他技术提供了一些宝贵的洞察力的细胞机制所需的神经系统功能, 大多数要求,果蝇大脑首先被解剖;仔细的大脑切除需要保留正确的大脑形态和大脑区域之间的连接模式。下面的协议使用蘑菇体和感光神经元作为例子神经元群体, 因为它引导你通过解剖和荧光染色成人果蝇的大脑。
研究方案
1. 果蝇 遗传学和可选热休克程序
- 一旦飞越和 F1 后代已经孵化, 获得适当基因型的雌性和/或雄性。根据被调查的大脑区域, 苍蝇应该每天收集并按性别分开, 以便更容易区分年龄依赖性和/或性二的脑连接模式.
注: 可选: 如果苍蝇被用于镶嵌分析与阻遏细胞标记 (MARCM) 分析 12 , 47 , 胚胎, 幼虫, 或蛹应热休克37和 #176; C 为 30-45 min 到诱导有丝分裂重组。为了针对蘑菇体的特定区域进行 MARCM 分析, 应根据由 12 确定并在 图 5 B 中概述的时间表对热休克进行计时。如果使用 MARCM 来调查蘑菇体以外的脑区, 则应进行试验, 确定最佳的热休克阶段。虽然下面的步骤是关于 eclosed 苍蝇, pharate 成人也可以解剖使用这些步骤后, 蛹案件已被删除.
2。解剖站准备
- 将显微镜和光源与连接的光纤 goosenecks 放在一个大的台式上。促进稳定的手运动, 减少手和 #34; 抖动和 #34; 解剖时, 显微镜周围有足够的手和臂休息空间是必不可少的。确保显微镜的两侧有大约 8-10 英寸, 显微镜的底部和工作台的边缘之间有 4-6 英寸.
- 用1.0 毫升的 PTN 缓冲液 (0.1 米磷酸钠缓冲液 pH 7.2, 0.1% 非离子表面活性剂, 见材料表完成缓冲组件), 在冰上解剖站旁边, 填充2或3口玻璃9井或3井盘。新解剖的大脑将被转移到这个盘子和储存, 直到固定步骤.
- 注意: 如果需要实时成像, 则剥离缓冲区应为1x 磷酸盐缓冲盐水 (PBS) 或 HL3 缓冲区 48 。如果需要细胞内蛋白定位, PBS 也可以作为一个替代的缓冲用于解剖和固定。在固定后, 应使用含有0.1% 或0.3% 非离子洗涤剂的 PTN 洗涤器来进行细胞膜的性.
- 如果 PBS 用于解剖和固定, 则应至少一次用含有洗涤剂的缓冲液 (如 PTN) 冲洗吸管提示, 以防止大脑在转移到离心管时粘在塑料吸管尖端.
- 使用空的 35 mm 玻璃或塑料培养皿, 构造一个含有硅胶弹性体的解剖盘。简单地说, 根据制造商和 #39 的方向, 将弹性体部件混合, 倒入35毫米的菜肴中, 让它在平坦的表面聚合过夜。含有解剖盘的弹性体应用于保护解剖钳的细微尖端, 如果在镊子和坚硬的表面 (如玻璃盘) 之间有接触, 就很容易损坏。我们也定期从网上零售商那里购买可提供的有机硅涂层菜肴。为了增加解剖时的对比度, 有机硅弹性体夹层中含有灭活炭 (因而有色黑色) 的菜肴特别有用.
3。成人大脑解剖过程
- 麻醉 3-5 天的老成人 D. 与 CO 2 或使用冰。如果使用冰, 将装有苍蝇的小瓶倒在冰桶中 (插头末端), 放入冰块中, 将瓶子放入冰中5分钟, 防止苍蝇在食物中放入。一旦苍蝇被麻醉, 将苍蝇放在冰冷的金属垫或培养皿中, 坐在冰上或 CO 2 发射飞垫上。如果解剖大脑来分析神经, 老苍蝇也可以使用.
- 将少量 (150-200 和 #181; L) 的 PTN 放在解剖盘的中心, 使用转移吸管或 p200 吸管来创建 #34; 气泡和 #34; PTN。将解剖盘置于显微镜下, 调整光照和焦距, 使 PTN 气泡充满视野, 并均匀地照亮.
- 操纵苍蝇, 使他们 #34; 腹部和 #34; ( 即 , 腹侧向上), 而躺在金属或 CO 2 垫.
- 使用一对 #5 钳, 抓住苍蝇的腹部进行解剖, 保持苍蝇, 完全淹没在解剖盘 PTN.
注意: 对于协议的其余部分, 在头部被淹没在 PTN 中时, 应执行所有步骤. - 使用第二对 #5 钳, 抓住飞鼻的底座, 将两对镊子拉开, 将飞头从身体中分离出来。丢弃腹部和胸腔。在这一步, 这是至关重要的头是不释放, 并允许漂浮在表面的 PTN。一旦头部漂浮, 它可能是很难抓住再次没有粉碎大脑.
注意: 使用这种方法, 大脑和腹神经线之间的连接被切断。如果需要 CNS 的这些区域之间的完整连接, 则应遵循替代的解剖协议, 如 49 , 50 。如果在头被移除前, 喙从苍蝇头上分离, 就会有一个小孔。在这种情况下, 抓住飞头在洞的边缘附近的一只眼睛。然后用适量的力除去头部, 同时将两对镊子分开。有时, 当头部从身体中移除时, 内脏和/或腹侧神经线仍然附着在头部, 在继续解剖之前应将其移除. - 当一对镊子抓住喙时, 第二对就应该掌握右苍蝇眼的内侧缘。慢慢地, 把钳子从彼此分开。这一步应该用少量稳定的侧向力来完成。当钳子慢慢地从彼此分开时, 喙应该从头部拉开, 在头部角质层中形成一个中心孔。用第一对镊子丢弃鼻部, 而不释放第二对的右眼内侧部分.
注意: 成年的 黑腹果蝇 大脑位于尾部 (即: 飞头的后/后部) 区域 ( 即 。因此, 应避免掌握该区域的头部。理想的情况下, 只有侧 ( 即 , 前部) 的头部附近的视网膜内侧应直接抓住镊子。现在, 大脑和相关的气管应该通过角质层的中央孔可见。此时, 从孔中伸出的任何白色的气管线都可以被移除和丢弃. - 与第二对钳, 抓住左视网膜内侧边缘 (在头部角质层的中心孔的边缘)。为了去除视网膜和相关的角质层, 慢慢地把镊子从一个 180 #176; 角度。当视网膜从下方的视神经叶离解时, 你应该会感觉到轻微的张力下降。缓慢地进行, 以防止撕裂的视神经叶.
注意: 在这一步中, 把镊子分离得太快可能导致撕裂e 光叶或蘑菇体结构的破坏。有时, 角质层会被移除, 但视网膜的碎片仍会附着在视神经叶上。如果成像的蘑菇身体, 它是没有完全必要的, 以消除整个视网膜。然而, 分析其他脑区 (如视神经脑叶的视网膜神经支配) 可能需要完全切除视网膜, 如 48 , 51 。 注意: 由于视网膜与大脑的下视叶逐渐分离, 因此视叶应可观察为白色、粘性气管覆盖的不透明白色结构。一旦一个视网膜被移除, 它就可以被丢弃。在分析视网膜神经元的寻时, 应特别注意这一步骤, 以防止对视神经的损害。一个附加的协议的重点是解剖和活体成像的感光神经元也可用 48 . - 现在, 小心地取出尽可能多的可见气管。气管可能已经包含或以后充满空气, 导致大脑漂浮, 并且在以后的免疫步骤中可能会丢失。为了去除气管, 用一双锋利的 #5 钳把它从大脑中取出. 通过使用两对钳来抓住左侧视网膜的内侧区域,
- 去除剩余的视网膜和周围的角质层。小心地把视网膜撕成两半, 去除视网膜和角质层的碎片。在某些情况下, 去除残留的角质层而不挤压大脑证明是特别具有挑战性的。在这些情况下, 我们发现, 其余的股的腹神经线可以代替抓住一副镊子, 而另一对钳子是用来小心删除最后的角质层.
- 使用 p200 吸管, 将解剖的大脑移动到9或 3 PTN 的一盘井中。同样的基因型的大脑应该被聚集到同一井里, 并保持在冰上。脑组织应在解剖后一小时内修复。大脑可以被固定在小批量和汇集, 如果需要更多的大脑。在大多数情况下, 一个经验丰富的研究员通常可以解剖大脑和转移到玻璃收集盘约 3-5 分钟.
4。固定和荧光染色程序
- 使用 p200 吸管, 将解剖的大脑从9个好的盘子转移到0.5 毫升的离心管中, 填充0.5 毫升4% 甲醛稀释在 PTN。至少 10-15 相同基因型的大脑可以组合成一个离心管。所有剩余步骤 (直到将大脑安装到幻灯片上) 在0.5 毫升离心管中完成.
注意: 甲醛 (粉煤灰) 应在通风柜中处理。应妥善保存和处置粉煤灰废弃物。20% 甲醛购买的玻璃安瓿可以 aliquoted 到离心管和存储在-20 和 #176; C, 直到需要. - 在通风罩内, 在室温下以慢速摇摆, 在4% 甲醛中孵育20分钟的大脑.
- 在固定后, 允许大脑以重力的离心管底部.
注意: 偶尔, 大脑可能会粘在离心管的一侧。如果发生这种情况, 它通常是有益的横向旋转的管之间的食指和拇指或非常轻轻地轻拍在板凳上的管, 以促进大脑下沉. - 使用 p1000 吸管移除定影液, 并执行两 #34; 快速 #34; 用500和 #181 冲洗; PTN, 允许大脑在洗涤之间的离心管底部沉淀。在这些快速冲洗过程中, 一旦所有的大脑都被重力固定在离心管的底部, PTN 就可以立即换新的缓冲液;不需要额外的清洗时间.
注意: 通常情况下, 在试管中留出额外的缓冲比冒险的大脑切除更可取。经常需要仔细检查吸管尖端, 以确保没有大脑被错误地从试管中移除。如果大脑被意外地 pipetted 进了尖端, 把它们放回离心管, 等待大脑解决, 然后继续去除剩余的多余的 PTN. - 在最后一次快速清洗后, 使用 p1000 吸管执行三和 #34; 长和 #34; 洗涤: 添加500和 #181; PTN 和洗涤20分钟, 在室温下的摇杆/nutator。所有未来和 #34; 长和 #34; 洗涤应该是20分钟.
注: 在这些洗涤之后, 固定的脑子可能隔夜被存放在4和 #176; C 在 PTN. - 使用 p1000 吸管移除最后一次洗涤, 并在室温下在0.5 毫升的阻挡液中孵育摇杆或 nutator 上的大脑 (PTN + 5% 正常山羊血清 (NGS)), 在室温下至少30分钟.
- 山羊二级抗体将用于后续的协议步骤。如果来自其他物种的二次抗体将被使用, 该物种的正常血清 (而非 NGS) 应用于阻断和抗体溶液中.
- 使用 p1000 吸管, 移除阻塞解决方案并添加 PTN 中稀释的主抗体 (PTN + 5% NGS + 稀释的主抗体)。第一次使用初级抗体时, 应根据经验确定该抗体的最佳稀释度.
注: 用于可视化蘑菇体神经元, 通常使用识别 Fas2 的抗体。这些抗体可从发育研究杂交瘤库 (DSHB) 作为抗体 1D4, 应稀释1:20 在 PTN + 5% NGS.
注意: 对于视觉感光神经元, 识别 chaoptin 的抗体通常被使用。Chaoptin 抗体可从 DSHB 作为抗体 24B10, 应稀释1:20 在 PTN + 5% NGS.
注: 固定过程通常消除荧光蛋白, 如绿色荧光蛋白 (GFP) 萤光。因此, 当使用 MARCM 分析单个 MB 神经元的轴突引导时, 使用一种能识别 GFP 的抗体. - 在 2-3 晚的摇杆/nutator 上孵育大脑在主抗体溶液中, 在4和 #176; C.
- 在与主抗体的孵育后, 允许大脑沉淀到离心管的底部, 然后移除主抗体溶液.
- 使用 p1000 吸管, 执行2和 #34; 快速和 #34; 洗涤和3和 #34; 长和 #34; 20 分钟洗涤与0.5 毫升的 PTN 如上所述, 在步骤4.4 和 4.5, 仔细地让大脑解决重力到底部的离心管之间的每洗.
- 在室温下用适当的荧光标记的二级抗体孵育大脑3小时。二次抗体通常被稀释在0.5 毫升的 PTN + 5% NGS 浓度为 1:200.
注: 一旦添加了荧光二级抗体, 在实验的其余部分, 大脑就应该保持在黑暗中.
注意: 如果残留的 gfp 荧光保持不变, 在进行 MARCM 分析时, 最好使用带有类似荧光刺激/发射波长的荧光的二次抗体 ( 例如 、Fluoroscein isothyocyanate (FITC) 或Alexa488). - 继二次抗体孵化后, 允许大脑沉淀到离心管的底部, 并去除二次抗体溶液.
- 执行2和 #34; 快速和 #34; 洗涤和 3 #34; 长和 #34; 20 分钟洗涤与0.5 毫升 PTN 如上所述, 在步骤4.4 和 4.5, 仔细地让大脑解决的底部的离心管之间的每洗.
- 在第三和 #34 之后; 长 #34; 20 分钟洗涤, 使用p200 吸管移除尽可能多的缓冲器.
- 添加75和 #181; L 荧光防安装介质的大脑。吸管的大脑和安装介质到吸管顶端一次混合。不要倒置管, 因为大脑可能会卡在离心管的顶部或两侧.
注: 在安装介质中, 在大脑悬浮后, 管子可以用铝箔包裹, 以减缓荧光淬火, 并储存在4和 #176; C 过夜。如有必要, 大脑可以在4和 #176 中储存数天, 但最好是尽快安装在幻灯片上.
5。安装成人的 黑腹果蝇 大脑到显微镜下的幻灯片和成像
- 生成和 #34; 桥和 #34; 幻灯片。位置两 #34; 底座和 #34; 片大约1厘米, 在一个带正电的幻灯片上。确保幻灯片的正面带电面朝上。使用指甲油将片粘附在幻灯片上, 如 图 3 A 所示。它通常是有益的, 以密封三外边缘的每个基地覆盖滑与指甲油, 以确保安装介质不灯芯在这些基本盖卡瓦。在继续之前, 让指甲油完全干燥 (10-15 分钟).
- 将幻灯片置于显微镜下, 并将安装介质解决方案插入两个片之间的空间。为了提供更多的对比, 它是有用的操纵鹅颈灯, 使他们是平行的板凳顶部.
- 使用吸管从幻灯片上卸下多余的安装介质, 注意不要将大脑移出幻灯片.
- 灯芯走额外的安装介质。这将使大脑在下一个步骤中更精确地定位.
- 使用一对镊子和显微镜, 定位在幻灯片上的大脑在一个网格模式与触角裂片朝上.
- 将盖板滑动 (#34; 桥 #34;) 在脑中 ( 图 3 a )。用指甲油封住桥盖滑动处的两侧, 并与 #34 接触; 底座和 #34; 盖板.
- 使用 p200 吸管, 用新的安装介质慢慢填充桥下的中心腔 ( 图 3 B )。一次放置在中心片的开放边缘, 并允许安装媒体灯芯下的中心桥片。继续, 直到整个腔充满了安装介质, 然后密封的顶部和底部与明确的指甲油.
- 指甲油干燥后, 立即将幻灯片图像或存储在-20 和 #176 的透光紧滑动框中.
- 在一个星期内, 图像大脑使用激光扫描共聚焦显微镜与激发激光器和过滤立方体适合选择的荧光二级抗体。蘑菇体神经元的 Z 叠加图像通常使用20X 和 #160; 或40X 和 #160; 目标。视网膜感光神经元的成像可能需要更高的放大倍数.
结果
上述方法允许对成人果蝇大脑的几乎任何区域进行可靠和可重现的可视化。在这里, 我们的重点是蘑菇体和感光神经元, 但其他研究使用类似的方法来可视化大脑区域, 如intercerebralis52, 时钟神经元53,54, 和触角裂片投射神经元55, 在许多其他。重要的是, 这种技术可以用来可视化整个大脑结构以及这些结构中的单个神经元, 使用诸如 MARCM12、47等技术。图 4、图 5和图 6显示了在成人大脑中的蘑菇体和感光神经元中的几种不同类型的数据, 可以使用这种解剖和免疫技术生成。
首先, 上述方法可用于直接可视化蘑菇体形态使用的任何抗体承认 Fasciculin 2 (Fas2) 或记者基因表达的蘑菇体神经元34。如图 4A和图 4B所示, Fas2 抗体可用于在成人果蝇大脑中对蘑菇体的α、β和 (在较小程度上) γ裂片进行可视化。Fas2 是神经元束所需的细胞粘附蛋白, 在α和β裂片23,56,57的高电平中表达, 使其成为这些蘑菇的可靠而稳固的标记身体神经元。值得注意的是, 位于成人大脑中央区域的圆形椭圆形身体也可以使用这种抗体 (图 4A) 进行可视化。
轴突引导蛋白的缺陷往往导致不完全渗透蘑菇体突变表型15,34,35。因此, 在大多数情况下, 应该对几十个大脑进行成像和分析。例如, 蘑菇体β叶轴突的 Nab2 空苍蝇不适当地穿过大脑中线。这种 "交叉" 或β裂片 "融合" 表型通常在80% 的成人 Nab2 空蝇中观察到, 但主要是缺乏野生型控制, 可分为轻微、适度或完全融合34。β裂片横跨中线的 "融合" 起因于对侧突的不正确投射到相反的大脑半球。如图 4C所示, 并在34、35中详细说明, 轻微融合指的是由 "细链 Fas2-positive 纤维" 连接的β裂片, 而适度融合指的是更实质上连接的β裂片这显示中线的耳垂厚度略有下降。完全 (或 "极端") 融合指的是完全连接的β裂片, 在中线上不显示耳垂厚度或 Fas2 染色的减少。蘑菇体β裂片融合的程度可以量化并显示在34,35或作为显示每种形态缺陷的大脑百分比的表中。
除了染色与 Fas2 抗体, MARCM 技术12,47,48也可以用来可视化的单独的 GFP+神经元内的蘑菇体裂片的轴突指导决定。MARCM 利用有丝分裂重组在发展过程中创建单独的神经元, 或无性相关的神经元群, 标记为 GFP (图 5A)。MARCM 提供了一种方法来产生少量的神经细胞, 完全缺乏一个蛋白质在其他杂苍蝇。因此, 这种技术在分析蛋白质的轴突引导功能方面特别有用, 对于整个个体的生存能力12,47也是必不可少的。用 gfp 标记的纯合空神经元可以直接与在野生型遗传背景下用 gfp 进行标记的神经元对照。此外, 根据当发育的幼虫或蛹是热休克, 不同类别的蘑菇体神经元可以目标 (图 5B)。
使用此技术生成的数据类型的示例如图 5C所示, 其中的野生类型 (即、控件) MARCM 克隆是作为示例生成的。为了生成在图 5C中显示的单个 GFP+蘑菇体神经元, 开发的 F1 幼虫最初安置在25° c。幼虫孵化后约 5-6 天 (84001), 蛹被热休克30分钟, 在37° c, 然后返回到25° c, 直到羽化。成人孵化后, 大脑被解剖 PTN, 固定, 并同时孵化与抗体识别 Fas2 (1D4, 稀释1:20 在 PTN) 和 GFP (稀释1:500 在 PTN)。然后, 大脑用二次抗体孵育, 并安装在上面描述的幻灯片上。用激光扫描共聚焦显微镜对 GFP+细胞进行了识别和成像, 并利用 ImageJ 创建了最大强度投影。如图 5C所示, 控制在α和β裂片中生成的 GFP+神经元与 Fas2 colocalize, 并在接触两个果蝇大脑半球的中线之前终止。一个单一的轴突项目前, 分, 然后项目的背和内侧形成α和β裂片。以前的几项研究使用这项技术来研究是否需要某些蛋白质在 axonogenesis 的许多方面自主学习细胞分裂, 包括扩展、寻、分支和/或修剪10, 11,12,13,1415,16,17,34。
除了蘑菇体, 视网膜感光神经元 (R 细胞) 的轴突寻决定也可以使用上述解剖方法 (以及解剖方法 de刻引用48)。苍蝇眼内的每个复眼包含8感光神经元, 可分为三组 (图 1): R1-R6 细胞, 投射到脑视叶表面的轴突;R7 细胞, 项目轴突到更深的 M6 层的髓质;和 R8 细胞, 项目轴突到中间 M3 层的延髓19,58。对每类感光光的投影模式进行了广泛的研究, 并结合这些神经元成功地作为一个模型来理解轴突引导所涉及的信号通路19,59。重要的是, 所有的感光轴突可以很容易地可视化解剖果蝇的免疫的成人, 蛹, 或幼虫组织使用的抗体, 承认 chaoptin, 细胞表面糖蛋白24,60,61. 在每个 R 细胞类型 (R1-R6、R7 和 R8 细胞) 中表达 GFP 或β-乳糖的报告基因也已建立, 可用于可视化每类感光器62。由于每种类型的 R 细胞终止在一个不同的层发展的视神经叶, 这些记者已经允许详细比较的信号通路所需的每个细胞类型, 以正确地找到其目标。在图 6中显示了两个这些记者基因所产生的表达模式的示例, 它们与 chaoptin 本地化 (可用作所有感光器神经元的标记) 结合使用。为了形象化 R7 光, 包含 R7-specific Rhodopsin4-LacZ报告基因的大脑被解剖, 并在 chaoptin 和β-乳糖抗体中染色。视 4(Rh4) 是专门在 R7 单元格的子集63中表达的。因此, Rh4启动器可用于仅在这些单元格中驱动记者基因表达式。不出所料, R7 细胞在髓质的更深的 M6 层中终止 (用黄色虚线图 6表示)。同样, 从视 6 (Rh6) 启动子中表达β-乳糖的大脑, 在 R8 光63中被明确表达, 使用识别 immunostained 的抗体进行解剖和 chaoptinβ-乳糖。如图 6所示, R8 光在髓质的 R3 层终止.虽然此处未显示, 但Rh1-LacZ也可用于可视化叶片中 R1-R6 光的终止。
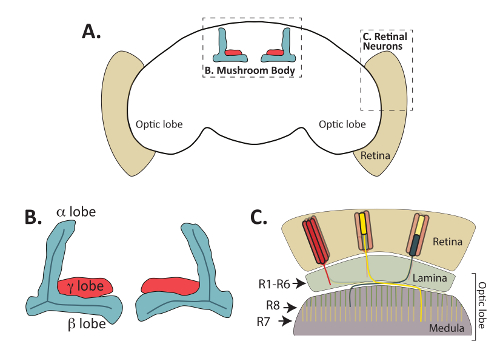
图 1:成人果蝇大脑由功能分明但相互关联的区域组成.(A) 显示了成年的黑腹果蝇的轮廓, 突出了位于中心位置的蘑菇体和外周视网膜感光神经元。(B) 成年蘑菇体轴突丛 (也称为裂片) 的放大图, 它们被 Fas2 抗体所识别。蘑菇体的固有神经元, 称为肯扬细胞, 项目轴突前从背定位细胞体 (细胞体从本图省略), 形成独特的叶结构。在成人大脑中, γ裂片 (以红色显示) 形成于一个单一的内侧束轴突, 而背α和内侧β裂片 (以蓝色显示) 形成从单一轴突分在寻过程中。α '/β ' 神经元发展轴突裂片, 部分重叠与那些α/β神经元, 但不承认的 Fas2 抗体, 并从这个图中省略。(C) 视网膜神经元在将视觉信息从视网膜传送到视神经的时候是至关重要的。轴突项目从细胞体位于视网膜 (米色) 和形成连接与后靶细胞在椎板或髓质。R1-R6 感光细胞 (以红色显示) 形成与光叶外层的细胞的特定连接, 称为叶片。R7 感光细胞 (黄色) 突触与目标在 M6 层的髓质, 而 R8 细胞 (显示在绿色) 项目轴突到稍浅 M3 层的髓质。根据麦克米伦出版商有限公司的许可改编的 C 部分: 自然神经科学 (参考64, 版权所有 (2011))。请单击此处查看此图的较大版本.
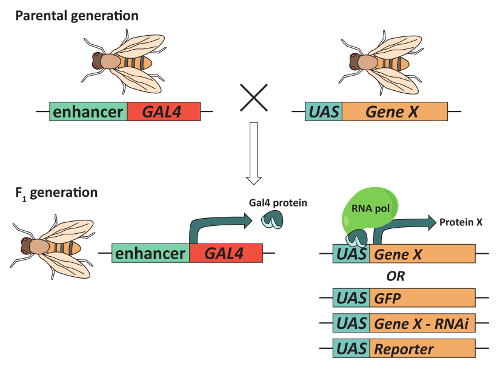
图 2:GAL4/UAS 系统可用于目标基因表达.为了获得苍蝇表达的兴趣基因 ("基因 X") 在组织特定的模式, 苍蝇必须包含两个转基因表达 Gal4 转录激活蛋白的控制下组织特异增强剂和转基因含有 Gal4 DNA绑定序列 (称为上游激活序列或无人飞行) 在基因 x 附近通常, 这种组合是通过交配亲本苍蝇, 其中每个包含一个转基因和选择为 F1后代, 其中包含两者。在结果 F1生成中, Gal4 将被表达, 并将绑定到无人参与, 以组织特定的方式激活基因 X 的转录。重要的是, 可以使用与相同的GAL4 "驱动程序" 相结合的不同的转基因。例如, 一种在蘑菇体 (MBs) 中表达 Gal4 的转基因可以与一个含有基因的转基因相结合, 以表达 GFP, 一种转基因, 利用 RNA 干扰, 或一种能产生一个记者的无人的转基因。请单击此处查看此图的较大版本.
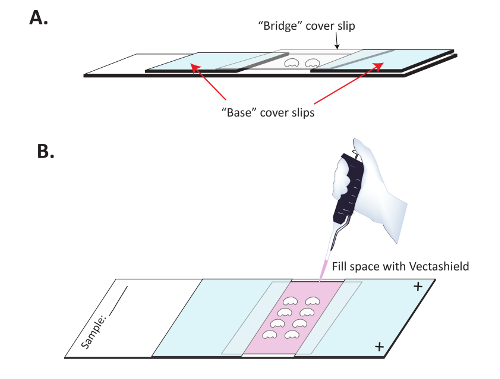
图 3:为免疫荧光成像准备的大脑安装。(A) 大脑安装在玻上, 加上一张桥盖, 防止大脑扁平化。两个 "基地" 的封面被粘在一个玻加上带正电的滑动, 指甲油清晰, 解剖后的大脑被放在它们之间的滑动上。一个明确的 "桥" 盖滑是放置在大脑上方, 并坚持基本盖卡瓦。(B) 指甲油干燥后, Vectashield 在桥下缓慢 pipetted, 以保持二次抗体的荧光。清除指甲油, 然后用密封的顶部和底部的 "桥" 盖滑。请单击此处查看此图的较大版本.
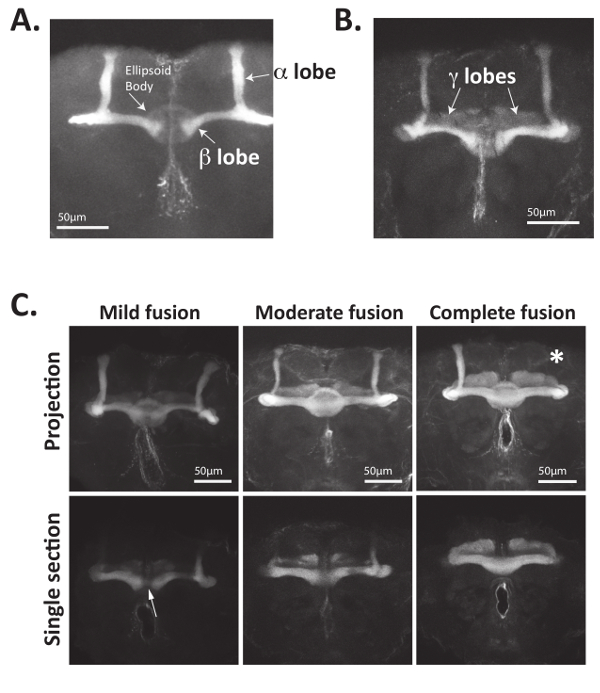
图 4:蘑菇体轴突可以用识别 Fas2 的抗体清楚地可视化.(A) 成年的果蝇大脑被解剖、固定, 并与识别 Fas2 的抗体一起孵育。使用 Alexa488-coupled 山羊-anti-mouse 二次抗体和大脑, 使用激光扫描共聚焦显微镜, 对主抗体进行了识别。Bisymmetrically 位于蘑菇身体细胞体延伸轴突前, 分叉, 并形成轴突丛 (也称为裂片)。形成背投射α裂片和内侧投射β裂片表达 Fas2 的轴突.重要的是, 野生型果蝇的β裂片在脑中线之前终止。中心位置的椭球体也可以使用1D4 抗体进行可视化。(B) 成年果蝇蘑菇体的内侧投射γ叶轴突也表达 Fas2, 可以使用1D4 抗体进行可视化。通常, Fas2 在γ叶轴突中的表达小于α和β叶。(C) Nab2-null 大脑的蘑菇体轴突 (基因型: Nab2ex3/Nab2ex3) mis-project contralaterally, 通常缺乏裂片。Nab2-null 的大脑被解剖, 固定, 和染色的1D4 抗体, 以可视化蘑菇体α, β, 和γ裂片。显示了最大强度 Z 叠加投影以及聚焦在中线区域的单个光学截面。虽然野生型蘑菇体β叶轴突很少穿过大脑中线, Nab2-null 大脑有不同数量的 mis-projection 横跨中线到对侧大脑半球, 导致 "融合" β裂片。如参考34,35中所定义的, 轻度融合指的是和 #60; β裂片只有几个 "股" 轴突穿过中线, 适度融合是指 Fas2 阳性β叶神经元穿过大脑中线而β叶的情况。中线的宽度减小, 完全融合指的是当裂片穿过脑中线时, β叶厚度不降低的情况。由于椭球体也表示 Fas2, 显示中线的光学剖面在可视化β裂片融合中往往更有用。值得注意的是, 缺少的裂片也经常被观察到 (这里用白色星号表示)。C 部分的数据用于蘑菇体表型的量化从参考34, 具有权限。请单击此处查看此图的较大版本.
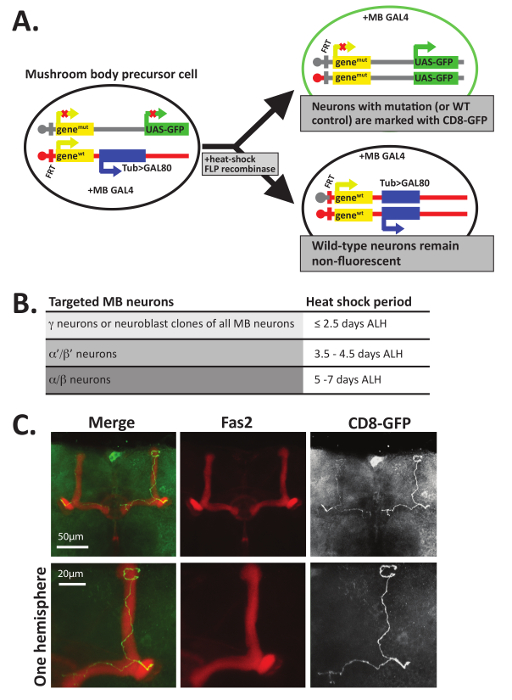
图 5: MARCM 可用于对单个神经元的轴突进行可视化.(a) 镶嵌分析与阻遏细胞标记 (MARCM) 使用 FLP 重组介导的有丝分裂重组在首次登记税网站创建两个截然不同的女儿细胞。在这个例子中, 所有的细胞都在一个单独的染色体上含有蘑菇体特定的 GAL4 蛋白。在细胞分裂期间有丝分裂重组, 一个女儿细胞 (顶) 表达 GFP (或膜界 CD8-GFP), 并包含两个突变的基因的兴趣, 而其他子细胞 (底部) 继承两个野生类型 (重量) 等位基因和用蛋白启动子表达 Gal80 蛋白的转基因。Gal80 抑制 Gal4, 因此任何产生 Gal80 的细胞都是荧光的, 应该是杂或纯合型。只有那些具有 GFP+的细胞才会包含两个变种等位基因的拷贝。注意, 仅有几种生成 GFP+细胞的方法中的一种, 同时也包含了感兴趣基因的两个变种等位性。有关其他示例, 请参见12,45,56 。(B) 由于蘑菇体神经元的发育始于γ神经元, 然后是α "/β" 神经元, 并以α/β神经元结束, 每类神经元都可以有选择地以热震惊的不同发育时间点为目标和可视化。如12中所述, 40 分钟热休克在37° c, 发生≤2.5 天幼虫孵化 (84001) 将专门针对γ; 神经元, 而热休克发生 3.5-4.5 天 84001 (在晚期 L3 幼虫阶段) 将目标α '/β ' 神经元, 和热休克, occurs 之间的5-7 天 84001 (在蛹发展期间) 将目标α/β神经元。(C) 单个的野生型轴突是用 MARCM 可视化的。野生型〜 5-6 天的老蛹 (基因型: hsFLP, UAS-CD8-GFP;FRT82B, UAS-CD8-GFP/FRT82B, 浴缸和 #62; Gal80;OK107-GAL4/+) 热休克37° c 40 分钟诱导有丝分裂重组。大脑被解剖, 固定, 并染色的抗体识别 GFP (1:500) 和 Fas2 (1:20)。然后用荧光标记的二级抗体培养大脑, 并通过共聚焦显微镜进行可视化。 蘑菇体β裂片 (形象化使用抗体认出 Fas2) 在到达大脑中线之前终止;α叶神经元也存在。为了显示更详细的信息, 一个大脑半球的放大视图显示在图像的底部行。C 部分在引用34的权限中进行了改编。请单击此处查看此图的较大版本.
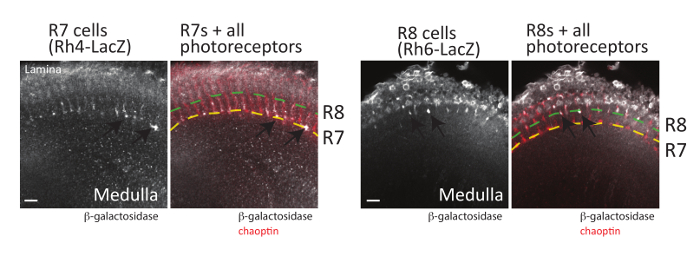
图 6: 感光神经轴突也可以可视化.成人大脑表达β-乳糖在 R7 光 (左, 使用Rh4-LacZ) 或 R8 光 (右, 使用Rh6-LacZ) 解剖, 固定, 并与识别β-乳糖或 chaoptin 的抗体孵育。然后用荧光标记的二级抗体培养大脑, 用激光扫描共聚焦显微镜进行可视化。每个脑部都显示单个光学部分。在左侧, 几个 R7 的感光轴突 (箭头) 可以看到终止在更深的 M6 层的髓质 (显示黄色虚线)。右侧, R8 的感光轴突 (箭头) 终止于髓质的外 M3 层 (由绿虚线显示)。由于 R7 光表示 Rh3 或 Rh4 和 R8 光表示 Rh5 或 Rh663, 所有 R7 或 R8 光都不能使用单个LacZ记者基因进行可视化。缩放栏 = 10 µm.请单击此处查看此图的较大版本.
讨论
上面描述的解剖和可视化方法可用于各种免疫和实时成像应用。我们已经概述了一个一般的免疫协议, 并强调了一种方法, 其中 MARCM 可以用来可视化轴突形态的个别蘑菇体神经元。此外, 这些一般程序也可用于成像其他脑区的固定或新解剖成人大脑48,65。在分析增强器陷阱、报告基因或模拟线66的表达模式时, 实时成像可以提供更有效的方法。为了防止在未固定组织中的 GFP 的活体成像过程中捕捉到细胞死亡, 应在1x 磷酸缓冲生理盐水 (pbs) 或 HL3 介质48中对大脑进行解剖, 在 1x pbs (或 HL3) 的桥式幻灯片上安装, 并在少于 15-20 分钟的图像中进行成像. 护理也应采取, 以消除尽可能多的气管从解剖大脑之前的成像, 因为它可以干扰可视化 GFP 荧光。
而染色条件, 以评估蘑菇体和感光神经元的形态学是相对完善的24,61,67, 在这些细胞的特定蛋白的本地化类型可能需要进行大量的故障排除和优化。特别是, 应优化几个关键步骤, 包括抗体稀释、阻断缓冲成分浓度和固定, 以产生最可重现和可靠的结果。首先, 应确定原抗体的最佳浓度。虽然商业上可得的抗体通常有一个建议的稀释 (我们通常开始使用这种浓度), 这些价值是很少确定的经验, 在果蝇组织。因此, 测试一系列的主要抗体稀释, 在制造商的开始建议的范围以上, 往往导致更具体的染色。虽然初级抗体稀释对染色精度有显著影响, 应精确确定, 但在含有溶液的初级抗体中, 时间大脑的孵育可能相差很大, 对整体结果影响不大。例如, 我们已经观察到类似的结果时, 孵化解剖大脑与 Fas2 抗体初级抗体的两个, 三, 甚至四天在4° c。虽然我们建议至少两个晚上, 我们还培养了一夜之间的主抗体溶液的大脑和获得可重复染色。重要的是, 在室温下 (或在4° c 的一晚), 限制大脑在二次抗体中孵育到3小时的时间, 有助于限制次级抗体与脑组织的非特异性结合。
其次, 可能需要使用额外的 "阻断" 试剂来消除不需要的背景信号。选择包括增加 NGS 的浓度到 ~ 10%, 增加 1-10% 牛血清白蛋白 (BSA) 的阻断和主/二级抗体溶液, 或 pre-adsorption 的主抗体过夜在4° c 与果蝇胚胎 (见引用68, 2.9 节, 步骤 3)。
虽然我们已经写了上述协议使用 PTN 作为建议的缓冲所有固定, 洗涤和抗体孵化步骤, 组织固定在其他缓冲区 (如进进和 PEM, 列出在材料表) 可能导致深刻的差异信号强度。例如, 以前的研究表明, 当组织固定在 PBS 的传统4% 甲醛中时, 细胞周期蛋白 E 在幼虫形象盘中是无法检测到的, 但是当组织在进进的缓冲中被固定时, 它是清晰可见的 (Ken Moberg, 个人通信和引用69)。除了缓冲成分的变化, 改变组织固定的时间和温度也可以显著影响荧光染色, 并可以根据经验确定如果需要。一般情况下, 固定时间应足够长, 以使细胞成分有足够的交联, 并能长期维持细胞的整体形态, 同时限制足以防止 over-crosslinking 和 "掩埋" 蛋白质表位。因此, 在最初优化新获得的初级抗体的染色条件时, 我们通常将固定时间限制在大约20分钟, 并且通常会在更冷的温度下修复组织。
在任何免疫荧光实验中都应包括多种控制, 以研究原发性和继发抗体的特异性以及转基因/遗传背景对观察表型的影响。为了确定主要的抗体是否是专门用来识别蛋白质的兴趣, 苍蝇组织缺乏这种蛋白质和/或组织表达的蛋白质应包括作为控制。额外的纯化抗原蛋白也可以被包括来确定是否主要抗体承认其他表位在苍蝇脑。最后, 当主抗体被省略时出现的任何荧光信号都代表所选二次抗体的非特异性结合水平。
还应包括一些重要的控制, 以评估遗传背景或转基因的存在对染色强度或神经元形态学的贡献。例如, 在图 5中的 MARCM 实验中使用的苍蝇包含多个转基因 (hsFLP、UAS-CD8-GFP、FRT82B、浴盆和 #62; GAL80 和 OK107-GAL4), 每一个都应分别分析其对蘑菇体形态的影响。在最起码的情况下, 应分析含有 OK107-GAL4 和 UAS-CD8-GFP 的苍蝇的蘑菇体形态。通过对含有 hsFLP 和 FRT82B 的苍蝇进行分析, 也可能需要评估热休克和 Flp 重组生产对蘑菇体发育的影响。虽然 MARCM 可以提供重要的洞察力, 是否一个给定的蛋白质自主控制轴突指导, 需要的控制数量, 以准确地作出这一结论可能是一个小的限制这一技术。在不太复杂的实验中, 类似的控制也适用。例如, 进行一个实验, 其中GAL4/UAS系统与 rna 干扰的转基因结合使用, 并在所有神经元中的一种感兴趣的蛋白质的击倒表达。在这个实验中, 至少有两个转基因将存在: 一个泛神经元 GAL4 驱动程序, 如elav-GAL4,和无人参与干扰转基因。除了果蝇在同一蝇中转基因的实验条件外, 还应研究转基因单飞蝇中的蘑菇体神经元的形态。
最后, 为了确定是否有兴趣的蛋白质表达的蘑菇体神经元, 通常是必要的 co-stain 的大脑与抗体 Fas2。另外, 荧光蛋白, 如 GFP, RFP, 或膜绑定 CD8-GFP 也可以使用GAL4/UAS系统表达, 并与识别感兴趣的蛋白质的抗体结合使用。由于 Fas2 只承认形成蘑菇体α和β裂片的 fasciculated 轴突, 使用 GAL4-driven, 膜结合 CD8-GFP 对标记蘑菇体神经元特别有用。
轴突引导的缺陷往往不是100% 渗透, 即使是同一基因型的大脑也可能表现出一定的变异性。因此, 当分析新产生的突变等位基因的缺陷, 蘑菇体或感光寻, 应利用不同的基因和方法的组合。文献中的大多数研究使用几种不同的方法来研究蛋白质是否在控制轴突引导中发挥细胞自主作用: i) 纯合空蝇寻缺陷的分析 (优选使用不同的怒江ll 等位基因), ii) 寻缺陷的分析苍蝇缺乏的蛋白质只在神经元 (通常通过 rna 干扰), iii) MARCM 分析寻缺陷, 和 iv) 的抢救实验中的基因 re-expressed 在神经元的纯合空苍蝇.理想的情况下, 每个基因型的几十个脑应分析的缺陷, 神经元形态学。
虽然这里描述的协议主要集中在固定组织内的蛋白质的荧光定位, 这项技术的未来应用正在开发的图像活体脑组织。一旦大脑被解剖 (通常在细胞培养基中), 它们就可以在25° c 下培养数天。这些ex 体内培养方法正在开发中, 目的是研究各种生物过程, 例如促进轴突再生的蛋白质活性70,71, 细胞内信号动力学72和神经元开发73。
披露声明
作者声明他们没有竞争的金融利益。
致谢
我们要感谢博士和 Alysia Vrailas 在最初的教学 SMK 脑解剖技术。我们还要感谢肯 Moberg 的实验小组成员, 特别是克里斯。从发育研究杂交瘤库中获得了 Fas2 (1D4) 和 chaoptin (24B10) 的抗体。抗体24B10 被 DSHB Benzer 和南四湖 Colley24,60,61, 抗体1D4 由科里古德曼22,23,56存入 DSHB。飞行股票是从布卢明顿股票中心获得的。我们还要感谢俄亥俄州农业研究和发展中心 (OARDC) MCIC 成像中心, 利用共焦显微镜对图4A 和 B 中的大脑进行成像. SMK 得到研究院 (1 R15 HD084241-01A1) 的赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
参考文献
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。