Method Article
Рассечение и Immunofluorescent окрашивание гриб тело и фоторецепторных нейронов в мозге взрослого Drosophila melanogaster
В этой статье
Резюме
Этот протокол описывает диссекции и иммуноокрашивания взрослых Drosophila melanogaster тканей мозга. В частности этот протокол подчеркивается использование дрозофилы грибные тела и фоторецепторных нейронов как пример нейрональных подмножества, которые точно можно выявить общие принципы, лежащие в основе многих аспектов развития нервной системы.
Аннотация
Развитие нервной системы включает в себя серию последовательных событий, которые координируются несколько сигнальных путей и регулирования сети. Многие из белков, участвующих в этих путей эволюционно консервируют между млекопитающих и других эукариот, например плодовой мушки Drosophila melanogaster, предполагая, что аналогичные организационные принципы существуют в ходе разработки этих организмов. Важно отметить, что дрозофилы широко используется для идентификации молекулярных и клеточных механизмов, регулирующих процессов, которые требуются в млекопитающих, включая нейрогенез, дифференциация, аксональное руководство и synaptogenesis. Мухи также успешно используются для моделирования различных заболеваний человека психомоторного развития. Здесь мы описываем протокол для поэтапного microdissection, фиксации и immunofluorescent Локализация белков в мозге взрослого дрозофилы . Этот протокол фокусируется на два примера нейрональных популяций, грибные тела нейронов и фоторецепторов сетчатки и включает в себя дополнительные шаги для отслеживания отдельных грибные тела нейронов, с помощью анализа мозаика с техникой Repressible маркер клеток (MARCM). А также краткое описание скоринга критерии аксональное руководство дефектов приводятся данные пример из дикого типа и мутантов мозги. Хотя этот протокол выделяет два устоявшихся антител для изучения морфологии грибные тела и фоторецепторных нейронов, другие Drosophila регионов мозга и Локализация белков в других регионах мозга может также быть расследование, используя этот протокол.
Введение
Хотя дрозофилы нервной системы меньше, чем людей и грызуны, его сложности обеспечивает мощный, доступный модель лучше понять его позвоночных коллегами. Во многих случаях геном позвоночных и мух кодирования очень похожие белки, которые определяют механизмы развития нервной системы. В самом деле многие из генов, необходимых для развития нервной системы позвоночных Ортологи в мух, включая те, которые участвовали в сигнальных путей, управления структурирования, нейрогенез и аксональной руководство1,2,3 ,4,5. Например Нетрины является лигандом для аксональное руководства в млекопитающих и D. melanogaster6,,78. В то время как Нетрины был первоначально изолирован от зародышевых куриных мозг ткани6, последующие исследования показали, что Нетрины играет роль сохраняется во время разработки эмбриональных центральной нервной системы (ЦНС) в дрозофилы8. Другие исследования использовали генетических экраны в эмбриональных дрозофилы ЦНС для выявления сохранившихся лигандов и рецепторы, необходимые для поиска пути в9 дрозофилы и позвоночных.
В то время как эмбриональные лету ЦНС широко используется в прошлом для идентификации лиганды рецепторов и внутриклеточных сигнальных белков, необходимых для аксональное руководство8,9, недавняя работа исследовала способов, в котором многие из Эти белки также контролировать Поиск пути решения на более поздних стадиях развития. В частности расследование грибные тела (МБ) и сетчатки фоторецепторных нейрон развития (рис. 1) предоставил заглянуть в механизмы, поиск пути управления, формирования синапсов, обрезка аксона и несколько других аспектов нейронов Разработка10,11,12,13,14,,1516,17. Фоторецептор нейронов Подключите летать сетчатки в регионы взрослого мозга называется пластинки и продолговатого мозга и имеют решающее значение для передачи визуальной информации в мозг (рассмотрен1918,), а грибные тела нейронов Отель расположен в лету мозга и необходимы для обучения и памяти20,21. Фоторецептор нейронов и встроенные нейронов Грибовидные тела, называемые клетки Кеньон, использовать механизмы эволюционно сохраняется diffusible и контакт зависимой аксональное руководства найти их пост синаптических целей. Помимо видимых в взрослых мух, фоторецептор и MB нейроны могут также быть непосредственно визуализирована в личинки и куколки с антителами или репортер генов22,23,24,25. Способность легко визуализировать эти два вида нейронов в разное время развития пунктов способствовал их использования превосходным образцом для многих аспектов развития нервной системы.
Помимо использования как модель для понимания механизмов развития нормальных нервной системы, недавние исследования показали, что мухи могут также служить точные модели широкого спектра заболеваний человека, включая синдром хрупкий X (FXS)26 , Интеллектуальной инвалидности (ID)27,28,,2930,31и другие32. Например для изучения молекулярных функции ZC3H14, ген недавно связаны с человеческой умственной инвалидности, мы создали модель fly ID с помощью null аллеля лету ZC3H14 ortholog, называется Nab230. Мухи не хватает Nab2 имеют серьезные памяти нарушениями и расширенный poly(A) хвосты, изложив что наблюдается у людей больных или пациентом производных клеток линии33,34. Главное мух, также не хватает Nab2 отображения тяжелых мозга морфология дефекты в их взрослых Грибовидные тела34, похож на то, что наблюдается в мух, не хватает FXS ген синдрома, FMR135. Таким образом мухи может служить организма важной моделью для изучения развития нормального мозга и заболеваний, которые сорвать его.
Наконец доступность методов высокой пропускной способности контролировать поведение, в сочетании с широкий спектр имеющихся генетических инструменты, сделать дрозофилы модельный организм выбора для выявления областях мозга, которые контролируют сложные поведения, такие как обучения и памяти, сна, ухаживания, жажда и другие36,37,,3839. Один особенно полезным инструментом, который находится в центре летать генетик «Инструментарий» является системой GAL4/Уан (рис. 2). 40,эта система41 использует конкретное выражение ткани transcriptional Gal4 активатора для увеличения выражение генов или трансгенов вниз по течению вверх по течению активации последовательности (Уан). Модификации этой системы позволило исследователям, например, точно контролировать возбудимость нейронов определенных42,43, overexpress или специфических генов нокдаун интерес44, 45, анализировать динамику реального времени кальция в vivo46и выразить репортер генов в ознаменование нейрональных линий41. Сочетание GAL4/Уан системы с митотическая рекомбинации, также допускается для создания мозаики анализа с12,Repressible маркер клеток (MARCM) в системе47. MARCM широко используется в один нейрон трассировки для выявления клеточных сигналов компонентов, необходимых для аксональное руководство12,47. Хотя эти и другие методы предоставили ряд ценную информацию о клеточных механизмов, необходимых для функции нервной системы, большинство требуют, что мозг дрозофилы сначала быть расчленены; тщательное удаление мозга требуется сохранить правильный мозг морфологии и связи моделей между областями мозга. Следующий протокол использует грибные тела и фоторецепторных нейронов, какПример нейрональных популяций как он проведет вас через вскрытие и immunofluorescent окрашивание взрослого дрозофилы мозги.
протокол
1. генетики дрозофилы и факультативные процедуры теплового шока
Пересекли- раз мух и потомства F1 вылупились, получить самок и самцов соответствующие генотипа. В зависимости от области мозга проводится расследование, должны быть собраны ежедневно мух и разделенных секс так, что зависимости от возраста и/или сексуально диморфных модели подключения мозга более легко отличить.
Примечание: Необязательно: Если мух используются для анализа мозаика с маркером Repressible клеток (MARCM) анализ 12 , 47, эмбрионы, личинки, или куколок должно быть шокированы при 37 ° C за 30-45 мин до тепла побудить митотическая рекомбинации. Для конкретных регионов Грибовидные тела для MARCM анализа, теплового шока должен быть приурочен согласно графику определяется 12 и изложенные в Рисунок 5 B. При использовании MARCM для расследования регионов мозга, помимо Грибовидные тела, экспериментальные эксперименты следует определить оптимальный этап быть шокированы тепла. Хотя действия записываются в отношении eclosed летит, pharate взрослых могут расчлененный, используя эти шаги после удаления куколки дело.
2. Рассечение станции подготовки
- позицию, стереомикроскопом и свет источника с придает волоконно оптические «Гуснекс» на большой benchtop. Для поощрения движений твердая рука и сократить ручной " трясти " при рассечения, важно, что достаточно места отдыха руку и руку вокруг Микроскоп. Убедитесь, что на обе стороны микроскопа и 4-6 дюймов между основание микроскопа и краем скамейке около 8-10 дюймов.
- Заливки 2 или 3 скважины стекла 9-Ну или 3-ну блюдо с 1,0 мл PTN буфера (0,1 М натрия фосфат буфера рН 7,2, 0.1%, неионогенные ПАВ, см. таблицу материалы для полного буфера компонентов) и место рядом с рассечения станции на льду. Недавно расчлененных мозги будут переданы это блюдо и хранятся до фиксации шаг.
- Примечание: Если требуется живых изображений, рассечение буфера должен быть 1 x фосфат буфер солевой (PBS) или HL3 буфера 48. Если требуется локализация внутриклеточных белков, PBS также может использоваться в качестве альтернативного буфера для фиксации и dissection. После фиксации, permeabilization клеточных мембран следует затем выполнить с помощью PTN моет содержащие 0,1% или 0,3% неионогенных моющее.
- Если PBS используется для вскрытия и фиксации, наконечники должны быть промыт по крайней мере один раз с буфером содержащие моющего средства (например, PTN) для предотвращения мозги от прилипания к пластиковые наконечники во время передачи microcentrifuge трубы.
- С помощью пустой 35 мм стекла или пластика Петри, построить рассечение блюдо, содержащий силиконового эластомера. Вкратце, смешивать компоненты эластомер по заявлению производителя ' s направления, налить в 35 мм блюда и пусть она на ночь полимеризоваться на плоской поверхности. Эластомер, содержащие рассечение блюда должны использоваться для защиты прекрасные советы рассекает щипцы, которые легко могут быть повреждены, если контакта между щипцы и труднее поверхность, например, стеклянную посуду. Мы также регулярно покупают коммерчески доступных силиконовым покрытием блюда из Интернет-магазинов. Чтобы увеличить контраст во время вскрытия, особенно полезны силиконовые эластомера рассечение блюда, содержащий инактивированные древесный уголь (и таким образом цветной черный).
3. Взрослый процедура диссекции мозга
- Anesthetize 3-5 день старых взрослых D. melanogaster с CO 2, или с помощью льда. Если используется лед, место, которое предотвращает флакон содержащий летит вверх ногами (конец вилки вниз) в ведёрке со льдом на ~ 5 мин, наладочные льда флакон вверх дном летит от стать подал в пищу. После того, как мухи были наркоз, место мух на холодных металлических pad или Петри сидя на льду или на CO 2, испуская летать колодки. Если разбор мозги анализировать нейродегенеративные, могут также использоваться старые мух.
- Место небольшую сумму (150-200 мкл) PTN в центре рассечение блюдо с помощью пипетки передачи или пипетки Р200 для создания " пузырь " из PTN. Поместите блюдо диссекция под стереомикроскопом и отрегулировать освещение и сосредоточиться, чтобы пузырь PTN заполняет поле зрения и равномерно освещено.
- Манипулировать мух так, что они являются " брюхом вверх " (то есть, вентральной стороне вверх) лежа на металл или CO 2 колодки.
- Использование одной пары #5 щипцами, понять живота, летать на быть расчленены и, держа лету, полностью погрузите его в PTN на блюдо рассечение.
Примечание: Для оставшейся части протокола, все шаги должны выполняться в то время как руководитель погружен в PTN. - С помощью второй пары #5 щипцами, понять основание летать Хоботок и потяните две пары щипцы врозь, чтобы отсоединить летать головы от тела. Отказаться от живота и грудной клетки. Во время этого шага важно, что голова не выпустил и разрешили плавать на поверхности PTN. После того, как плавающий голову, это может быть очень трудно понять снова без дробления мозга.
Примечание: С помощью этого метода, разорваны связи между мозгом и воспалении брюшины шнур. Если требуются нетронутыми соединений между этими регионами центральной нервной системы, следует альтернативных рассечение протокол, например 50 49 ,. Если Хоботок отсоединяется от летать головы до головы удаляется, будет отверстие, где Хоботок был. В этом случае понять головку летать на краю отверстия возле один глаз. Затем удалите головы, используя умеренное количество силы потянув две пары щипцы отдельно друг от друга. Иногда, когда руководитель удаляется из организма, кишки и/или брюшной нервной шнур остается прикреплены к голове и должны быть удалены перед продолжением диссекции. - В то время как одна пара щипцы захватывает Хоботок, вторая пара должна понять медиального края право летать глаз. Медленно потяните щипцы отдельно друг от друга. Этот шаг должен выполняться с небольшим количеством устойчивый боковых сил. Как щипцы медленно перемещать отдельно друг от друга, Хоботок должен тянуть от головы и создать центральное отверстие в голову кутикулы. Отказаться от Хоботок с первой парой щипцов не отпуская медиальной части правого глаза от второй пары.
Примечание: Взрослый D. melanogaster мозг находится в хвостовой (т.е., задняя/задние) регион летать головы. Таким образом следует избегать цепляния этого региона головы. В идеале, только ростральной (то есть, фронт) часть головы у медиальной сетчатки должны быть непосредственно понято щипцы. Мозг и связанные трахеи теперь должно быть видно через центральное отверстие в кутикулу. В это время, все белые стринги потоки трахеи торчащих из отверстия можно удалены и отбрасывается. - С второй пары щипцами, понять медиального края левой сетчатки (на краю центрального отверстия в голову кутикулы). Чтобы удалить сетчатки и связанные кутикулы, медленно потяните щипцы подальше друг от друга под углом 180 °. Как сетчатки дистанцируется от основной доли Оптика, вы должны чувствовать некоторое снижение напряженности. Действовать медленно, чтобы предотвратить разрыв лоб зрительный.
Примечание: Разделение щипцы слишком быстро на этом этапе может привести к разрыву thлоб зрительный e или нарушение грибные тела структур. Иногда Кутикула будет удалена, но части сетчатки будет оставаться прикрепленной к лоб зрительный. Если изображений Грибовидные тела, не стоит полностью удалить всю сетчатку. Однако, анализ других регионов мозга (например, сетчатки нейрон иннервации оптические мозга долей) может потребовать сетчатки полностью извлечься как описано в 51 48 ,.
Примечание: Как сетчатки медленно отделяется от базовых зрительного доли мозга, лоб зрительный должно быть наблюдаемой как непрозрачный белый структуры, покрытые белым, тягучий трахеи. После того, как был удален один сетчатки, он может быть удален. При анализе pathfinding сетчатки нейронов, особое внимание следует во время этого шага для предотвращения повреждения зрительного мочку. Дополнительный протокол сосредоточена на вскрытие и живой изображений фоторецепторных нейронов является также доступны 48. - Теперь, тщательно удалить как можно больше видимой трахеи как можно скорее. Трахеи может уже содержать или позднее заполнить с воздухом, вызывая мозги, чтобы плавать и, потенциально, быть потеряны во время последующих шагов иммуноокрашивания. Чтобы удалить трахеи, обрывать его мозг, используя пару очень острые щипцы #5.
- Удалить оставшиеся сетчатки и окружающие кутикулы с помощью обеих пар щипцы понять медиальной области левой лететь сетчатки. Тщательно разрыв сетчатки в половину, чтобы удалить части сетчатки и кутикулы. В некоторых случаях удаление оставшихся Кутикула без дробления мозг оказывается особенно сложным. В этих случаях, мы обнаружили, что оставшиеся нити воспалении брюшины шнур вместо этого может быть понято по одной паре щипцов, в то время как другие пара щипцы используется тщательно удалить последний кутикулы.
- С помощью пипетки p200, переехать одной скважиной 9 - или 3-ну блюдо, содержащих PTN расчлененных мозги. Мозг же генотипа необходимо объединить вместе в тот же хорошо и на льду. Ткани мозга должно быть исправлено в течение одного часа диссекции. Мозг может быть исправлена небольшими партиями и пула, если требуется большее количество мозги. В большинстве случаев, опытный исследователь обычно можно вскрыть мозга и перенести его на стекла коллекции блюдо в приблизительно 3-5 мин
4. Фиксация и Immunofluorescent процедуры окрашивания
- с помощью пипетки p200, передать расчлененных мозги от 9-Ну блюдо 0.5 мл microcentrifuge заполнены с 0,5 мл 4% параформальдегида разводят в PTN. По крайней мере 10-15 мозги же генотипа могут быть объединены в один пробки microcentrifuge. Все остальные шаги (до монтажа мозги на слайды) будут завершены в пробирках 0.5 мл microcentrifuge.
Предупреждение: Параформальдегида (PFA) должно быть обработано в зонта. PFA отходы следует сохранить и утилизировать надлежащим образом. 20% параформальдегида приобрели в стеклянных ампулах может быть aliquoted в microcentrifuge трубы и хранятся при-20 ° C до тех пор, пока требуется. - Внутри Зонта, инкубировать мозги в параформальдегида 4% в течение 20 мин с медленной скоростью качания при комнатной температуре.
- После фиксации, позволяют мозги поселиться в нижней части пробки microcentrifuge самотеком.
Примечание: Иногда, мозг может прилипнуть к стороне пробки microcentrifuge. Если это происходит, это обычно полезно боково вращать трубу между указательным и большим пальцем или очень осторожно использовать трубку на скамейке содействие гибель мозга. - Удаление фиксатором с помощью p1000 Пипетка и выполнять два " быстро " моет с 500 мкл PTN, позволяя мозги, чтобы поселиться в нижней части пробки microcentrifuge между моет. Во время этих быстро моет после того как все мозги поселились под действием силы тяжести в нижней части пробки microcentrifuge, PTN могут быть немедленно заменены на свежие буфера; без дополнительных мыть время требуется.
Примечание: Как правило, оставляя дополнительный буфер в трубках предпочтительнее рискуя мозга удаления. Тщательное изучение кончика пипетки часто требуется обеспечить, что не мозги были ошибочно удалены из трубки. Если мозги были случайно накапаны в наконечник, отказаться от их обратно в пробки microcentrifuge, ждать мозги, чтобы урегулировать и затем продолжить удаление каких-либо дополнительных PTN, которая остается. - После последней быстрой стирки, используйте пипетку p1000 три " длинные " смывки: 500 мкл PTN и мыть за 20 мин при комнатной температуре на рокер/nutator. Все будущие " длинные " смывки должна быть на 20 минут.
Примечание: После этих моет, фиксированной мозги может храниться на ночь при 4 ° C в PTN. - Удалить последний мыть с помощью пипетки p1000 и инкубировать мозги на качалку или nutator при комнатной температуре в 0,5 мл блокирования решения [PTN + 5% нормальной козьего сыворотки (НГС)] по крайней мере 30 минут при комнатной температуре и.
- Вторичные антитела козочки будет использоваться в последующих протокол шаги. Если будет использоваться вторичные антитела от другого вида, нормальной сыворотки от этого вида (а не NGS) должны использоваться в решениях блокирование и антитела.
- С помощью пипетки p1000, Удалите блокирующий решения и добавьте основное антитело, разбавленных в PTN (PTN + 5% NGS + разреженных основное антитело). При использовании основного антитела для в первый раз, Оптимальное разведение что антитела должны определяться эпирически.
Примечание: Для визуализации грибные тела нейронов, антитела, признавая Fas2 обычно используются. Эти антитела доступны от развития Банк гибридомной исследований (DSHB) как антитела 1 d 4 и должно быть разбавленным 1:20 в PTN + 5% NGS.
Примечание: Для визуализации фоторецепторных нейронов, антитела, признавая chaoptin обычно используются. Chaoptin антитела доступны от DSHB как 24B10 антител и должно быть разбавленным 1:20 в PTN + 5% NGS.
Примечание: Процесс фиксации обычно устраняет флуоресценции от флуоресцентных белков, таких как Зеленый флуоресцентный белок (ГПУП). Таким образом, при использовании MARCM для анализа аксональное руководство отдельных нейронов MB, использовать антитело, признавая GFP. - Инкубировать мозги в раствор первичных антител на рокер/nutator для 2-3 ночи на 4 ° C.
- После инкубации с первичных антител, позволяют мозги, чтобы поселиться в нижней части пробки microcentrifuge и затем удалить решение основное антитело.
- С помощью пипетки p1000, выполнить 2 " быстро " смывки и 3 " длинные " 20 мин с 0,5 мл PTN моет, как описано выше в шаги 4.4 и 4.5, тщательно позволяя мозги урегулировать самотеком в нижней части пробки microcentrifuge между каждой Вашингтон
- Мозги инкубировать на 3 ч при комнатной температуре с соответствующим дневно меченых вторичные антитела. Вторичные антитела обычно разбавленной в 0,5 мл PTN + 5% NGS в концентрации 1: 200.
Примечание: После того, как были добавлены флуоресцентные вторичные антитела, мозги должны храниться в темноте на оставшуюся часть эксперимента.
Примечание: В случае остаточного остается флуоресценции GFP, при выполнении MARCM анализа, целесообразно использовать вторичное антитело обозначено с Флюорофор, имеющих аналогичные волны возбуждения/выбросов как GFP (например, isothyocyanate флуоресцеином (FITC) или Alexa488). - После вторичное антитело инкубации, позволяют мозги, чтобы поселиться в нижней части пробки microcentrifuge и удалить решение вторичное антитело.
- Выполнять 2 " быстро " смывки и 3 " длинные " 20 мин с 0,5 мл PTN моет, как описано выше в шаги 4.4 и 4.5, тщательно позволяя мозги поселиться в нижней части пробки microcentrifuge между каждой Вашингтон
- После третьего " длинные " 20 минут вымыть, использование Р200 Пипетка Удалить столько буфера как можно скорее.
- Добавить 75 мкл флуоресцентные анти затухания монтажа средних мозги. Пипетка мозги и монтажа средних в наконечник пипетки раз перемешать. Не перевернуть трубку так как мозг может стать застрял на колпачок или сторонах пробки microcentrifuge.
Примечание: После перерыва мозги в среде монтажа, трубы может быть завернуты в фольгу, чтобы замедлить Флюорофор тушения и хранить при 4 ° C на ночь. При необходимости, мозг может храниться несколько дней при температуре 4 ° C, но в идеале должен быть установлен на слайды как можно скорее.
5. Монтаж взрослых D. melanogaster мозги на Микроскоп слайды и изображения
- построить " мост " слайд. Позиции двух " база " coverslips примерно 1 см друг от друга на положительно заряженный слайд. Убедитесь, что положительно заряженных стороне слайд вверх. Придерживаться coverslips на слайд с ноготь польский, как показано на рисунке 3 A. Это обычно полезно вывести на печать три внешние края каждого базового покрытия скольжения с ноготь польский обеспечить монтаж СМИ не фитиль в этих базовых скользит крышка. Пусть ноготь польский высохнуть (10-15 мин) перед продолжением.
- Место слайд под стереомикроскопом и Пипетка установки СМИ раствор, содержащий расчлененных мозги в пространство между двумя coverslips. Предоставлять более контрастно, это полезно для маневра гусиная шея огни, так что они параллельно с настольного.
- Удалить дополнительный монтаж СМИ от слайда с помощью пипетки, стараясь не Пипетка мозги со слайда.
- Вика прочь дополнительный монтаж СМИ. Это позволит мозги, чтобы быть размещены более точно во время следующего шага.
- Используя пару щипцы и стереомикроскопом, позиция мозги, на слайде в сетке схема с усиков лопастями, стоящих перед наверх
- Место крышку выскальзования (" мост ") над мозги ( рис A). Использование ноготь польский для уплотнения по бокам крышки выскальзования мост, где они связаться " база " скользит крышка.
- С помощью пипетки p200, медленно заполните полость центр под мостом с свежими монтажа СМИ ( рис. 3 B). Место одна капля в то время, на краю открытого центра coverslip и позволяют монтаж СМИ фитиль в центр мост coverslip. Продолжать до тех пор, пока вся полость заполняется с монтажными средствами массовой информации, а затем уплотнение верхней и нижней с четкой ноготь польский.
- Как только ноготь лак высохнет, изображение слайды сразу или хранить в поле светонепроницаемыми туго слайд в -20 ° с.
- В течение одной недели, изображение мозги с помощью сканирования лазерного конфокального микроскопа с возбуждением лазеры и фильтровать Кубы, соответствующие выбранной флуоресцентные вторичные антитела. Z-стек изображений грибные тела нейронов обычно получаются с помощью 20 X или 40 X целей. Томография сетчатки фоторецепторных нейронов может потребоваться увеличение.
Результаты
Метод, описанный выше позволяет для надежных и воспроизводимых визуализации практически любого региона взрослого мозга дрозофилы . Здесь мы сосредоточились на Грибовидные тела и фоторецепторных нейроны, но другие исследования использовали аналогичные методы для визуализации мозга регионов, таких как Парс intercerebralis52, Будильник нейронов53,54и усиков Лепесток проекции нейронов55, среди многих других. Важно отметить, что этот метод может использоваться для визуализации структуры всего мозга, а также отдельных нейронов в рамках этих структур, с помощью таких методов, как MARCM12,47. Рисунок 4, Рисунок 5и Рисунок 6 показать несколько различных типов данных из Грибовидные тела и фоторецепторных нейронов в взрослых мозги, которые могут быть созданы с помощью этой техники рассечения и иммуноокрашивания.
Во-первых непосредственно визуализировать морфология грибные тела с использованием антител, которые признают Fasciculin 2 (Fas2) или репортер генов, выраженная в грибные тела нейронов34может использоваться метод, описанный выше. Как показано в рисунке 4A и Рисунок 4B, Fas2 антител может использоваться для визуализации α, β и (в меньшей степени) γ лопастями Грибовидные тела взрослых дрозофилы мозги. Fas2 является белок адгезии клеток необходимые для нейрона подрагивание и выражается в высоких уровнях в α и β лопастями23,56,57, что делает его надежным и хорошо налаженные маркер этих грибов тела нейронов. Примечательно циркуляр образный эллипсоид тела, расположенная в регионе Центральной взрослого мозга также могут быть визуализированы с помощью этой антитела (рис. 4A).
Дефекты в аксональное руководство белки часто вызывают неполно капиллярный грибные тела мутанта фенотипов15,34,35. Таким образом в большинстве случаев, несколько десятков мозги должны отражаться и проанализированы. Например грибные тела β доли аксоны Nab2 null мух ненадлежащим образом крест срединной мозга. Этот «crossing over» или β доли «фьюжн» фенотип обычно наблюдается в ~ 80% взрослого Nab2 null, летает, но в основном отсутствует одичал тип элементов управления и могут быть классифицированы как незначительные, умеренной или завершить слияние34. «Фьюжн» β долей по всей средней линии результатом неправильного контралатеральной проекция аксоны в противоположном полушарии мозга. Как показано на рисунке 4C и подробно в34,35, небольшие фьюжн относится к β долей соединены «тонкую прядь Fas2-позитивных волокон,» хотя умеренный фьюжн относится к более существенно подключенных β лопастями в средней линии, которые показывают толщиной чуть снижение доли. Полный (или «Экстрим») фьюжн относится к β лопастями, которые полностью подключены и показать не снижение доли толщины или Fas2 пятнать в средней линии. Степени грибные тела β доли фьюжн можно количественно и отображается, как показано в 34,35 или как таблица, показывающая процент мозги, показаны каждый тип дефекта морфологии.
В дополнение к окрашиванию Fas2 антител, MARCM технику12,,4748 также может использоваться для визуализации аксона руководством решения индивидуальных GFP+ нейронов в грибные тела лопастями. MARCM использует митотическая рекомбинации во время разработки для создания отдельных нейронов, или клонально связанных групп нейронов, отмеченные GFP (рис. 5A). MARCM предоставляет способ для генерации небольшое количество нейронов, которые полностью лишены белков в противном случае гетерозиготных летать. Таким образом эта техника была особенно полезной при анализе аксональное руководство функции белков, которые также важны для общего научные жизнеспособности12,47. Гомозиготная null нейронов, отмеченные GFP можно непосредственно по сравнению с контролировать нейронов, отмеченные GFP в генетический фон одичал тип. Кроме того в зависимости от того, когда развивающихся личинок и куколок, тепло шокирован, различные классы грибные тела нейронов может быть объектом (рис. 5B).
Пример типа данных, получаемых с помощью этого метода показан на рис. 5C, где одичал тип (то есть, управления) MARCM клоны создаются в качестве примера. Для создания отдельных нейронов грибные тела GFP+ , показанный на рис. 5C, разработке F1 личинки были первоначально размещены при 25 ° C. Приблизительно 5-6 дней после вылупления личинок (ALH), куколки были тепло шокирован на 30 минут при 37 ° C и затем вернулся в 25 ° C до eclosion. После взрослых штриховкой, мозги были расчленены в PTN, фиксированной и одновременно инкубировали с антителами, признавая Fas2 (1 d 4, разбавленный 1:20 в PTN) и GFP (разбавленных 1: 500 в PTN). Мозги были затем инкубируют с вторичные антитела и монтируется на слайдах, как описано выше. GFP+ клетки были выявлены и образы с помощью сканирования лазерного конфокального микроскопа и максимальная интенсивность прогнозы были созданы с использованием ImageJ. Как продемонстрировано в Рисунок 5C, управления GFP+ нейронов, сгенерирована α и β лопастями colocalize с Fas2 и прекратить до связавшись по средней линии, которая отделяет два полушария мозга дрозофилы . Один Аксон проекты кпереди, может разветвлять каждой присваивать и затем проектов оба дорсально и медиально к форме α и β лопастями. Несколько предыдущих исследований использовали этот метод для расследования, должны ли определенные белки для изучения клеточного деления автономно для многих аспектов axonogenesis, включая расширение, поиск пути, ветвление или обрезка10, 11,12,13,14,,1516,17,34.
В дополнение к Грибовидные тела аксональное Поиск пути решения нейронов сетчатки фоторецептор (R-клетки) могут также быть визуализированы с помощью метода рассечение, описанный выше (а также де метод вскрытиявписать в ссылку48). Каждый фасеточном в лету глаз содержит 8 фоторецепторных нейронов, которые можно подразделить на три группы (рис. 1): R1 R6 клетки, которые проект аксоны к поверхностным пластинки зрительного доли мозга; R7 клетки, которые проект аксоны глубокого слоя M6 продолговатого мозга; и R8 клетки, которые проект аксоны промежуточного слоя м3 продолговатого19,58. Подробно изучено проекции шаблон каждого класса фоторецепторных и вместе эти нейроны успешно используются как модель для понимания сигнальных путей, участвующих в аксона руководство19,59. Важно отметить, что все фоторецепторных аксоны могут быть легко визуализированы в расчлененных дрозофилы мозги иммуноокрашивания взрослого, куколки, или личинок тканей, с использованием антител, признает chaoptin, клеток поверхности гликопротеина24, 60 , 61. репортер генов GFP или β-галактозидазы в каждом типе Р-клетки (клетки, R1-R6 и R7 R8) также были построены и может использоваться для визуализации каждого класса фоторецепторных62. Поскольку каждый тип R-клеток прекращается в другой слой зрительного доли развивающихся, эти журналисты позволили детальное сравнение сигнальных путей, необходимых для каждого типа клеток, чтобы правильно найти свою цель. Пример выражения моделей, производимых два из этих генов репортер в сочетании с chaoptin локализацией (которая может использоваться в качестве маркера всех нейронов фоторецепторных) показан на рисунке 6. Чтобы визуализировать R7 фоторецепторов, мозги, содержащие R7-специфических Rhodopsin4-LacZ Репортер ген были расчлененные и витражи с антителами к chaoptin и β-галактозидазы. Родопсин 4 (Rh4) выражается именно в подмножество R7 клетки63; Rh4 промоутер таким образом может использоваться для привода репортер экспрессии генов в только эти клетки. Как и ожидалось, R7 клетки прекратить в глубокий слой M6 medulla (обозначается желтой пунктирной линией на рисунке 6). Аналогичным образом, мозги, выражая β-галактозидазы от промоутера родопсин 6 (Rh6), которая выражается именно в R8 фоторецепторов63, были расчленены и immunostained с использованием антител, признавая chaoptin и Β-галактозидазы. Как показано на рисунке 6, R8 фоторецепторов прекращено в R3 слойпродолговатого. Хотя здесь не показан, Rh1-LacZ также может использоваться для визуализации прекращение R1 R6 фоторецепторов в пластинки.
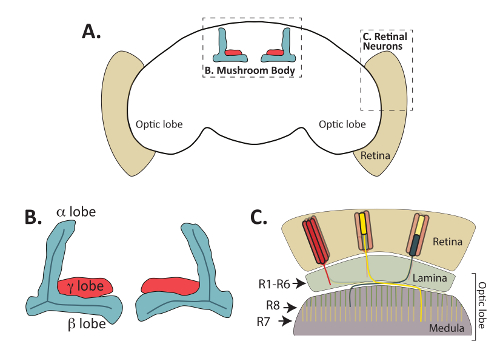
Рисунок 1: Взрослый Drosophila melanogaster мозга состоит из функционально различных, но взаимосвязанных областей. (A) краткое изложение взрослых D. melanogaster мозг показано, подчеркнув расположен Грибовидные тела и периферийных сетчатки фоторецепторных нейронов. (B) расширенное диаграмма взрослого гриба тела аксона связки (также называемый лепестков), которые распознаются Fas2 антител. Внутренняя нейронов Грибовидные тела, называемые клетки Кеньон, проект аксоны кпереди от дорзально расположен клеток органов (клеток тела, исключены из этой схемы) и образуют структуры отдельных лепестков. В взрослого мозга, γ лопастями (показано красным) формы от одного медиальной пучок аксонов, а спинной α и медиальной β лопастями (показано в синий) формы от одного аксона, может разветвлять каждой присваивать во время процесса поиска пути. Α ' / β' нейронов развивать аксональное лопастями, которые частично совпадают с теми α/β нейронов, но не распознаются Fas2 антител и исключены из этой схемы. Нейроны сетчатки (C) имеют решающее значение для ретрансляции визуальной информации на лоб зрительный от сетчатки. Проект аксоны ячейки органов, расположенных в сетчатки (бежевый) и образуют соединения с пост синаптических целевых ячеек в пластинки или Продолговатый мозг. R1-R6 фоторецепторных клеток (показано красным цветом) формы определенных подключений с ячейками в наружном слое лоб зрительный, называемые пластинки. R7 фоторецепторных клеток (желтый) синапса с целевыми показателями в слое M6 продолговатого мозга, в то время как клетки R8 (показано зеленым) проект аксоны чуть более поверхностный слой м3 Продолговатый мозг. Часть C, адаптированных с разрешения от Macmillan Publishers Ltd: Природа Neuroscience (ссылка64, авторские права (2011)). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
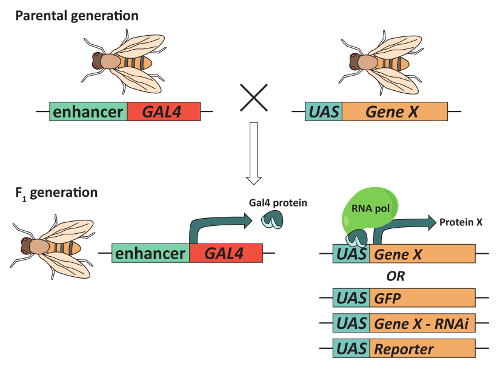
Рисунок 2: GAL4/Уан система может использоваться для выражения целевого гена. Чтобы получить мух, выражая ген интереса («ген X») в ткани шаблону, мухи должны содержать трансген, выражая Gal4 transcriptional Активатор белков под контролем ткани конкретных усилитель и трансген, содержащие Gal4 ДНК Обязательные последовательности (вверх по течению активации последовательности или UAS) рядом с гена X. как правило, это сочетание достигается путем скрещивания родительских мух, каждый из которых содержит один трансген и выбрав для потомства1 F, которые содержат оба. В результате F1 поколения Gal4 будет выражаться и будет привязан к UAS для того чтобы активировать транскрипцию генов X определенным образом ткани. Важно отметить, что различные UAS-содержащих трансгенов может использоваться в сочетании с же GAL4 «драйвер». Например трансген, выражая Gal4 в Грибовидные тела (MBs) могут быть объединены с бас содержащих трансген Экспресс GFP, трансген, который сбивает экспрессии гена интереса, с помощью РНК-интерференция, или UAS-трансген, который производит репортер. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
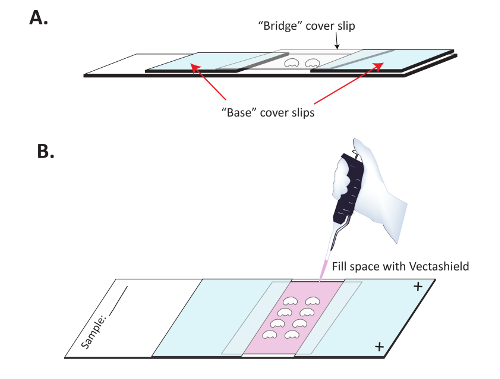
Рисунок 3 : Монтажа мозги в рамках подготовки к иммунофлюоресценции изображений. (A) мозги монтируются на SuperFrost плюс слайды с моста крышкой для предотвращения уплощение мозги. Два «базовый» скользит крышка привязаны к Superfrost плюс положительно заряженных слайд с четкой ноготь польский и расчлененных мозги затем помещаются на слайде между ними. Скольжения обложки ясно «мост» помещается выше мозги и придерживаться базового скользит крышка. (B) когда ноготь польский высохнет, Vectashield медленно накапаны под мостом для сохранения флуоресценции вторичное антитело. Четкие ногтей лак затем используется для герметизации верхней и нижней крышки выскальзования «мост». Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
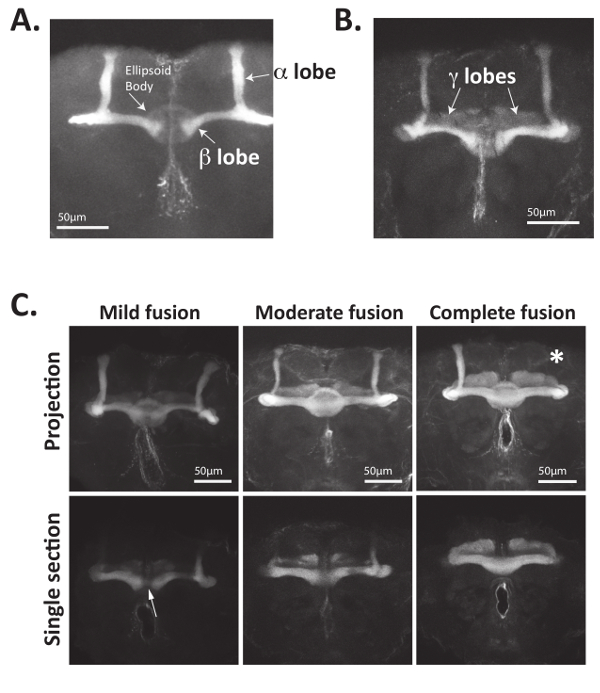
Рисунок 4: Гриб аксоны тела могут быть визуализированы четко, с использованием антител, которые признают Fas2. (A) взрослых дрозофилы мозги были расчленены, фиксированной и инкубировали с антителами, признавая Fas2. Первичного антитела были признаны с помощью Alexa488-сочетании коза анти мышь вторичные антитела и мозги были смонтированы на положительно заряженный слайды и образы, используя лазерный Сканирующий конфокальный микроскоп. Bisymmetrically расположен грибные тела клетки органов продлить аксоны кпереди, раздвоить и образуют пучки аксона (также называемый лепестков). Аксоны, которые формируют дорсально проектирование α лопастями и медиально проектирование β лопастями Экспресс Fas2. Критически β лопастями одичал тип мух прекратить до срединной линии мозга. Расположен эллипсоид тела также могут быть визуализированы с помощью 4 1 d антитела. (B) медиально проектирование γ доли аксоны взрослых дрозофилы грибные тела также выразить Fas2 и могут быть визуализированы с помощью 4 1 d антитела. Выражение Fas2 в γ доли аксоны обычно меньше чем α и β лопастями. (C) грибные тела аксоны Nab2-null мозги (генотип: Nab2ex3/Nab2ex3) неправильно проекта contralaterally и часто не хватает лопастями. Nab2-значение null мозги были расчленены, фиксированной и витражи с 1 d 4 антитела для визуализации грибные тела α, β и γ лопастями. Максимальная интенсивность Z-стек прогнозы, а также отдельные разделы оптических сосредоточена на регионе срединной линии отображаются. Грибные тела одичал тип β доли аксоны редко пересекать срединной мозга, мозги Nab2-null имеют различную неправильного проекции всей срединной линии в полушарии контралатеральной мозга, что приводит к «плавленый» β лопастями. Как определено в ссылки34,35, мягкий фьюжн относится к < β лопастями с только несколько «нити» аксоны пересечения срединной линии, умеренные фьюжн относится к ситуациям, где нейронов доли положительных β Fas2 крест срединной но β доли мозга Ширина в средней линии уменьшается, и полное слияние относится к ситуациям, где нет сокращения β доли толщины как долей мозга средней линии. Так как эллипсоид тело выражает также Fas2, оптические секции показаны midline часто являются более полезными в визуализации β доли фьюжн. Примечательно недостающие лопастями также часто наблюдаются (обозначается здесь с белая звездочка). Данные в части C используется в квантификации фенотипов грибные тела от ведения34, с разрешения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
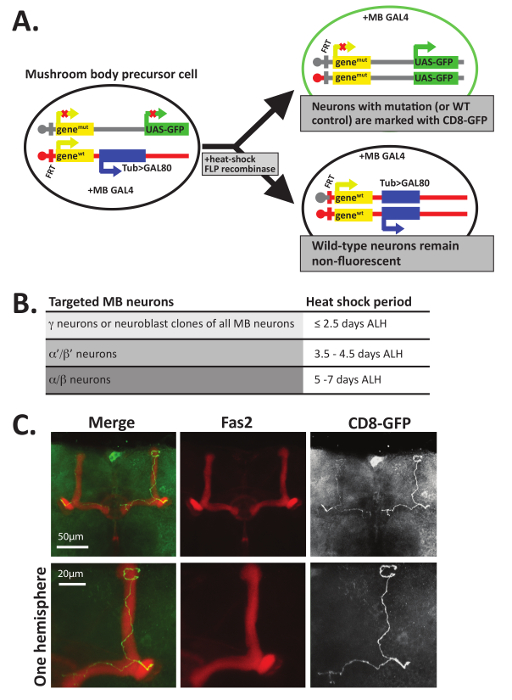
Рисунок 5 : MARCM может использоваться для визуализации одного нейронов. (A) анализ мозаика с маркер Repressible клеток (MARCM) использует ФЛП рекомбиназа опосредованной митотическая рекомбинации в FRT мест для создания двух отдельных клеток дочи. В этом примере все клетки содержат Грибной белок GAL4 орган специфических на отдельном хромосоме. После митотическая рекомбинации во время деления клеток, одна дочь клеток (вверху) выражает GFP (или мембраны связаны CD8-GFP) и содержит два мутантные аллели гена интереса, в то время как другие клетки дочь (внизу) наследует две аллели одичал тип (WT) и в трансген, выражая белка Gal80, с помощью промоутера тубулина. Gal80 ингибирует Gal4, так что любой клетки, вырабатывающие Gal80 будет не люминесцентные и должно быть у гетерозиготных мышей или гомозиготных одичал тип. Только те клетки, которые являются GFP+ будет содержать две копии аллеля мутанта. Обратите внимание, что отображается только один из нескольких методов для создания GFP+ клетки, которые также содержат два мутантных аллелей гена интереса; Пожалуйста, смотрите12,45,56 для других примеров. (.B) поскольку разработка грибные тела нейронов начинается с γ нейронов, а затем α'/ β' нейронов и заканчивается с α/β нейронов, каждый класс нейрон можно выборочно целевых и визуализированное тепла шокирует в разное время развития точках. Как описано в 12, 40 мин теплового шока при 37 ° C, что происходит ≤2.5 дней после вылупления личинок (ALH) будет конкретно γ; нейронов, а теплового шока, который происходит 3.5-4.5 дней ALH (в конце личиночной стадии L3) будет направлена α'/ β' нейронов и тепловой шок что o ccurs между 5-7 дней ALH (во время развития куколки) пристрелет α/β нейронов. (C) отдельных одичал тип аксоны были визуализируется с помощью MARCM. Одичал тип ~ 5-6 день старого куколки (генотип: hsFLP, бас-CD8-GFP; FRT82B, бас-CD8-GFP/FRT82B, Ванна > Gal80; OK107-GAL4/+) были шокированы при 37 ° C 40 мин побудить митотическая рекомбинации тепла. Мозги были расчленены, фиксированной и витражи с антителами, признавая GFP (1: 500) и Fas2 (1:20). Мозги были затем инкубируют с дневно обозначенные вторичные антитела и визуализированное confocal микроскопии. В этом примере данные из генотипа «контроль» GFP позитивные клетки с помощью MARCM одичал тип и вместо содержащих двух аллелей генаМут , содержат две аллели генаWT . Грибные тела β лопастями (визуализируется с использованием антител, признавая Fas2) прекратить до достижения мозга средней; Также присутствуют α доли нейронов. Чтобы показать более подробно, увеличено с учетом одного мозга полушария отображается в нижней строке изображений. Часть C был адаптирован с разрешения ссылки34. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
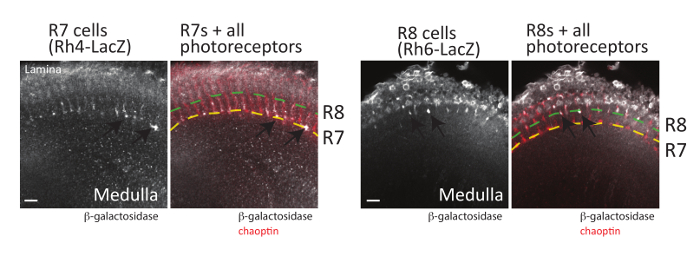
Рисунок 6 : Фоторецептор аксоны также могут быть визуализированы. Взрослый мозг выражая β-галактозидазы в R7 фоторецепторов (слева, с помощью Rh4-LacZ) или R8 фоторецепторов (правая, с помощью Rh6-LacZ) были расчленены, фиксированной и инкубировали с антителами, признавая β-галактозидазы или chaoptin. Мозги были затем инкубируют с дневно обозначенные вторичные антитела и визуализированное лазерная сканирующая конфокальная микроскопия. Один оптический секции показываются от каждого мозга. На левой стороне можно увидеть несколько R7 фоторецепторных аксоны (стрелки) прекращения в глубокий слой M6 medulla (показано желтой пунктирной линией). Справа R8 фоторецепторных аксоны (стрелки) прекратить в наружном слое м3 мозга (показано зеленой пунктирной линией). R7 фоторецепторов Экспресс либо Rh3 или Rh4 и R8 фоторецепторов Экспресс Rh5 или Rh663, все R7 или R8 фоторецепторов нельзя быть визуализированы с помощью один Репортер ген LacZ . Масштаб баров = 10 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Рассечение и визуализации методом, описанным выше может быть использован в широком спектре иммуноокрашивания и жить графических приложений. Мы наметили протокол общего иммуноокрашивания и показали один из способов, в которых MARCM может использоваться для визуализации аксональное морфология отдельных грибные тела нейронов. Кроме того эти общие процедуры могут также использоваться для визуализации других регионов мозга в фиксированных или свежей расчлененных взрослого мозги48,65. Живой изображений может обеспечить более эффективный подход при анализе моделей выражение усилитель ловушки, репортер генов или имитировать линии66, например. Для предотвращения захвата артефакты от смерти клетки во время живых изображений GFP в незаписанных тканей, мозги следует расчлененный в 1 x фосфат буфер солевой (PBS) или HL3 СМИ48, установленный на мост слайды в 1 x PBS (или HL3) и отражаться в менее чем 15-20 минут Уход следует также удалить столько трахеи как можно дальше от расчлененных мозга до изображений, так как это может помешать с визуализацией GFP флуоресценции.
В то время как окрашивание условия для оценки морфологии грибные тела и фоторецепторных нейронов, относительно устоявшихся24,61,67, локализация специфического протеина интереса в эти ячейки типы могут потребовать диагностики и оптимизации. В частности несколько критических шагов, включая разбавления антитела, блокирующий буфер компонента концентрации и фиксации, должны быть оптимизированы для создания наиболее надежные и воспроизводимые результаты. Во-первых должны быть определены оптимальная концентрация основное антитело. Хотя коммерчески доступных антител часто имеют предлагаемые разрежения (и мы часто сначала начать с помощью этой концентрации), эти значения редко определяются эмпирически на ткани дрозофилы . Таким образом тестирование серию разведений первичных антител, которые диапазон выше и ниже производителя начиная предложение часто приводит к более специфического окрашивания. Хотя основное антитело разрежения может иметь значительное влияние на окрашивание точность и следует точно определить, время мозги инкубируют в основное антитело содержащие решения может значительно изменяться с незначительное воздействие на общий результат. Например мы наблюдаем аналогичные результаты при инкубации расчлененный мозги с Fas2 антитела основное антитело для два, три или даже четыре дня при 4 ° C. Хотя мы рекомендуем по крайней мере две ночи, мы также инкубировали мозги в раствор первичных антител на одну ночь и получить воспроизводимые пятнать. Важно отметить, что ограничивает количество времени, которое мозги инкубируют в вторичное антитело до 3 ч при комнатной температуре (или одну ночь при 4 ° C) помогает предел привязки неспецифических вторичных антител ткани мозга.
Во-вторых это может быть необходимо использовать дополнительные «блокирование» реагенты для устранения нежелательного фонового сигнала. Параметры включают в себя повышение концентрации NGS ~ 10%, добавив 1-10% бычьим сывороточным альбумином (БСА) для блокировки и первичные/вторичные антитела решения, или предварительно адсорбции первичных антител на ночь при 4 ° C с дрозофилы эмбрионов (см. Ссылка68, разделе 2.9, шаг 3).
Хотя мы писали выше протокол, с помощью PTN как предлагаемые буфер для всех фиксации, мыть и Антитело инкубации шаги, фиксация ткани в других буферов (например ПЛП и PEM, перечисленные в Таблице материалов) может привести к глубокие различия в Сила сигнала. Например предыдущие исследования показали, что циклин E обнаруживается в личиночных имагинальных дисков, когда ткани фиксируются в традиционных параформальдегида 4%, разбавленных в PBS, но хорошо видна, когда ткани фиксируются в буфере ПЛП (Ken Моберг, личное коммуникации и ведения69). Помимо изменения в буфере компоненты, изменяя время и температура для фиксации ткани может также существенно повлиять на immunofluorescent окрашивание и может определяться эмпирически в случае необходимости. Как правило фиксации времени должно быть достаточно долго, чтобы обеспечить достаточную сшивки клеточных компонентов и долгосрочное поддержание общей клеточной морфологии будучи ограничены достаточно, чтобы предотвратить более сшивки и «захоронение» epitopes белка. Таким образом когда первоначально оптимизации окрашивание условия для вновь приобретенного основного антитела, мы обычно ограничивают время фиксации до примерно 20 мин и часто будет исправить тканей при холодных температурах.
Несколько элементов управления должны быть включены в любой иммунофлюоресценции эксперимента исследовать специфику первичных и вторичных антител, а также влияние трансгенов/генетический фон на наблюдаемых фенотип. Чтобы определить, распознает ли основное антитело, используются специально протеина интереса, ткани от мух не хватает этот белок и/или тканей, экспрессирующих белка должны быть включены как элементы управления. Добавление избыток антигена очищенный протеин также могут быть включены чтобы определить, распознает ли основное антитело другие epitopes в лету мозга. Наконец любой флуоресцентные сигнал, когда первичного антитела опущены представляет уровень неспецифической привязки выбранного вторичные антитела.
Несколько важных элементов управления также должны быть включены для оценки вклада генетический фон или наличие трансгенов интенсивности окрашивания или нейронов морфологии. Например, мухи, используемые в MARCM эксперименте на рисунке 5 содержат несколько трансгенов (hsFLP, бас-CD8-GFP, FRT82B, Ванна > GAL80 и OK107-GAL4), каждая из которых должны быть проанализированы отдельно для воздействия на морфологию грибные тела. В очень минимальные, грибные тела морфология мух содержащие OK107-GAL4 и бас-CD8-GFP должны быть проанализированы. Она также может быть необходимо оценить влияние теплового шока и ФЛП рекомбиназа производства на развитие грибные тела, анализируя летит, содержащий hsFLP и FRT82B. Хотя MARCM может обеспечить значительное понимание ли данный белок самостоятельно управляет аксональное руководство, количество элементов управления, требуется точно сделать этот вывод может быть незначительные ограничения этой техники. В менее сложных экспериментов также применимы аналогичные элементы управления. Например возьмем эксперимент, где GAL4/Уан система используется в сочетании с RNAi трансген нокдаун выражение протеина интереса к всех нейронов. В этом эксперименте, будет присутствовать по крайней мере два трансгенов: Пан нейронов GAL4 драйвер, например Elav-GAL4 и трансген UAS-РНК-интерференции . Морфология грибные тела нейронов в мух, содержащие каждый из этих трансгенов только должны быть расследованы в дополнение к экспериментальной условие, где мухи гавани оба трансгенов в том же ходу.
Наконец чтобы определить, является ли протеина интереса выражается в грибные тела нейронов это обычно необходимо совместно пятно мозги с антителами к Fas2. В качестве альтернативы флуоресцентных белков, таких как CD8-GFP связаны GFP, ППП или мембраны могут также выражаться с помощью системы GAL4/Уан и используется в сочетании с антителами, признавая протеина интереса. Fas2 распознает только fasciculated аксонов, которые формируют грибные тела α и β лопастями, использование ориентированных на GAL4, мембрана прыгните CD8-GFP пор особенно полезно для маркировки грибные тела нейронов.
Дефекты в аксональное руководство часто не 100% проникающей и даже мозги же генотипа может показать некоторые изменчивости. Таким образом при анализе недавно мутантные аллели дефекты в грибные тела или фоторецепторных пути, следует использовать сочетание различных аллелей и подходы. Большинство исследований в литературе использовать несколько различных подходов расследовать ли белок играет клетки автономная роль в управлении аксональное руководство: я) анализ пути дефекты в гомозиготной null мух (желательно с использованием различных нюLL аллели), ii) анализ пути дефекты мух, не хватает белка интерес только в нейронах (обычно через RNAi), iii) MARCM анализ дефектов пути и iv) спасти эксперименты, где ген повторно выраженную в нейронах гомозиготных null мух. В идеале несколько десятков мозги на генотип должны быть проанализированы для дефектов в нейрональных морфологии.
Хотя Протокол описан здесь главным образом фокусируется на immunofluorescent Локализация белков в рамках фиксированных тканей, несколько будущего применения этой техники разрабатываются для изображения живой мозговой ткани. Как только мозги разделяются (обычно в СМИ культуры клеток), они может быть культивировали в течение нескольких дней при температуре 25 ° C. Эти ex vivo культивирования методы в настоящее время разрабатываются для того, чтобы исследовать широкий спектр биологических процессов, таких как активность белка, способствует регенерации аксона, после травмы70,71, внутриклеточной Сигнальный динамика72и развития нервной системы73.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Мы хотели бы поблагодарить Чангху Пак и Alysia Врайлас Мортимер первоначально преподавания СМК технику рассечения мозга. Мы также благодарим членов группы лаборатории Кен Моберг, особенно Крис раундов, за критически читать рукопись. Антитела, признавая Fas2 (1 d 4) и chaoptin (24B10) были получены от развития банка гибридомной исследования. 24B10 антитела к DSHB сданный Сеймур Бензер и гастрольный Colley24,,6061, антитела 1 d 4 был сдан на хранение до DSHB Кори Гудман 22,23,56. Покупать акции были получены от центра Bloomington складе. Мы также хотели бы поблагодарить Огайо сельскохозяйственных исследований и развития центр (OARDC) MCIC центр изображений для использования Конфокальный микроскоп изображение мозги в рисунке 4A и B. SMK поддерживается грант от NICHD (1 R15 HD084241-01A1).
Материалы
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
Ссылки
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены