Method Article
Dissektion, Immunofluorescent Färbung der Pilz Körper und Photorezeptor Neuronen im Gehirn Erwachsener Taufliege melanogaster
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Dissektion und Immunostaining von Erwachsenen Drosophila Melanogaster Gewebe des Gehirns. Insbesondere unterstreicht dieses Protokoll die Verwendung von Drosophila Pilz Körper und Photorezeptor Neuronen als Beispiel neuronale Teilmengen, die genau verwendet werden, um die allgemeinen Grundsätze für viele Aspekte der neuronalen Entwicklung aufzudecken.
Zusammenfassung
Nervensystem-Entwicklung beinhaltet eine sequenzielle Serie von Ereignissen, die durch mehrere Signalwege und Regulationsnetzwerke koordiniert werden. Viele von den Proteinen, die in diesen Bahnen sind evolutionär konserviert zwischen Säugetieren und anderen Eukaryoten, wie der Fruchtfliege Drosophila Melanogaster, was darauf hindeutet, dass ähnliche organisierende Grundregeln bei der Entwicklung dieser vorhanden Organismen. Wichtig ist, wurde Drosophila ausgiebig zur zelluläre und molekulare Mechanismen, die Regulierung der Prozesse, die erforderlich sind, bei Säugetieren einschließlich Neurogenese, Differenzierung, axonalen Beratung und Synaptogenese zu identifizieren. Fliegen haben auch erfolgreich eingesetzt, um eine Vielzahl von menschlichen Neurodevelopmental Krankheiten zu modellieren. Hier beschreiben wir ein Protokoll für die schrittweise Mikrodissektion, Fixierung und immunofluorescent Lokalisierung von Proteinen im erwachsenen Gehirn Drosophila . Dieses Protokoll konzentriert sich auf zwei Beispiel neuronalen Populationen, Pilz Körper Neuronen und retinalen Photorezeptoren und beinhaltet optionale Schritte zu einzelnen Pilz Körper Neuronen mit Mosaik-Analyse mit einer tragen Zelle Marker (MARCM) Technik zu verfolgen. Beispieldaten aus Wildtyp und Mutanten Gehirne sind mit einer kurzen Beschreibung der Bewertungskriterien für axonalen Anleitung Mängel gezeigt. Während dieses Protokoll zwei etablierte Antikörper zeigt für die Untersuchung der Morphologie der Pilze Körper und Photorezeptor Neuronen, andere Hirnregionen Drosophila und die Lokalisierung der Proteine in anderen Hirnregionen können auch mit Hilfe dieses Protokolls untersucht.
Einleitung
Zwar das Nervensystem Drosophila kleiner als die von Menschen und Nagern, stellt seine Komplexität ein kraftvoll, ansprechbar Modell zum besseren Verständnis seiner fest gefügten Pendants. In vielen Fällen kodieren das Genom der Wirbeltiere und fliegt sehr ähnliche Proteine, die die Mechanismen der Entwicklung des Nervensystems zu diktieren. In der Tat erforderlich viele der Gene, für die neuronale Entwicklung bei Wirbeltieren Orthologe in fliegen, einschließlich derjenigen Signalwege, dass Kontrolle Musterung, Neurogenese und axonalen Anleitung1,2,3 beteiligt haben ,4,5. Netrin ist beispielsweise ein Ligand für axonalen Beratung bei Säugetieren und D. Melanogaster6,7,8erforderlich. Während Netrin von embryonalen Küken Gehirn Gewebe6ursprünglich isoliert war, haben nachfolgende Studien gezeigt, dass Netrin spielt eine erhaltene Rolle während der Entwicklung des embryonalen zentrale Nervensystem (ZNS) in Drosophila8. Andere Studien haben genetische Bildschirme in der embryonalen Drosophila CNS zum konservierten Liganden und Rezeptoren für Pathfinding in Drosophila und Wirbeltieren9erforderlichen identifizieren.
Während die embryonale Fliege CNS weitgehend in der Vergangenheit verwendet worden ist, um Liganden, Rezeptoren und intrazellulären Signalproteine axonalen Anleitung8,9gefordert zu identifizieren, hat die jüngsten Arbeiten die Wege in denen viele der untersucht. Diese Proteine Steuern Pathfinding Entscheidungen auch in späteren Phasen der Entwicklung. Insbesondere hat Untersuchung von Pilz Körper (MB) und Netzhaut Photorezeptor Neuron Entwicklung (Abbildung 1) Einblick in die Mechanismen dieser Kontrolle Wegfindung, Synapse Bildung, Axon beschneiden, und verschiedene andere Aspekte der neuronalen zur Verfügung gestellt Entwicklung10,11,12,13,14,15,16,17. Photorezeptor Neuronen verbinden die Fliege Netzhaut Regionen des erwachsenen Gehirns genannt der Lamina und Medulla und sind entscheidend für die Weiterleitung von visuellen Informationen an das Gehirn (rezensiert von18,19), während der Pilz Körper Neuronen sind zentral gelegen im Gehirn Fliege und sind erforderlich für lernen und Gedächtnis20,21. Photorezeptor Neuronen und die intrinsische Neuronen die Pilzkörper, Kenyon Zellen, genannt nutzen evolutionär konservierte diffusiblem und Kontakt-abhängige axonalen Anleitung Mechanismen um ihre postsynaptischen Ziele zu finden. Abgesehen davon, dass bei Erwachsenen fliegen, können Photorezeptor und MB Neuronen werden auch direkt in die Larven und Puppen mit Antikörpern oder Reporter Gene22,23,24,25visualisiert. Die Fähigkeit, leicht zu diesen beiden Gruppen von Neuronen zu unterschiedlichen Entwicklungsstörungen Zeitpunkten visualisieren hat ihre Verwendung als hervorragende Modelle für viele Aspekte der neuronalen Entwicklung gefördert.
Neben dem Einsatz als Modell um zu verstehen, die Mechanismen der normalen Nervensystem Entwicklung, haben neuere Studien gezeigt, dass fliegen auch dazu als genaue Modelle für eine Vielzahl von menschlichen Krankheiten dienen können, einschließlich Fragile X Syndrom (FXS)26 , Geistige Behinderung (ID)27,28,29,30,31, und andere32. Beispielsweise um die molekulare Funktion des ZC3H14 zu untersuchen, ein Gen, das vor kurzem verbunden mit menschlicher geistiger Behinderung haben wir fliegen Modellcharakter für die ID mit einer null Allel der Fliege ZC3H14 Ortholog, genannt Nab230. Fliegen fehlt Nab2 haben schweren Gedächtnisstörungen und poly(A) Tails erweitert, Rekapitulation was wird beobachtet bei menschlichen Patienten oder Patienten abgeleitet Zelle Linien33,34. Wichtig ist, anzeigen fliegen fehlt Nab2 auch schwere Gehirn Morphologie Mängel in ihren Erwachsenen Pilzkörper34, ähnlich wie was beobachtet wird, in denen das FXS-Syndrom gen, 135fliegen. So können fliegen dienen als ein wichtiger Modellorganismus, normale Gehirnentwicklung und Krankheiten, die es stören zu studieren.
Schließlich machen die Zugänglichkeit von Hochdurchsatz-Methoden, Verhalten, kombiniert mit der Vielzahl der verfügbaren genetischen Tools überwachen Drosophila Modellorganismus der Wahl für die Ermittlung der Hirnregionen, die komplexe Verhaltensweisen, wie z. B. Steuern lernen und Gedächtnis, Schlaf, Balz, Durst und andere36,37,38,39. Ein besonders nützliches Werkzeug, das in der Mitte eine Fliege Genetiker "Toolbox" ist ist das GAL4/UAS-System (Abbildung 2). Dieses System40,41 verwendet Gewebe Konkretisierung der Gal4 transcriptional Aktivator, um den Ausdruck der Gene oder transgene flussabwärts von einer vorgelagerten Aktivierung Sequenz (UAS) zu erhöhen. Änderungen dieses Systems konnten Forscher, z. B. genau steuern, die Erregbarkeit der spezifische Neuronen42,43, Overexpress oder Knock-down spezifischen Genen Interesse44, 45, Echtzeit-Kalzium Dynamik in Vivo46zu analysieren und express Reporter Gene neuronale Linien41markieren. Die Kombination aus der GAL4/UAS-System mit mitotische Rekombination, die auch für die Erstellung der Mosaik-Analyse mit einem tragen Zelle Marker (MARCM) System12,47erlaubt. MARCM ist beträchtlich bei der Rückverfolgung der einzelnen Nervenzelle benutzt worden, um zellulären Signalisierung für axonalen Führung12,47benötigten Komponenten zu identifizieren. Obwohl diese und andere Techniken etliche wertvolle Erkenntnisse über die zellulären Mechanismen erforderlich für die Funktion des Nervensystems zur Verfügung gestellt haben, erfordern die meisten, dass Drosophila Gehirn zuerst zerlegt werden; schonende Entfernung des Gehirns ist erforderlich, um korrekte Gehirn Morphologie und Verbindung Muster zwischen Gehirnregionen zu behalten. Das folgende Protokoll verwendet Pilz Körper und Photorezeptor Neuronen alsBeispiel neuronalen Populationen als es führt Sie durch die Zerlegung und immunofluorescent Färbung der Erwachsenen Drosophila Gehirne.
Protokoll
1. Drosophila Melanogaster Genetik und optionale Heat Shock Verfahren
- Einmal fliegen gekreuzt worden und F1-Nachkommen haben ausgebrütet, Weibchen und Männchen der entsprechenden Genotyp erhalten. Abhängig von der Region des Gehirns untersucht, fliegen sollte täglich abgeholt und nach Geschlecht getrennt, so dass altersabhängig und/oder sexuell dimorphen Muster des Gehirns Konnektivität leichter unterschieden werden können.
Hinweis: Optional: Wenn fliegen für Mosaik-Analyse mit einem tragen Zelle Marker (MARCM) Analyse 12 , 47, Embryonen, Larven werden oder Puppen sollten Wärme bei 37 ° C für 30-45 min bis schockiert mitotische Rekombination zu induzieren. Um bestimmte Regionen die Pilzkörper Analysezwecken MARCM anzugehen, sollten Hitzeschock planmäßig von 12 festgelegt und gemäß Abbildung 5 B gelegt werden. Wenn MARCM Hirnregionen als die Pilzkörper untersuchen, sollten Pilotprojekte durchgeführt werden, um die optimale Bühne Hitze schockiert sein zu bestimmen. Während der folgenden Schritte im Hinblick auf geschrieben werden geschlüpften fliegt, Pharate Erwachsene können auch mithilfe der folgenden Schritte nach dem Entfernen des pupal Fall seziert werden.
2. Dissektion Station Vorbereitung
- Position die Stereomikroskop und Licht Quelle mit Fiber optic Schwanenhälse auf einem großen Benchtop befestigt. Zur Förderung ruhige Handbewegungen und Hand " schütteln " beim sezieren, es ist wichtig, dass ausreichend Hand- und Armbewegungen Rest Platz rund um das Mikroskop zur Verfügung. Sicherstellen, dass auf beiden Seiten des Mikroskops und 4 bis 6 Zoll zwischen der Basis des Mikroskops und Kante der Bank gibt es ca. 8-10 Zoll.
- Füllung 2 oder 3 Brunnen eines Glases 9-Brunnen oder 3-gut Gericht mit 1,0 mL der PTN Puffer (0,1 M-Natrium-Phosphat-Puffer pH 7,2, 0,1 % nichtionische Tenside, siehe Materialtabelle für komplette Puffer Komponenten) und neben dem sezierenden Bahnhof auf Eis legen. Neu seziert Gehirne werden zu diesem Gericht übertragen und dort gespeichert, bis die Fixierung Schritt.
- Hinweis: wenn live Bildgebung erforderlich ist, sollte die Dissektion Puffer 1 x Phosphat gepufferte Kochsalzlösung (PBS) oder HL3 Puffer 48. Wenn intrazelluläre Protein Lokalisierung erforderlich ist, werden PBS dient auch als eine alternative Puffer zum sezieren und zur Fixierung. Nach Fixierung, Permeabilisierung von Zellmembranen sollten dann durchgeführt werden mit PTN Waschungen mit 0,1 % oder 0,3 % nichtionische Waschmittel.
- Wenn PBS für Sezierungen und Fixierung verwendet wird, sollte Pipettenspitzen gespült mindestens ein Mal mit einem Spülmittel enthaltende Puffer (z. B. PTN) zu verhindern, dass Gehirne festhalten an den Kunststoff Pipettenspitzen während der Übertragung zu Mikrozentrifugenröhrchen.
- Mit einem leeren 35 mm Glas oder Kunststoff Petrischale konstruieren eine Dissektion Schale mit einem Silikon-Elastomer. Kurz, mischen die Elastomer-Komponenten nach Angaben des Herstellers ' s Richtungen in 35 mm Schalen gießen, und lassen Sie es über Nacht auf einer flachen Oberfläche zu polymerisieren. Elastomer mit Dissektion Gerichte sollte verwendet werden, zum Schutz der feinen Spitzen Zange, die leicht beschädigt werden kann, wenn Kontakt zwischen Zange und einer härteren Oberfläche, wie z. B. eine Glasschale sezieren. Wir kaufen auch regelmäßig im Handel erhältlichen silikonbeschichtet Gerichte von Online-Händlern. Silikon Elastomer Dissektion Speisen mit inaktivierten Holzkohle (und damit farbige schwarz) sind besonders nützlich, um Kontrast während Sezierungen erhöhen,.
3. Erwachsenen Gehirn Dissektion Verfahren
- Anesthetize 3-5 Tage alte Erwachsene D. Melanogaster mit CO 2 oder mit Eis. Wenn Eis verwenden, Ort, an dem die Fläschchen mit fliegt kopfüber (Stecker Ende nach unten) in einem Eiskübel für ~ 5 min. platzieren das Fläschchen kopfüber in Eis verhindert flieht immer eingelegt in der Nahrung. Einmal fliegen betäubt haben, legen Sie die fliegen auf ein kaltes Metall-Pad oder Petrischale sitzen im Eis oder auf eine CO-2 emittieren fliegen Pad. Wenn sezieren Gehirne um Neurodegeneration zu analysieren, ältere fliegen können auch verwendet werden.
- Legen Sie eine kleine Menge (150-200 µL) von PTN in der Mitte der Dissektion Schale mit einer Transferpipette oder einer Pipette p200 erstellen eine " Blase " von PTN. Die Dissektion Schale unter dem Stereomikroskop und passen Sie die Beleuchtung und konzentrieren, so dass die Blase der PTN das Sichtfeld füllt und gleichmäßig ausgeleuchtet.
- Fliegen zu manipulieren, so dass sie " Bauch " (d. h. ventralen Seite nach oben) auf das Metall oder CO 2 Pad liegend.
- Mit ein paar #5 Pinzetten erfassen den Bauch einer Fliege werden seziert und halten halten der Fliege, komplett in tauchen die PTN auf die Dissektion Gericht.
Hinweis: Für den Rest des Protokolls, alle Schritte sollten durchgeführt werden, während der Kopf in PTN untergetaucht ist. - Mit einer zweiten Zange #5, die Basis der Fliege Rüssel greifen und ziehen Sie die zwei Paare der Zange auseinander fliegen Kopf vom Körper trennen. Entsorgen Sie den Bauch und Brustkorb. Bei diesem Schritt ist es wichtig, dass der Kopf nicht freigegeben und auf der Oberfläche der PTN schwimmen durfte. Sobald der Kopf schwebt, kann es sehr schwierig, wieder ohne Zerkleinerung des Gehirns zu erfassen sein.
Hinweis: Bei dieser Methode werden Verbindungen zwischen dem Gehirn und dem ventralen Nervenstrang durchtrennt. Wenn intakte Verbindungen zwischen diesen Regionen des ZNS benötigt werden, sollten eine alternative Dissektion Protokoll, z. B. 49 , 50, befolgt werden. Wenn der Rüssel von fliegen Kopf löst, bevor der Kopf entfernt ist, werden ein Loch, wo der Rüssel war. In diesem Fall halten Sie fliegen am Rand des Loches in der Nähe von einem Auge. Entfernen Sie dann den Kopf mit ein mittleres Maß an Kraft und ziehen Sie die beiden Paare von Pinzetten getrennt voneinander. Gelegentlich, wenn der Kopf vom Körper entfernt ist, die Darm-und/oder ventrale Nerv Schnur bleibt am Kopf und sollte entfernt werden, bevor Sie fortfahren die Dissektion. - , Während ein paar Zangen Rüssel ergreift, sollte das zweite Paar der medialen Rand des Auges direkt fliegen fassen. Ziehen Sie langsam, die Zange voneinander. Dieser Schritt sollte mit einer kleinen Menge der stetigen Querkraft durchgeführt werden. Während der Zange langsam voneinander bewegen, sollte der Rüssel ziehen vom Kopf Weg und erstellen eine mittige Bohrung in den Kopf Kutikula. Verwerfen Sie den Rüssel mit dem ersten paar der Zange ohne Loslassen des medialen Teils des rechten Auges aus dem zweiten Paar.
Hinweis: Der Erwachsene D. Melanogaster Gehirn ist in der kaudalen (d.h. Posterior/hinten) Region des Kopfes fliegen. Somit sollte greifen diese Region des Kopfes vermieden werden. Im Idealfall nur die rostral (d. h. vorne) Teil des Kopfes in der Nähe der medialen Netzhaut sollte direkt von der Pinzette erfasst werden. Das Gehirn und die damit verbundenen Luftröhre sollte jetzt durch das zentrale Loch in die Nagelhaut sichtbar sein. Zu diesem Zeitpunkt keine weißen Fäden Threads der Luftröhre ragen aus dem Loch entfernt und verworfen werden können. - Mit dem zweiten paar der Zange fassen den medialen Rand der linken Netzhaut (am Rande des zentralen Loch in den Kopf Kutikula). Um die Netzhaut und damit verbundenen Nagelhaut zu entfernen, ziehen Sie die Pinzette Weg von einander in einem Winkel von 180°. Die Netzhaut von der zugrunde liegenden Optik Lappen distanziert, sollten Sie einen leichten Rückgang der Spannung spüren. Gehen Sie langsam, um zu verhindern, reißen die Optik Lobe.
Hinweis: Trennen die Zange zu schnell bei diesem Schritt unter Umständen das Zerreißen der the Optik Lappen oder Unterbrechung der Pilz Körperstrukturen. Gelegentlich wird die Nagelhaut entfernt, aber Teile der Netzhaut bleiben an der Optik-Lappen. Wenn die Pilzkörper imaging, ist es nicht absolut notwendig, die gesamte Netzhaut zu entfernen. Analyse von anderen Hirnregionen (z. B. retinalen Neuron Innervation der optischen Hirnlappen) erfordern jedoch die Netzhaut vollständig entfernt werden, wie beschrieben durch 48 , 51.
Hinweis: Da die Netzhaut langsam aus der zugrunde liegenden Optik Lappen des Gehirns getrennt ist, sollte der Optik Lappen beobachtbar als undurchsichtige weiße Struktur bedeckt mit weißen, strähnig Luftröhre. Sobald eine Netzhaut entfernt wurde, kann es verworfen werden. Bei der Analyse der Wegfindung von retinalen Neuronen sollte während dieses Schritts der besonders darauf geachtet werden, um Schäden an der Optik-Lappen. Ein zusätzliches Protokoll auf Dissektion und live Bildgebung der Photorezeptor Neuronen ist auch verfügbar 48. - Nun, vorsichtig so viel von der sichtbaren Luftröhre wie möglich. Die Luftröhre kann später füllen sich mit Luft, wodurch Gehirne zu schweben und, möglicherweise verloren während der späteren Immunostaining Schritten oder bereits enthalten. Um Luftröhre zu entfernen, holen sie sich das Gehirn mit einer sehr scharfen #5 Pinzetten.
- Entfernen der restlichen Netzhaut und umliegenden Nagelhaut mithilfe beide Paare der Zange, um die mediale Region der linken Fliege Netzhaut zu erfassen. Reißen Sie vorsichtig die Netzhaut in der Mitte der Netzhaut und die Nagelhaut zu entfernen. In manchen Fällen erweist sich die Entfernen der restlichen Nagelhaut ohne Zerkleinerung des Gehirns besonders anspruchsvoll. In diesen Fällen haben wir festgestellt, dass die restlichen Stränge der ventrale Nerv Schnur stattdessen durch ein paar der Zange erfasst werden können, während das andere paar der Zange verwendet wird, entfernen vorsichtig die letzte der Kutikula.
- Mit einer Pipette p200 seziert Gehirne zu einem Brunnen der 9 oder 3 Brunnen Schale mit PTN bewegen. Gehirne von den gleichen Genotyp sollte gebündelt in das gleiche gut und auf Eis gehalten werden. Hirngewebe sollte innerhalb einer Stunde nach der Präparation fixiert werden. Gehirne können in kleinen Chargen behoben und gebündelt, wenn eine größere Anzahl von Gehirn erforderlich ist. In den meisten Fällen ein erfahrener Forscher kann in der Regel eine Gehirn zu sezieren und überträgt es auf Sammlung Glasschale in ca. 3-5 min.
4. Fixierung und Immunofluorescent Färbung Verfahren
- mit einer Pipette p200 seziert Gehirne aus der 9-Brunnen-Schale zu einem 0,5 mL Microcentrifuge Schlauch gefüllt mit 0,5 mL 4 % Paraformaldehyd in PTN verdünnt übertragen. Mindestens 10-15 Gehirne des gleichen Genotyps können in einem Microcentrifuge Schlauch kombiniert werden. Alle verbleibenden Schritte (bis Montage des Gehirns auf Folien) werden in 0,5 ml Mikrozentrifugenröhrchen abgeschlossen.
Achtung: Paraformaldehyd (PFA) sollte unter einem Abzug gehandhabt werden. PFA Abfälle sollte gerettet und fachgerecht entsorgt. 20 % Paraformaldehyd in Glasampullen gekauft kann sein regelmÄÑig in Mikrozentrifugenröhrchen und gespeicherte bei-20 ° C bis benötigt. - In einer Dampfhaube Gehirne in 4 % Paraformaldehyd für 20 min mit langsamer Geschwindigkeit rocken bei Raumtemperatur inkubieren.
- Nach Fixierung ermöglichen Gehirn durch die Schwerkraft, sich an der Unterseite des Rohres Microcentrifuge.
Hinweis: Gelegentlich, können die Gehirn auf die Seite der Microcentrifuge Schlauch kleben. In diesem Fall ist es meist hilfreich, um das Rohr zwischen dem Zeigefinger und dem Daumen seitlich drehen oder klopfen sehr leicht das Rohr auf der Bank zur Förderung des Gehirns sinkt. - Entfernen Fixativ mit einem p1000 pipette und führen zwei " schnell " wäscht mit 500 µL PTN, so dass die Gehirn sich an der Unterseite des Microcentrifuge Schlauch zwischen den Waschgängen. Während dieser schnellen Waschgänge sobald die Gehirn durch die Schwerkraft nach unten von den Microcentrifuge Schlauch angesiedelt haben, kann der PTN sofort für frische Puffer ausgetauscht werden; keine zusätzliche Waschzeit ist erforderlich.
Hinweis: In der Regel empfiehlt zusätzliche Puffer in das Rohr verlassen Gehirnentfernung zu riskieren. Sorgfältiger Prüfung der Pipettenspitze ist oft erforderlich, um sicherzustellen, dass kein Hirn fälschlicherweise aus der Tube entfernt wurden. Wenn Gehirne versehentlich Pipettieren in die Spitze wurden, zurück in den Microcentrifuge Schlauch zu verzichten, warten auf das Gehirn, sich niederzulassen und entfernen alle zusätzlichen PTN, das bleibt dann weiter. - Nach der letzten schnelle Wäsche verwenden eine Pipette p1000 drei durchführen " lange " wäscht: 500 µL PTN und Wash für 20 min bei Raumtemperatur auf einer Wippe/Nutator hinzufügen. Alle zukünftigen " lange " Wäschen sollte für 20 min.
Hinweis: Nach dieser Waschungen, feste Köpfe kann gespeichert werden über Nacht bei 4 ° C in PTN. - Entfernen die letzten Wäsche mit einer Pipette p1000 und Gehirne auf einer Wippe oder Nutator bei Raumtemperatur in 0,5 mL blockiert Lösung [PTN + 5 % normalem Ziegenserum (NGS)] für mindestens 30 Minuten bei Raumtemperatur inkubieren.
- Ziege Sekundärantikörper wird in nachfolgenden Protokoll Schritte verwendet werden. Sekundärantikörper von einer anderen Spezies verwendet werden, normales Serum von dieser Spezies (eher als NGS) sollte verwendet werden in die Sperrung und Antikörper Lösungen.
- Mit Hilfe einer Pipette p1000, blockierende Lösung entfernen und Hinzufügen der Primärantikörper in PTN (PTN + 5 % NGS + verdünnte Primärantikörper) verdünnt. Wenn Sie einen primären Antikörper zum ersten Mal verwenden, sollte die optimale Verdünnung dieser Antikörper empirisch ermittelt werden.
Hinweis: Zur Visualisierung von Pilz Körper Neuronen, werden Antikörper erkennen Fas2 normalerweise verwendet. Diese Antikörper sind als Antikörper 1 4 aus der Entwicklungsbiologie Studien Hybridoma Bank (DSHB) zur Verfügung und sollte verdünnten 01:20 in PTN + 5 % NGS.
Hinweis: Zur Visualisierung von Photorezeptor Neuronen, werden Antikörper erkennen Chaoptin normalerweise verwendet. Chaoptin Antikörper sind die DSHB als Antikörper 24B10 ab und sollte verdünnten 01:20 in PTN + 5 % NGS.
Hinweis: Die Fixierung Prozess entfällt in der Regel Fluoreszenz von fluoreszierenden Proteins wie grün fluoreszierendes Protein (GFP). Daher MARCM axonalen Beratung einzelner MB Neuronen zu analysieren, verwenden einen Antikörper erkennen GFP. - Inkubieren Gehirne in Primärantikörper Lösung auf einer Wippe/Nutator für 2-3 Nächte bei 4 ° c
- Nach Inkubation mit Primärantikörpern, Gehirne am unteren Rand der Microcentrifuge Schlauch zu begleichen und entfernen die primären Antikörper-Lösung zu ermöglichen.
- Mit Hilfe einer Pipette p1000 führen 2 " schnelle " Waschungen und 3 " lang " 20 min wäscht mit 0,5 mL PTN, wie oben beschrieben in Schritten 4.4 und 4.5, um durch die Schwerkraft nach unten von den Microcentrifuge Schlauch zwischen jeder Wash begleichen Gehirne sorgfältig ermöglicht
- Inkubieren Gehirne für 3 h bei Raumtemperatur mit entsprechenden Fluoreszent-markierten Sekundärantikörper. Sekundäre Antikörper sind in der Regel in 0,5 mL PTN + 5 % verdünnt NGS in einer Konzentration von 1: 200.
Hinweis: Nachdem Sie fluoreszierende Sekundärantikörper hinzugefügt haben, Gehirne aufbewahrt werden in der Dunkelheit für den Rest des Experiments.
Hinweis: im Fall residual GFP Fluoreszenz bleibt, bei der MARCM Analyse es ratsam ist, einen sekundären Antikörper beschriftet mit einem Fluorophor mit ähnlichen Erregung/Emission Wellenlängen wie GFP zu verwenden (z. B. Fluoroscein Isothyocyanate (FITC) oder Alexa488). - Nach Sekundärantikörper Inkubation, Gehirne, am unteren Rand der Microcentrifuge Schlauch und entfernen die sekundäre Antikörper-Lösung ermöglichen.
- Führen Sie 2 " schnelle " Waschungen und 3 " lang " 20 min wäscht mit 0,5 mL PTN, wie oben beschrieben in Schritten 4.4 und 4.5, um am Ende den Microcentrifuge Schlauch zwischen jeder Wash begleichen Gehirne sorgfältig ermöglicht
- Nach der dritten " lange " 20 min waschen, Einsatz ein p200-Pipette, so viel Puffer wie möglich zu entfernen.
- Fügen Sie 75 µL fluoreszierenden Anti-Fade Eindeckmittel auf die Gehirne. Pipette Gehirne und Montage Medium in die Pipettenspitze einmal zu mischen. Das Rohr nicht umkehren, da Gehirne auf der Kappe oder auf Seiten der Microcentrifuge Schlauch stecken bleiben können.
Hinweis: Nach Aussetzung der Gehirne in Eindeckmedium, Rohre werden eingewickelt in Alufolie, Fluorophor abschrecken zu verlangsamen und über Nacht bei 4 ° C gelagert. Wenn notwendig, Gehirne für mehrere Tage bei 4 ° C gelagert werden können, sondern im Idealfall auf Objektträger so bald wie möglich montiert werden sollte.
5. Montage Erwachsene D. Melanogaster Gehirne auf Mikroskop gleitet und Imaging
- bauen eine " Brücke " Folie. Position 2 " Basis " Deckgläsern etwa 1 cm Abstand auf einer positiv geladenen Folie. Stellen Sie sicher, dass die positiv geladene Seite der Folie nach oben. Deckgläsern auf die Folie mit Nagellack zu halten, wie in Abbildung 3 dargestellt. Es ist in der Regel hilfreich, die drei Außenkanten jeder base Deckglas mit Nagellack darauf Montage Medien nicht unter diese Basis Deckel rutscht Docht zu versiegeln. Nagellack trocknen lassen (10-15 min), bevor Sie fortfahren.
- Legen Sie die Folie unter dem Stereomikroskop und pipette die Montage-Media-Lösung enthält die seziert Gehirne in den Raum zwischen den zwei Deckgläsern. Um mehr Kontrast zu geben, ist es sinnvoll, die Schwanenhals-Leuchten zu manövrieren, so dass sie parallel mit der Bank-Oberseite sind.
- Entfernen zusätzliche Montage Medien aus der Folie mit einer Pipette vorsichtig nicht zu die Gehirnen von der Folie pipette.
- Docht entfernt zusätzliche Montage Medien. Dadurch wird die Gehirn, genauer gesagt im nächsten Schritt positioniert werden.
- Mit einer Zange und Stereomikroskop, positionieren Sie die Köpfe auf der Folie in einem Raster mit Riechzentrum Lappen mit Blick auf
- Legen Sie ein Deckglas (die " Brücke ") über das Gehirn ( Abbildung 3). Verwenden Sie Nagellack, um die Seiten des Deckglases Brücke zu versiegeln, kontaktieren sie die " Basis " Deckel rutscht.
- Mit einer Pipette p200 langsam füllen den Zentrum Hohlraum unter der Brücke mit frischen Montage Medien ( Abbildung 3 B). Ein Tropfen zu einem Zeitpunkt auf der offenen Kante von der Mitte Deckglas und erlauben Sie die Montage Medien unter der Mitte Brücke Deckglas Docht. Fortgesetzt, bis der gesamte Hohlraum gefüllt mit Montage Medien, dann versiegeln oben und unten mit klaren Nagellack.
- Sobald der Nagellack trocken ist, die Folien sofort Bild oder speichern in einer lichtdichten engen Folie Box bei-20 ° c
- Innerhalb einer Woche Bild Gehirne mit konfokale Laserscanning-Mikroskop mit Erregung Laser und Würfel angebracht, die gewählten fluoreszierende Sekundärantikörper zu filtern. Z-Stapel Bilder von Pilz Körper Neuronen stammen in der Regel mit 20 X oder 40 X Ziele. Darstellung der Netzhaut Photorezeptor Neuronen erfordern höheren Vergrößerung.
Ergebnisse
Die oben beschriebene Methode ermöglicht die zuverlässige und reproduzierbare Visualisierung von nahezu jeder Region des erwachsenen Gehirns Drosophila . Hier haben wir die Pilzkörper und Photorezeptor Neuronen fokussiert, aber andere Studien haben ähnliche Methoden verwendet, um Gehirnregionen wie die Pars Intercerebralis52, Uhr Neuronen53,54, zu visualisieren und Riechzentrum Lappen Projektion Neuronen55, unter vielen anderen. Wichtig ist, kann diese Technik verwendet werden, um ganze Hirnstrukturen sowie einzelner Neuronen innerhalb dieser Strukturen mit Techniken wie MARCM12,47zu visualisieren. Abbildung 4, Abbildung 5und Abbildung 6 zeigen verschiedene Arten von Daten von Pilzkörper und Photorezeptor Nervenzellen im erwachsenen Gehirn, die mit dieser Dissektion und Immunostaining Technik erzeugt werden können.
Erstens kann die oben beschriebene Methode verwendet werden, Pilz Körper Morphologie mit entweder Antikörper, die Fasciculin 2 (Fas2) erkennen oder Reporter Gene Pilz Körper Neuronen34direkt zu visualisieren. Wie dargestellt in Abbildung 4A und Abbildung 4 b, Fas2 Antikörper verwendet werden, um die α, β, visualisieren und (in geringerem Maße) γ Lappen der Pilzkörper im erwachsenen Gehirn Drosophila . Fas2 ist ein Zell-Zell-Adhäsion Protein erforderlich für Neuron Faszikulation und drückt sich auf hohem Niveau in der α und β Lappen23,56,57, so dass es einen zuverlässige und gut etablierten Marker für diesen Pilz Körper-Neuronen. Insbesondere kann die kreisförmige Ellipsoid Körper befindet sich in der zentralen Region des erwachsenen Gehirns auch mit dieser Antikörper (Abb. 4A) visualisiert werden.
Mängel im axonalen Führung Proteine verursachen oft unvollständig penetrant Pilz Körper mutierten Phänotypen15,34,35. Daher sollte in den meisten Fällen mehrere Dutzend Köpfe abgebildet und analysiert werden. Der Pilz Körper β Lappen Axone Nab2 null fliegen Kreuz beispielsweise unangemessen die Gehirn-Mittellinie. Dieses "Crossing Over" oder β Lappen "Fusion" Phänotyp wird in der Regel in ~ 80 % der Erwachsenen Nab2 Null fliegt aber ist vor allem von Wildtyp Steuerelemente abwesend und klassifiziert werden können so leicht beobachtet, moderieren oder Fusion34abschließen. Die "Verschmelzung" der β-Lappen über der Mittellinie ergibt sich aus der falschen kontralateralen Projektion der Axone in der gegenüberliegenden Hirnhälfte. Wie in Abbildung 4C und detaillierte in34,35, bezieht sich leichte Fusion auf β-Lappen, die durch eine "dünne Strähne Fas2-Positive Fasern," verbunden, während moderate Fusion zu mehr wesentlich angeschlossenen β Lappen bezieht sich zeigen, dass eine leicht verringerte Lappen Dicke an der Mittellinie. Komplette (oder "extreme") Fusion bezieht sich auf β-Lappen, die vollständig verbunden und zeigen keine Abnahme der Dicke Lappen oder Fas2 Färbung an der Mittellinie. Das Ausmaß der Pilz Körper β Lappen Fusion kann quantifiziert und angezeigt, wie in 34,35 oder als Tabelle zeigt den Prozentsatz des Gehirns zeigen, jede Art von Morphologie defekt nachgewiesen.
Neben der Färbung mit Fas2 Antikörper, MARCM Technik12,47,48 auch einsetzbar, Axon Guidance Entscheidungen einzelner GFP+ Neuronen innerhalb der Pilz Körper Lappen zu visualisieren. MARCM nutzt mitotische Rekombination während der Entwicklung zum Erstellen von einzelnen Neuronen oder klonal verwandte Gruppen von Neuronen, mit GFP (Abb. 5A) gekennzeichnet. MARCM bietet eine Möglichkeit, eine kleine Anzahl von Neuronen zu generieren, die ein Protein in einem ansonsten heterozygot fliegen ganz fehlt. Diese Technik wurde als solche besonders nützlich bei der Analyse der axonalen Anleitung Funktionen von Proteinen, die auch für insgesamt organismal Lebensfähigkeit12,47unerlässlich sind. Homozygote null Neuronen mit GFP markiert können direkt verglichen werden, um Neuronen in einem Wild-Typ genetischen Hintergrund mit GFP markiert zu steuern. Darüber hinaus je nachdem wann entwickelnden Larven oder Puppen Hitze schockiert sind, gezielt verschiedene Klassen von Pilz Körper, die Neuronen werden können (Abb. 5B).
Ein Beispiel für den Typ der Daten, die mit dieser Technik erzeugt ist in Abbildung 5C, wo Wildtyp (d.h.Kontrolle) MARCM Klone als Beispiel erzeugt. Um die einzelnen GFP+ Pilz Körper Neuronen dargestellt in Abbildung 5C, Entwicklung von F1 zu generieren wurden Larven zunächst bei 25 ° c untergebracht. Ca. 5-6 Tage nach dem Schlupf der Larven (ALH), wurden Puppen Hitze schockiert für 30 min bei 37 ° C und dann wieder auf 25 ° C bis Bewegungsapparate. Nach Erwachsenen Schraffur Gehirne wurden seziert in PTN, fixiert und gleichzeitig mit Antikörper erkennen Fas2 inkubiert (1 4, verdünnt 01:20 in PTN) und GLP (verdünnt 1: 500 in PTN). Gehirne wurden dann mit Sekundärantikörper inkubiert und montiert auf Folien wie oben beschrieben. GFP+ Zellen wurden identifiziert und abgebildet, mit einem Laser-scanning confocal Mikroskop und maximaler Intensität Projektionen mit ImageJ erstellt wurden. Wie in Abbildung 5C, Kontrolle GFP+ Neuronen erwirtschaftete die α und β Lappen colocalize mit Fas2 und beenden Sie vor der Kontaktaufnahme mit der Mittellinie, die die beiden Gehirnhälften Drosophila trennt. Ein einziges Axon Projekte anterior, gabelt, und dann beide Projekte dorsal und medial Form der α und β-Lappen. Mehrere frühere Studien haben diese Technik verwendet, um zu untersuchen, ob bestimmte Proteine erforderlich sind, um die Zellteilung autonom für viele Aspekte des Axonogenesis, einschließlich der Verlängerung, Pathfinding, Verzweigung und/oder Beschneidung10zu studieren, 11,12,13,14,15,16,17,34.
Neben den Pilzkörpern können die axonalen Wegfindung Entscheidungen der Photorezeptoren der Netzhaut Neuronen (R-Zellen) auch visualisiert werden mit der beschriebenen (sowohl oberhalb als auch von der Dissektion Methode de Dissektion-MethodeReferenz-48beschrieben). Jedes Ommatidien im fliegen Auge enthält 8 Photorezeptor-Neuronen, die in drei Gruppen (Abbildung 1) eingeteilt werden können: R1-R6-Zellen, die Axone, die oberflächlichen Lamina des Gehirns Optik Lappens; Projekt R7-Zellen, die Axone, die tiefer liegenden M6 der Medulla Projekt; und R8 Zellen, die Axone, die M3-Zwischenschicht der Medulla19,58-Projekt. Die Projektion Muster der einzelnen Klassen von Photorezeptor wurde ausgiebig untersucht und gemeinsam diese Neuronen haben erfolgreich eingesetzt als Modell um zu verstehen, die Signalwege Axon Guidance19,59beteiligt. Wichtig ist, alle Photorezeptor Axone visualisiert werden können leicht in seziert Drosophila Gehirnen von Immunostaining des Erwachsenen, pupal, oder Larven Gewebe mit einem Antikörper erkennt, dass Chaoptin, eine Zelle Oberfläche Glykoprotein24, 60 , 61. Reporter-Gene, die mit dem Ausdruck GFP oder β-Galaktosidase in jeder R-Zelltyp (R1-R6, R7 und R8-Zellen) sind auch konstruiert worden und kann verwendet werden, um jede Klasse der Photorezeptor62zu visualisieren. Da jede Art von R-Zelle in eine andere Ebene des entwickelnden Optik Lappens beendet wird, dürfen diese Reporter für detaillierte Vergleiche der Signalwege, die erforderlich für jeden Zelltyp, korrekt sein Ziel zu finden. Abbildung 6zeigt ein Beispiel für die Expressionsmuster von zwei dieser Reporter Gene in Kombination mit Chaoptin-Lokalisierung (nutzbar als Marker für alle Photorezeptor Neuronen) produziert. Um R7 Photorezeptoren zu visualisieren, wurden Gehirne, enthält das R7-spezifische Rhodopsin4-LacZ Reportergen seziert und gefärbt mit Antikörper gegen Chaoptin und β-Galaktosidase. Rhodopsin 4 (TH4) drückt sich konkret in eine Teilmenge der R7 Zellen63; TH4 -Promotor kann daher verwendet werden, Reporter-gen-Expression in nur diese Zellen zu fahren. Wie erwartet, kündigen R7 Zellen in den tiefer liegenden M6 der Medulla (gekennzeichnet mit einem gelben gepunkteten Linie Abbildung 6). In ähnlicher Weise Gehirne β-Galaktosidase aus dem Rhodopsin-6 (Rh6)-Promotor, der drückt sich konkret in R8 Photorezeptoren63, wurden seziert und Immunostained mit Antikörpern erkennen Chaoptin auszudrücken und Β-Galaktosidase. Wie in Abbildung 6dargestellt, R8 Photorezeptoren beendet die R3-Schicht von derMedulla. Obwohl hier nicht gezeigt, können Rh1-LacZ auch verwendet werden, um die Beendigung des R1-R6 Fotorezeptoren in der Lamina zu visualisieren.
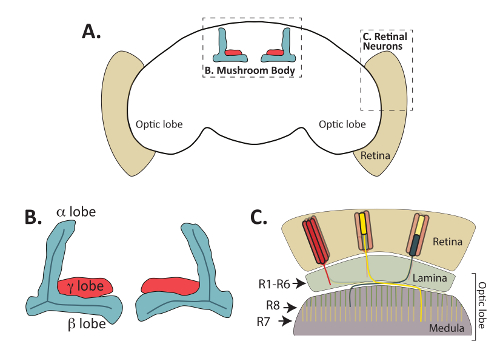
Abbildung 1: Der Erwachsenen Drosophila Melanogaster Gehirn besteht aus funktional unterschiedliche, aber miteinander verbundenen Regionen. (A) einen Überblick über die Erwachsenen D. Melanogaster Gehirn gezeigt, Hervorhebung der zentral gelegenen Pilzkörper und peripheren Netzhaut Photorezeptor Neuronen. (B) vergrößerte Abbildung der Körper eines Erwachsenen Pilz Axon Bundles (auch als Lappen), die durch Fas2 Antikörper erkannt werden. Die intrinsische Neuronen die Pilzkörper, Kenyon Zellen, genannt Projekt Axone Körpertiefe von dorsal gelegen Zellkörper (Zellkörper aus diesem Diagramm ausgelassen) und verschiedene Lappen Strukturen zu bilden. Im erwachsenen Gehirn, γ Lappen (gezeigt im rot) Form aus einem einzigen medialen Bündel von Axonen, während die dorsale α und medialen β Lappen (gezeigt im blau) Form von ein einziges Axon gabelt, die bei der Wegfindung. Α ' / β' Neuronen entwickeln axonale Lappen, die teilweise überschneiden sich mit denen von α/β-Neuronen, aber werden nicht durch Fas2 Antikörper erkannt und werden aus diesem Diagramm ausgelassen. (C) Netzhaut Neuronen sind entscheidend für die Weiterleitung von visuellen Informationen von der Netzhaut, der Optik-Lappen. Axone projizieren von Zellkörpern befindet sich in der Netzhaut (Beige) und bilden Verbindungen mit postsynaptischen Zellen in der Lamina oder Medulla. R1-R6 Photorezeptor Zellen (rot dargestellt) bilden bestimmte Verbindungen mit Zellen in der äußeren Schicht des Lappens Optik, genannt der Lamina. R7 Photorezeptor Zellen (gelb) Synapse mit Zielen in der M6-Schicht von der Medulla, während R8-Zellen (grün dargestellt) Axone, die eher oberflächliche M3 Schicht der Medulla projizieren. Teil C adaptiert mit Erlaubnis von Macmillan Publishers Ltd: Nature Neuroscience (64verweisen, copyright (2011)). Bitte klicken Sie hier für eine größere Version dieser Figur.
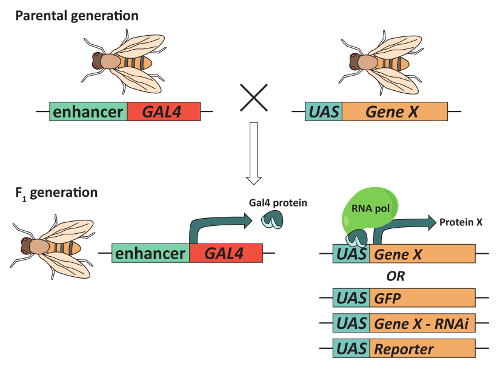
Abbildung 2: The GAL4/UAS-System eignet sich für gezielte Genexpression. Fliegen müssen um fliegen mit dem Ausdruck eines Gens von Interesse ("Gene X") in ein bestimmtes Muster von Gewebe zu erhalten, eine Transgene Ausdruck das Gal4 transcriptional Activator Protein unter der Kontrolle von einem Gewebe spezifische Enhancer und ein Transgen, enthält die Gal4 DNA enthalten. verbindliche Reihenfolge (Upstream Aktivierung Sequenz oder FH genannt) neben Gene X. in der Regel, diese Kombination wird erreicht durch Paarung elterliche fliegen, die jeweils ein Transgen enthalten und die Auswahl für F-1 -nachkommen, die beide enthalten. In der daraus resultierenden F1 Generation Gal4 wird ausgedrückt werden und binden an der FH, Transkription der Gene X Gewebe gezielt zu aktivieren. Wichtig ist, können verschiedene UAS-haltigen transgene in Kombination mit der gleichen GAL4 "Fahrer" verwendet werden. Beispielsweise kann ein Transgen Gal4 in die Pilzkörper (MBs) auszudrücken mit einer FH-haltigen Transgen ausdrückliche GFP, ein Transgen, der nach unten Expression eines Gens mit RNA-Interferenz schlägt oder ein FH-Transgen, das einen Reporter produziert kombiniert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
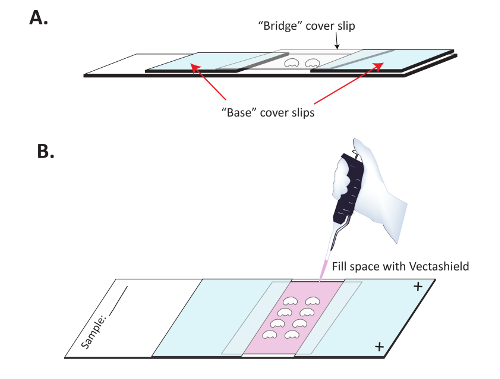
Abbildung 3 : Montage der Gehirne in der Vorbereitung für die Immunfluoreszenz-Bildgebung. (A) Gehirne sind montiert auf SuperFrost Plus Folien mit einer Brücke, Abflachung des Gehirns zu verhindern. Zwei "base" Deckel rutscht eine Superfrost Plus positiv geladene Folie mit klaren Nagellack eingehalten werden und seziert Gehirne sind dann auf der Folie dazwischen platziert. Eine klare "Brücke"-Deckglas ist oberhalb der Gehirne und der Basis Deckel rutscht eingehalten werden. (B) Sobald der Nagellack getrocknet ist, Vectashield wird langsam unter der Brücke, die Fluoreszenz des sekundären Antikörpers zu bewahren pipettiert. Klarer Nagellack wird dann verwendet, um die oberen und unteren Rand der "Brücke"-Deckglas zu versiegeln. Bitte klicken Sie hier für eine größere Version dieser Figur.
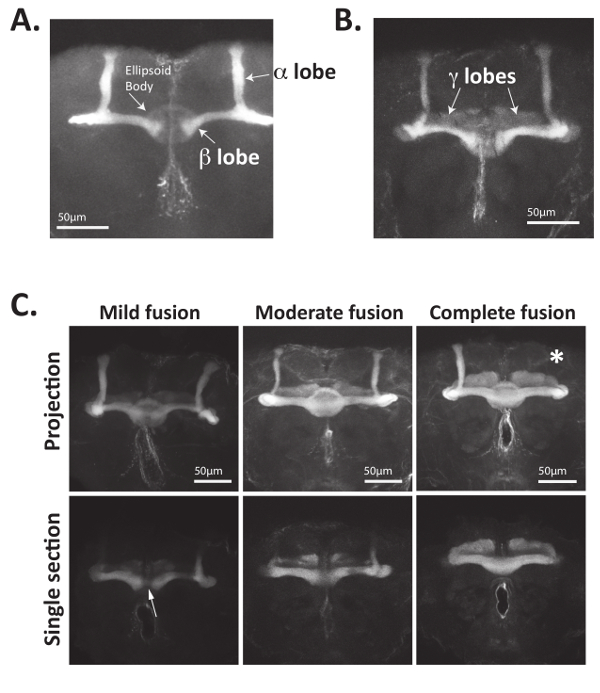
Abbildung 4: Pilz Körper Axone können übersichtlich visualisiert werden mit Antikörpern, die Fas2 erkennen. (A) Erwachsenen Drosophila Gehirne seziert, fixiert und mit Antikörper erkennen Fas2 inkubiert wurden. Primäre Antikörper wurden mit Alexa488-gekoppelten Ziege-Anti-Maus Sekundärantikörper erkannt und Gehirne wurden positiv geladenen Folien befestigt und abgebildet, mit einem Laser-scanning-confocal Mikroskop. Bisymmetrically befindet sich Pilz Körperzelle Körper verlängern Axone anterior, Gabeln und Axon Bündel (auch als Lappen) zu bilden. Axone, die dorsal-Projektierung α Lappen und medial Projektion β Lappen bilden express Fas2. Entscheidend ist, kündigen β Lappen von Wildtyp fliegen vor der Gehirn-Mittellinie. Das zentral gelegene Ellipsoidkörper auch visualisiert werden mit Hilfe von 1-4 Antikörper. (B) die medial-Projektierung γ Lappen Axone des Erwachsenen Drosophila Pilz Körpers auch express Fas2 und visualisiert werden mit Hilfe von 1-4 Antikörper. Die Expression von Fas2 in γ Lappen Axone ist in der Regel geringer als die von α und β Lappen. (C) den Pilz Körper Axone Nab2-Null Gehirne (Genotyp: Nab2ex3/Nab2ex3) MIS contralaterally Projekt und haben oft keine Lappen. Nab2-Null Gehirne wurden seziert, fixiert und gefärbt mit 1-4 Antikörper Pilz Körper α, β und γ Lappen zu visualisieren. Maximale Intensität Z-Stapel Projektionen sowie einzelne optische Abschnitte auf der Mittellinie Region konzentriert werden angezeigt. Während Wildtyp Pilz Körper β Lappen Axone selten die Gehirn-Mittellinie überqueren, haben Nab2-Null Gehirne unterschiedliche Mengen an MIS Projektion über der Mittellinie in der kontralateralen Hirnhälfte, wodurch "verschmolzen" β-Lappen. Im Sinne von Referenzen34,35, milde Fusion bezieht sich auf < β-Lappen mit nur einigen "Stränge" der Axone kreuzen der Mittellinie, moderate Fusion bezieht sich auf Situationen, wo Fas2 positive β Lappen Neuronen kreuzen den Gehirn-Mittellinie aber β-Lappen, Breite an der Mittellinie wird verringert, und vollständige Fusion bezieht sich auf Situationen wo es keine Reduktion der β-Lappen-Dicke wie die Lappen die Gehirn-Mittellinie zu überqueren. Da der Ellipsoid Körper auch Fas2 drückt, optischen Abschnitte zeigen die Mittellinie sind oft hilfreich bei der Visualisierung von β-Lappen-Fusion. Insbesondere werden die fehlenden Lappen auch häufig beobachtet (hier mit dem weißen Sternchen gekennzeichnet). Daten in Teil C ist bei Quantifizierung der Pilz Körper Phänotypen von Referenz34, mit freundlicher Genehmigung verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
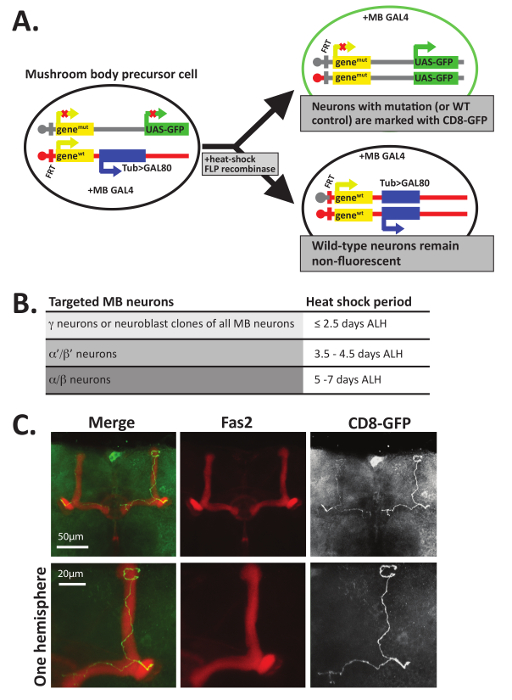
Abbildung 5 : MARCM kann verwendet werden, um die Axone der einzelnen Neuronen zu visualisieren. (A) Mosaik Analyse mit einer tragen Zelle Marker (MARCM) Verwendungen FLP Rekombinase-vermittelten mitotische Rekombination an FRT Standorten um zwei unterschiedliche Tochterzellen zu erstellen. In diesem Beispiel enthalten alle Zellen ein Pilz Körper-spezifische GAL4-Protein auf einem separaten Chromosom. Nach mitotische Rekombination während der Zellteilung, äußert eine Tochterzelle (oben) GLP (oder die Membran gebunden CD8-GFP) und enthält zwei mutierte Allele eines Gens von Interesse, während die andere Tochterzelle (unten) zwei Wildtyp (WT) Allele erbt und eine Transgen das Gal80 Protein Tubulin Förderer mit zum Ausdruck zu bringen. Gal80 hemmt Gal4, so Gal80 produzierenden Zellen nicht fluoreszierenden werden und sollte entweder heterozygot oder homozygot Wildtyp. Nur jene Zellen, die GFP+ enthält zwei Kopien des mutierten Allels. Beachten Sie, dass nur eine von mehreren Methoden zur Erzeugung von GFP+ -Zellen, die auch zwei mutierte Allele eines Gens von Interesse enthalten dargestellt ist; finden Sie12,45,56 für weitere Beispiele. (B) da die Entwicklung der Pilz Körper Neuronen mit γ Neuronen, dann α beginnt "/ β' Neuronen, und endet mit α/β Neuronen, jede Klasse von Neuron können selektiv ausgerichtet und visualisiert durch Hitze zu unterschiedlichen Entwicklungsstörungen Zeitpunkten schockierend. Wie in 12beschrieben, richtet einen Hitzeschock 40 min bei 37 ° C, das auftritt, ≤2.5 Tage nach dem schlüpfen Larven (ALH) γ gezielt wird, Neuronen, während Hitzeschock, der auftritt, 3,5-4,5 Tage ALH (im späten L3 Larvenstadium) α'/ β' Neuronen und eine Hitze, dass o Schock Ccurs zwischen 5-7 Tage ALH (während der pupal Entwicklung) werden α/β Neuronen abzielen. (C) individuelle Wildtyp Axone wurden mit MARCM visualisiert. Wildtyp ~ 5-6 Tage alten Puppen (Genotyp: HsFLP, UAS-CD8-GFP; Badewanne FRT82B, UAS-CD8-GLP/FRT82B, > Gal80; OK107-Gal4/+) schockierte Wärme bei 37 ° C für 40 min. mitotische Rekombination zu induzieren. Gehirne wurden seziert, fixiert und gefärbt mit Antikörpern erkennen GFP (1: 500) und Fas2 (01:20). Gehirne wurden dann mit Fluoreszent markierten Sekundärantikörper inkubiert und visualisiert durch konfokale Mikroskopie. In diesen Beispieldaten aus einer "Kontrolle" Genotyp GFP positive Zellen mit MARCM erzeugt sind Wildtyp und statt mit zwei genMut Allele, enthalten zwei genWT Allele. Pilz Körper β Lappen (mit Antikörper erkennen Fas2 visualisiert) kündigen vor Erreichen der Gehirn-Mittellinie; Α-Lappen-Neuronen sind ebenfalls vorhanden. Um mehr Details anzuzeigen, wird eine vergrößerte im Hinblick auf ein einzelnes Gehirn-Hemisphäre in der untersten Zeile der Bilder angezeigt. Teil C wurde mit freundlicher Genehmigung von Referenz34angepasst. Bitte klicken Sie hier für eine größere Version dieser Figur.
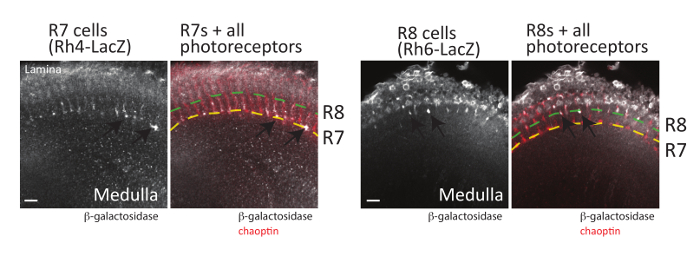
Abbildung 6 : Photorezeptor Axone visualisiert werden. Erwachsenen Gehirne mit dem Ausdruck ihrer β-Galaktosidase in R7 Photorezeptoren (links, mit TH4-LacZ) oder R8 Photorezeptoren (rechts, mit Rh6-LacZ) wurden seziert, fixiert und mit Erkennung von β-Galaktosidase oder Chaoptin Antikörper inkubiert. Gehirne wurden dann mit Fluoreszent markierten Sekundärantikörper inkubiert und visualisiert durch Laser-scanning-konfokalen Mikroskopie. Einzigen optischen Abschnitte sind aus jedem Gehirn gezeigt. Auf der linken Seite mehrere R7 Photorezeptor Axone (Pfeile) sehen Sie beenden in den tiefer liegenden M6 der Medulla (angezeigt durch die gelbe gestrichelte Linie). Auf der rechten Seite kündigen R8 Photorezeptor Axone (Pfeile) in der äußeren Schicht der M3 von der Medulla (dargestellt durch die grüne gestrichelte Linie). Da R7 Photorezeptoren entweder Rh3 auszudrücken oder TH4 und R8 Photorezeptoren Rh5 oder Rh663 Express, können nicht alle R7 und R8 Photorezeptoren mit einer einzigen LacZ -Reporter-gen visualisiert werden. Skalieren von Balken = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die Dissektion und Visualisierung der oben beschriebene Methode kann in einer Vielzahl von Immunostaining verwendet werden und live imaging-Anwendungen. Wir haben eine allgemeine Immunostaining Protokoll beschrieben und haben deutlich gemacht, dass eine Art und Weise MARCM axonalen Morphologie der einzelnen Pilz Körper Nervenzellen visualisieren verwendet werden kann. Darüber hinaus diese allgemeine Verfahren können auch verwendet werden, für andere Hirnregionen in festen imaging oder frisch seziert Erwachsenen Gehirne48,65. Live Imaging können ein effizienteres Vorgehen bei der Analyse der Expressionsmuster von Enhancer fallen, Reporter-Gene oder mimischen Linien66, zum Beispiel. Um zu verhindern, dass erfassen Artefakte von Zelltod während der live Aufnahme der GLP in fixierten Gewebe, Gehirne sollten werden zerlegt in 1 x Phosphat gepufferte Kochsalzlösung (PBS) oder HL3 Medien48, montiert auf Brücke Folien in 1 x PBS (oder HL3) und abgebildet in weniger als 15-20 min. Pflege auch achten so viel Luftröhre möglichst aus dem seziert Gehirn vor Bildgebung, zu entfernen, da es mit Visualisierung der GFP Fluoreszenz stören kann.
Während Färbung Bedingungen für die Beurteilung der Morphologie der Pilze Körper und Photorezeptor Neuronen relativ gut etablierte24,61,67, die Lokalisierung eines spezifischen Proteins des Interesses an dieser Zelle sind Typen erfordern umfangreiche Fehlerbehebung und Optimierung. Insbesondere sollte einige wichtige Schritte, einschließlich Antikörper Verdünnung, blockierende Puffer Komponente Konzentration und Fixierung, optimiert werden, um reproduzierbare und zuverlässige Ergebnisse zu generieren. Zunächst sollte die optimale Konzentration der primären Antikörper bestimmt werden. Obwohl im Handel erhältlichen Antikörper oft eine empfohlene Verdünnung haben (und wir oft erst beginnen durch den Einsatz dieser Konzentration), sind diese Werte auf Drosophila Gewebe selten empirisch ermittelt. Daher testen eine Reihe von primären Antikörper-Verdünnungen, der Bereich oberhalb und unterhalb des Herstellers ab Vorschlag oft spezifische Färbung führt. Während Primärantikörper Verdünnung kann erhebliche Auswirkungen auf die Färbung Genauigkeit und sollte genau bestimmt werden, die Zeit Gehirne im primären Antikörper enthaltenden ausgebrütet werden können Lösungen mit wenig Einfluss auf das Gesamtergebnis erheblich variieren. Zum Beispiel haben wir ähnliche Ergebnisse beobachtet, wenn Inkubation Gehirne mit den Fas2 Antikörper Primärantikörper für zwei, drei oder sogar vier Tage bei 4 ° c seziert Zwar wir mindestens zwei Nächte empfehlen, haben wir auch Gehirne in Primärantikörper Lösung für eine einzige Nacht inkubiert und reproduzierbare Färbung erhalten. Wichtiger ist, hilft die Begrenzung der Höhe der Zeit, die Gehirne in der sekundären Antikörper zu 3 h bei Raumtemperatur (oder eine Nacht bei 4 ° C) inkubiert werden Grenze unspezifische Bindung der Sekundärantikörper, Hirngewebe.
Zweitens kann es notwendig, zusätzliche "Sperrung" Reagenzien zu verwenden, um unerwünschte Hintergrundgeräusche Signal zu beseitigen sein. Erhöhung der Konzentration von NGS auf ~ 10 %, 1-10 % Bovine Serum Albumin (BSA) hinzufügen, die Sperrung und primäre/sekundäre Antikörper Lösungen oder Pre-Adsorption von primären Antikörper über Nacht bei 4 ° C mit Drosophila Embryos (siehe Optionen Referenz-68, Abschnitt 2.9, Schritt 3).
Während wir das obige Protokoll mit PTN als den vorgeschlagenen Puffer für alle Fixierung geschrieben haben, führen waschen, und Antikörper Inkubationsschritte, Gewebe Fixierung in anderen Puffer (z. B. PLP und PEM, aufgeführt in der Materialtabelle) tiefgreifende Unterschiede in Signalstärke. Zum Beispiel haben frühere Studien gezeigt, dass Cyclin E ist nicht nachweisbar im Larvenstadium imaginalen Scheiben, wenn Gewebe im traditionellen 4 % Paraformaldehyd in PBS verdünnt behoben werden, aber ist deutlich sichtbar, wenn Gewebe im PLP Puffer (Ken Moberg, persönliche behoben werden Kommunikation und Referenz-69). Neben Änderungen im Puffer Komponenten, Änderung der Zeit und Temperatur für Gewebe Fixierung auch erheblich immunofluorescent beeinträchtigen kann beflecken und kann bei Bedarf empirisch ermittelt werden. In der Regel Fixierzeit sollte lang genug sein, für ausreichende Vernetzung von Zellkomponenten ermöglichen und langfristige Erhaltung der gesamten zellulären Morphologie während begrenzt genug, um über Vernetzung und "vergraben" von Protein Epitope zu verhindern. Daher beim zunächst Färbung Bedingungen für einen neu erworbenen Primärantikörper optimieren wir in der Regel Fixierzeit ca. 20 min zu begrenzen und behebt oft Gewebe bei kälteren Temperaturen.
Mehrere Steuerelemente sollten in jedem Immunfluoreszenz-Experiment zu untersuchen, die Spezifität der primären und sekundären Antikörper sowie die Wirkung der transgene/genetische Herkunft auf den beobachteten Phänotyp aufgenommen werden. Um festzustellen, ob der primäre Antikörper speziell verwendet wird das Protein des Interesses erkennt, sollte Gewebe von den fliegen fehlt dieses Protein und/oder des Gewebes, die das Protein überexprimiert als Steuerelemente enthalten sein. Die Zugabe von überschüssige gereinigte Antigen Protein kann auch aufgenommen werden, um festzustellen, ob der primäre Antikörper andere Epitope im Gehirn Fliege erkennt. Schließlich stellt jeder Fluoreszenzsignal anwesend, als primären Antikörper entfallen das Niveau der unspezifischen Bindung durch die ausgewählten sekundäre Antikörper.
Mehrere wichtige Steuerelemente sollten auch aufgenommen werden, um den Beitrag der genetische Hintergrund oder das Vorhandensein von transgenen Färbung Intensität oder neuronale Morphologie zu beurteilen. Beispielsweise enthalten die fliegen in die MARCM Experiment in Abbildung 5 verwendet mehrere transgene (HsFLP, UAS-CD8-GFP, FRT82B, Wanne > GAL80 und OK107-GAL4), von denen jeder für Auswirkungen auf die Morphologie der Pilze Körper getrennt analysiert werden sollte. Auf ein absolutes minimum, Pilz Körper Morphologie von fliegen sollten mit OK107-GAL4 und UAS-CD8-GFP analysiert werden. Es kann auch erforderlich sein, die Wirkung der Hitzeschock und Flp Rekombinase Produktion auf Pilz Karosserieentwicklung Dateientyp fliegt mit HsFLP und FRT82B. Obwohl MARCM erhebliche Einblick bieten, ob ein gegebenen Proteins autonom axonalen Führung steuert, kann die Anzahl der Kontrollen erforderlich, um genau diese Schlussfolgerung machen eine kleine Einschränkung dieser Technik sein. In weniger komplizierten Experimente gelten ähnliche Kontrollen auch. Zum Beispiel nehmen Sie ein Experiment, wo ist die GAL4/UAS -System in Kombination mit einer RNAi-Transgen Knockdown Ausdruck eines Proteins des Interesses an alle Neuronen verwendet wird. In diesem Experiment werden mindestens zwei transgene anwesend: eine Pfanne neuronalen GAL4-Treiber z. B. Ilav-GAL4 und UAS-RNAi -Transgen. Die Morphologie der Pilze Körper Neuronen im fliegen, enthält jeder der diese transgene allein sollte neben der Versuchsbedingung untersucht werden, wo fliegen beide transgene in der gleichen Fliege beherbergen.
Schließlich, um festzustellen, ob das Protein des Interesses in Pilz Körper Neuronen zum Ausdruck kommt ist es normalerweise notwendig, Co Fleck Gehirne mit Antikörpern gegen Fas2. Fluoreszierende Proteine wie z. B. GFP, RFP oder die Membran gebunden CD8-GFP können alternativ auch ausgedrückt werden, verwenden das GAL4/UAS -System und in Kombination mit Antikörpern, die das Protein des Interesses zu erkennen. Fas2 erkennt nur die fasciculated Axone, die die Pilz Körper α und β-Lappen zu bilden, seit die Verwendung von GAL4-driven, Membrane-springen CD8-GFP besonders nützlich für die Kennzeichnung von Pilz Körper Neuronen.
Mängel bei der axonalen Beratung sind oft nicht 100 % Penetranz und sogar Gehirne des gleichen Genotyps können gewisse Variabilität zeigen. Daher, wenn mutierten Allele für Mängel in Pilz oder Photorezeptor Pathfinding Analyse neu generiert werden, sollte eine Kombination aus verschiedenen Allelen und Ansätze genutzt werden. Die meisten Studien in der Literatur verschiedene Ansätze um zu untersuchen, ob ein Protein eine Zelle-autonome Rolle bei der Kontrolle der axonalen Anleitung verwenden: ich) Analyse der Pfadfindung Mängel bei homozygot null fliegen (vorzugsweise mit verschiedenen Null-Allele), Ii) Analyse der Pfadfindung Mängel an fliegen fehlt das Protein des Interesses nur in Neuronen (in der Regel über RNAi), Iii) MARCM Analyse der Pfadfindung Mängel und iv) Experimente, wo das Gen erneut zum Ausdruck in den Neuronen der homozygot Null ist, zu retten fliegt. Im Idealfall sollten mehrere Dutzend Köpfe pro Genotyp für Mängel in neuronale Morphologie analysiert werden.
Obwohl das Protokoll hier in erster Linie konzentriert sich auf immunofluorescent Lokalisierung von Proteinen innerhalb fixierte Gewebe beschrieben, werden mehrere zukünftige Anwendungen dieser Technik zum Bild live Hirngewebe entwickelt. Gehirn (in der Regel in Zellkulturmedien) seziert werden, kann sie dann kultiviert für mehrere Tage bei 25 ° c Diese ex Vivo Kultivierung Methoden entwickelt, um eine Vielzahl von biologischen Prozessen, wie z. B. Proteinaktivität zu untersuchen, das Axon Regeneration nach Verletzungen70,71, intrazelluläre fördert Signalisierung Dynamik72und neuronale Entwicklung73.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Wir möchten Changhui Pak und Alysia Vrailas Mortimer bedanken für den Unterricht zunächst SMK Gehirn Dissektion Technik. Wir danken auch Mitglieder des Ken Mobergs Lab-Gruppe, vor allem Chris Runden für das Manuskript kritisch zu lesen. Antikörper erkennen Fas2 (1-4) und Chaoptin (24B10) stammen aus der Entwicklungsbiologie Studien Hybridoma Bank. Antikörper-24B10 wurde auf die DSHB durch Seymour Benzer und Nansi Colley24,60,61eingezahlt, Antikörper 1 4 war, die DSHB von Corey Goodman 22,23,56hinterlegt. Fliegende-Aktien wurden von Bloomington Stock Center erhalten. Wir möchten auch danke dem Ohio Agricultural Research und Development Center (OARDC) MCIC Imaging Center für den Einsatz des konfokalen Mikroskops Gehirne in Abbildung 4A Image und B. SMK wird unterstützt durch einen Zuschuss von NICHD (1 R15 HD084241-01A1).
Materialien
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
Referenzen
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten