Method Article
Disección y tinción inmunofluorescente de seta del cuerpo y las neuronas fotorreceptoras en cerebros de adultos de Drosophila melanogaster
En este artículo
Resumen
Este protocolo describe la disección y el immunostaining del adulto de Drosophila melanogaster los tejidos del cerebro. Específicamente, este protocolo destaca el uso de setas neuronas cuerpo y fotorreceptor Drosophila como subconjuntos neuronal de ejemplo que pueden utilizarse con precisión para descubrir principios generales subyacentes a muchos aspectos del desarrollo neuronal.
Resumen
Desarrollo del sistema nervioso consiste en una serie secuencial de acontecimientos que son coordinados por varias vías de señalización y redes reguladoras. Muchas de las proteínas implicadas en estas vías son evolutivamente conservados entre los mamíferos y otros eucariotas, tales como la mosca de la fruta Drosophila melanogaster, sugiriendo que existen principios de organización similares durante el desarrollo de estos organismos. Lo importante, Drosophila se ha utilizado ampliamente para identificar los mecanismos celulares y moleculares de regulación de procesos que se requieren en los mamíferos incluyendo la neurogénesis, diferenciación, Guía axonal y sinaptogénesis. Moscas también se han utilizado con éxito para modelar una variedad de enfermedades del desarrollo neurológico humano. Aquí se describe un protocolo para la microdisección paso a paso, fijación y localización inmunofluorescente de proteínas en el cerebro adulto de Drosophila . Este protocolo se centra en dos poblaciones neuronales de ejemplo, las neuronas del cuerpo de la seta y fotorreceptores retinianos e incluye pasos opcionales para rastrear las neuronas cuerpo seta individual mediante análisis de mosaico con una técnica de marcador celular Repressible (MARCM). Ejemplo datos de tipo salvaje y mutantes cerebros se presentan junto con una breve descripción de un criterio de puntuación para los defectos de Guía axonal. Si bien este protocolo destaca dos anticuerpos bien establecidos para la investigación de la morfología del cuerpo de la seta y las neuronas fotorreceptoras, otras regiones del cerebro de Drosophila y la localización de proteínas dentro de otras regiones del cerebro también puede ser investigados mediante este protocolo.
Introducción
Aunque el sistema nervioso de Drosophila es menor que la de los seres humanos y roedores, su complejidad proporciona un modelo potente y accesible para entender mejor sus equivalentes vertebrados. En muchos casos, los genomas de vertebrados y moscas codifican proteínas muy similares que determinan los mecanismos de desarrollo del sistema nervioso. De hecho, muchos de los genes necesarios para el desarrollo neuronal en vertebrados han ortólogos en moscas, incluyendo aquellos involucrados en vías de señalización patrones de control, la neurogénesis y Guía axonal1,2,3 ,4,5. Por ejemplo, netrin es un ligando para la Guía axonal en mamíferos y D. melanogaster6,7,8. Mientras netrin fue originalmente aislado de chick embrionario cerebro tejido6, estudios posteriores han revelado que netrin desempeña un papel conservado durante el desarrollo del embrionario sistema nervioso central (SNC) en Drosophila8. Otros estudios han utilizado pantallas genéticas en el embrión de Drosophila CNS para identificar conservados ligandos y receptores para pathfinding en tanto en Drosophila como en vertebrados9.
Mientras que la mosca embrionaria del CNS se ha utilizado ampliamente en el pasado para identificar ligandos, receptores y proteínas de señalización intracelulares necesarias para la Guía axonal8,9, el trabajo reciente ha investigado las formas en que muchos de Estas proteínas también controlan las decisiones pathfinding durante etapas posteriores del desarrollo. Específicamente, investigación del cuerpo de la seta (MB) y desarrollo de neuronas fotorreceptoras retinianas (figura 1) ha proporcionado información sobre los mecanismos pathfinding control, formación de sinapsis, axón poda y otros aspectos del neuronal desarrollo10,11,12,13,14,15,16,17. Las neuronas fotorreceptoras conectan la retina de la mosca a las regiones del cerebro adulto llamada la lámina y médula y son fundamental para transmitir información visual al cerebro (revisado por18,19), mientras que las neuronas del cuerpo de la seta centralmente localizado en el cerebro de mosca y son necesarios para el aprendizaje y la memoria de20,21. Las neuronas fotorreceptores y las neuronas intrínsecas de los cuerpos de hongos, llamadas células de Kenyon, utilizan mecanismos evolutivamente conservado Guía axonal difusible y dependientes del contacto para encontrar sus blancos postsinápticos. Además de ser visible en moscas adultas, fotorreceptores y neuronas MB pueden también ser directamente visualizadas en larvas y pupas con anticuerpos o reportero genes22,23,24,25. La capacidad de visualizar fácilmente estos dos conjuntos de neuronas en diferentes momentos del desarrollo ha promovido su uso como modelos excelentes para muchos aspectos del desarrollo neuronal.
Además de ser utilizado como un modelo para entender los mecanismos del desarrollo normal del sistema nervioso, estudios recientes han demostrado que moscas también sirven como modelos precisos de una gran variedad de enfermedades humanas, incluyendo el síndrome de X frágil (FXS)26 ,29,30,31de discapacidad intelectual (di)27,28,y otros32. Por ejemplo, para estudiar la función molecular de ZC3H14, un gen recientemente vinculado a discapacidad intelectual humano, hemos creado un modelo de mosca de ID con un alelo nulo de la mosca ZC3H14 ortólogo, llamado Nab230. Moscas que carecen Nab2 tienen discapacidad severa de la memoria y poly(A) colas, recapitulando lo que se observa en pacientes humanos o paciente derivado célula líneas33,34. Lo importante, moscas que carecen Nab2 también mostrarán defectos de morfología cerebral grave en sus cuerpos seta adultos34, similar a lo que se observa en moscas que carecen el gene del síndrome de FXS, FMR135. Por lo tanto, moscas pueden servir como un organismo modelo importante para estudiar el desarrollo normal del cerebro y enfermedades que lo interrumpen.
Por último, la accesibilidad de métodos de alto rendimiento para controlar el comportamiento, combinado con la amplia gama de herramientas genéticas disponibles, hacer Drosophila , un organismo modelo de elección para la identificación de las regiones del cerebro que controlan los comportamientos complejos, tales como aprendizaje y memoria, sueño, cortejo, sed y otros36,37,38,39. Una herramienta especialmente útil que está en el centro de "caja de herramientas" de un genetista mosca es el sistema de GAL4/UAS (figura 2). Este sistema40,41 utiliza la expresión específica de tejido del activador transcripcional Gal4 para aumentar la expresión de genes o transgenes aguas abajo de una secuencia de activación ascendente (UAS). Modificaciones de este sistema han permitido a los investigadores, por ejemplo, precisamente el control de la excitabilidad de las neuronas específicas42,43, sobrexpresan o precipitación de genes específicos de interés44, 45, analizar la dinámica de calcio en tiempo real en vivo46y expresar genes del reportero para marcar linajes neuronal41. La combinación del sistema de GAL4/UAS con la recombinación mitótica también permitida la creación del análisis de mosaico con un marcador de célula Repressible (MARCM) sistema12,47. MARCM se ha utilizado extensivamente en seguimiento de neurona única para identificar los componentes celulares de señalización necesarios para la Guía axonal12,47. Aunque estas y otras técnicas han proporcionado una cantidad de información valiosa sobre los mecanismos celulares necesarios para la función del sistema nervioso, la mayoría requieren que el cerebro de la Drosophila primero se diseca; eliminar del cerebro es necesaria para mantener patrones de morfología y conexión correcta del cerebro entre las regiones del cerebro. El siguiente protocolo utiliza neuronas cuerpo y fotorreceptor hongos comopoblaciones neuronales ejemplo como él le guía a través de la disección y cerebros inmunofluorescente de la coloración del adulto de Drosophila .
Protocolo
1. genética de drosophila melanogaster y los procedimientos de descarga de calor opcional
Moscas- una vez han sido cruzados y progenie F1 han tramado, obtener hembras o machos de genotipo apropiado. Dependiendo de la región del cerebro investigada, moscas deben recogerse diariamente y separados por sexo para que se pueden distinguir más fácilmente los patrones depende de la edad y dimorfismo sexual de la Conectividad del cerebro.
Nota: Opcional: Si vuela se utilizan para el análisis de mosaico con un marcador de célula Repressible (MARCM) análisis 12 , 47, embriones, larvas o pupas deben ser dado una sacudida eléctrica a 37 ° C durante 30-45 minutos a calor inducir la recombinación mitótica. Para apuntar regiones específicas de los cuerpos setas para análisis MARCM, choque térmico debe ser programado según el horario determinado por 12 y se indica en la figura 5 B. Si usa MARCM para investigar las regiones del cerebro que no sea de los cuerpos de la setas, experiencias piloto deben realizarse para determinar la etapa óptima para ser sorprendido por el calor. Mientras que los siguientes pasos se escriben en lo que respecta a eclosed vuela, pharate adultos también pueden ser disecados usando estos pasos una vez que se ha eliminado la envoltura pupal.
2. Preparación de la estación de disección
adjunto de- posición el estereomicroscopio y la luz de la fuente con cuellos de cisne óptica de fibra en una mesa grande. A promover movimientos de mano firme y reducir la mano " shake " y disección, es esencial que haya suficiente espacio de resto mano y el brazo en el microscopio. Asegúrese de que hay aproximadamente 8-10 pulgadas a cada lado del microscopio y de 4 a 6 pulgadas entre la base del microscopio y el borde del Banco.
- Llenar 2 o 3 pocillos de cristal plato 9-pozo o bien 3 con 1,0 mL de tampón PTN (0.1 M fosfato de sodio tampón pH 7,2, surfactante no iónico 0.1%, ver tabla de materiales para componentes de búfer completo) y coloque al lado de la estación de disección en el hielo. Se transfirió a este plato y guardados hasta el paso de fijación cerebros recién disecados.
- Nota: Si requiere la proyección de imagen vivo, almacenador intermediario de la disección debe ser 1 x de buffer de fosfato tampón salino (PBS) o HL3 48. Si la localización intracelular de la proteína es necesaria, PBS puede también utilizarse como una alternativa para la disección y fijación. Tras fijación, permeabilización de las membranas celulares debe entonces realizarse PTN lavados con detergente no iónico 0.1% o 0.3%.
- Si PBS se utiliza para disecciones y fijación, puntas de pipeta deben ser lavado al menos una vez con un tampón que contiene detergente (por ejemplo, PTN) para impedir que se pegue a las puntas de pipeta de plástico durante la transferencia a tubos de microcentrífuga cerebros.
- Usando un cristal vacío de 35 mm o un plato de petri de plástico, construir un plato de disección con un elastómero de silicón. Mezclar brevemente, los componentes de elastómero según el fabricante ' direcciones s, verter en cuencos de 35 mm y dejar polimerizar durante la noche sobre una superficie plana. Elastómero que contiene platos de disección debe utilizarse para proteger las puntas finas de disección pinzas, que pueden dañarse fácilmente si se hace contacto entre las pinzas y una superficie más dura, como un plato de cristal. También compramos platos disponibles en el mercado de silicona recubierto de minoristas en línea. Para aumentar el contraste durante las disecciones, platos de disección de elastómero de silicona que contienen carbón inactivada (y así color negro) son particularmente útiles.
3. Procedimiento de disección de cerebro adulto
- Anesthetize 3-5 días adulto viejo D. melanogaster con CO 2 o con hielo. Si se utiliza hielo, lugar el frasco que contiene moscas boca abajo (extremo del enchufe hacia abajo) en un cubo de hielo ~ 5 minutos colocar el frasco en el hielo hacia abajo evita que vuela de ser alojado en el alimento. Una vez que han sido anestesiadas moscas, colocar las moscas en una sesión metal frío de la almohadilla o placa de Petri en hielo o en un CO 2 emiten pad mosca. Si diseccionar cerebros para analizar neurodegeneración, moscas mayores pueden usarse también.
- Colocar una pequeña cantidad (150-200 μL) de PTN en el centro de la placa de disección utilizando una pipeta o una pipeta p200 para crear un " burbuja " de PTN. Coloque el plato de disección bajo el estereomicroscopio y ajustar la iluminación y enfoque para que la burbuja de PTN llena el campo de visión y es iluminada uniformemente.
- Manipular las moscas para que sean " del vientre para arriba " (es decir, la parte ventral hacia arriba) mientras se está acostado en el metal o CO 2 pad.
- Usando un par de #5 pinzas, sujete el abdomen de una mosca para ser disecado y, completamente manteniendo pulsado de la mosca, sumérjalo en la PTN en la bandeja de disección.
Nota: Para el resto del Protocolo, todas las medidas deben realizarse mientras la cabeza se sumerge en PTN. - Utilizando un segundo par de pinzas para #5, asirla por la base de la probóscide de la mosca y tire los dos pares de pinzas aparte para separar la cabeza de mosca de cuerpo. Deseche el abdomen y el tórax. Durante este paso, es fundamental que la cabeza no es liberada y permite flotar en la superficie de la PTN. Una vez que la cabeza esté flotando, puede ser muy difícil de captar otra vez sin machacar el cerebro.
Nota: Utilizando este método, se cortó las conexiones entre el cerebro y cordón nervioso ventral. Si se requieren conexiones intactas entre estas regiones del SNC, se debe seguir un protocolo de disección alternativos, como 49 , 50. Si la probóscide se desprende de la cabeza de la mosca antes de retira la cabeza, habrá un agujero donde estaba la probóscide. En este caso, sujete la cabeza de la mosca en el borde del agujero cerca de un ojo. Quite la cabeza con una cantidad moderada de fuerza tirando los dos pares de pinzas aparte de uno otro. Ocasionalmente, cuando se extirpa la cabeza del cuerpo, los restos de cuerda de tripa o ventral del nervio colocado en el cabezal y debe eliminarse antes de continuar con la disección. - Mientras un par de Pinzas sujeta la probóscide, el segundo par debe agarrar el borde medial del ojo derecho mosca. Lentamente, tirar de las pinzas aparte de uno otro. Este paso debe realizarse con una pequeña cantidad de fuerza lateral constante. El fórceps se mueva lentamente aparte de uno otro, la probóscide debe tirar de la cabeza y crear un orificio central en la cutícula de la cabeza. Deseche la probóscide con el primer par de pinzas sin soltar la porción medial del ojo derecho desde el segundo par.
Nota: El adulto cerebro de D. melanogaster es en el caudal (es decir, posterior/posterior) región de la cabeza de mosca. Por lo tanto, debe evitarse sujetando la región de la cabeza. Idealmente, sólo la rostral (es decir, frontal) parte de la cabeza cerca de la retina intermedia debe ser captado directamente por el fórceps. El cerebro y la tráquea asociado deben quedar visibles a través del agujero central en la cutícula. En este momento, cualquier blanco hilos fibrosos de tráquea que sobresale del agujero se pueden quitar y desechar. - Con el segundo par de pinzas, sujete el borde medial de la retina izquierda (en el borde del agujero central en la cutícula de la cabeza). Para quitar las retinas y cutícula asociada, lentamente, tirar de las pinzas de uno con el otro en un ángulo de 180 °. Como la retina se disocia del lóbulo óptico subyacente, debe sentir una ligera disminución en la tensión. Proceder lentamente para evitar desgarros del lóbulo óptico.
Nota: Separar las pinzas demasiado rápidamente durante esta etapa puede resultar en el rasgado de the óptico lóbulo o interrupción de las estructuras del cuerpo de la seta. En ocasiones, se eliminará la cutícula pero piezas de la retina permanecerá Unidos al lóbulo óptico. Si los cuerpos setas la proyección de imagen, no es completamente necesario eliminar la retina entera. Sin embargo, el análisis de otras regiones del cerebro (por ejemplo, inervación de neuronas retinianas de los lóbulos ópticos del cerebro) pueden requerir la retina a retirarse completamente descrito por 48 , 51.
Nota: Como la retina se separa lentamente del subyacente lóbulo óptico del cerebro, el lóbulo óptico debe ser observable como una estructura opaca blanco cubierta con tráquea blanco, fibroso. Cuando una retina se ha eliminado, puede ser desechado. Al analizar el pathfinding de neuronas retinianas, debe tenerse cuidado especial durante este paso para evitar daños en el lóbulo óptico. Un protocolo adicional se centró en la disección y en proyección de imagen de las neuronas fotorreceptoras también está disponible 48. - Ahora, retire con cuidado tanto de la tráquea visible como sea posible. La tráquea puede contener ya o más tarde se llenan de aire, haciendo que el cerebro a flotar y, potencialmente, se perderán durante los pasos posteriores de inmunotinción. Para quitar la tráquea, escogerlo apagado el cerebro con un par muy fuerte de #5 fórceps.
- Quitar la retina restantes y la cutícula circundante utilizando dos pares de pinzas para agarrar la región medial de la retina izquierda mosca. Con cuidado rasgue la retina por la mitad para retirar las piezas de la retina y la cutícula. En algunos casos, quitar la cutícula restante sin machacar el cerebro resulta especialmente desafiante. En estos casos, hemos encontrado que las hebras restantes de la cuerda ventral del nervio en su lugar pueden agarradas por un par de pinzas mientras que el otro par de pinzas se utiliza para extraer cuidadosamente el último de la cutícula.
- Con una pipeta de p200, mover cerebros disecados para bien del plato de 9 o 3 bien con PTN. Cerebros del mismo genotipo deben ser agrupados juntos en el mismo bien y mantenerse en hielo. Tejido cerebral debe fijarse dentro de una hora de la disección. Cerebro puede fijo en lotes pequeños y agrupado si se requiere un mayor número de cerebros. En la mayoría de los casos, un investigador experimentado generalmente puede diseccionar un cerebro y ponerlo en el plato de la colección de vidrio en aproximadamente 3-5 min
4. Fijación y el procedimiento de tinción inmunofluorescente
- con una pipeta de p200, transferencia de cerebros disecados de la fuente 9-bien a un tubo de microcentrífuga de 0, 5 mL con 0,5 mL de paraformaldehído al 4% diluido en PTN. Al menos 10-15 cerebros del mismo genotipo pueden combinarse en un tubo de microcentrífuga. Todos los pasos restantes (hasta el montaje de los cerebros en diapositivas) se realizan en tubos de microcentrífuga de 0, 5 ml.
PRECAUCIÓN: Paraformaldehido (PFA) debe manejarse en una campana de humos. Residuos PFA deben guardar y desechar correctamente. 20% paraformaldehido en ampollas de vidrio puede ser alícuotas en tubos de microcentrífuga y almacenado a-20 ° C hasta que sea necesario. - Dentro de una campana de humos, incubar cerebros en paraformaldehído al 4% por 20 min con velocidad lenta oscilación en la temperatura ambiente.
- Después de fijación, permite cerebros para instalarse en la parte inferior del tubo de microcentrífuga por gravedad.
Nota: Ocasionalmente, el cerebro puede quedarse al lado del tubo de microcentrífuga. Si esto ocurre, es generalmente útil para rotar lateralmente el tubo entre el dedo índice y el pulgar o a golpear muy suavemente el tubo en el Banco para promover el hundimiento de los cerebros. - Fijador quite usando una p1000 pipeta y realizar dos " rápido " lavado con 500 μl del PTN, permitiendo que el cerebro colocar en la parte inferior del tubo de microcentrífuga entre lavados. Durante estos lavados rápidos, una vez que todos los cerebros se han asentado por gravedad a la parte inferior del tubo de microcentrífuga, el PTN inmediatamente canjeable para almacenador intermediario fresco; no se requiere ningún tiempo adicional lavado.
Nota: Normalmente, dejando amortiguación extra en el tubo es preferible correr el riesgo de eliminación del cerebro. La examinación cuidadosa de la punta de la pipeta a menudo es necesaria para asegurar que ningún cerebro erróneamente eliminado del tubo. Si los cerebros han sido accidentalmente pipetea en la punta, dispensar en el tubo de microcentrífuga, espere los cerebros resolver y continuar eliminando cualquier extra PTN que queda. - Después del último lavado rápido, utilizar una pipeta p1000 para realizar tres " largo " lava: Añadir 500 μl de PTN y lavado por 20 min a temperatura ambiente en un eje de balancín/nutator. Todo futuro " largo " lavados deben ser durante 20 minutos.
Nota: Siguiendo estos lavados, fijada los cerebros puede ser almacenada durante la noche a 4 ° C en PTN. - Quitar el último lavado con ayuda de una pipeta p1000 e incubar cerebros en un eje de balancín o nutator a temperatura ambiente en 0,5 mL de bloquear la solución [PTN + 5% de suero normal de cabra (NGS)] por lo menos 30 min a temperatura ambiente.
- Anticuerpos secundarios cabra se utilizará en los pasos subsiguientes del protocolo. Si va a utilizar anticuerpos secundarios de otra especie, el suero normal de esa especie (en lugar de NGS) debe usarse en las soluciones de bloqueo y anticuerpo.
- Con una pipeta p1000, quitar el bloqueo de la solución y añadir el anticuerpo primario diluido en PTN (PTN 5% NGS + anticuerpo primario diluido). Cuando se utiliza un anticuerpo primario por primera vez, la dilución óptima del anticuerpo que debe determinarse empíricamente.
Nota: Para la visualización de las neuronas del cuerpo de la seta, por lo general se utilizan anticuerpos reconociendo Fas2. Estos anticuerpos están disponibles de banco de hibridoma de estudios del desarrollo (DSHB) como anticuerpos 1 4 y debe ser diluido 1:20 en PTN + 5% NGS.
Nota: Para la visualización de las neuronas fotorreceptoras, típicamente se utilizan anticuerpos reconocimiento chaoptin. Anticuerpos Chaoptin en el DSHB como anticuerpo 24B10 y debe ser diluido 1:20 en PTN + 5% NGS.
Nota: El proceso de fijación por lo general elimina la fluorescencia de la proteína fluorescente como la proteína verde fluorescente (GFP). Por lo tanto, cuando use MARCM para analizar la Guía axonal de neuronas individuales MB, utilice un anticuerpo reconocer GFP. - Incubar cerebros en la solución de anticuerpo primario en un eje de balancín/nutator durante 2-3 noches en el 4 ° C.
- Tras incubación con anticuerpos primarios, permite el cerebro para colocar en la parte inferior del tubo de microcentrífuga y retire la solución de anticuerpo primario.
- Con una pipeta p1000, realizar 2 " rápido " lavados y 3 " largo " 20 minutos lava con 0,5 mL de PTN como se describe en pasos 4.4 y 4.5, con cuidado lo que los cerebros para asentarse por gravedad a la parte inferior del tubo de microcentrífuga entre cada Washington
- Cerebro incubar durante 3 horas a temperatura ambiente con anticuerpos secundarios marcada con fluorescencia apropiados. Anticuerpos secundarios se diluyen generalmente en 0.5 mL de PTN + 5% NGS en una concentración de 1: 200.
Nota: Una vez que se han añadido fluorescentes anticuerpos secundarios, cerebros deben conservarse en la oscuridad por el resto del experimento.
Nota: en caso residual GFP fluorescencia restos, al realizar análisis MARCM es recomendable utilizar un anticuerpo secundario marcado con un fluoróforo que longitudes de onda de excitación/emisión similar como GFP (p. ej., Fluoroscein isothyocyanate (FITC) o Alexa488). - Después de la incubación del anticuerpo secundario, permite cerebros se asiente en la parte inferior del tubo de microcentrífuga y retirar la solución de anticuerpo secundario.
- 2 realizar " rápido " lavados y 3 " largo " 20 minutos lava con 0,5 mL de PTN como se describe en pasos 4.4 y 4.5, con cuidado lo que los cerebros para colocar en la parte inferior del tubo de microcentrífuga entre cada Washington
- Después de la tercera " largo " 20 min lavado, uso una pipeta de p200 para quitar tanta amortiguación posible.
- Añadir 75 μl de anti-fade fluorescente medio de montaje para el cerebro. Cerebros de pipeta y medio de montaje en la punta una vez para mezclar. Invertir el tubo ya que el cerebro puede atascarse en la tapa o los lados del tubo de microcentrífuga de.
Nota: Tras suspensión de cerebros en el medio de montaje, tubos pueden ser envuelto en papel de aluminio para lento amortiguamiento fluoróforo y almacenados a 4 ° C durante la noche. Si es necesario, cerebros pueden guardarse por varios días a 4 ° C, pero idealmente debe ser montados en diapositivas tan pronto como sea posible.
5. Cerebros de adultos D. melanogaster en microscopio de diapositivas y proyección de imagen de montaje
- construir un " puente " diapositiva. Coloque dos " base " cubreobjetos aproximadamente 1 cm de separación en una diapositiva de carga positiva. Asegúrese de que el lado cargado positivamente de la diapositiva es hacia arriba. Adherir el cubreobjetos a la diapositiva con esmalte de uñas como se muestra en la figura 3 A. Es generalmente útil sellar los bordes de cada base cubierta con esmalte de uñas para montaje de los medios de comunicación no mecha bajo estos cubreobjetos base tres. Deje que esmalte de uñas se seque completamente (10-15 min) antes de proceder.
- Colocar el portaobjetos bajo el estereomicroscopio y pipetear la solución de medios de montaje que contiene los cerebros disecados en el espacio entre los dos cubreobjetos. Para proporcionar mayor contraste, es útil maniobrar las luces de cuello de cisne para que sean paralelas a la mesa.
- Quitar montaje extra los medios de comunicación de la diapositiva usando una pipeta, procurando no pipetear el cerebro apagado la. Medios de montaje extra lejos de
- mecha. Esto permitirá que el cerebro se coloca más precisamente durante el siguiente paso.
- Con un par de pinzas y el estereomicroscopio, colocar los cerebros en la diapositiva en una cuadrícula con los lóbulos antenales hacia arriba
- Colocar un cubreobjetos (el " puente ") sobre el cerebro ( figura 3 A). Usar esmalte de uñas para sellar los lados de la hoja de cubierta del puente donde se Contacta con el " base " cubreobjetos.
- Lentamente con una pipeta de p200, rellenar la cavidad del centro bajo el puente con medios de montaje fresco ( figura 3 B). Coloque una gota en un momento en el borde abierto del centro cubreobjetos y deje que los medios de montaje para fieltro bajo el cubreobjetos del puente de centro. Continúe hasta que la cavidad entera se llena con el montaje de los medios de comunicación, luego sellar la parte superior e inferior con esmalte de uñas claro.
- Una vez seco el esmalte de uñas, las diapositivas de imagen inmediatamente o almacenar en una caja portaobjetos firmemente resistente a la luz-20 ° C.
- Dentro de una semana, imagen cerebro utilizando un microscopio confocal de escaneo láser con láser de excitación y filtro de cubos adecuados los anticuerpos secundarios fluorescentes solicitadas. Típicamente se obtienen imágenes Z-stack de neuronas del cuerpo de la seta con 20 X o 40 X objetivos. Proyección de imagen de las neuronas fotorreceptoras retinianas puede requerir aumento mayor.
Resultados
El método descrito permite la visualización confiable y reproducible de prácticamente cualquier región del cerebro de Drosophila adulto. Aquí nos hemos centrado en los cuerpos setas y las neuronas fotorreceptoras, pero otros estudios han utilizado métodos similares para visualizar las regiones del cerebro como la pars intercerebralis52,53,de las neuronas54de reloj y antenal lóbulo proyección neuronas55, entre muchos otros. Lo importante, esta técnica puede utilizarse para visualizar las estructuras del cerebro entero así como neuronas individuales dentro de esas estructuras mediante técnicas como la MARCM12,47. Figura 4, figura 5y figura 6 muestran diferentes tipos de datos de cuerpos setas y las neuronas fotorreceptoras en los cerebros adultos que se pueden generar con esta técnica de disección y el immunostaining.
En primer lugar, el método descrito anteriormente puede utilizarse para visualizar directamente la morfología del cuerpo de la seta utilizando anticuerpos que reconocen Fasciculin 2 (Fas2) o genes del reportero expresados en el cuerpo de la seta neuronas34. Como se muestra en la figura 4A y 4B figura, Fas2 anticuerpos pueden utilizarse para visualizar el α, β y (en menor medida) lóbulos γ de los cuerpos setas en adulto Drosophila cerebros. Fas2 es una proteína de adhesión célula-célula necesaria para la fasciculación de la neurona y se expresa en altos niveles en la α y β lóbulos23,56,57, lo que es un marcador confiable y bien establecido de estos hongos neuronas del cuerpo. En particular, el cuerpo elipsoide con forma circular ubicado en la región central del cerebro adulto se puede también visualizar con este anticuerpo (figura 4A).
Defectos en proteínas Guía axonal causan a menudo incompleto penetrante cuerpo seta fenotipos mutantes15,34,35. Por lo tanto, en la mayoría de los casos, varios docena cerebros deben ser reflejados y analizados. Por ejemplo, los axones de lóbulo β de cuerpo de la seta de moscas nulas Nab2 inapropiadamente cruzan la línea media del cerebro. Este fenotipo de "fusión" lóbulo "crossing over" o β se observa típicamente en el ~ 80% de adultos Nab2 null vuela pero es principalmente ausencia de controles de tipo salvaje y se puede clasificar como leve, moderada o completa fusión34. La "fusión" de lóbulos β a través de la línea media el resultado de la incorrecta proyección contralateral de axones en el hemisferio opuesto del cerebro. Como se muestra en la figura 4C y detallada en34,35, fusión leve se refiere a lóbulos β conectados por un "filamento delgado de fibras Fas2-positivo," aunque moderada fusión se refiere a más lóbulos β substancialmente conectado muestran un grosor ligeramente menor del lóbulo en la línea media. Fusión completa (o «extrema») se refiere a lóbulos β que están totalmente conectadas y no mostrar ninguna disminución de espesor del lóbulo o Fas2 tinción en la línea media. El grado de fusión de cuerpo de la seta β del lóbulo puede ser cuantificado y muestra como se demuestra en 34,35 o como una tabla que muestra el porcentaje de cerebro que muestra cada tipo de defecto de morfología.
Además de coloración con los anticuerpos Fas2, MARCM técnica12,47,48 también puede utilizarse para visualizar las decisiones de orientación axón de neuronas individuales del GFP+ dentro de los lóbulos del cuerpo de la seta. MARCM utiliza la recombinación mitótica durante el desarrollo para crear neuronas individuales o clonally relacionados con grupos de neuronas, marcados con GFP (figura 5A). MARCM proporciona una manera de generar un pequeño número de neuronas que carecen completamente de una proteína dentro de una mosca de otra forma heterozigótica. Por lo tanto, esta técnica ha sido especialmente útil en el análisis de las funciones de Guía axonal de proteínas que también son esenciales para la viabilidad general de la12,47. Homocigóticas nulas neuronas marcadas con GFP se pueden comparar directamente para controlar neuronas marcadas con GFP en un fondo genético de tipo salvaje. Además, dependiendo de cuando en desarrollo de las larvas o pupas son sorprendido por el calor, diferentes clases de cuerpo de la seta las neuronas pueden ser dirigido (figura 5B).
Un ejemplo del tipo de datos generados con esta técnica se muestra en la figura 5C, donde el tipo salvaje (es decir, control) MARCM clones se generan como un ejemplo. Para generar las neuronas individuales del cuerpo de la seta de GFP+ que se muestra en la figura 5C, desarrollo de F1 larvas fueron alojadas inicialmente a 25 ° C. Aproximadamente 5-6 días después de la eclosión larval (ALH), pupas fueron calor conmocionado durante 30 min a 37 ° C y volvió a 25 ° C hasta la eclosión. Tras la eclosión de adultos, cerebros fueron disecados en PTN fijo y simultáneamente se incubaron con anticuerpos reconociendo Fas2 (1 4, diluido 1:20 en PTN) y GFP (diluido 1: 500 en PTN). Los cerebros fueron incubados con anticuerpos secundarios y montados en portaobjetos como se describió anteriormente. Células GFP+ se identificaron y fotografiada utilizando un microscopio confocal de escaneo láser y proyecciones de máxima intensidad se crearon con ImageJ. Como se demuestra en la figura 5C, control GFP+ las neuronas generadas en los lóbulos α y β colocalize con Fas2 y terminan antes de ponerse en contacto con la línea media que separa los dos hemisferios del cerebro de Drosophila . Proyectos de un solo axón anterior, bifurca y entonces proyecta tanto dorsal y medial que forma el α y β lóbulos. Varios estudios anteriores han utilizado esta técnica para investigar si ciertas proteínas se requieren para el estudio de división celular autónomamente para muchos aspectos de axonogenesis, extensión, incluso, pathfinding, ramificación y poda10, 11,12,13,14,15,16,17,34.
Además de los cuerpos de la setas, las decisiones de pathfinding axonal de neuronas fotorreceptoras retinianas (R-células) también se pueden visualizar utilizando el método de disección descrito arriba (así como por el de método de diseccióndescriben en la referencia48). Cada ommatidia dentro del ojo de la mosca contiene 8 neuronas fotorreceptoras que pueden clasificarse en tres grupos (figura 1): R1-R6 células, que se proyectan axones a la lámina superficial del cerebro óptico lóbulo; Células de la R7, que se proyectan axones a la capa más profunda de la M6 de la médula; y las células de la R8, que proyectan axones a la capa intermedia de la M3 de la médula19,58. El patrón de la proyección de cada clase de fotorreceptores se ha estudiado extensivamente y juntos estas neuronas han utilizado con éxito como un modelo para entender las vías de señalización implicadas en axón dirección19,59. Lo importante, los axones fotorreceptores se pueden visualizar fácilmente en los cerebros disecados de Drosophila immunostaining del adulto, pupa, o tejidos larvales usando un anticuerpo que reconoce a chaoptin, una célula superficial glicoproteína24, 60 , 61. genes del reportero expresando GFP o β-galactosidasa en cada tipo de célula R (R1-R6, R7 y R8 células) también se han construido y se puede utilizar para visualizar cada clase de fotorreceptores62. Puesto que cada tipo de célula de la R termina en una capa diferente del desarrollo lóbulo óptico, estos reporteros han permitido comparaciones detalladas de las vías de señalización necesarias para que cada tipo de célula encontrar correctamente su objetivo. En la figura 6se muestra un ejemplo de los patrones de expresión producida por dos de estos genes del reportero en combinación con la localización de chaoptin (que puede ser utilizado como un marcador de todas las neuronas fotorreceptoras). Para visualizar el R7 fotorreceptores, cerebros que contiene el gen reportero de R7-específicos Rhodopsin4-LacZ fueron disecados y teñidos con anticuerpos chaoptin y β-galactosidasa. Rhodopsin 4 (Rh4) se expresa concretamente en un subconjunto de R7 células63; el promotor Rh4 por lo tanto puede utilizarse para impulsar la expresión del gen reportero en sólo estas células. Como era de esperar, R7 células terminan en la capa más profunda de la M6 de la médula (marcada con una línea punteada amarilla figura 6). Del mismo modo, cerebros expresar β-galactosidasa de la promotora de la rodopsina 6 (Rh6), que se expresa específicamente en R8 fotorreceptores63, fueron disecados y immunostained con anticuerpos reconociendo chaoptin y Β-galactosidasa. Como se muestra en la figura 6, fotorreceptores R8 terminaron en la capa de R3 de lamédula. Aunque no se muestra aquí, Rh1-LacZ puede utilizarse para visualizar la terminación de los fotorreceptores de R1-R6 en la lámina.
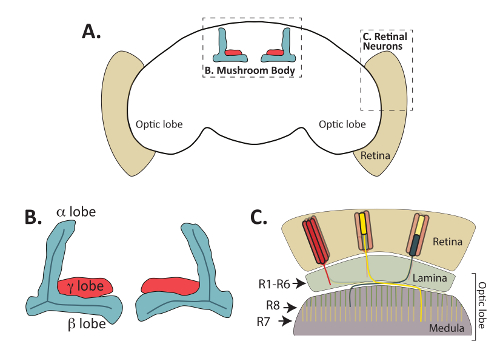
Figura 1: El adulto cerebro de la Drosophila melanogaster está conformada por las regiones funcionalmente distintas pero interconectadas. Se muestra el cerebro (A) un esquema de los adultos de D. melanogaster , destacando los cuerpos setas céntricos y las neuronas fotorreceptoras retinianas periféricas. (B) diagrama ampliado de los paquetes de axon de cuerpo adulto de la seta (también llamadas lóbulos) que son reconocidos por anticuerpos Fas2. Las neuronas intrínsecas de los cuerpos de hongos, llamadas células de Kenyon, proyecto axones anterior de cuerpos celulares ubicados dorsalmente (cuerpos celulares omitidos en este diagrama) y forma estructuras distintas del lóbulo. En el cerebro adulto, la forma de lóbulos (mostrado en rojo) γ de un solo paquete intermedio de axones, mientras que la dorsal α y β intermedio lóbulos (mostrado en azul) de un único axón bifurca durante el proceso de pathfinding. Α ' / β' neuronas desarrollan lóbulos axonales que parcialmente se superponen con los de las neuronas α/β, pero no son reconocidos por anticuerpos Fas2 y se omiten de este diagrama. Las neuronas retinianas (C) son fundamentales para transmitir información visual desde la retina hasta el lóbulo óptico. Proyecto de axones del cuerpo celular situado en la retina (beige) y forma conexiones con dianocitos postsinápticos en la lámina o médula. R1-R6 fotorreceptor células (mostradas en rojo) forma conexiones específicas con las células en la capa externa del lóbulo óptico, llamado la lámina. R7 fotorreceptor células sinapsis (amarillo) con objetivos en la capa de M6 de la médula, mientras que las células R8 (mostradas en verde) proyecto axones a la capa más superficial de la M3 de la médula. Parte C adaptado con permiso de Macmillan Publishers Ltd: Nature Neuroscience (referencia64, copyright (2011)). Haga clic aquí para ver una versión más grande de esta figura.
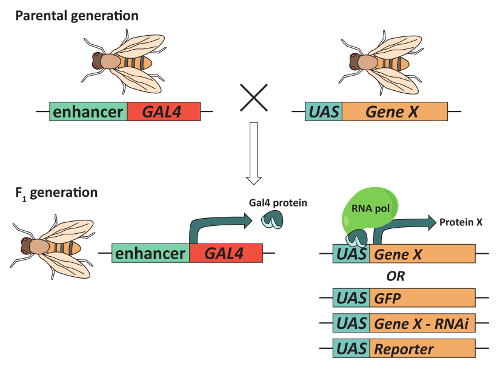
Figura 2: Sistema de GAL4/UAS el puede utilizarse para la expresión del gen objetivo. Para obtener moscas expresando un gen de interés ("Gene X") en un patrón específico de tejido, moscas deben contener un transgen expresando la proteína del activador transcripcional Gal4 bajo el control de un potenciador específico de tejido y un transgen que contiene el ADN de Gal4 enlace de secuencia (llamada la secuencia de activación Upstream o UAS) adyacente al gen X. normalmente, esta combinación se logra moscas los padres que cada uno contiene un transgen de apareamiento y selección de progenie de1 F que contienen. En la F1 generación resultante, Gal4 se expresará y se unirá a la UAS para activar la transcripción del Gene X de una manera específica de tejido. Lo importante, transgenes diferentes que contiene la UAS puede utilizarse en combinación con el mismo GAL4 «conductor». Por ejemplo, un transgene expresión de Gal4 en los cuerpos de la setas (MBs) puede combinarse con un transgén que contiene la UAS a GFP expreso, un transgen que derriba a la expresión de un gen de interés mediante RNA de interferencia o un transgen de UAS que produce un reportero. Haga clic aquí para ver una versión más grande de esta figura.
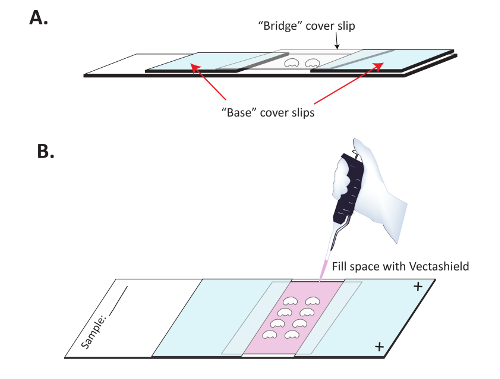
Figura 3 : Montaje de cerebros en preparación para la proyección de imagen de inmunofluorescencia. Cerebros (A) se montan en portaobjetos SuperFrost Plus con una cubierta del puente para evitar el aplanamiento de los cerebros. Dos cubreobjetos «base» se adhiere a un portaobjetos Superfrost Plus cargado positivamente, con esmalte de uñas transparente y cerebros disecados se colocan en el portaobjetos entre ellos. Un cubreobjetos claro "puente" se coloca por encima de los cerebros y adherido a las base cubreobjetos. (B) una vez haya secado el esmalte de uñas, Vectashield se pipetea lentamente bajo el puente para preservar la fluorescencia del anticuerpo secundario. Esmalte de uñas transparente se utiliza para sellar la parte superior e inferior de la hoja de cubierta de "puente". Haga clic aquí para ver una versión más grande de esta figura.
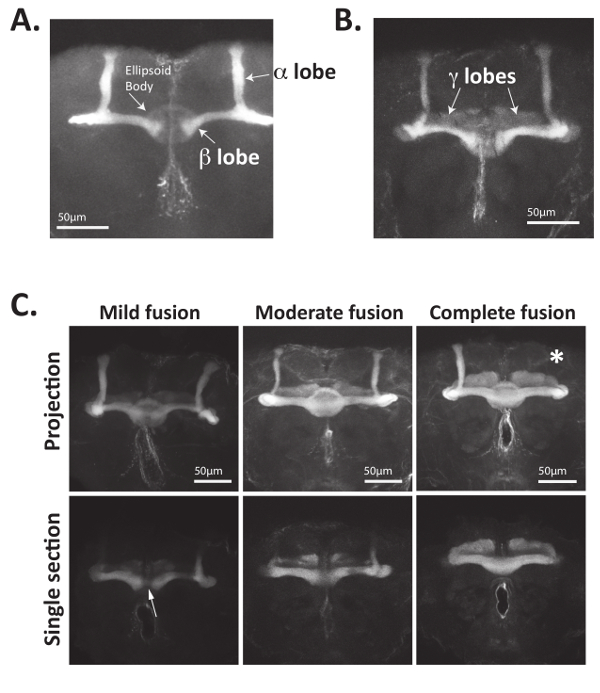
Figura 4: Axones del cuerpo de seta pueden visualizarse claramente utilizando anticuerpos que reconocen Fas2. (A) adulto Drosophila cerebros fueron disecados, fijo y se incubaron con anticuerpos reconociendo Fas2. Anticuerpos primarios fueron reconocidos usando los anticuerpos secundarios de cabra anti-ratón Alexa488 junto y cerebros fueron montados en portaobjetos con carga positiva y reflejada usando un microscopio confocal de escaneo láser. Bisymmetrically encuentra seta célula de cuerpo cuerpos axones extienden hacia delante, bifurcan y forman haces de axones (también llamadas lóbulos). Axones que forman los lóbulos β proyectándose medialmente y lóbulos α proyecta dorsalmente expresan Fas2. Críticamente, lóbulos β del salvaje-tipo vuela terminan antes de la línea media del cerebro. También se puede visualizar el cuerpo elipsoide situado el 4 en 1 anticuerpo. (B) intermedio-proyección γ lóbulo axones del cuerpo seta adultos de Drosophila también express Fas2 y pueden ser visualizados usando el 4 1 anticuerpo. Por lo general, la expresión de Fas2 en axones de lóbulo γ es menor que el de lóbulos α y β. (C) el cuerpo de la seta axones de cerebros Nab2 null (genotipo: Nab2ex3/Nab2ex3) mal proyecto contralateral y a menudo carecen de lóbulos. Nab2 nulo cerebro fueron disecado, fijo y manchado con el 4 1 anticuerpo para visualizar el cuerpo de la seta lóbulos α, β y γ. Se muestran las proyecciones de máxima intensidad Z-stack secciones ópticas así como individuales centradas en la zona media. Mientras que los axones de cuerpo de la seta tipo β del lóbulo raramente cruzan la línea media del cerebro, cerebros Nab2 nulo tienen cantidades variables de proyección errónea a través de la línea media en el hemisferio cerebral contralateral, resultando en lóbulos β "fundido". Como se define en referencias34,35, fusión suave se refiere a < lóbulos β con solo varios "hilos" de axones cruzan la línea media, moderada de fusión se refiere a situaciones donde las de neuronas del lóbulo positivo β de Fas2 cruzan el lóbulo cerebral media pero β se disminuye el ancho de la línea media, y fusión completa se refiere a situaciones donde no hay ninguna reducción de espesor de lóbulo β como los lóbulos cruzan la línea media del cerebro. Puesto que el cuerpo elipsoide también expresa Fas2, secciones ópticas mostrando la línea media suelen ser más útiles para visualizar la fusión de lóbulo β. En particular, falta de lóbulos también con frecuencia se observan (denotada aquí con el asterisco blanco). Datos en la parte C se utilizan en la cuantificación de los fenotipos del cuerpo de la seta de referencia34, con permiso. Haga clic aquí para ver una versión más grande de esta figura.
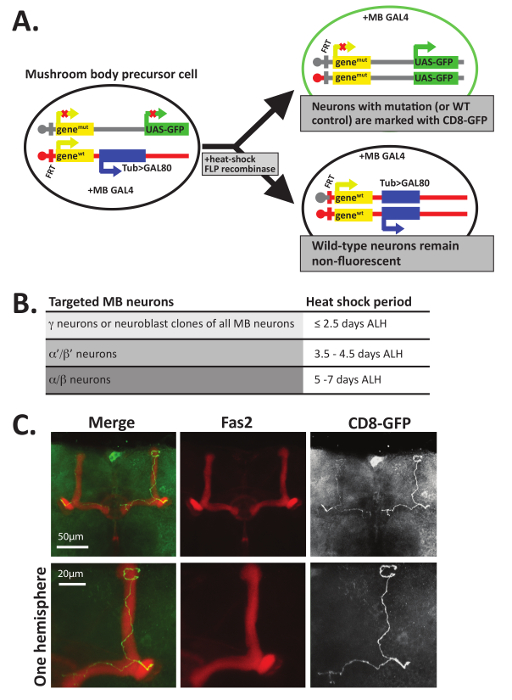
Figura 5 : MARCM puede utilizarse para visualizar los axones de las neuronas solo. (A) análisis de mosaico con una marcador de célula Repressible (MARCM) utiliza FLP recombinase-mediada mitotic recombinación en sitios FRT para crear dos células hijas distintas. En este ejemplo, todas las células contienen una proteína seta de GAL4 de cuerpo específico en un cromosoma separado. Tras la recombinación mitótica durante la división celular, una célula hija (arriba) expresa GFP (o límite de la membrana CD8-GFP) y contiene dos alelos del mutante de un gen de interés, mientras que la otra célula hija (abajo) hereda dos alelos de tipo salvaje (WT) y un transgénica expresando la proteína Gal80 utilizando un promotor de la tubulina. Gal80 inhibe Gal4, así las células produciendo Gal80 no fluorescente y deben ser homocigoto o heterocigoto de tipo salvaje. Sólo aquellas células que son GFP+ contiene dos copias del alelo del mutante. Tenga en cuenta que sólo uno de varios métodos para generar células GFP+ que también contienen dos alelos del mutante de un gen de interés se muestra; por favor vea12,45,56 para otros ejemplos. (B) puesto que el desarrollo de las neuronas del cuerpo de la seta se inicia con las neuronas γ y α'/ β' las neuronas y acaba con las neuronas α/β, cada clase de neurona selectivamente puede dirigido y visualizados por calor impactante en diferentes momentos del desarrollo. Como se describe en 12, un choque de calor de 40 min a 37 ° C que ocurre ≤2.5 días después de la eclosión larval (ALH) apuntará específicamente γ; las neuronas, mientras que el choque térmico que ocurre 3.5-4.5 días ALH (en la última etapa larval L3) destino α'/ β' las neuronas y un calor que o de choque ocurrir entre los 5-7 días ALH (durante el desarrollo pupal) centrará en las neuronas α/β. (C) los axones de tipo salvaje se visualizaron mediante MARCM. Pupas de tipo salvaje ~ 5-6 días (genotipo: hsFLP, UAS-CD8-GFP; FRT82B, UAS-CD8-GFP/FRT82B, tina > Gal80; OK107-GAL4/+) fue calor a 37 ° C durante 40 minutos inducir la recombinación mitótica. Cerebro fueron disecado, fijo y teñida con anticuerpos reconociendo GFP (1: 500) y Fas2 (1:20). Cerebro fueron incubado con anticuerpos secundarios fluorescencia etiquetados y visualizado por microscopía confocal. En este ejemplo de datos de un genotipo de "control", positivos células generadas usando MARCM tipo salvaje GFP y en vez de contener dos alelos de genesmut , contienen dos alelos de genesWT . Lóbulos β del cuerpo de la seta (visualizados mediante anticuerpos reconociendo Fas2) terminan antes de llegar a la línea media del cerebro; Las neuronas del lóbulo α también están presentes. Para mayor detalle, un zoom a la vista de un hemisferio del cerebro solo se muestra en la fila inferior de imágenes. Parte C fue adaptada con el permiso de referencia34. Haga clic aquí para ver una versión más grande de esta figura.
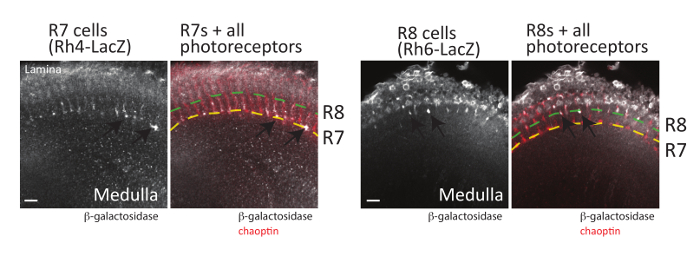
Figura 6 : Axones fotorreceptores pueden ser visualizados también. Cerebros de adultos expresando su β-galactosidasa en fotorreceptores R7 (a la izquierda, usando Rh4-LacZ) o fotorreceptores R8 (a la derecha, usando Rh6-LacZ) fueron disecados, fijo y se incubaron con anticuerpos reconocimiento de β-galactosidasa o chaoptin. Cerebro fueron incubado con anticuerpos secundarios fluorescencia etiquetados y visualizado por microscopía confocal de barrido láser. Se muestran secciones ópticas individuales de cada cerebro. A la izquierda, se observan varios axones fotorreceptores de R7 (flechas) en la capa más profunda de la M6 de la médula (se muestra por la línea punteada amarilla). A la derecha, axones fotorreceptores de R8 (flechas) terminan en la capa externa de la M3 de la médula (se muestra por la línea punteada verde). Desde R7 fotorreceptores expresan o Rh3 o fotorreceptores Rh4 y R8 expresan Rh5 o Rh663, todos los fotorreceptores R7 o R8 no se pueden visualizar mediante un solo gene del reportero LacZ . Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método de disección y visualización descrito anteriormente puede utilizarse en una amplia variedad de inmunotinción y aplicaciones en vivo. Han descrito un protocolo general de inmunotinción y han puesto de relieve una forma en la que MARCM permite visualizar la morfología axonal de neuronas del cuerpo individual de la seta. Además, estos procedimientos generales pueden utilizarse también para otras regiones del cerebro fija la proyección de imagen o adulto recién disecado cerebros48,65. En proyección de imagen puede proporcionar un enfoque más eficiente al analizar patrones de expresión de enhancer trampas, genes del reportero o imitador líneas66, por ejemplo. Para evitar capturar artefactos de muerte celular durante proyección de imagen viva de la GFP en el tejido no fijado, cerebros disecados en 1 x fosfato tampón salino (PBS) o HL3 media48, montados en portaobjetos de puente de 1 x PBS (o HL3) y reflejados en menos de 15-20 min cuidado deben adoptarse para eliminar tanto tráquea como sea posible del cerebro disecados antes de la proyección de imagen, ya que puede interferir con la visualización de la fluorescencia de GFP.
Mientras que condiciones de tinción para la evaluación de la morfología de las neuronas cuerpo y fotorreceptor setas están relativamente bien establecidas24,61,67, la localización de una proteína específica de interés en estas células tipos pueden requerir optimización y solución de problemas extensa. En particular, varios pasos críticos, incluyendo la dilución del anticuerpo, tampón componente concentración bloqueo y fijación, deben ser optimizados para generar los resultados más reproducibles y fiables. En primer lugar, debe determinarse la concentración óptima del anticuerpo primario. Aunque anticuerpos disponibles en el mercado suelen tienen una dilución sugerida (y a menudo inicialmente empezamos por esa concentración), estos valores rara vez determinados empíricamente en los tejidos de la Drosophila . Por lo tanto, probando una serie de diluciones del anticuerpo primario que gama por encima y por debajo de la propuesta inicial del fabricante a menudo resulta en manchas más específica. Mientras que la dilución del anticuerpo primario puede tener un efecto significativo en la coloración de precisión y debe determinarse precisamente, se incuban los cerebros de la época en que contiene el anticuerpo primario soluciones pueden variar considerablemente con poco efecto sobre el resultado global. Por ejemplo, hemos observado resultados similares cuando incubando diseccionado cerebros con el anticuerpo primario Fas2 anticuerpo para dos, tres o incluso cuatro días a 4 ° C. Aunque recomendamos al menos dos noches, también hemos incubado cerebros en la solución de anticuerpo primario para una sola noche y obtuvo tinción reproducible. Lo importante, limitando la cantidad de tiempo que los cerebros se incuban en el anticuerpo secundario a 3 h a temperatura ambiente (o una noche a 4 ° C) permite a fijación de límite no específica de anticuerpos secundarios tejido cerebral.
En segundo lugar, puede ser necesario utilizar reactivos adicionales de "bloqueo" para eliminar señales de fondo no deseados. Las opciones incluyen aumento de la concentración de NGS a ~ 10%, agregar 1-10% albúmina de suero bovino (BSA) al bloqueo y primario y secundario soluciones de anticuerpos, o la adsorción de anticuerpos primarios durante la noche a 4 ° C con Drosophila embriones (véase de referencia68, sección 2.9, paso 3).
Mientras que hemos escrito el anterior protocolo usando RTP como el búfer sugerido para la fijación de todos, colada y pasos de incubación de anticuerpos, fijación del tejido en otros búferes (como PLP y PEM, indicados en la Tabla de materiales) puede resultar en diferencias profundas en intensidad de la señal. Por ejemplo, estudios anteriores han demostrado que la ciclina E es indetectable en los discos imaginales larvas cuando los tejidos se fijan en paraformaldehído al 4% de tradicional diluido en PBS, pero es claramente visible cuando los tejidos se fijan en tampón de PLP (Ken Moberg, personal comunicación y referencia69). Además de los cambios en el búfer de componentes, alterando el tiempo y la temperatura de fijación del tejido también significativamente puede afectar inmunofluorescente tinción y puede determinarse empíricamente si es necesario. En general, tiempo de fijación debe ser lo suficientemente largos para permitir la reticulación suficiente de componentes celulares y mantenimiento a largo plazo de morfología general celular estando limitado lo suficiente para evitar la sobre-reticulación y "enterrar" de epítopes de la proteína. Por lo tanto, cuando inicialmente optimizar condiciones de tinción para un anticuerpo primario recién adquirida, generalmente limitar el tiempo de fijación para aproximadamente 20 minutos y a menudo va a arreglar los tejidos a temperaturas más frías.
Varios controles deben incluirse en cualquier experimento de inmunofluorescencia para investigar la especificidad de los anticuerpos primarios y secundarios, así como el efecto de los transgenes/genética en el fenotipo observado. Para comprobar si el anticuerpo primario se utiliza específicamente reconoce la proteína de interés, tejido de moscas que carecen de esta proteína o tejido overexpressing la proteína debe ser incluido como controles. También se pueden incluir la adición de exceso proteína purificada para determinar si el anticuerpo primario reconoce otros epítopes en el cerebro de mosca. Por último, cualquier señal fluorescente cuando se omiten los anticuerpos primarios representa el nivel de fijación no específica de los anticuerpos secundarios seleccionados.
También deben incluir varios controles importantes para evaluar la contribución de la genética o la presencia de los transgenes a la intensidad de la tinción o morfología neuronal. Por ejemplo, las moscas utilizadas en el experimento MARCM en la figura 5 contienen múltiples transgenes (hsFLP, UAS-CD8-GFP, FRT82B, tina > GAL80 y OK107-GAL4), cada uno de los cuales debe ser analizado por separado para efectos en la morfología del cuerpo de la seta. En una morfología de cuerpo mínimo, seta de las moscas que contengan OK107-GAL4 y UAS-CD8-GFP debe analizarse. También puede ser necesario evaluar el efecto del choque del calor y producción de recombinase de Flp en el desarrollo del cuerpo de la seta analizando vuela que contiene hsFLP y FRT82B. Aunque MARCM puede proporcionar la penetración importante en si una determinada proteína controla autónomamente la Guía axonal, el número de controles necesarios para realizar con precisión esta conclusión puede ser una menor limitación de esta técnica. En los experimentos menos complicados, controles similares también son aplicables. Por ejemplo, tomar un experimento donde el sistema de GAL4/UAS se está utilizando en combinación con un transgén ARNi a precipitación expresión de una proteína de interés en todas las neuronas. En este experimento, por lo menos dos transgenes estará presentes: un conductor GAL4 pan-neuronal, elav-GAL4, como el transgén UAS-ARNi . La morfología de las neuronas del cuerpo de la seta de moscas que contiene cada uno de estos transgenes solo debe investigarse además de la condición experimental donde moscas albergan tanto los transgenes en la mosca de la misma.
Finalmente, para determinar si la proteína de interés se expresa en las neuronas del cuerpo de la seta es generalmente necesario cerebros mancha Co con anticuerpos para Fas2. Por otra parte, proteínas fluorescentes como GFP y RFP la membrana destino CD8-GFP también puede expresarse utilizando el sistema de GAL4/UAS y utilizado en combinación con anticuerpos reconocer la proteína de interés. Desde Fas2 sólo reconoce los axones fasciculados que forman los lóbulos α y β del cuerpo de la seta, el uso de GAL4-conducido, unida a la membrana CD8-GFP ha sido especialmente útil para marcar las neuronas del cuerpo de la seta.
Defectos en la Guía axonal a menudo no son 100% penetrante y cerebro incluso del mismo genotipo puede mostrar cierta variabilidad. Por lo tanto, cuando analizando nuevamente genera alelos del mutante para defectos en el cuerpo de la seta o pathfinding fotorreceptor, debería utilizarse una combinación de alelos diferentes y enfoques. Mayoría de los estudios en la literatura utiliza varios métodos para investigar si una proteína desempeña un papel autónomo de la célula en el control de Guía axonal: i) análisis de pathfinding defectos homocigóticos moscas nulas (preferentemente utilizando diferentes nualelos de ll), ii) análisis de pathfinding defectos de moscas que carecen de la proteína de interés sólo en las neuronas (generalmente vía RNAi), iii) análisis MARCM de pathfinding defectos y iv) rescate de experimentos donde el gen es volver a expresado en las neuronas de homocigotos nulos vuela. Idealmente, deben analizarse varios docena cerebros por genotipo por defectos en la morfología neuronal.
Aunque el protocolo descrito aquí sobre todo se centra en localización inmunofluorescente de proteínas dentro del tejido fijo, se están desarrollando varias futuras aplicaciones de esta técnica al tejido fino del cerebro en imagen. Una vez que los cerebros se disecan (generalmente en medios de cultivo celular), pueden entonces ser cultivadas durante varios días a 25 ° C. Estos métodos de cultivo ex vivo se están desarrollando con el fin de investigar una amplia variedad de procesos biológicos, como la actividad de la proteína que promueve la regeneración del axón siguiendo lesión70,71, intracelular señalización dinámica72y73de desarrollo neuronal.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Nos gustaría agradecer a Changhui Pak y Alysia Vrailas Mortimer inicialmente enseñanza SMK la técnica de disección del cerebro. También agradecemos a los miembros del grupo de lab de Ken Moberg, especialmente Chris rondas, para leer críticamente el manuscrito. Anticuerpos reconociendo Fas2 (1 4) y chaoptin (24B10) se obtuvieron del Banco de hibridoma de estudios del desarrollo. Anticuerpos 24B10 se depositó a la DSHB por Seymour Benzer y Nansi Colley24,60,61, anticuerpo 1 4 se depositó a la DSHB por Corey Goodman 22,23,56. Las poblaciones de mosca se obtuvieron desde el centro de Stock de Bloomington. También queremos agradecer al Ohio Agricultural Research y desarrollo centro (OARDC) MCIC Imaging Center, para el uso del microscopio confocal para obtener imágenes del cerebro en la Figura 4A y B. SMK es apoyado por una beca de la NICHD (1 R15 HD084241-01A1).
Materiales
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
Referencias
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados