Method Article
Diseksiyon ve mantar vücut immünfloresan boyama ve yetişkin Drosophila melanogaster beynindeki nöronlar Photoreceptor
Bu Makalede
Özet
Bu iletişim kuralı diseksiyon ve yetişkin Drosophila melanogaster immunostaining açıklar beyin dokuları. Özellikle, bu iletişim kuralı doğru nöronal gelişim birçok yönlerini temel genel prensipler ortaya çıkarmak için kullanılabilecek örnek nöronal alt kümeleri olarak Drosophila mantar beden ve photoreceptor nöronlar kullanımı vurgulamaktadır.
Özet
Sinir sistemi gelişimi çeşitli sinyal yolları ve düzenleyici ağları tarafından koordine olayları sıralı bir dizi içerir. Birçok bu yollar dahil proteinlerin örümceklerle memeliler ve meyve sineği Drosophila melanogasterbenzer organizasyon ilkeleri bunlar geliştirilmesi sırasında bulunduğunu düşündüren, gibi diğer Ökaryotlar arasında korunmuş organizmalar. Önemlisi, Drosophila neurogenesis, farklılaşma, aksonlar rehberlik ve synaptogenesis de dahil olmak üzere memelilerde gereken işlemlerini düzenleyen hücresel ve moleküler mekanizmaları tanımlamak için yaygın olarak kullanılmıştır. Sinekler de başarılı bir şekilde insan nörogelişimsel hastalıkları çeşitli modellemek için kullanılmaktadır. Burada adım adım mikrodiseksiyon, fiksasyon ve yetişkin Drosophila beyin içinde proteinlerin immünfloresan yerelleştirme için bir protokolü açıklar. Bu protokol iki örnek nöron popülasyonları, mantar vücut nöronlar ve retina photoreceptors odaklanır ve bireysel mantar vücut nöronlar Repressible hücre işaretçisi (MARCM) tekniği ile mozaik analizi kullanarak izlemek için isteğe bağlı adımları içerir. Hem vahşi tipi ve mutant beyin örnek verilerden bir puanlama ölçütünü aksonal rehberlik kusurları için kısa bir açıklama ile birlikte gösterilir. Bu iletişim kuralı mantar vücut morfolojisi soruşturma için iki köklü antikorlar vurgular ve photoreceptor nöronlar, diğer Drosophila beyin bölgeleri ve diğer beyin bölgeleri içinde proteinlerin yerelleştirme da olabilir Bu iletişim kuralını kullanan araştırıldı.
Giriş
Drosophila sinir sistemi insanlar ve kemirgenler, karmaşıklığı daha iyi anlamak, omurgalı karşıtları için güçlü ve ulaşılabilir bir modelini sağlayan daha küçük olmasına rağmen. Birçok durumda, omurgalı ve sinekler genleri sinir sistemi gelişimi mekanizmaları dikte çok benzer protein kodlamak. Aslında, birçok gen omurgalılarda nöronal gelişim için de dahil olmak üzere, sinekler orthologs sinyal yollar bu denetim desenlendirme, neurogenesis ve aksonal rehberlik1,2,3 bu işe gerekli ,4,5. Örneğin, netrin bir ligand memeliler ve D. melanogaster6,7,8' aksonal rehberlik için gerekli olur. Netrin ilk olarak embriyonik piliç beyin doku6izole iken, sonraki çalışmalar bu netrin korunmuş bir rol oynar embriyonik merkezi sinir sistemi (MSS) geliştirilmesi sırasında Drosophila8' ortaya çıkardı. Diğer çalışmalar genetik ekranlar embriyonik Drosophila içinde CNS korunmuş ligandlar ve reseptörleri Drosophila ve omurgalıların9bunun için gerekli belirlemek için kullandık.
Embriyonik anında CNS kapsamlı bir şekilde geçmişte ligandlar, reseptörleri ve hücre içi sinyal proteinleri aksonal rehberlik8,9için gerekli belirlemek için kullanılmıştır iken, son iş hangi birçok şekillerde araştırmış Bu proteinler de geliştirme daha sonraki aşamalarında bunun kararları denetler. Özellikle, soruşturma mantar vücut (MB) ve retina photoreceptor nöron geliştirme (şekil 1) mekanizmaları içgörü bu denetimi kılavuz, sinaps oluşumu, akson budama ve çeşitli diğer yönleri nöronal sağlamıştır geliştirme10,11,12,13,14,15,16,17. Photoreceptor nöronlar sinek retina lamina denilen yetişkin beyin bölgelerine bağlanmak ve medulla ve mantar vücut nöronlar ise beyin, (18,19tarafından gözden) görsel bilgi geçişi için kritik vardır Merkezi olarak sinek beyinde bulunan ve öğrenme ve hafıza20,21için gereklidir. Photoreceptor nöronlar ve içsel nöronlar Kenyon hücreleri denilen mantar organlarının Post sinaptik hedefleri bulmak için evrimsel korunmuş diffusible ve ilgili kişi-bağımlı aksonal rehberlik mekanizmaları kullanmaktadır. Yetişkin sinekli görünür olmasının yanı sıra, photoreceptor ve MB nöronlar da doğrudan larva ve pupa antikorlar veya muhabir gen22,23,24,25ile görüntülenmeyecektir. Yetenek kolayca farklı gelişim zaman noktalarda nöronlar bu iki kümesi görselleştirmek için nöronal gelişim birçok yönleri için süper model olarak bunların kullanımı teşvik etmiştir.
Bir model olarak normal sinir sistemi gelişimi mekanizmaları anlamak için kullanılan ek olarak, son yıllarda yapılan çalışmalarda sinekler de insan hastalıkları, kırılgan X Sendromu (FXS)26 da dahil olmak üzere çok çeşitli doğru modelleri hizmet verebilir göstermiştir , Fikri Engellilik (ID)27,28,29,30,31ve diğerleri32. Örneğin, ZC3H14 moleküler işlevinin çalışması için son zamanlarda insan Fikri Engellilik için bağlantılı bir gen biz sinek manken Nab230denilen anında ZC3H14 ortholog, bir null alleli kullanarak kimliği oluşturdu. Nab2 eksik sinekler ciddi hafıza bozuklukları ve Poli(a) kuyruğu genişletilmiş, ne recapitulating insan hastalarda gözlenen veya hasta hücre hatları33,34türetilmiş. Önemlisi, sinekler Nab2 de eksik onların yetişkin mantar organları34, FXS Sendromu gen FMR135eksik sinekli gözlenen için benzer şiddetli beyin Morfoloji hataları görüntüler. Böylece, sinekler normal beyin gelişimi ve bunu bozmaya hastalıkları eğitim için önemli model organizma hizmet verebilir.
Son olarak, davranışı, genetik araçlar, geniş dizi ile birlikte izlemek için yüksek aktarım yöntemleri erişilebilirlik olun Drosophila bir model organizma gibi karmaşık davranışlar, kontrol beyin bölgeleri tanımlamak için tercih öğrenme ve bellek, uyku, Kur yapma, susuzluk ve diğerleri36,37,38,39. Bir sinek genetikçi'nın "araç kutusu" merkezinde bir özellikle yararlı bir araç (Şekil 2) GAL4/UAS sistemidir. Bu sistem40,41 Gal4 transkripsiyon harekete geçirmek doku belirli ifade genleri veya transgenes aşağı, bir yukarı etkinleştirme sıra (UAS) ifade artırmak için kullanılır. Bu sistemin değişiklikler, örneğin, tam olarak kontrol uyarılabilirlik belirli nöronlar42,43, overexpress veya knock-down belirli genler faiz44, , araştırmacılar izin 45, gerçek zamanlı kalsiyum dynamics in vivo46çözümlemek ve hızlı reporter genler nöronal soy41işaretlemek için. Mitotik rekombinasyon de mozaik analizi ile bir Repressible hücre işaretçisi (MARCM) sistem12,47yaratılması için izin GAL4/UAS sistemiyle birleşimi. MARCM kapsamlı tek nöron izleme aksonal rehberlik12,47için gereken hücresel sinyal bileşenlerini tanımlamak için kullanılmıştır. Bunlar ve diğer teknikleri değerli bakış açısı çok sayıda sinir sistemi işlevi için gerekli hücresel mekanizmaları üzerinde sağlanan rağmen çoğu Drosophila beyin ilk disseke gerekir; dikkatli kaldırma beyin beyin bölgeleri arasında doğru beyin morfoloji ve bağlantı desenleri korumak için gereklidir. Aşağıdaki iletişim kuralı olarak mantar beden ve photoreceptor nöronlar kullanırörnek olarak nöron popülasyonları diseksiyon ile yol gösterir ve immünfloresan yetişkin boyama Drosophila beyin.
Protokol
1. drosophila melanogaster genetik ve isteğe bağlı ısı şok yordamlar
- Bir kez sinekler geçti ve F1 döl yumurtadan, kadın ve/veya uygun genotip erkek elde edilir. Soruşturma altında beyin bölgesi bağlı olarak sinekler her gün toplanması ve böylece beyin bağlantısı yaş bağımlı ve/veya cinsel şekilli desen daha kolay ayırt edilebilir seks tarafından ayrılmış.
Not: İsteğe bağlı: sinekler bir Repressible hücre işaretçisi (MARCM) analizi 12 , 47, embriyo, larvaları ile mozaik analiz için kullanılmaktadır, ya da pupa ısı 30-45 dk 37 ° C'de şok olmalı Mitotik rekombinasyon neden. MARCM analiz için mantar organlarının belirli bölgeleri hedeflemek için şekil 5 ' te B ana hatlarıyla ve 12 tarafından belirlenen zamanlamaya göre ısı şok zaman. MARCM beyin bölgeleri mantar organları dışında araştırmak için kullanılıyorsa, pilot deneyler ısı şok olmak en iyi sahne belirlemek için yapılmalıdır. Belgili tanımlık merdiven aşağı konuda yazılmış olsa da eclosed uçar, pharate yetişkin de disseke pupa durum kaldırıldıktan sonra aşağıdaki adımları kullanarak.
2. Diseksiyon istasyonu hazırlık
- stereomicroscope ve ışık kaynağı ile konum bağlı fiber optik goosenecks üzerinde büyük bir benchtop. Sürekli el hareketleri teşvik etmek ve azaltmak el " sallamak " diseksiyon sırasında yeterli el ve kol dinlenme alanı mevcuttur mikroskop için önemlidir. Mikroskop ve 4-6 inç mikroskop Bankası tezgah kenarı arasındaki iki tarafında yaklaşık 8-10 inç olduğundan emin olun. Bir cam
- dolgu 2 veya 3 Kuyu PTN arabelleği 1.0 mL ile 9-şey veya 3-iyi yemek (0.1 M sodyum fosfat tampon pH 7.2, % 0,1 Nonyonik yüzey aktif, tam arabellek bileşenleri için malzemeler tabloya bakınız) ve yer yanında bulunuyor parçalanmış buz üzerinde. Yeni disseke beyin bu yemek için transfer ve fiksasyon adım kadar saklı.
- Not: canlı görüntüleme gerekiyorsa, diseksiyon arabellek fosfat tamponlu tuz (PBS) veya HL3 arabellek 48 x 1 olmalıdır. İntraselüler protein yerelleştirme gerekiyorsa, PBS de alternatif bir tampon olarak diseksiyon ve fiksasyon için kullanılabilir. Fiksasyon, hücre zarları permeabilization sonra gerçekleştirilmesi PTN yıkar %0,1 veya % 0,3 Noniyonik deterjan içeren kullanarak.
- PBS diseksiyonu ve fiksasyon için kullandıysanız, pipet ipuçları deterjan içeren bir arabellek (örneğin PTN) ile durulanır en az bir kez beyin microcentrifuge tüpler transfer sırasında plastik pipet ipuçları yapışmasını önlemek için olmalıdır.
- Bir boş 35 mm cam veya plastik petri dish, kullanarak oluşturmak bir silikon elastomer içeren bir diseksiyon yemek. Kısaca, üretici göre elastomer bileşenleri karıştırmak ' s yön, 35 mm yemeklerin dökün ve bir gecede düz bir yüzeye polimerize sağlar. Diseksiyon yemekleri içeren elastomer forseps forseps ve bir cam tabak gibi sert bir yüzeye arasında iletişim yapılırsa hangi kolayca hasar görebilir, anatomi iyi ipuçları korumak için kullanılır. Biz de düzenli olarak online perakendecilerin ticari olarak mevcut silikon kaplı yemekleri satın alma. Inaktif kömür (ve böylece renkli siyah) içeren silikon elastomer diseksiyon yemekleri kontrast diseksiyonu sırasında artırmak için özellikle yararlı.
3. Yetişkin beyin diseksiyon yordam
- Anesthetize 3-5 gün eski yetişkin D. melanogaster CO 2 ile veya kullanarak buz. Buz kullanılıyorsa, sinekler baş aşağı içeren flakon (Tak son aşağı) içine buz kovası ~ 5 dk. şişe buz baş aşağı koyarak engeller yer gıda teslim olma uçar. Bir kez sinekler anestezi, sinekler üzerinde bir soğuk metal yüzey veya petri kabına oturan buz veya sinek pad yayan bir CO 2 yerleştirin. Eğer ateş analiz etmek için beyni anatomi, büyük sinekler de kullanılabilir.
- PTN oluşturmak için bir transfer pipet veya p200 pipet kullanarak diseksiyon çanak merkezinde, küçük bir miktar (150-200 µL) yer bir " kabarcık " PTN in. Stereomicroscope altında diseksiyon tabak yerleştirin ve aydınlatma ayarlayın ve böylece PTN balonu görüş alanı doldurur ve düzgün aydınlatılmış odaklanmak.
- Böylece onlar işlemek sinekler " kadar göbek " (Yani, ventral tarafı yukarı) metal veya CO 2 yastık üzerinde yatarken.
- Kullanarak bir çift #5 forseps, kavramak disseke ve anında tutun tutmak tamamen bu PTN diseksiyon çanak üzerinde daldırın için bir sinek karın.
Not: baş PTN içinde sular altında iken protokol geri kalanı için tüm adımlar gerçekleştirilmelidir. - #5 forseps ikinci bir çifti kullanarak, sinek hortum Bankası kavrayın ve forseps ayrı vücuttan sinek kafa ayırmak için iki çift çekin. Karın ve göğüs atmak. Bu adım sırasında bu kafa değil serbest bırakmak ve PTN yüzeyinde gezmek için izin önemlidir. Bir kez başından yüzen, yine beyin ezme olmadan kavramak zor olabilir.
Not: Bu yöntemi kullanarak, beyin ve ventral sinir kablosu arasındaki bağlantıları kopmuş. MSS bu bölgeler arasındaki sağlam bağlantıları gerekliyse, 49 , 50 gibi bir alternatif diseksiyon protokolü takip edilmelidir. Baş kaldırılmadan önce hortum sinek baştan çıkarır, hortum neredeydi bir delik olacak. Bu durumda, bir eye yakınındaki deliğin kenarında sinek kafa kavramak. Sonra başından forseps dışında bir başka iki çift kablolarıylaberaber orta miktarda güç kullanarak kaldırın. Bazen, kafa vücuttan çıkarıldığı zaman, gut ve/veya ventral sinir kordonu kalır kafasına bağlı ve diseksiyon devam etmeden önce kaldırılması gerektiğini.
Forseps bir çift hortum kavrıyor ise - , ikinci çift şu sinek göz medial kenarı kavramak gerekir. Yavaş yavaş, bir başka dışında forseps çek. Bu adımı sabit yanal kuvvet küçük bir miktar ile yapılmalıdır. Forseps yavaş yavaş dışında bir başka hareket ettirdiğinizde, hortum uzak kafanı çıkar ve merkezi bir delik kafa kütikül oluşturmanız gerekir. İkinci Çift sağ gözünden medial kısmı bırakmadan forseps ilk çifti ile hortum atın.
Not: Yetişkin D. melanogaster beynidir Kaudal (Yani, arka/arka) bölgesinin sinek. Böylece, o bölgesinin açgözlü kaçınılmalıdır. İdeal olarak, yalnızca rostral (Yani, açık) medial retina yakınındaki baş kısmını doğrudan kavradı tarafından forseps. Beyin ve ilişkili Trakea artık manikür orta delikten görünür olmalıdır. Şu anda, delikten nefes borusu çıkıntılı herhangi bir beyaz kılçıklı konu kaldırıldı ve atılan. - (Baş kütikül Merkez delik kenarındaki) sol retina medial kenarı forseps ikinci çifti ile kavramak. Retina ve ilişkili kütikül kaldırmak için yavaş yavaş birbirlerine uzak forseps 180 ° açıyla çekin. Retina temel optik LOB ayrışıp gibi gerilim hafif bir düşüş hissetmeniz gerekir. Yavaş yavaş optik LOB yırtılma önlemek için devam.
Not: forseps, çok hızlı bir şekilde bu adımı sırasında ayıran th yırtılma sonuçlanabilire optik LOB veya kesintileri mantar vücut yapıları. Zaman zaman, manikür kaldırılacak ancak retina adet optik LOB bağlı kalır. Mantar cesetleri Imaging, tüm retina kaldırmak gerekli değildir. Ancak, diğer beyin bölgeleri (gibi retina nöron innervasyon optik beyin LOB) analizini 48 , 51 tarafından açıklandığı gibi tamamen kaldırılacak retina gerektirebilir.
Not: retina yavaş yavaş beynin temel optik LOB ayrılır, optik LOB observable beyaz, kılçıklı trake ile kaplı bir opak beyaz yapısı olarak olmalıdır. Bir retina kaldırıldıktan sonra göz ardı. Kılavuz retina nöronların analiz ederken, belirli bu adımı sırasında optik lobe hasarı önlemek için özen gösterilmelidir. Ek bir protokol diseksiyon üzerinde duruldu ve canlı görüntüleme photoreceptor nöron da kullanılabilir 48. - Şimdi, dikkatli bir şekilde mümkün olduğunca görünür Trakea daha fazla çıkarın. Trakea zaten içeriyor veya daha sonra hava, float ve büyük olasılıkla, daha sonra immunostaining adımları sırasında kayıp beyin neden ile doldurun. Trakea kaldırmak için #5 forseps çok keskin bir çift kullanarak beyin off al.
- Kalan retina ve çevresindeki kütikül sol sinek retina medial bölge kavramak için her iki çift forseps kullanarak kaldırın. Dikkatle retina retina ve kütikül parçalarını kaldırmak için ikiye gözyaşı. Bazı durumlarda, özellikle zorlu beyin ezme olmadan kalan kütikül kaldırma kanıtlıyor. Bu gibi durumlarda, forseps diğer çifti dikkatle manikür sonunu kaldırmak için kullanıldığı gibi ventral sinir kordonu kalan ipliklerini yerine forseps bir çift tarafından anlaşılacak bulduk.
- P200 pipet hareket ettirmek istimal disseke beyin PTN içeren 9 - veya 3-da yemek bir şey için. Aynı genotip beyinlerinin de aynı birlikte havuza alınmış ve buz tuttu. Beyin dokusu diseksiyon bir saat içinde sabit olmalıdır. Beyni küçük gruplar halinde sabit ve beyin daha çok sayıda gerekliyse havuza alınmış. Birçok durumda, deneyimli bir araştırmacı genellikle bir beynini incelememize ve cam koleksiyonu çanak yaklaşık 3-5 dak transfer
4. Fiksasyon ve immünfloresan boyama prosedürü
- p200 pipet kullanarak, disseke beyin PTN içinde seyreltilmiş %4 paraformaldehyde 0.5 mL ile dolu bir 0.5 mL microcentrifuge Tube 9-iyi yemek transfer. Aynı genotip beyinlerinin en az 10-15 bir microcentrifuge tüp içine birleştirilebilir. 0.5 ml microcentrifuge tüplerde (kadar beyin slaytlar üzerine montajı) tüm kalan adımları tamamlanır.
Dikkat: Paraformaldehyde (PFA) bir duman mahallede ele alınmalıdır. İngiltere'de yılın atık kaydedilir ve düzgün pislikleri atmak için kullanmamıştım. cam ampul içinde satın alınan % 20 paraformaldehyde microcentrifuge tüpler içine bölünmemeli ve saklı-20 ° c kadar gerekli olabilir. - Bir duman başlık içinde oda sıcaklığında sallanan yavaş hızı ile %4 paraformaldehyde 20 dk için beyinlerinde kuluçkaya.
- Fiksasyon beyin yerçekimi tarafından microcentrifuge tüp altına yerleşmek izin.
Not: Bazen, beyin microcentrifuge tüp tarafına yapışabilir. Bu durum ortaya çıkarsa, yanal başparmak ve işaret parmağı arasında tüp döndürmek veya tüp beyni batan tanıtmak için tezgah üzerinde hafifçe dokunun genellikle yardımcı olur. - Kaldır sabitleştirici bir p1000 kullanarak pipet ve iki gerçekleştirmek " hızlı " yıkar 500 µL PTN, beyin yıkama arasında microcentrifuge tüp altına yerleşmek izin ile. Tüm beyin tarafından yerçekimi microcentrifuge tüp altına yerleşmiş bir kez bu hızlı yıkama sırasında PTN hemen taze arabelleği için değiştirilebilir; hiçbir ek yıkama zamanı gereklidir.
Not: Genellikle, tüpe ilave arabellek bırakarak beyin kaldırma riske için tercih edilir. Pipet ucu dikkatli muayene genellikle beyinsiz tüp sizden yanlışlıkla kaldırılmıştır emin olmak için gereklidir. Beyin belgili tanımlık uç pipetted kaza olması gerekir, onları geri microcentrifuge tüpüne dağıtmak, yerleşmeye beynim bekleyin ve kalır herhangi bir ilave PTN kaldırmaya devam. - Son hızlı yıkama sonra üç gerçekleştirmek için p1000 pipet kullanın " uzun " yıkar: bir rock'çı / nutator üzerinde oda sıcaklığında PTN ve yıkama 20 dk için 500 µL ekleyin. Gelecekteki tüm " uzun " yıkar 20 dakika için olmalıdır.
Not: Bu yıkar, beyin sabit takip gecede PTN 4 ° C'de depolanmış olabilir. - P1000 pipet kullanarak son yıkama kaldırmak ve kuluçkaya beyin bir rocker veya nutator, oda sıcaklığında en az 30 dakika oda sıcaklığında için çözüm [PTN + % 5 normal keçi serum (NGS)] engelleme 0.5 ml.
- Keçi ikincil antikorlar sonraki Protokolü adımda kullanılacak. Başka bir tür ikincil antikorlar kullanılacaksa bu tür (yerine NGS) normal serum engelleme ve antikor çözümlerinde kullanılmalıdır.
- P1000 pipet kullanarak, engelleme çözüm kaldırın ve PTN (PTN + %5 NGS + seyreltilmiş birincil antikor) seyreltilmiş birincil antikor ekleyin. Birincil bir antikor ilk kez kullanırken, bu antikor en uygun seyreltme ampirik olarak tespit edilmelidir.
Not: mantar vücut nöronlar görüntülenmesi için Fas2 tanıma antikorlar genellikle kullanılır. Bu antikorlar antikor 1 d 4 gelişim çalışmaları Hibridoma banka (DSHB) üzerinden kullanılabilir ve sulandırılmış 1:20 PTN + % 5 olmalıdır NGS.
Not: photoreceptor nöronlar görüntülenmesi için chaoptin tanıma antikorlar genellikle kullanılır. Chaoptin antikor DSHB antikor 24B10 olarak kullanılabilir ve sulandırılmış 1:20 PTN + % 5 olmalıdır NGS.
Not: Fiksasyon işlemi genellikle floresan yeşil flüoresan protein (GFP) gibi floresan protein üzerinden ortadan kaldırır. Bu nedenle, MARCM aksonal rehberlik bireysel MB nöronların analiz etmek için kullanırken, GFP tanıma bir antikor kullanın. - 2-3 gece 4 birincil antikor çözüm üzerinde bir rocker/nutator beyinlerinde kuluçkaya ° C.
- Beyin microcentrifuge tüp altına yerleşmek ve birincil antikor çözümü kaldırmak birincil antikorlar ile kuluçka izin.
- P1000 pipet kullanarak yerine 2 " hızlı " yıkama ve 3 " uzun " 20 dk adımları 4.4 ve 4.5 yukarıda açıklandığı gibi PTN 0.5 mL ile yıkar, dikkatli bir şekilde izin microcentrifuge tüp her yıkama arasında altına yerçekimi tarafından yerleşmek beyin
- Incubate beyin fluorescently etiketli uygun ikincil antikorlar ile oda sıcaklığında 3 h için. İkincil antikorlar genellikle seyreltilmiş 0.5 mL PTN + % 5, 1: 200 bir konsantrasyon NGS.
Not: floresan ikincil antikorlar ekledikten sonra beyin deneme geri kalanı için karanlıkta tutulmalıdır.
Not: benzer uyarma/emisyon dalga boylarında GFP sahip bir fluorophore ile etiketli bir ikincil antikor kullanmak için tavsiye MARCM çözümleme işlemi sırasında büyük kalıntı GFP Floresans kalır içinde (örneğin, Fluoroscein isothyocyanate (FITC) veya Alexa488). - İkincil antikor kuluçka, takip izin microcentrifuge tüp altına yerleşmek ve ikincil antikor çözümü kaldırmak beyin.
- Gerçekleştirmek 2 " hızlı " yıkama ve 3 " uzun " 20 dk adımları 4.4 ve 4.5 yukarıda açıklandığı gibi PTN 0.5 mL ile yıkar, dikkatli bir şekilde izin microcentrifuge tüp her yıkama arasında alt yerleşmek beyin
- Üçüncü takip " uzun " 20 dk yıkama, kullanım mümkün olduğunca fazla arabellek kaldırmak için p200 pipet.
- Ekleyin 75 µL floresan Anti-fade in montaj orta beyin ve. Pipet beyin ve montaj orta içine karıştırmak için bir kez pipet ucu. Beyin kap veya microcentrifuge tüp kısımlarına sıkışmış beri tüp ters değil.
Not: süspansiyon montaj orta beyin, tüpler olabilir fluorophore Şoklama yavaşlatmak için alüminyum folyo sarılı ve gecede 4 ° C'de depolanan. Gerekli, beyin birkaç gün 4 ° C'de depolanan Eğer, ama ideal olarak en kısa zamanda slaytlar monte edilmelidir.
5. Yetişkin D. melanogaster beyin mikroskop slaytlar ve görüntüleme üzerine montaj
- Yapı bir " Köprüsü " slayt. İki pozisyon " temel " coverslips yaklaşık 1 cm pozitif yüklü bir slayt üzerinde ayrı. Slaydın pozitif yüklü yan bakan emin olun. Coverslips tırnak Lehçe içeren şekil 3 ' te A gösterilen uygun. Ortam takma altında bu temel kapak paket fişi fitil değil emin olmak için tırnak Lehçe ile temel her kapak notu üç dış kenarlarını mühür genellikle yararlıdır. Tırnak Lehçe tamamen kuru izin (10-15 dk) devam etmeden önce.
- Stereomicroscope altında slayt yerleştirin ve iki coverslips arasındaki boşluğa disseke beyin içeren montaj medya çözüm pipette. Daha fazla karşıtlık sağlamak için böylece tezgah üstü paralel boynu ışıklar manevra yararlıdır.
- Beyin slaydın dışına pipette değil dikkatli ekstra bir pipet kullanarak slayttan ortam takma kaldır.
- Fitil uzakta ilave montaj medya. Bu beyin daha doğrusu sonraki adımı sırasında konumlandırılmış olması izin verir.
- Forseps ve stereomicroscope bir çift kullanarak beyin antennal loblar yukarıya bakan ile ızgara desen slaytta getirin
- Yer bir kapak kayma (" Köprüsü ") beyin ( şekil 3 A) bitti. Nerede onlar iletişim köprüsü kapak notu kenarlarında imzalamaya tırnak Lehçe kullanmak " temel " kapak notları.
- P200 pipet kullanarak yavaş yavaş taze montaj medya ( şekil 3 B) ile köprü altında Merkezi boşluğu doldurmak. Merkezi coverslip açık kenarında bir seferde bir damla yerleştirin ve montaj medya merkezi Köprüsü coverslip altında fitil sağlar. Ortam, takma ile tüm boşluğu doldurulana kadar devam sonra mühür üst ve alt açık tırnak boyasıyla.
- Kez tırnak Lehçe kuru, slaytları hemen görüntü veya mağaza lightproof sıkı slayt kutusunda, -20 ° c
- Bir hafta içinde beyni uyarma lazerler ile lazer tarama confocal mikroskop kullanarak görüntü ve filtre küpleri için seçilen ikincil floresan antikor uygun. Z-yığın görüntüleri mantar vücut nöronların genellikle 20 X veya 40 X hedefleri kullanarak elde edilir. Görüntüleme retina photoreceptor nöron daha yüksek büyütme gerektirebilir.
Sonuçlar
Yukarıda açıklanan yöntemi hemen hemen her yetişkin Drosophila beyin bölgesinin güvenilir ve tekrarlanabilir görselleştirme için sağlar. Burada mantar organları ve photoreceptor nöronlar üzerinde odaklanmıştır, ancak diğer çalışmalar pars intercerebralis52, saat nöronlar53,54, gibi beyin bölgeleri görselleştirmek için benzer yöntemler kullandık ve antennal LOB projeksiyon nöronlar55, diğerleri arasında. Önemlisi, bu teknik hem tüm beyin yapıları hem de MARCM12,47gibi teknikleri kullanarak bu yapılar içinde bireysel nöronlar görselleştirmek için kullanılabilir. Şekil 4, şekil 5ve şekil 6 birçok farklı veri türüne mantar organları ve photoreceptor nöronlar diseksiyon ve immunostaining kullanılarak oluşturulan yetişkin beyinlerinde göster.
İlk olarak, yukarıda açıklanan yöntem doğrudan mantar vücut Morfoloji ya Fasciculin 2 (Fas2) tanımak antikorlar veya muhabir gen mantar vücut nöronlar34ifade kullanarak görselleştirmek için kullanılabilir. Şekil 4A ve şekil 4B, antikorlar α, β, görselleştirmek için kullanılabilir Fas2 ve (daha az ölçüde) gösterildiği gibi γ loblar yetişkin mantar organlarının Drosophila beyin. Bu mantar güvenilir ve iyi kurulmuş bir işaretleyici yapım o bir hücre-hücre adezyon protein nöron fasciculation için gerekli ve α ve β loblar23,56,57, yüksek düzeyde ifade Fas2 olduğunu vücut nöronlar. Özellikle, Yetişkin beyin Merkez bölgesinde yer alan dairesel şekilli elips vücut da bu antikor (şekil 4A) kullanarak görüntülenmiştir.
Kusurları aksonal rehberlik proteinler genelde eksik olarak penetrant mantar vücut mutant fenotipleri15,34,35neden. Bu nedenle, birçok durumda, birkaç düzine beyin görüntüsü analiz ve. Örneğin, mantar vücut β LOB aksonlar Nab2 null Sineklerin Tanrısı uygunsuz bir şekilde beyin orta hat çapraz. Bu "öbür tarafa" veya β LOB "füzyon" fenotip genelde ~ 80 %'null uçar ama esas olarak Nab2 vahşi tipi denetimlerden yok ve sınıflandırılabilir yetişkin gibi hafif görülmektedir, orta veya füzyon34tamamlamak. Orta çizgi boyunca β loblar "füzyon" ters beyin yarım kürenin içine yanlış kontralateral projeksiyon akson ve kaynaklanır. Şekil 4C ve ayrıntılı olarak açıklandığı34,35, gösterildiği gibi hafif fusion orta füzyon için daha fazla önemli ölçüde bağlı β loblar anlamına gelir iken bir "ince iplikçik Fas2 pozitif liflerinin tarafından" bağlı β loblar anlamına gelir orta çizgi biraz azalmış LOB kalınlığı gösterin. Tam (veya "aşırı") füzyon tamamen bağlı ve LOB kalınlığı veya Fas2 orta hat boyama hiçbir azalma göstermek β loblar anlamına gelir. Mantar vücut β LOB füzyon verdiği ölçüde sayılabilir ve 34,35 veya morfolojisi kusur her türü gösteren beyin yüzdesini gösteren bir tablo olarak gösterildiği gibi görüntülenir.
Fas2 antikorlar ile boyama ek olarak, MARCM teknik12,47,48 axon rehberlik bireysel GFP+ nöronlar içinde mantar vücut loblar kararlarının görselleştirmek için de kullanılabilir. MARCM Mitotik rekombinasyon bireysel nöronlar veya nöronların GFP (şekil 5A) ile işaretlenmiş, clonally ilgili gruplar oluşturmak için geliştirme sırasında kullanır. MARCM tamamen aksi takdirde heterozigoz bir sinek içinde bir protein eksikliği nöronların az sayıda oluşturmak için bir yol sağlar. Bu nedenle, bu teknik aynı zamanda genel olarak organizma canlılığı12,47için gerekli olan proteinler aksonal rehberlik işlevlerini analiz özellikle yararlı olmuştur. Homozigoz null nöronlar GFP ile işaretlenmiş bir vahşi tipi genetik arka planda GFP ile işaretlenmiş nöronlar denetlemek için doğrudan karşılaştırılabilir. Ayrıca, ne zaman veya geliştirme larva pupa ısı şok bağlı olarak, nöronlar olabilir mantar vücudun farklı sınıflar (şekil 5B) hedeflenir.
Bu tekniği kullanarak oluşturulan veri türüne bir örnek, şekil 5C, örnek olarak vahşi MARCM klonlar türü (örneğin, Denetim) oluşturulduğu gösterilir. Şekil 5' teCF1 geliştirme, gösterilen bireysel GFP+ mantar vücut sinir hücreleri oluşturmak için larvalar başlangıçta 25 ° C'de muhafaza Yaklaşık 5-6 gün sonra larva kuluçka (SKİP'in), Pupa 25 ° C'ye kadar eclosion sonra geri döndü ve 37 ° C'de 30 dk için şok ısı vardı. Yetişkin tarama sonrasında beyin içinde PTN disseke, sabit ve aynı anda Fas2 tanıma antikorlar ile inkübe (1 d 4, 1: 20'si PTN seyreltilmiş) ve GFP (PTN içinde seyreltilmiş 1:500). Beyin daha sonra ikincil antikorlar ile inkübe ve yukarıda açıklandığı gibi slaytlar üzerine monte. GFP+ hücreleri tespit edilmiştir ve bir lazer tarama confocal mikroskop kullanarak yansıma ve maksimum yoğunluk projeksiyon ImageJ kullanarak oluşturulmuştur. Şekil 5C, denetim GFP+ gösterdiği olarak α ve β loblar oluşturulan nöronlar Fas2 ile colocalize ve iki Drosophila beyin hemisferlerin ayıran orta hat başvurmadan önce bitirmek. Bir tek axon projeler anteriorly, bifurcates ve sonra her ikisi de dorsally ve hemen formu α ve β loblar projeleri. Birkaç önceki çalışmalarda belirli proteinler hücre bölünmesi axonogenesis uzantısı, kılavuz, dallanma, ve/veya budama10dahil olmak üzere, birçok açıdan özerk için çalışma için gerekli olup olmadığını araştırmak için bu tekniği kullanmış, 11,12,13,14,15,16,17,34.
Mantar cesetleri ek olarak retina photoreceptor nöronlar (R-hücreleri) aksonal kılavuz kararlarının da yukarıda (yanı sıra diseksiyon yöntemi de tarafından açıklanan diseksiyon yöntemiyle görüntülenmeyecektir««kayıtsız kalamayız) başvuru48yılında. Her ommatidia içinde sinek göz içeren üç gruba (şekil 1) sınıflandırılabilir 8 photoreceptor nöronlar: akson beyin optik LOB; yüzeysel lamina için proje R1-R6 hücreleri Akson medulla daha derin M6 tabakası için proje R7 hücreleri; ve akson medulla19,58ara M3 tabakası için proje R8 hücreleri. Photoreceptor her sınıfın projeksiyon desen kapsamlı eğitim gördü ve birlikte bu nöronların başarıyla bir model olarak sinyal yolları axon rehberlik19,59yılında dahil anlamak için kullanılmıştır. Önemli, tüm photoreceptor akson kolayca disseke Drosophila beyinlerinde yetişkin, Pupa, immunostaining tarafından görüntülenmeyecektir ya da larva dokular bir antikor kullanarak bu chaoptin, tanıdığı bir hücre yüzey glikoprotein24, 60 , 61. GFP veya β-galaktozidaz her R-hücre türü (R1-R6, R7 ve R8 hücreleri) ifade reporter genler de inşa edilmiştir ve her sınıf photoreceptor62görselleştirmek için kullanılabilir. R-hücre her tip gelişmekte olan optik LOB farklı bir katmanda sona erer, bu gazetecilere her hücre türü için doğru hedef bulmak gerekli sinyal yollar ayrıntılı karşılaştırmalar için izin. İki chaoptin yerelleştirme (ki tüm photoreceptor nöronlar bir işareti olarak kullanılabilir) ile birlikte bu muhabir gen tarafından üretilen ifade desen örneği şekil 6' da gösterilmiştir. R7 photoreceptors görselleştirmek için beyin R7 özel Rhodopsin4-LacZ muhabir gen içeren disseke ve antikor chaoptin ve β-galaktozidaz için ile lekeli. Rhodopsin 4 (Rh4) özellikle alt R7 hücreleri63ifade edilir; Rh4 organizatörü bu nedenle muhabir gen ekspresyonu bu hücreler yalnızca sürücü için kullanılabilir. Beklendiği gibi R7 hücreleri ( şekil 6sarı noktalı çizgi ile gösterilir) medulla daha derin M6 tabakası sonlandırın. Benzer şekilde, β-galaktozidaz üzerinden özellikle R8 photoreceptors63ifade edilir, disseke Rhodopsin 6 (Rh6) düzenleyici ve immunostained antikor chaoptin tanıma kullanarak ifade beyin ve Β-galaktozidaz. Şekil 6' da gösterildiği gibi R8 photoreceptors sona erdi R3 tabakasımedulla. Her ne kadar burada gösterilmeyen, Rh1 LacZ R1-R6 photoreceptors lamina içinde sona erdirilmesi görselleştirmek için de kullanılabilir.
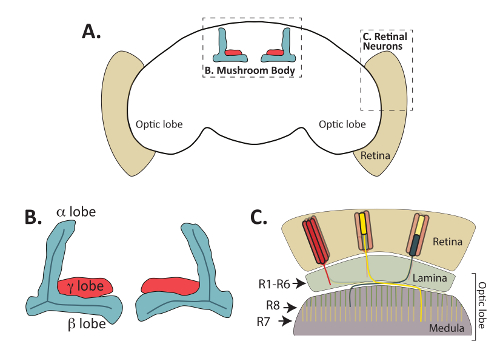
Şekil 1: Yetişkin Drosophila melanogaster beyin işlevsel olarak farklı ama birbirine bağlı bölgelerinde oluşur. (A) Yetişkin D. melanogaster anahattı beyin gösterildiği, merkezi bir konumda bulunan mantar organları ve periferik retina photoreceptor sinir hücreleri vurgulama. (B) büyütülmüş diyagramı demetleri Fas2 antikorlar tarafından tanınan (LOB olarak da bilinir) Yetişkin mantar vücut axon. Kenyon hücreleri denilen mantar organlarının içsel nöronlar aksonlar anteriorly dorsally bulunduğu hücre gövdeleri (hücre bu diyagramdan atlanmış organları) üzerinden proje ve form ayrı LOB yapıları. Yetişkin beyinde aksonlar, tek bir medial bohça γ loblar (gösterilen kırmızı) formundan ise dorsal α ve medial β loblar (gösterildiği mavi) tek bir akson formundan bu kılavuz işlemi sırasında bifurcates. Α ' / β' nöronlar geliştirmek aksonal loblar kısmen üst üste bu α/β nöronlar, ile ancak Fas2 antikorları tarafından tanınmaz ve bu diyagramdan göz ardı edilir. (C) retina sinir hücreleri optik LOB retina gelen görsel bilgi geçişi önemlidir. Akson projeden hücre lamina veya medulla Post sinaptik hedef hücreler ile retina (bej) ve form bağlantıları bulunan ceset. R1-R6 photoreceptor hücreleri (kırmızı ile gösterilen) formu belirli bağlantıları ile optik LOB, dış tabakası hücrelerde lamina denilen. R8 hücreleri (yeşil renkle gösterilmiştir) aksonlar medulla biraz daha yüzeysel M3 tabakası için proje iken R7 photoreceptor (sarı) synapse medulla, M6 tabakası alanında hedefleri olan hücreleri. Bölüm C izninden Macmillan yayıncılar Ltd tarafından uyarlanmış: Doğa Neuroscience (64başvuru, telif hakkı (2011)). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
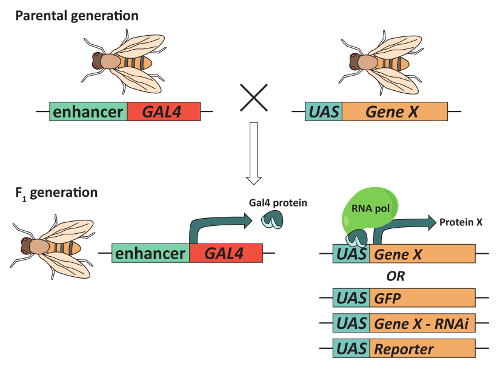
Resim 2: GAL4/UAS sistem-ebilmek var olmak kullanılmış için hedeflenen gen ekspresyonu. Sinekler bir doku belirli desende bir gen ("Gen X") ilgi ifade elde etmek için sinekler Gal4 transkripsiyon aktivatör protein bir doku belirli artırıcı kontrol altında ifade bir transgene ve Gal4 DNA içeren bir transgene içermelidir (ters yönde sıra etkinleştirme veya UAS denir) sıralı bağlama için gen x genellikle bitişik, bu kombinasyon her bir transgene içeren ebeveyn sinekler çiftleşme ve her ikisi de içeren F1 döl için seçerek elde edilir. Elde edilen F1 nesil Gal4 ifade edilebilir ve UAS için gen x transkripsiyon bir doku belirli şekilde etkinleştirmek için bağlar. Önemlisi, farklı UAS içeren transgenes aynı GAL4 "sürücü" ile birlikte kullanılabilir. Örneğin, Gal4 mantar organları (MBs) ifade bir transgene UAS içeren transgene hızlı GFP, bir genin RNA müdahale kullanarak ilgi ifade darbelere bir transgene veya bir muhabir üreten bir UAS transgene ile kombine edilebilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
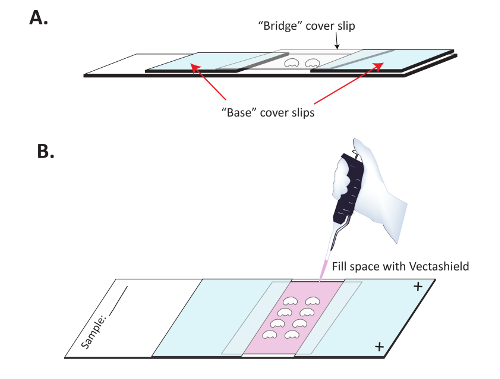
Şekil 3 : Beyin ayirt görüntüleme için hazırlık montaj. (A)beyin SuperFrost artı slaytlara beyni düzleştirme önlemek için bir köprü kapağı ile monte edilmiştir. İki "temel" kapak paket fişi Superfrost artı olumlu ücret ile bir slayt açık tırnak Lehçe yapıştırılır vardır ve disseke beyin sonra aralarında slayt yerleştirilir. Bir açık "köprü" kapak notu beyin yerleştirilir ve temel kapak makbuzları yapıştırılır. (B) bir zamanlar tırnak Lehçe kurudu, Vectashield yavaş yavaş ikincil antikor Floresans korumak için köprünün altından pipetted. Açık tırnak Lehçe sonra üst ve alt "köprü" kapak fişinin mühür için kullanılır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
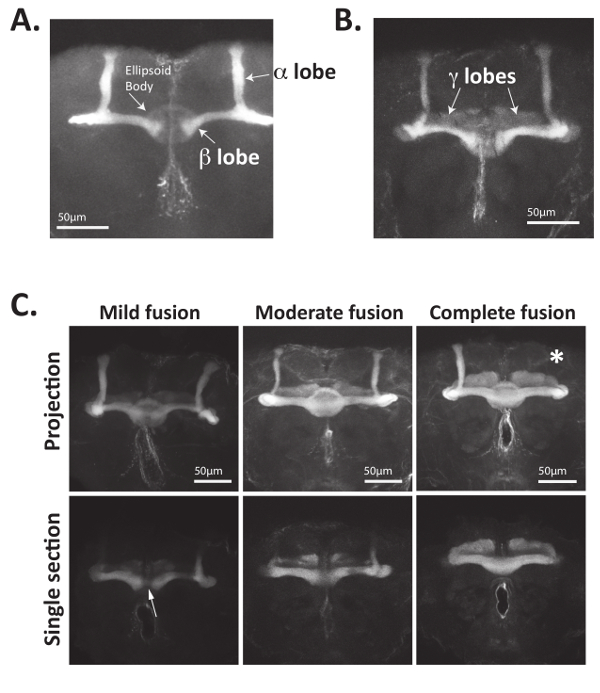
Şekil 4: Mantar vücut aksonlar açıkça görselleştirildiği Fas2 tanımak antikorları kullanarak. (A)yetişkin Drosophila beyin disseke, sabit ve Fas2 tanıma antikorlar ile inkübe. Keçi-anti-fare ikincil antikorlar Alexa488 birleştiğinde kullanarak birincil antikorlar tanınmıyor ve beyin olumlu tahsil slaytlar monte edildi ve bir lazer confocal mikroskobu tarama kullanarak yansıma. Bisymmetrically mantar vücut organları aksonlar anteriorly genişletmek, bifurcate ve akson demetleri (LOB olarak da bilinir) formu hücre yer. α loblar dorsally projelendirme ve β loblari da projelendirme oluşturan aksonlar Fas2 hızlı. Eleştirel, vahşi-türü sinekler β lobları beyin orta hat önce sonlandırın. Merkezi bir konumda bulunan elips vücut da 1 d 4 kullanarak görüntülenmeyecektir antikor. (B) hemen projelendirme γ LOB aksonlar yetişkin Drosophila mantar vücudun da Fas2 hızlı ve 1 d 4 kullanarak görüntülenir antikor. Genellikle, γ LOB aksonlar Fas2 ifadede bu α ve β LOB daha azdır. (C) Mantar vücut aksonlar Nab2 boş beyin (genotip: Nab2ex3/Nab2ex3) contralaterally yanlış proje ve genellikle loblar eksikliği. Nab2 null beyin disseke, sabit ve 1 d 4 ile lekeli mantar vücut α, β ve γ loblar görselleştirmek için antikor. Maksimum yoğunluk Z-yığın projeksiyonlar orta hat bölgesine de olarak bireysel optik bölümleri odaklı gösterilir. Vahşi-türü mantar vücut β LOB aksonlar nadiren beyin orta hat çapraz, Nab2 null beyin içine "erimiş" β loblar kaynaklanan kontralateral beyin yarıküre orta çizgi boyunca mis projeksiyon değişen miktarlarda olması. Başvurular34,35içinde tanımlandığı gibi hafif füzyon başvurduğu < β loblar yalnızca birkaç "ipliklerini" orta hat, ılımlı füzyon geçiş aksonlar ile ifade eder durumlara nerede Fas2 olumlu β LOB nöronlar çapraz beyin orta hat ama β LOB orta hat genişlikte azalmıştır ve kaynaşması anlamına gelir durumlara loblar beyni orta hat geçerken β LOB kalınlığı hiçbir azalma olduğu yerde. Elips vücut Fas2 da ifade eder beri optik bölümleri orta hat gösterilen daha çoğu kez β LOB füzyon görüntülenmesi yararlı. Özellikle, eksik loblari da sık sık (burada beyaz yıldız işaretiyle gösterilir) gözlenir. C bölümündeki verileri başvuru34, izni ile gelen mantar vücut fenotipleri quantification kullanılır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
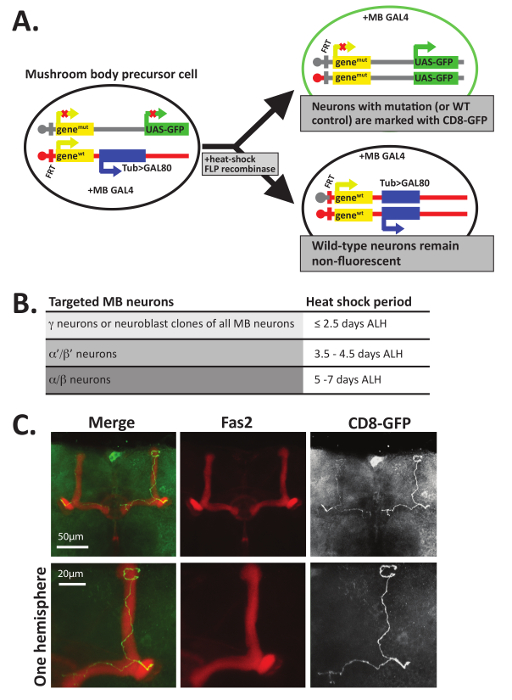
Şekil 5 : MARCM-ebilmek var olmak kullanılmış-tek nöronların aksonlar görselleştirmek için. (A)mozaik iki ayrı kızı hücreleri oluşturmak için analizi ile bir Repressible hücre işaretçisi (MARCM) kullanır FLP recombinase-aracılı Mitotik rekombinasyon FRT sitelerde. Bu örnekte, tüm hücreler ayrı bir kromozom bir mantar vücut özel GAL4 protein içerir. Hücre bölünmesi sırasında Mitotik rekombinasyon bir kızı hücre (üst) GFP ifade eder (veya membran CD8-GFP bağlı) ve diğer kızı hücre (alt) iki vahşi-tipi (WT) gen devralır ve bir ilgi, bir genin iki mutant gen içerir transgene tübülin düzenleyici kullanarak Gal80 protein ifade. Bu yüzden Gal80 üreten hücreleri floresan sigara olacak ve heterozigoz ya da homozigoz vahşi türü Gal80 Gal4, engeller. Sadece, GFP+ hücreleri iki mutant gen kopyalarını içerir. Not yalnızca biri de ilgi bir genin iki mutant gen içeren GFP+ hücreleri oluşturmak için birkaç yöntem gösterilir; 12,45,56 diğer örnekleri için bakınız. (γ nöronlar, sonra α mantar vücut nöronlar gelişimi başlarB)'/ β' neurons ve α/β nöronlar, nöron her sınıfı ile biter seçici olabilir hedef ve ısı farklı gelişim zaman noktalarda şok edici tarafından görüntülenmiştir. 12' de açıklandığı gibi 40 dk ısı şok 37 ° C'de ≤2.5 gün sonra larva kuluçka (SKİP'in) özellikle γ hedefleyecek; nöronlar, 3,5-4,5 gün SKİP'in (içinde belgili tanımlık geç L3 larva sahne) oluşur ısı şok sırasında oluşan α hedef olacaktır ' / β' neurons ve o o şok bir ısı ccurs 5-7 gün SKİP'in (sırasında pupa geliştirme) arasında α/β nöronlar hedefleyecektir. (C) bireysel vahşi tipi aksonlar MARCM kullanarak görüntülenir. Vahşi tipi ~ 5-6 gün eski pupa (genotip: hsFLP, UAS-CD8-GFP; Küvet FRT82B, UAS-CD8-GFP/FRT82B, > Gal80; OK107-GAL4/+) ısı Mitotik rekombinasyon ikna etmek 40 dakika 37 ° C'de şaşırdılar. Beyin disseke, sabit ve GFP (1:500) ve Fas2 tanıma antikorlar ile lekeli (1:20). Beyin sonra fluorescently etiketli ikincil antikorlar ile inkübe ve confocal mikroskobu tarafından görüntülenmiştir. Bu örnek verilerden bir "Denetim" genotip, GFP pozitif hücrelerinin MARCM kullanılarak oluşturulan vahşi türüdür ve iki genmut gen içeren yerine, iki genWT gen içerir. Mantar vücut β loblar (antikorlar Fas2 tanıma kullanarak görüntülenir) beyin orta hat ulaşmadan önce sonlandırmak; Α LOB nöronlar da mevcuttur. Daha fazla ayrıntı göstermek için Yakınlaştırılmış tek beyin yarıküre görünümünde alt sıra resimler gösterilir. C parçasını referans34izniyle uyarlanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
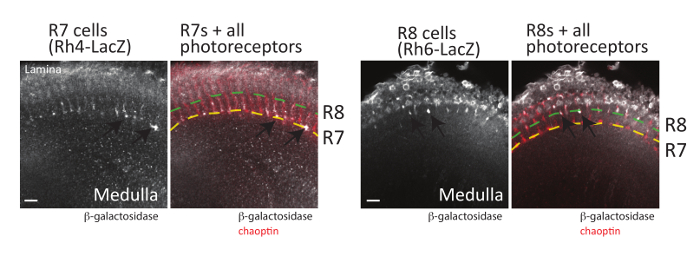
Şekil 6 : Photoreceptor akson-da var görüntülenmiştir. Yetişkin beyin ifade β-galaktozidaz R7 photoreceptors (sol, Rh4-LacZkullanarak) veya R8 photoreceptors (sağ, Rh6-LacZkullanarak) disseke, sabit ve β-galaktozidaz veya chaoptin tanıma antikorlar ile inkübe. Beyin sonra fluorescently etiketli ikincil antikorlar ile inkübe ve confocal mikroskobu tarama lazer tarafından görüntülenmiştir. Tek optik bölümleri her beyin gösterilir. Sol tarafta, birkaç R7 photoreceptor akson (oklar) (sarı noktalı çizgiyle gösterilen) medulla daha derin M6 tabakası içinde sonlandırma görülebilir. Sağ tarafta, R8 photoreceptor akson (oklar) (yeşil noktalı çizgiyle gösterilen) medulla dış M3 tabakası içinde sonlandırmak. R7 photoreceptors ya Rh3 hızlı veya Rh4 ve R8 photoreceptors ya Rh5 ya da Rh663hızlı beri tüm R7 veya R8 photoreceptors tek bir LacZ muhabir gen kullanarak görüntülenir olamaz. Ölçek çubukları 10 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Yukarıda açıklanan diseksiyon ve görselleştirme yöntemi immunostaining çok çeşitli olarak kullanılabilir ve düşsel kullanma yaşamak. Biz bir genel immunostaining protokol belirttiğimiz ve MARCM içinde bireysel mantar vücut nöronların aksonal Morfoloji görselleştirmek için kullanılabilir bir yol çizer. Ayrıca, bu genel yordamları da diğer beyin bölgeleri sabit içinde görüntüleme için kullanılabilir veya taze disseke yetişkin48,65beyin. Canlı görüntüleme ifade desenleri artırıcı tuzakları, muhabir gen veya mimik çizgileri66, örneğin analiz ederken daha verimli bir yaklaşım sağlar. Önlemek için hücre ölümü GFP sabitlenmemiş dokusunda canlı görüntüleme sırasında yapılardan yakalama, beyin gereken 1 fosfat tamponlu tuz (PBS) veya HL3 medya48x disseke, köprü slaytlar 1 x PBS (veya HL3) üzerine monte ve daha az 15-20 dk. bakım görüntüsü Ayrıca GFP Floresans görselleştirme ile etkileyebilir beri--dan disseke beyin görüntüleme önce mümkün olduğu kadar Trakea kaldırmak için alınmalıdır.
Mantar beden ve photoreceptor nöronlar morfolojisi değerlendirmek için boyama koşulları nispeten iyi kurulmuş24,61,67, bu hücredeki ilgi belirli bir protein lokalizasyonu iken türleri kapsamlı sorun giderme ve en iyi duruma getirme gerektirebilir. Özellikle, antikor seyreltme, engelleme arabelleği bileşeni konsantrasyon ve fiksasyon, dahil olmak üzere birkaç önemli adımlar en tekrarlanabilir ve güvenilir sonuçlar üretmek için optimize edilmelidir. İlk olarak, birincil antikor en yüksek konsantrasyonu tespit edilmelidir. Piyasada bulunan antikorlar genellikle önerilen bir seyreltme (ve genellikle başlangıçta bu konsantrasyon kullanarak başlatın rağmen), bu değerler nadiren Drosophila dokular üzerinde ampirik olarak belirlenir. Bu nedenle, aralığın üstündeki ve altındaki üreticinin başlangıç öneri kez daha özel boyama sonuçları birincil antikor dilutions bir dizi test. Birincil antikor seyreltme doğruluk boyama üzerinde önemli bir etkiye sahip olabilir ve tam olarak belirlenir, birincil antikor içeren zaman beyin inkübe çözümler genel sonuç küçük etkisi ile önemli ölçüde değişebilir. Kuluçka beyin Fas2 antikor birincil antikor ile iki, üç, hatta dört gün 4 ° C'de disseke zaman örneğin, benzer sonuçlar gözlemledim Her ne kadar en az iki gece tavsiye, ayrıca tek bir geceliğine birincil antikor çözüm beyinlerinde inkübe ve tekrarlanabilir boyama elde. Önemlisi, beyin içinde oda sıcaklığında (ya da bir gece 4 ° C'de) 3 h ikincil antikor inkübe saat miktarını sınırlayarak sınırı non-spesifik bağlama ikincil antikorların beyin dokusu ile yardımcı olur.
İkinci olarak, istenmeyen arka plan sinyal ortadan kaldırmak için ek "engelleme" reaktifler kullanmak gerekli olabilir. NGS konsantrasyon ~ %10 1-%10 sığır Serum Albumin (BSA) engelleme ve birincil/ikincil antikor çözümleri veya gecede 4 ° C'de Drosophila embriyo (bkz: ile birincil antikorların öncesi adsorpsiyon ekleme, artan seçenekler şunlardır: referans68, Bölüm 2.9, adım 3).
Biz PTN önerilen tampon olarak tüm fiksasyon için yukarıdaki iletişim kuralı'nı yazılı iken, yıkama ve antikor kuluçka adımları, doku fiksasyon (PIP ve Malzemeler tabloPEM gibi) diğer arabelleklerindeki derin farklılıklar neden olabilir sinyal gücü. Örneğin, önceki çalışmalarda siklin E dokuları da PBS içinde seyreltilmiş geleneksel %4 paraformaldehyde sabit olan zaman içinde larva Imaginal yuvarlak yüzey mümkün değildir ama doku PLP arabellekte (Ken Moberg, kişisel tamir ederken açıkça görülmeye başlıyor göstermiştir iletişim ve başvuru69). Arabellekteki değişikliklere ek bileşenleri, doku fiksasyon de önemli ölçüde immünfloresan etkileyebilir için zaman ve sıcaklık değiştirme boyama ve gerekirse ampirik olarak belirlenebilir. Genel olarak, fiksasyon zaman hücresel bileşenleri yeterli polietilenin için izin vermek yeterince uzun olmalıdır ve uzun vadeli olurken genel olarak hücresel Morfoloji bakımından yeterli bitti-çapraz ve "protein epitopları gömme" önlemek için sınırlı. Bu nedenle, başlangıçta yeni alınan bir birincil antikor boyama koşullarını iyileştirirken, genellikle yaklaşık 20 dk fiksasyon zaman sınırı ve genelde doku soğuk sıcaklıklarda ortadan kaldırır.
Birden çok denetimi birincil ve ikincil antikorları özgüllük yanı sıra transgenes/genetik arka plan gözlenen fenotip üzerindeki etkisini araştırmak için herhangi bir ayirt denemede dahil edilmelidir. Özellikle kullanılan birincil antikor protein ilgi tanır olup olmadığını tespit etmek için bu protein ve/veya protein overexpressing doku eksik sinekler dokudan denetimleri dahil edilmelidir. Aşırı saf antijen protein ek birincil antikor sinek beyindeki diğer epitopları tanır olup olmadığını belirlemek için de kullanılabilir. Son olarak, herhangi bir floresan sinyal zaman birincil antikorlar atlanırsa mevcut seçili ikincil antikorlar tarafından non-spesifik bağlama düzeyini temsil eder.
Birkaç önemli denetimleri de genetik arka plan katkısını veya transgenes boyama yoğunluğu veya nöronal Morfoloji varlığı değerlendirmek için dahil edilmelidir. Örneğin, birden çok transgenes şekil 5 MARCM deneyde kullanılan sinekler içerir (hsFLP, UAS-CD8-GFP, FRT82B, küvet > GAL80 ve OK107-GAL4), her biri ayrı ayrı mantar vücut Morfoloji üzerindeki etkileri için analiz edilmelidir. Sinekler bir çok az, mantar vücut Morfoloji OK107-GAL4 ve UAS-CD8-GFP içeren analiz edilmelidir. Ayrıca ısı şok etkisini değerlendirmek için gerekli olabilir ve hsFLP ve FRT82B içeren Flp recombinase üretim mantar vücut geliştirme analiz tarafından üzerinde uçar. MARCM olup olmadığını denetler verilen bir protein özerk aksonal rehberlik hakkında önemli fikir sağlamasına karşın, bu sonuç doğru bir şekilde yapmak için gerekli denetimlerin sayısını bu tekniğin küçük bir sınırlama olabilir. Daha az karmaşık deneylerde benzer denetimler de geçerlidir. Örneğin, nerede GAL4/UAS sistemi bütün nöronlar ilgi bir protein devirme ifade için bir RNAi transgene ile birlikte kullanılan bir deneyi ele alalım. Bu deneyde, en az iki transgenes mevcut olacaktır: Elav-GAL4 ve UAS RNAi transgene gibi bir pan-nöronal GAL4 sürücüsü. Her biri bu transgenes yalnız içeren sinekler nöronlarda mantar vücut morfolojisi ek olarak her iki transgenes aynı sinek içinde sinekler nerede liman deneysel durumu araştırılmalıdır.
Son olarak, protein ilgi mantar vücut nöronlarda ifade olup olmadığını belirlemek için bu ortak leke beyin için genellikle Fas2 antikorlar ile gereklidir. Alternatif olarak, floresan proteinler gibi GFP, RFP veya membran CD8-GFP bağlı aynı zamanda GAL4/UAS sistemi kullanılarak ve faiz protein tanıma antikorlar ile birlikte kullanılan ifade edilebilir. Fas2 sadece mantar vücut α ve β loblar formu fasciculated akson tanır, GAL4 dayalı, membran bağlı CD8-GFP kullanımı mantar vücut nöronlar işaretlemek için özellikle yararlı beri.
Kusurları aksonal rehberlikte genellikle % 100 penetrant değildir ve hatta aynı genotip beyinlerinin bazı değişkenlik gösterebilir. Ne zaman yeni analiz mutant gen kusurları için mantar vücut veya photoreceptor bunun içinde oluşturulan, bu nedenle, farklı gen ve yaklaşımların bir arada kullanılan. Literatürde en çalışmaları bir protein aksonal rehberlik kontrol hücre özerk bir rol oynar olup olmadığını araştırmak için birkaç farklı yaklaşım kullanın: Ben) bunun analizini kusurları (tercihen farklı nu kullanarak homozigoz null sineklill allelleri), II) bunun analizini kusurları nöronlar (genellikle üzerinden RNAi), sadece ilgi protein eksik sinek içinde III) kılavuz kusurları ve IV MARCM analizi) kurtarma gene nerede homozigoz null nöronlarda yeniden ifade deneyler uçar. İdeal olarak, genotip başına birkaç düzine beyin nöronal Morfoloji kusurları için analiz edilebilir.
İletişim kuralı öncelikle odaklanır sabit doku içinde proteinlerin immünfloresan yerelleştirme burada açıklanan rağmen bu tekniğin bazı gelecekteki uygulamalar görüntü canlı beyin dokusu ile geliştirilmektedir. Bir kez beyin (genellikle hücre kültür medyada) disseke, onlar sonra birkaç gün 25 ° C'de kültürlü olabilir Bu ex vivo kodlamayla yöntemleri çok çeşitli yaralanma70,71, hücre içi takip axon rejenerasyon teşvik protein aktivite gibi biyolojik süreçleri araştırmak amacıyla geliştirilmekte olan sinyal dynamics72ve nöronal gelişim73.
Açıklamalar
Yazarlar onlar rakip hiçbir mali çıkarları var bildirin.
Teşekkürler
Changhui Pak ve Alysia Vrailas Mortimer başlangıçta beyin diseksiyonu tekniği SMK verdiğiniz için teşekkür etmek istiyorum. Biz de Ken Moberg'ın laboratuar grubunun üyeleri, özellikle Chris mermi, eleştirel yazının okumak için teşekkür ederiz. Fas2 tanıma antikorlar (1 d 4) ve chaoptin (24B10) gelişim çalışmaları Hibridoma bankadan elde. Antikor 24B10 Seymour Benzer ve Nansi Colley24tarafından,60,61DSHB için yatırılır, antikor 1 d 4 için DSHB Corey Goodman 22,23,56tarafından yatırılır. Sinek stokları Bloomington hisse senedi merkezden elde edilmiştir. Ayrıca Ohio tarımsal araştırma ve Geliştirme Merkezi (OARDC) MCIC görüntüleme Merkezi confocal mikroskop kullanımı için şekil 4A beyinlerinde görüntü için teşekkür etmek istiyorum ve B. SMK NICHD hibe tarafından desteklenmektedir (1 R15 HD084241-01A1).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
Referanslar
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır