Method Article
해 부 및 Immunofluorescent 얼룩의 버섯 몸과 성인 초파리 melanogaster 두뇌 신경 세포 포토 리셉터
요약
이 프로토콜 설명 해 부와 성인 초파리 melanogaster 의 immunostaining 뇌 조직. 특히,이 프로토콜은 신경 개발의 많은 측면을 기본 일반적인 원리를 밝히기 위해 정확 하 게 사용할 수 있는 예제 신경 하위 집합으로 초파리 버섯 몸과 포토 리셉터 뉴런의 사용을 강조 표시 합니다.
초록
신 시스템 개발 순차적 일련을의 여러 신호 경로 규제 네트워크 조정 되는 이벤트를 포함 한다. 이 경로에 관련 된 단백질의 많은 포유류와 과일 파리 초파리 melanogaster, 유사한 조직 원리의 개발 하는 동안 존재 제안 등 다른 진핵생물 사이 보존 봤을 유기 체입니다. 중요 한 것은, Drosophila 성체, 차별화, axonal 지침 및 synaptogenesis을 포함 한 포유류에 필요한 프로세스를 규제 하는 세포질이 고 분자 메커니즘을 식별 하기 위해 광범위 하 게 사용 되었습니다. 파리 또한 인간의 neurodevelopmental 질병의 다양 한 모델을 성공적으로 사용 되어 왔습니다. 여기 우리는 단계별 기정, 고정, 및 성인 초파리 뇌 내 단백질의 immunofluorescent 지역화에 대 한 프로토콜을 설명합니다. 이 프로토콜 두 예제 신경 인구 버섯 몸 신경, 망막 대뇌에 집중 하 고 개별 버섯 몸 신경 Repressible 셀 마커 (MARCM) 기법으로 모자이크 분석을 사용 하 여 추적을 선택적 단계를 포함. 야생-타입 및 돌연변이 두뇌에서 예제 데이터 axonal 지도 결함에 대 한 채 점 기준의 간략 한 설명과 함께 표시 됩니다. 이 프로토콜 하이라이트 두 잘 설립 항 체 버섯 몸 및 포토 리셉터 뉴런, 다른 초파리 뇌 영역 및 다른 뇌 영역 내에서 단백질의 지 방화의 형태를 조사 하는 동안 수 있습니다. 이 프로토콜을 사용 하 여 조사.
서문
초파리 신 경계 인간과 설치류 보다 작습니다, 하지만 그 복잡성 척추 대응 이해를 강력 하 고 친근 한 모델을 제공 합니다. 대부분의 경우에서 척추와 파리의 게놈 신 시스템 개발의 메커니즘을 지정 하는 매우 비슷한 단백질을 인코딩합니다. 사실, 많은 유전자의 필요한 척추 신경 개발에 대 한 포함 하 여, 파리에 orthologs 관계가 신호 경로에 컨트롤 패턴, 성체, 및 axonal 지도1,2,3 ,,45. 예를 들어 netrin 포유류에 D. melanogaster6,,78axonal 지도에 필요한 ligand 이다. Netrin 미 발달 병아리 뇌 조직6에서 원래 고립 된 동안, 후속 연구 밝혀졌다 그 netrin 초파리8미 발달 중앙 신경 시스템 (CNS)의 개발 하는 동안 보존된 역할을 담당. 다른 연구 보존된 ligands와 초파리 및 척추 동물9길에 필요한 수용 체를 식별 하는 배아 초파리 CNS에서에서 유전 스크린을 사용 했습니다.
최근 작품의 많은 방법을 조사는 배아 비행 CNS는 ligands, 수용 체, 그리고 세포내 신호 단백질 axonal 안내8,9에 필요한 식별 하는 과거에 광범위 하 게 사용 되었다, 이 단백질은 또한 개발의 나중 단계 동안 길 결정을 제어합니다. 특히, 버섯 몸 (MB) 및 포토 리셉터 망막 신경 개발 (그림 1)의 조사는 제어 길, 시 냅 스 형성, 축 삭 가지 치기, 그리고 신경의 다른 여러 측면 메커니즘에 대 한 통찰력 제공 하고있다 개발10,11,12,13,14,15,,1617. 포토 리셉터 신경 세포는 lamina 라는 성인 두뇌의 지역에 비행 망막 연결 되며 골 수와 뇌 (18,19의 검토), 버섯 몸 신경 동안 시각적 정보를 릴레이 대 한 중요 한 중앙 비행 뇌에 위치 하 고 학습 및 메모리20,21에 필요한. 포토 리셉터 신경 및 Kenyon 셀 이라고 하는 버섯 시체의 내장 신경 그들의 시 냅 스 후 목표를 찾을 수 봤이 보존된 diffusible 연락처-종속 axonal 지도 및 메커니즘을 활용 합니다. 성인 파리에 표시 되 고, 이외에 포토 리셉터와 MB 뉴런 수 있습니다 또한 직접 구상 될 애벌레 및 번데기 항 체 또는 리포터 유전자22,23,,2425에. 쉽게 다른 발달 시간 지점에서 신경 세포의 두 집합을 시각화 하는 기능 신경 개발의 여러 측면에 대 한 최상의 모델으로 그들의 사용을 승진 했다.
정상적인 신 시스템 개발의 메커니즘을 이해 하는 모델로 사용 되 고, 이외에 최근 학문은 설명 했다 파리도 다양 한 허약한 X 증후군 (FXS)26 포함 하 여 인간의 질병의 정확한 모델로 사용할 수 있습니다. , 지적 장애 (ID)27,,2829,30,31, 그리고 다른 사람32. 예를 들어 ZC3H14의 분자 기능 연구, 최근 인간의 지적 장애에 연결 하는 유전자 만들었습니다 ZC3H14 ortholog의 Nab230라는 null 대립 유전자를 사용 하 여 ID의 비행 모델. 파리 Nab2 부족 심각한 메모리 장애가 있고, 인간 환자에서 관찰은 무슨 업과 확장 많은 꼬리, 또는 환자 파생 셀 라인33,34. 중요 한 것은, 파리 Nab2를 또한 부족 그들의 성인 버섯 시체34, 무슨 파리 FXS 증후군 유전자 FMR135부족에서 관찰은 유사한 심각한 두뇌 형태학 결함을 표시 합니다. 따라서, 파리는 정상적인 두뇌 개발 및 그것을 방해 하는 질병을 연구 하는 중요 한 모델 생물으로 사용할 수 있습니다.
마지막으로, 동작, 사용 가능한 유전 도구의 광대 한 배열을 함께 모니터링 높은 처리량 메서드의 액세스 가능성 확인 초파리 모델 유기 체와 같은 복잡 한 동작을 제어 하는 뇌 영역을 식별에 대 한 선택의 학습 및 메모리, 수 면, 구애, 갈증, 그리고 다른36,,3738,39. 비행 유전학의 "도구 상자"의 센터에 있는 1 개의 특히 유용한 도구가입니다 GAL4/UAS 체계 (그림 2). 이 시스템40,41 유전자 또는 transgenes 다운스트림의 상류 활성화 순서 (UAS)의 식을 높이기 위해 조직 특정 표현의 Gal4 transcriptional 활성 제를 사용 합니다. 이 시스템의 수정 허용, 예를 들어 정확 하 게 제어할 특정 뉴런42,43, overexpress 또는 노크 다운 관심44, 의 특정 유전자의 흥분 연구원 45, 실시간 칼슘 역학 vivo에서46, 분석 하 고 신경 계보41를 리포터 유전자를 표현. 또한 Repressible 셀 마커 (MARCM) 시스템12,47와 모자이크 분석의 창조에 대 한 허용 mitotic 재결합 GAL4/UAS 시스템의 조합입니다. MARCM는 axonal 지도12,47에 필요한 세포 신호 구성 요소를 식별 하기 위해 단일 신경 추적에 광범위 하 게 사용 되었습니다. 이들과 다른 기술을 신 경계 기능에 필요한 세포질 기계 장치에 다양 한 중요 한 통찰력 제공, 비록 대부분 필요는 초파리 뇌 먼저 수 해 부; 두뇌의 주의 제거는 두뇌 지구 사이 정확한 두뇌 형태학 및 연결 패턴을 유지 해야 합니다. 다음 프로토콜 사용으로 버섯 몸과 포토 리셉터 뉴런예 신경 인구로 안내 하는 절 개 하 고 immunofluorescent 성인 얼룩 초파리 두뇌.
프로토콜
1. 초파리 melanogaster 유전학 및 선택적 열 충격 절차
- 한 번
- 파리를 건너 고 F1 자손 부 화는, 여성 및/또는 적절 한 유전자 형의 남성 얻을. 조사 되 고 두뇌 지역에 따라 파리 매일 수집 해야 하 고 두뇌 연결성의 연령에 따라 또는 성적으로 동종이 형 패턴을 보다 쉽게 구분할 수 있도록 성별 구분.
참고: 옵션: 파리 Repressible 셀 마커 (MARCM) 분석 12 , 47, 배아, 애벌레, 모자이크 분석에 사용 되는 또는 pupae 열을 30-45 분 동안 37 ° C에서 충격 을된 해야 합니다. 유도 mitotic 재결합. MARCM 분석에 대 한 버섯의 특정 영역을 대상으로 하기 위해서는 12로 결정 하 고 그림 5 B에 명시 된 일정에 따라 열 충격을 초과 한다. MARCM를 사용 하 여 버섯 시체 외 두뇌 지역 조사를 하는 경우 파일럿 실험 열 충격 될 최적의 결정을 수행 되어야 합니다. 다음 단계는에 관해서는 작성 하는 동안 eclosed 파리, pharate 성인 수 있습니다 또한 수 해 부 번데기 케이스를 제거 되 면 다음이 단계를 사용 하 여.
2. 해 부 역 준비
- 위치와 소스 stereomicroscope 및 빛 섬유 광섬유 goosenecks 큰 벤치탑에 첨부. 꾸준한 손 움직임을 홍보 하 여 손을 감소 " 흔들어 " 해 부, 하는 동안 적절 한 손과 팔 나머지 공간을 현미경 주위 사용할 수 필수적입니다. 현미경 및 현미경의 기지와 벤치의 가장자리 사이 4-6 인치 양쪽에 약 8-10 인치 인지 확인.
- 채우기 2 또는 3 웰 스는 유리의 9 잘 또는 3-잘 접시 PTN 버퍼의 1.0 mL (0.1 M 나트륨 인산 버퍼 pH 7.2, 0.1% 비 계면 활성 제, 완전 한 버퍼 구성 요소에 대 한 자료 표 참조) 얼음 해 역 장소. 새로 해 부 두뇌가이 접시에 전송 되 고 정착 단계까지 저장.
- 참고: 라이브 이미징 필요한 경우 절 개 버퍼 인산 염 버퍼 식 염 수 (PBS) 또는 HL3 버퍼 48 x 1 이어야 한다. 세포내 단백질 지역화가 필요한 경우 PBS 또한 사용할 수 있습니다 대체 버퍼 해 부 및 고정. 다음 고정, 세포 막의 permeabilization 다음 수행 해야 0.1% 또는 0.3% 비 세제를 포함 하는 PTN 세척을 사용 하 여.
- 피 펫 팁 두뇌 microcentrifuge 관에 전송 하는 동안 플라스틱 피 펫 팁에 집착 하지 않도록 씻어 서 한 번 이상 (PTN) 등 세제를 포함 하는 버퍼를 해야 해 및 고정 PBS를 사용 하는 경우.
- 실리콘 탄성 중합체를 포함 하는 해 부 접시를 만들 빈 35 m m 유리 또는 플라스틱 페 트리 접시를 사용 하 여. 간단히, 믹스 제조 업체에 따라 탄성 중합체 구성 요소 ' s 방향, 35 mm 접시에 부 어 하 고 평평한 표면에 하룻밤 유해. 엘라 스토 머 해 부 요리를 포함 하는 집게는 집게와 유리 접시와 같은 더 표면 사이 접촉 경우 쉽게 손상 될 수 있는 해 부의 좋은 팁을 보호 하기 위해 사용 되어야 한다. 우리는 또한 정기적으로 온라인 소매 업체에서 상업적으로 사용 가능한 실리콘 코팅 요리를 구입. 해 동안 대비를 증가, 실리콘 엘라 스토 머 해 부 요리 사 숯 (그리고 따라서 컬러 블랙)를 포함 하는 특히 유용 합니다.
3. 성인 뇌 해 부 절차
- Anesthetize 3-5 일 오래 된 성인 D. melanogaster CO 2 또는 사용 하 여 얼음. 얼음을 사용 하 여, 유리병 파리를 포함 하는 것은 거꾸로 (아래 플러그 끝) ~ 5 분 얼음으로 유리병을 거꾸로 배치에 대 한 얼음 양동이에 방지 하는 장소에서 음식에 박 혀 되 고 파리. 일단 파리 anesthetized 되었습니다, 얼음에서 또는 플라이 패드 방출 CO 2에 차가운 금속 패드 또는 페 트리 접시 앉아에 파리 놓습니다. Neurodegeneration을 분석 하 고 머리를 해 부, 이전 파리 사용할 수도 있습니다.
- 만들 전송 피 펫 또는 p200 피 펫을 사용 하 여 해 부 접시의 중앙에 PTN의 소량 (150-200 µ L) 장소는 " 거품 " PTN의. stereomicroscope 아래 해 부 접시와 놓고, 조명 조정 PTN의 거품 보기의 필드를 채우고 고 균일 하 게 조명 집중.
- 파리를 조작 하는 그들은 "를 배 " (즉, 복 부 쪽) 금속 또는 CO 2 패드에 누워 있는 동안.
- #5 집게의 한 쌍을 사용 하 여 파악을 해 부 수, 유지 비행의 완전히 잠수함 그것은 PTN에서 해 부 접시에 파리의 복 부.
참고: 프로토콜의 나머지 부분에 대 한 모든 단계를 수행 해야 머리 PTN에 잠긴 동안. - 플라이 코의 파악 #5 집게의 두 번째 쌍을 사용 하 고 떨어져 시체에서 비행 머리를 분리 하려면 집게의 두 쌍. 복 부와 흉부를 삭제 합니다. 이 단계는 머리 나왔고는 PTN의 표면에 떠 허용 하지 중요 하다. 일단 머리에 떠 있는 그것은 매우 어려울 수 있습니다 두뇌를 분쇄 하지 않고 다시 파악.
참고:이 메서드를 사용 하 여 뇌와 복 부 신경 코드 간의 연결 절단 됩니다. CNS의 이러한 영역 간 그대로 연결 필요한 경우 50, 49 , 등의 대체 해 부 프로토콜을 따라야 한다. 코 머리 제거 되기 전에 비행 머리에서 분리, 구멍은 코가 있을 것입니다. 이 경우에, 비행 머리 한쪽 눈 근처 구멍의 가장자리에 파악. 서로 떨어져 집게의 두 쌍을 당기면 힘의 적당 한 금액을 사용 하 여 머리를 제거 합니다. 때때로, 머리는 신체에서 제거 되 면 본질적인 또는 복 부 신경 코드 남아 머리에 연결 된 및 해 부를 계속 하기 전에 제거 되어야 합니다. - 집게 한 쌍 코를 장악 하는 동안, 두 번째 쌍 바로 비행 눈의 중간 가장자리를 파악 한다. 천천히, 서로 떨어져 집게를 당겨. 이 단계는 안정 측면 힘의 작은 금액으로 수행 되어야 한다. 집게는 서로 그렇다 하 고 천천히 이동, 코 머리 떠나 고 머리 표 피에 중앙 구멍을 만들고 해야 합니다. 두 번째 쌍에서 오른쪽 눈의 중간 부분을 공개 하지 않고 코 집게의 첫 번째 쌍 삭제.
참고: 성인 D. melanogaster 두뇌는 꼬리에 (즉, 후부/후면) 비행 헤드의 지역. 머리의 그 지역 파악을 따라서, 피해 야 한다. 이상적으로,만 고 rostral (즉, 전면) 부분의 중간 망막 근처 머리는 겸 자에 의해 직접 파악 해야 한다. 두뇌와 관련된 기관 지금 표 피에 중앙 구멍을 통해 볼 수 있어야 합니다. 이 시점에서 기관 구멍에서 튀어나와의 흰색 힘 줄 스레드 수 제거 하 고 삭제. - 집게의 두 번째 쌍 (머리 표 피에 중앙 구멍의 가장자리)에서 왼쪽된 망막의 내측 가장자리를 잡고. 망막과 관련 된 표 피 제거, 180 ° 각도로 서로 멀리 집게를 당겨 천천히. 로 망막 기본 광 엽에서 분리, 당신은 긴장에 약간의 감소를 느껴야 한다. 천천히 찢 어 시 엽을 방지 하기 위해 진행.
참고:이 단계는 집게를 너무 빨리 분리의 찢 어에 발생할 수 있습니다.e 광 엽 또는 버섯 몸 구조의 중단. 때때로, 표 피를 제거 될 것 이다 하지만 망막의 광 엽에 연결 된 상태로 유지 됩니다. 버섯 시체를 이미징 하는 경우 완전히 전체 망막을 제거할 필요는 없습니다. 그러나, 다른 뇌 영역 (예: 광섬유 뇌 돌출부의 망막 신경 innervation)의 분석 48 , 51에 의해 설명 된 대로 완전히 제거 되 고 망막을 요구할 수 있습니다.
참고: 망막은 천천히 두뇌의 기본 광 엽에서 분리 해, 광 엽 해야 관찰 불투명 흰색 구조 백색, 힘 줄 기관으로 덮여 있습니다. 한 망막 제거 되었습니다 일단 삭제 될 수 있습니다. 분석할 때 망막 신경의 길, 광 엽 손상을 방지 하려면 특정 배려가 단계가지고 한다. 해 부에 초점을 맞춘 추가 프로토콜 및 포토 리셉터 뉴런의 라이브 이미징이 또한 사용할 수 48. - 이제 조심 스럽게 가능한 보이는 기도의 제거. 기도 포함 되어 또는 나중 부동 하 고, 잠재적으로, 나중에 immunostaining 단계 동안 손실 될 두뇌를 일으키는 공기를 채울 수 있습니다. #5 집게의 매우 날카로운 쌍을 사용 하 여 뇌에서 선택 기도 제거 하려면.
- 집게의 두 쌍을 사용 하 여 왼쪽된 비행 망막의 중간 영역을 파악 하 여 나머지 망막 및 주변 표 피를 제거 합니다. 신중 하 게 망막과 표 피 제거를 절반 망막 눈물. 어떤 경우에는 두뇌를 분쇄 하지 않고 남아 있는 표 피를 제거 증명 특히 도전 한다. 이러한 경우에 우리는 복 부 신경 코드의 나머지 가닥 대신 장악 될 수 있다 집게 한 쌍에 의해 집게의 다른 쌍 신중 하 게 표 피의 마지막을 제거 하는 동안 나타났습니다.
- PTN 포함 9 또는 3 잘 요리 한 잘 해 부 두뇌 이동 p200 피 펫을 사용 하 여. 동일한 유전자 형의 두뇌는 잘 동일에 함께 풀링된 고 얼음에 보관 해야 합니다. 뇌 조직의 해 부의 1 시간 이내 고정 되어야 한다. 머리 작은 배치에서 고정 하 고 두뇌의 많은 수 필요한 경우 풀링된 수 있습니다. 대부분의 경우에는 경험 있는 연구원 수 일반적으로 두뇌를 해 부와 약 3-5 분에 유리 컬렉션 접시에 그것을 전송
4. 고정 및 Immunofluorescent 얼룩이 절차
- 0.5 mL microcentrifuge 튜브 4% paraformaldehyde PTN에 희석의 0.5 mL 가득 9-잘 접시에서 해 부 두뇌를 전송 p200 피 펫을 사용 하 여. 동일한 유전자의 적어도 10-15 두뇌는 하나의 microcentrifuge 관으로 결합할 수 있습니다. (슬라이드에 두뇌의 장착)까지 모든 나머지 단계 0.5 ml microcentrifuge 튜브에 완료 됩니다.
주의: Paraformaldehyde (PFA) 증기 두건에서 처리 되어야 합니다. PFA 폐기물 저장 하 고 적절히 폐기 해야 합니다. 20 %paraformaldehyde 유리 ampules에 구입한 microcentrifuge 튜브에 aliquoted 및 필요한 때까지-20 ° C에서 저장 될 수 있습니다. - 증기 두건 안쪽 락을 실 온에서 느린 속도로 20 분 동안 4 %paraformaldehyde 두뇌를 품 어.
- 고정, 다음 중력에 의해 microcentrifuge 튜브의 하단에 정착을 두뇌 허용.
참고: 때때로, 두뇌 microcentrifuge 튜브의 측면에 충실 수 있습니다. 이 경우, 검지와 엄지 사이 튜브를 옆으로 회전 하거나 두뇌의 침 몰 홍보를 벤치에 관을 매우 부드럽게 일반적으로 도움이 됩니다. - 제거 정착 제는 p1000 사용 하 여 플라스틱 및 수행 2 " 빠른 " 세척 사이 microcentrifuge 튜브의 하단에 정착 하는 머리를 수 있도록 PTN의 500 µ L로 세척. 이러한 빠른 세척 하는 동안 모든 두뇌 microcentrifuge 튜브의 아래쪽에 중력에 의해 정착 되 면는 PTN 교환할 수 있습니다 즉시 신선한 버퍼; 추가 세척 시간은 필요 없습니다.
참고: 일반적으로, 뇌 제거를 걸고 하는 것이 좋습니다는 튜브에 여분의 버퍼를 떠나입니다. 피 펫 팁의 주의 깊은 검사 자주 없는 두뇌 튜브에서 잘못 제거 된 것을 보장 하기 위해 필요 합니다. 만약 두뇌 실수로 끝으로 pipetted, microcentrifuge 튜브에 다시 그들을 분배, 정착, 두뇌에 대 한 대기 및 다음 남아 있는 모든 여분의 PTN 제거 계속. - 마지막 빠른 세척 후 3을 수행을 p1000 피 펫을 사용 " 긴 " 세척: 로커/nutator에 실 온에서 PTN 및 20 분에 대 한 세척의 500 µ L를 추가. 모든 미래 " 긴 " 20 분 동안 세척 되어야 합니다.
참고: 다음이 세척, 머리 고정에 따라 저장 될 수 있습니다 하룻밤 PTN에서 4 ° C에서. - 마지막 세척 p1000 피 펫을 사용 하 여 제거 하 고 로커 또는 0.5 ml 차단 솔루션 [PTN + 5% 정상 염소 혈 청 (NGS)] 실내 온도에 적어도 30 분 동안 실 온에서 nutator에 두뇌를 품 어.
- 염소 2 차 항 체는 후속 프로토콜 단계에서 사용 됩니다. 다른 종에서 이차 항 체 사용 될 차단과 항 체 솔루션에 그 종 (보다는 NGS)에서 정상적인 혈 청 사용 해야 합니다.
- P1000 피 펫을 사용 하 여, 차단 솔루션을 제거 하 고 추가 PTN (PTN 5 %NGS + 희석된 주 항 체)에 희석 하는 주 항 체. 1 차적인 항 체를 사용 하 여 처음으로, 그 항 체의 최적의 희석 실험적으로 결정 되어야 합니다.
참고: 버섯 몸 신경, 시각화에 대 한 Fas2를 인식 하는 항 체 일반적으로 사용 됩니다. 이러한 항 체 항 1D 4 체로 발달 연구 Hybridoma 은행 (DSHB)에서 사용할 수 있습니다 및 PTN + 5% 희석된 1시 20분 해야 NGS.
참고: 포토 리셉터 뉴런을 시각화, chaoptin를 인식 하는 항 체 일반적으로 사용 됩니다. Chaoptin 항 체 항 체 24B10로 DSHB에서 사용할 수 있으며 PTN + 5% 희석된 1시 20분 해야 NGS.
참고: 고정 프로세스는 일반적으로 형광 녹색 형광 단백질 (GFP) 등 형광 단백질에서 제거합니다. 따라서, MARCM를 사용 하 여 개별 MB 뉴런의 axonal 지도 분석을 사용 항 체를 인식 하는 GFP. - 2-3 박 4 주 항 체 솔루션 로커/nutator에 있는 두뇌를 품 어 ° c.
- 1 차 항 체를 가진 외피, 다음 microcentrifuge 튜브의 하단에 정착 하 고 다음 주 항 체 솔루션을 제거 하 고 머리 허용.
- P1000 피 펫을 사용 하 여 수행 2 " 빠른 " 세척 및 3 " 긴 " 각 워시 사이 microcentrifuge 튜브의 아래쪽에 중력에 의해 정착 두뇌 신중 하 게 수 있도록 20 분 PTN의 0.5 mL로 세척 단계 4.4 및 4.5에서 위에서 설명한 대로,
- 적절 한 붙일 표시 된 이차 항 체와 실 온에서 3 h에 대 한 품 두뇌. 2 차 항 체는 일반적으로 0.5 ml PTN + 5% 희석 1: 200의 농도에서 NGS.
참고: 일단 형광등 2 차 항 체를 추가 두뇌에서에서 지켜져야 한다 실험의 나머지 부분에 대 한 어두운.
참고: 경우 잔여 GFP 형광 남아, 그것은 이차 항 체 fluorophore GFP로 비슷한 여기/방출 파장을 갖는 표시를 사용 하는 것이 좋습니다 MARCM 분석을 수행할 때에 (예를 들어, Fluoroscein isothyocyanate (FITC) 또는 Alexa488). - Microcentrifuge 튜브의 하단에 정착 하 고 이차 항 체 솔루션을 제거 하 고 머리를 허용 다음 이차 항 체 외피.
- 수행 2 " 빠른 " 세척 및 3 " 긴 " 각 워시 사이 microcentrifuge 튜브의 하단에 정착 머리 수 있도록 신중 하 게 단계 4.4 및 4.5에서 위에서 설명한 대로 20 분 PTN의 0.5 mL로 씻어,
- 다음 3 " 긴 " 20 분 세척, 사용 가능한 많은 버퍼를 제거 하는 p200 피 펫.
- 추가 75 µ L 형광 방지 페이드의 두뇌를 장착 중간. 피 펫 두뇌 그리고 혼합 한 번 피 펫 팁으로 장착 매체. 이후 두뇌 모자 또는 microcentrifuge 튜브의 측면에 갇혀 될 수 있습니다 튜브를 반전 하지 마십시오.
참고: 설치 매체에는 두뇌의 정지, 다음 관 수 fluorophore 냉각 속도를 알루미늄 호 일에 싸여 되며 4 ° C에서 밤새 껏 저장. 경우 필요한 두뇌 4 ° C에서 며칠 동안 저장 될 수 있다 하지만 이상적으로 마운트되어야 슬라이드에 최대한 빨리.
5. 현미경 슬라이드 및 이미징에 성인 D. melanogaster 두뇌 장착
- 빌드는 " 다리 " 슬라이드. 2 위치 " 기본 " coverslips 대략 1 cm 충전 된 슬라이드에 떨어져. 슬라이드의 충전 된 측 직면 하 고 있는지 확인 합니다. 그림 3 A와 같이 손톱 폴란드어와 슬라이드를 coverslips를 준수 합니다. 이러한 기본 커버 전표에서 하지 심지 않는 미디어 장착 되도록 손톱 폴란드어와 각 기본 커버 슬립의 3 개의 외부 가장자리를 밀봉 하기 위하여 일반적으로 도움이 된다. 손톱 폴란드어 건조 보자 (10-15 분) 진행 하기 전에.
- 는 stereomicroscope 아래 슬라이드를 배치 하 고 해 부 두뇌를 포함 하는 두 개의 coverslips 사이 공간으로 설치 미디어 솔루션 플라스틱. 제공 하기 위해 더 많은 반면, 유용 벤치 탑과 평행 되도록 목이 빛을 기 동시 키는 것.
- 제거를 피 펫을 사용 하 여 슬라이드에서 미디어를 추가 장착 되는 슬라이드 두뇌 플라스틱 하지 않도록 주의.
- 심지 떨어져 추가 설치 미디어입니다. 이것은 두뇌를 다음 단계 더 정확 하 게 배치할 수.
- 한 쌍의 집게와 stereomicroscope를 사용 하 여 세를 직면 하는 더듬이 돌출부와 그리드 패턴에서 슬라이드에 머리 위치
- 장소 커버 슬립 (는 " 다리 ") ( 그림 3 A) 두뇌에. 다리 커버 슬립의 측면을 봉인 하기 위해 손톱 폴란드어를 사용 하 여 어디에 그들은 문의 " 기본 " 커버 전표.
- 신선한 설치 미디어 ( 그림 3 B) 다리 아래 센터 구멍 채우기 천천히 p200 피 펫을 사용 하 여. 센터 coverslip의 오픈 가장자리에 한 번에 한 방울을 놓고 장착 미디어 센터 브리지 coverslip 아래 심지를 허용 합니다. 전체 캐비티 미디어, 장착으로 채워질 때까지 계속 다음 위쪽 인감 및 분명 손톱 폴란드어와 아래쪽.
- 손톱 폴란드어 건조 되 면, 즉시 슬라이드 이미지 또는-20에서 광선이 꽉 슬라이드 상자에 저장할 ° c.
- 1 주일 이내 두뇌 여기 레이저와 레이저 검사 confocal 현미경을 사용 하 여 이미지 및 큐브 선택한 형광 이차 항 체에 적절 한 필터. 버섯 몸 뉴런의 Z-스택 이미지 20 X 40 X 목표를 사용 하 여 얻을 수 있습니다 일반적으로. 포토 리셉터 망막 신경 세포 이미징 높은 확대를 요구할 수 있습니다.
결과
위에서 설명한 방법을 성인 초파리 뇌의 거의 모든 지역의 안정적이 고 재현 가능한 시각화 수 있습니다. 여기 우리는 초점을 버섯 몸과 포토 리셉터 신경, 하지만 다른 연구는 동위 intercerebralis52,54, 클록의 뉴런53,같은 뇌 영역을 시각화 하기 위해 유사한 방법을 사용 및 더듬이 엽 프로젝션 뉴런55, 많은 다른 사람의 사이에서. 중요 한 것은,이 기술은 전체 뇌 구조 뿐만 아니라 개별 뉴런 MARCM12,47같은 기술을 사용 하 여 그 구조 내에서 시각화를 사용할 수 있습니다. 그림 4, 그림 5, 그림 6 이 해 부 및 immunostaining 기술을 사용 하 여 생성 될 수 있는 성인 두뇌에서 버섯 몸과 포토 리셉터 뉴런에서 여러 가지 종류의 데이터를 보여줍니다.
첫째, 위에서 설명한 방법은 직접 버섯 몸 형태 Fasciculin 2 (Fas2)을 인식 하는 항 체 또는 버섯 몸 신경34표현 리포터 유전자를 사용 하 여 시각화를 사용할 수 있습니다. 그림 4A 에 그림 4B, Fas2 항 체는 α, β, 시각화를 사용할 수 있습니다 그리고 (조금 적게)를 같이 성인에서 버섯의 γ 돌출부 초파리 두뇌. Fas2 세포 세포 접착 단백질 신경 fasciculation에 필요한 고는 α와 β 돌출부23,,5657의 높은 수준에서 표시 됩니다 그것은이 버섯의 안정적이 고 확고 마커 몸 신경입니다. 특히, 성인 뇌의 중앙 지역에 있는 원형 모양의 둥글지 몸 수 있습니다 또한 구상 될이 항 체(그림 4)를사용 하 여.
결함 axonal 지도 단백질에는 종종 불완전 침투 버섯 몸 돌연변이 고기15,,3435원인이 됩니다. 따라서, 대부분의 경우, 몇몇 다스 두뇌 몇 군데와 있어야 분석 합니다. 예를 들어 Nab2 null 파리의 버섯 몸 β 엽 축 삭에는 부적절 하 게 뇌 중간 선 교차. 이 "크로스 오버" 또는 β 엽 "퓨전" 형은 일반적으로 관찰 성인 Nab2 null 파리 하지만 주로 야생-타입 컨트롤에서 결 석 하 고 분류 될 수 있다 ~ 80%로 약간의 보통 또는 퓨전34를 완료 합니다. 중간 선 걸쳐 β 돌출부의 "융해" 반대 두뇌 반구에 축 삭의 잘못 된 contralateral 투영에서 유래한 다. 그림 4C 에에34,35, 같이 약간의 퓨전 적당 한 퓨전 더 실질적으로 연결 된 β 돌출부를 말합니다. "Fas2 양성 섬유의 얇은 가닥"에 의해 연결 된 β 돌출부를 말합니다. 그는 중간에 약간 감소 엽 두께 표시합니다. 완전 한 (또는 "극단적인") 퓨전 완전히 연결 된 엽 두께 또는 Fas2는 중간에 얼룩에 감소를 보여 β 돌출부를 의미 합니다. 버섯 몸 β 엽 퓨전의 계량 하 고 같이 34,35 또는 형태학의 각 종류를 보여주는 두뇌의 백분율을 보여 주는 테이블을 표시 수 있습니다.
Fas2 항 체와 얼룩, 뿐만 아니라 MARCM 기술12,,4748 또한 버섯 몸 돌출부 내의 개별 GFP+ 신경의 축 삭 지도 결정을 시각화 하기 위해 사용할 수 있습니다. MARCM 개별 뉴런 또는 신경, GFP (그림 5A)로 표시 된 clonally 관련된 그룹을 만들을 개발 하는 동안 mitotic 재결합을 활용 합니다. MARCM는 완전히 다르게 heterozygous 비행 내 단백질 부족 신경 세포의 작은 수를 생성 하는 방법을 제공 합니다. 따라서,이 기술은 또한 전반적인 organismal 생존12,47필수 단백질의 axonal 지도 기능 분석에 특히 유용 했습니다. GFP로 표시 된 homozygous null 뉴런 뉴런 야생-타입 유전자 배경에서 GFP로 표시 된 제어를 직접 비교할 수 있습니다. 또한 때 개발 유 충 이나 번데기는 열 충격, 따라 뉴런 수 버섯 신체의 다른 클래스 (그림 5B) 대상.
이 기술을 사용 하 여 생성 된 데이터의 종류의 예는 그림 5C, 야생-타입 (즉, 제어) MARCM 복제 예를 들어 생성 됩니다에 표시 됩니다. 그림 5C, f 1을 개발 하는 개별 GFP+ 버섯 몸 신경 생성 하 애벌레 처음 25 ° c.에 보관 했다 애벌레 부 화 후 약 5-6 일 (ALH), pupae 했다 열 37 ° C에서 30 분에 대 한 충격을 일수로까지 25 ° C에 반환. 성인 부 화에 따라 두뇌 PTN에서 해 부, 고정 되었고 동시에 Fas2를 인식 하는 항 체와 알을 품 (1D 4, 희석 PTN 1시 20분) 그리고 GFP (PTN에 희석된 1: 500). 두뇌 이차 항 체와 인 큐베이 팅 그리고 위에서 설명한 대로 슬라이드에 장착 했다. GFP+ 세포 발견 했다 레이저 검사 confocal 현미경을 사용 하 여 몇 군데와 최대 강도 예측 ImageJ를 사용 하 여 만들어진. 그림 5C, 제어 GFP+ 시연으로 뉴런 α와 β 돌출부에서 생성 된 Fas2와 colocalize 고 두 초파리 뇌 반구를 구분 하는 중간에 연락 하기 전에 종료. 단일 축 삭 프로젝트 anteriorly, 분기, 및 다음 프로젝트 모두 dorsally 및 medially 형태는 α와 β 돌출부를 한다. 여러 이전 연구 여부를 특정 단백질 axonogenesis, 확장, 길, 분기, 또는 정리10,등의 여러 측면에 대 한 자율적으로 세포 분열을 공부 하는 데 필요한 조사를이 기술을 사용합니다 11,12,13,14,15,,1617,34.
버섯 몸 뿐만 아니라 망막 포토 리셉터 뉴런 (R-세포)의 axonal 길 결정 또한 구상 될 수 있다 위 (뿐만 아니라 해 부 방법 데로 설명 하는 절 개 방법을 사용 하 여참조48에 scribed). 비행 눈 내 각 ommatidia 포함 3 그룹 (그림 1)으로 분류 될 수 있다 8 포토 리셉터 뉴런: 뇌 광 엽;의 피상적인 lamina에 축 삭 프로젝트 R1-r 6 셀 R7 셀 axons 정도;의 깊은 M6 레이어에 프로젝트 그리고 프로젝트 축 삭 모19,58의 중간 m 3 층에 R8 셀. 포토 리셉터의 각 클래스의 투영 패턴을 광범위 하 게 공부 하 고 함께 이러한 뉴런 성공적으로 사용 되었습니다 모델 축 삭 지도19,59에 관련 된 신호 전달 경로 이해 하. 중요 한 것은, 모든 포토 리셉터 axons 구상 될 수 있다 쉽게 해 부 초파리 두뇌에 성인, 번데기, immunostaining에 의해 또는 애벌레 조직 항 체를 사용 하 여 그 인식 하는 chaoptin, 셀 표면 당단백질24, 60 , 61. 리포터 유전자 표현 GFP 또는 각 R-세포 유형 (R1 ~ R6, R7, R8 셀)에서 β-galactosidase 또한 건설 및 포토 리셉터62의 각 클래스를 시각화 하는 데 사용할 수 있습니다. 각 유형의 R-셀 개발 광 엽의 다른 계층에서 종료, 이후이 기자 각 셀 입력 올바르게 대상에 필요한 신호 통로의 상세한 비교에 대 한 수 있다. (이 모든 포토 리셉터 신경 세포의 표식으로 사용 될 수 있다) chaoptin 지역화와 함께에서 이러한 리포터 유전자의 두 생산 식 패턴의 예는 그림 6에 표시 됩니다. R7 대뇌를 시각화 하려면 두뇌 R7 전용 Rhodopsin4 LacZ 취재 원 유전자를 포함 하는 해 부 되었고 chaoptin 및 β-galactosidase 항 체와 스테인드. Rhodopsin 4 (Rh4) R7 셀63;의 하위 집합에서 구체적으로 표현 Rh4 발기인만이 세포에 리포터 유전자 발현을 따라서 사용할 수 있습니다. 예상 했던 대로, R7 셀 모 (노란 점선 그림 6으로 표시)의 깊은 M6 계층에서 종료 합니다. 마찬가지로, 두뇌는 R8 대뇌63에서 구체적으로 표현, 해 부 했다 Rhodopsin 6 (Rh6) 발기인에서 β-galactosidase 및 immunostained chaoptin를 인식 하는 항 체를 사용 하 여 표현 하 고 Β-galactosidase입니다. 그림 6에서 같이, R8 대뇌의 r 3 계층에서 종료는정도. 여기에 표시 되지, 비록 Rh1 LacZ 시각화는 lamina에 r 1-r 6 대뇌의 종료를 또한 사용할 수 있습니다.
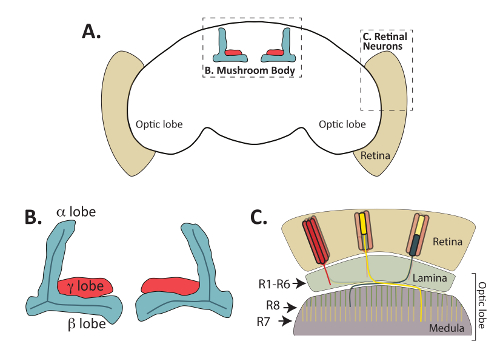
그림 1: 성인 초파리 melanogaster 뇌 기능적으로 뚜렷한 하지만 상호 지역 이루어져 있다. (A) 성인 D. melanogaster 의 개요 뇌를 위치한 버섯 몸과 주변 망막 포토 리셉터 뉴런 강조 표시 됩니다. (B) Fas2 항 체에 의해 인식 되는 (돌출부 라고도 함) 성인 버섯 몸 축 삭 번들의 확대 다이어그램. Kenyon 셀 이라고 하는 버섯 시체의 내장 신경 축 삭 anteriorly dorsally 위치 셀 시체 (셀 시체가이 다이어그램에서 생략)에서 프로젝트 고유 엽 구조를 형성 하 고. 두뇌의 축 삭의 단일 중간 번들에서 γ 돌출부 (에 표시 된 빨간색) 양식 등 α와 단일 축 삭에서 중간 β 돌출부 (에 표시 된 파란색) 형태는 분기 길 과정. Α ' / β' 뉴런 개발 axonal 돌출부를 부분적으로 α/β 뉴런의 중복 하지만 Fas2 항 체에 의해 인식 되지 않습니다이 다이어그램에서 생략 됩니다. (C) 망막 신경 세포는 광 엽에 망막에서 시각 정보를 릴레이에 중요 합니다. Lamina 또는 수 질에 포스트 시 냅 스 대상 세포와 망막 (베이지색) 및 양식 연결에 위치한 셀 시체에서 축 삭 프로젝트. R1 R6 포토 리셉터 세포 (빨간색으로 표시) 양식 특정 연결 광 엽의 외부 층에 있는 세포는 lamina를 라고 합니다. R7 포토 리셉터 세포는 모 수의 m 6 층에 대상이 (노란색) 냅 R8 셀 (녹색에서 표시) 프로젝트 축 삭 모 수의 약간 더 표면 m 3 층을 하는 동안. 맥 밀란 발행인 주식 회사에서 허가 의해 적응 C 부: 자연 신경 과학 (64참조, (2011) 저작권). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
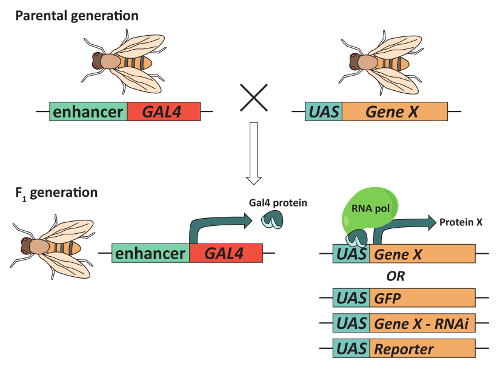
그림 2: 대상된 유전자 발현의에 GAL4/UAS 시스템은 사용할 수 있습니다. 조직의 특정 패턴에 관심 ("유전자 X")의 유전자를 표현 하는 파리를, 파리 포함 되어 있어야 합니다 조직의 특정 증강의 통제 Gal4 transcriptional 활성 제 단백질을 표현 하는 transgene와 transgene Gal4 DNA를 포함 하 바인딩 순서 (상류 활성화 순서 또는 UAS 라고) 인접 한 유전자 X. 일반적으로,이 조합은 각각 하나의 transgene를 포함 하는 부모의 파리 짝짓기 하 고 둘 다를 포함 하는 F1 자손에 대 한 선택 하 여 이루어집니다. 결과 F1 세대에 Gal4 표현 될 것 이다 하 고 조직 특정 방법에 있는 유전자의 전사를 활성화 하는 UAS에 바인딩하는 것입니다. 중요 한 것은, 다른 포함 하는 UAS transgenes는 동일한 GAL4 "드라이버"와 함께에서 사용할 수 있습니다. 예를 들어 버섯 시체 (MBs)에 Gal4 표현 transgene 급행 GFP, RNA 간섭를 사용 하 여 관심사의 유전자의 표현 눕힌 transgene 또는 기자를 생산 하는 UAS transgene를 포함 하는 UAS transgene와 결합할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
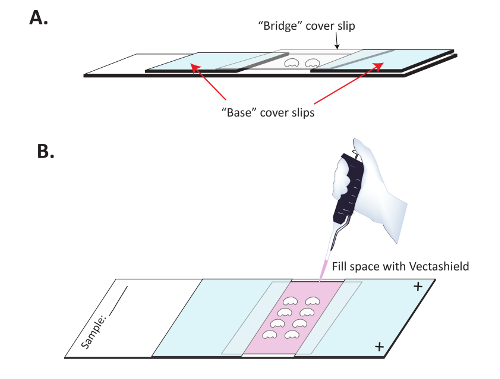
그림 3 : 면역 형광 이미징에 대 한 준비에 머리를 장착. (A) 두뇌 두뇌의 병합을 방지 하기 위해 다리 커버 SuperFrost 플러스 슬라이드에 거치 된다. 2 개의 "기본" 표지 전표 Superfrost 플러스 긍정적으로 위탁 슬라이드 분명 손톱 폴란드어와 준수는 고 해 부 두뇌 다음 그들 사이의 슬라이드에 배치 됩니다. 분명 "다리" 커버 슬립은 머리 위에 배치 하 고 기본 커버 슬립을. (B) 한 번 손톱 폴란드어 건조 했다, Vectashield는 이차 항 체의 형광을 유지 하기 위해 다리 아래 pipetted 천천히. 분명 손톱 폴란드어 다음 위쪽 및 아래쪽의 "다리" 커버 슬립을 봉인 하는 데 사용 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
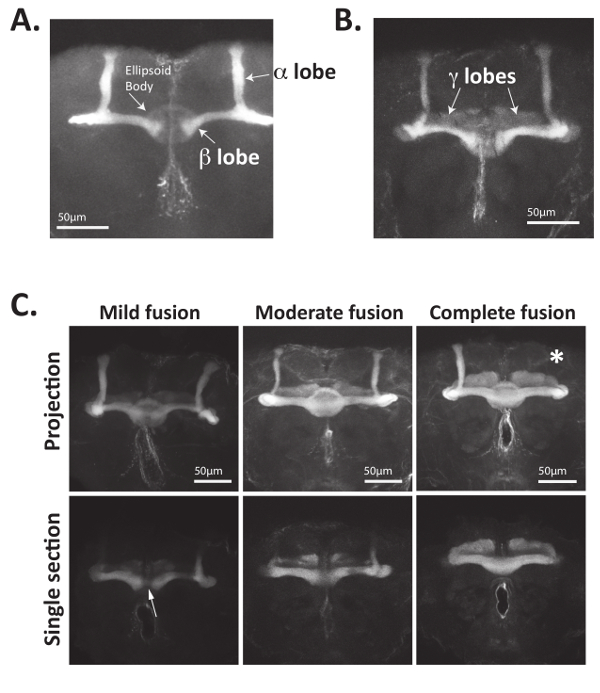
그림 4: Fas2를 인식 하는 항 체를 사용 하 여 버섯 몸 축 삭을 명확 하 게 구상 될 수 있다. (A) 성인 초파리 두뇌 했다 해 부, 고정, 및 Fas2를 인식 하는 항 체와 알을 품을. 1 차 항 체는 Alexa488 결합 염소-안티-마우스 2 차 항 체를 사용 하 여 인식 되었다 고 두뇌 긍정적으로 위탁 슬라이드에 거치 되었다 confocal 현미경 스캐닝 레이저를 사용 하 여 몇 군데. Bisymmetrically 있는 버섯 본문 셀 axons anteriorly 확장, 분기, 몸과 축 색 다발 (엽이 라고도 함)를 형성. Α 돌출부 dorsally 예상 및 medially 예상 β 돌출부를 형성 하는 축 삭 Fas2 익스프레스. 비판적으로, β 돌출부 야생-타입 파리의 뇌 중간 선 전에 종료합니다. 위치한 둥글지 몸 또한 구상 될 수 있다 1D 4를 사용 하 여 항 체. (B) medially 예상 γ 엽 축 삭의 성인 초파리 버섯 몸 또한 Fas2 익스프레스와 1D 4를 사용 하 여 구상 될 수 있다 항 체. 일반적으로, γ 엽 축 삭에 Fas2의 식 α와 β 돌출부의 그것 보다 작습니다. Nab2-null 두뇌의 (C) 버섯 몸 축 삭 (유전자 형: Nab2e x 3/Nab2e x 3) contralaterally 프로젝트 잘못 하 고 부족 한 돌출부. Nab2-null 두뇌 했다 해 부, 고정, 및 1D 4 물 버섯 몸 α, β, γ 돌출부를 시각화 하기 위해 항 체. 최대 강도 Z 스택 예측 뿐만 아니라 개별 광학 섹션 중간 지역에 초점을 맞춘 표시 됩니다. 야생-타입 버섯 몸 β 엽 축 삭은 거의 뇌 중간 선 교차, Nab2-null 두뇌 "융합된" β 돌출부의 결과로 contralateral 두뇌 반구에 중간에 걸쳐 다양 한 양의 잘못 투영가지고. 가벼운 퓨전 참조 참조34,35에 정의 된 대로 <만 여러 "물가" 중간, 중간 퓨전 교차 하는 축 삭의 β 엽 Fas2 긍정적인 β 엽 신경 뇌 중간 하지만 β 엽을 교차 하는 상황을 말합니다 중간 선 폭 감소 하 고 완벽 한 퓨전 상황 의미 돌출부 크로스 뇌 중간 β 엽 두께의 감소는. 둥글지 몸 또한 Fas2 표현 하 고, 이후 중간 선 보여주는 광학 섹션은 종종 더 β 엽 퓨전을 시각화 하는 데 유용. 특히, 누락 된 돌출부 (여기 흰색 별표가 표시 됨)도 자주 관찰 된다. C에 데이터 참조34, 허가에서 버섯 몸 고기의 정량화에 사용 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
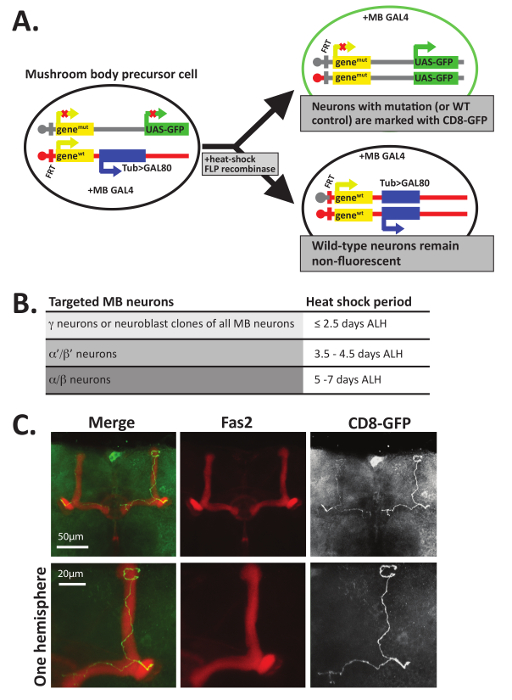
그림 5 : MARCM 단일 뉴런의 축 삭을 시각화 하는 데 사용할 수 있습니다. 두 가지 딸 세포를 만드는 데는 Repressible 셀 마커 (MARCM)를 사용 하 여 FLP recombinase 중재 mitotic 재결합 FRT 사이트에서 함께 (A) 모자이크 분석. 이 예제에서는 모든 셀 별도 염색체에 버섯 몸 전용 GAL4 단백질을 포함. 세포 분열 동안 mitotic 재결합, 다음 한 딸 셀 (맨 위) 표현 하는 GFP (또는 막 바인딩된 CD8-GFP) 및 다른 딸 셀 (아래) 두 야생-타입 (WT) 대립 유전자를 상속 하는 동안, 관심사의 유전자의 2 개의 돌연변이 체 대립 유전자를 포함 하는 고 transgene tubulin 발기인을 사용 하 여 Gal80 단백질을 표현. Gal80 억제 Gal4, 그래서 Gal80 생산 셀 비 형광 되며 heterozygous 또는 homozygous 야생-타입 이어야 한다. GFP+ 셀만은 돌연변이 체 대립 유전자의 두 복사본을 포함 합니다. Note는 또한 관심사의 유전자의 2 개의 돌연변이 체 대립 유전자를 포함 하는 GFP+ 셀을 생성 하기 위한 여러 가지 방법 중 하나만 표시 됩니다. 12,,4556 에 대 한 다른 예를 참조 하십시오. (B) α와 γ 뉴런, 버섯 몸 신경의 개발 시작 이후 ' / β' 뉴런, α/β 뉴런, 뉴런의 각 클래스와 끝 수 선택적으로 표적으로 고 열 다른 발달 시간 지점에서 충격적인 시각. 12에 설명 된 대로 ≤2.5 일 후 애벌레 해칭 (ALH)은 특히 γ 표적; 신경, 3.5-4.5 일 ALH (후반 L3 애벌레 단계)에서 발생 하는 열 충격 동안에 발생 하는 37 ° C에서 40 분 열 충격 α 대상 것입니다 ' / β' 뉴런, 그리고 충격 그 오 열 (번데기 개발) 중 5-7 일 ALH 사이 ccurs α/β 뉴런을 타겟으로 합니다. (C) 개별 야생-타입 축 삭 MARCM를 사용 하 여 시각화 했다. 야생-타입 ~ 5-6 일 오래 된 번데기 (유전자 형: hsFLP, UAS-CD8-GFP; FRT82B, UAS-CD8-GFP/FRT82B, 욕조 > Gal80; OK107-GAL4/+) 열 mitotic 재결합을 유도 하기 위해 40 분 동안 37 ° C에서 충격을 했다. 머리 해 부, 고정 되었고 GFP (1: 500) 및 Fas2를 인식 하는 항 체 물 (1:20). 두뇌 붙일 붙인된 2 차 항 체를 incubated 그리고 confocal 현미경 검사 법에 의해 시각화 했다. 이 예제 데이터 "제어" 유전자 형, GFP 긍정적인 MARCM를 사용 하 여 생성 하는 세포는 야생-타입 유전자mut 의 2 개의 대립 유전자를 포함 하는 대신, 두 유전자WT 대립 유전자 포함. 버섯 몸 β 돌출부 (Fas2를 인식 하는 항 체를 사용 하 여 시각); 뇌 중간에 도달 하기 전에 종료 Α 엽 신경은 또한 존재 한다. 더 자세히 보려면, 하나의 두뇌 반구에 비추어 확대 표시 됩니다 이미지의 맨 아래 행에. 파트 C 참조34허가 적응 시켰다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
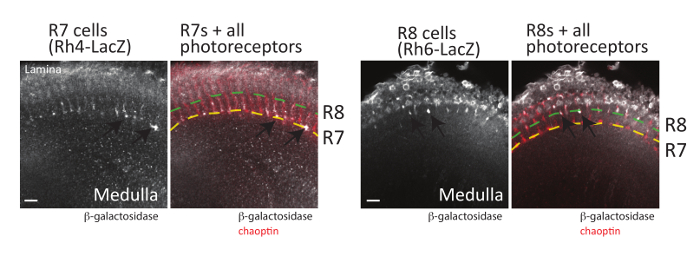
그림 6 : 포토 리셉터 axons 시각도 있습니다. 성인 두뇌 표현 β-galactosidase R7 대뇌 (왼쪽, Rh4 LacZ를 사용 하 여) 또는 R8 대뇌 (오른쪽, Rh6 LacZ를 사용 하 여) 해 부, 고정, 및 β-galactosidase 또는 chaoptin를 인식 하는 항 체와 알을 품을 했다. 두뇌 붙일 붙인된 2 차 항 체를 incubated 그리고 레이저 confocal 현미경 검사 법을 검사 하 여 시각화 했다. 단일 광학 섹션은 각 뇌에서 표시 됩니다. 왼쪽에 여러 R7 포토 리셉터 축 삭 (화살표) 볼 수 있습니다 (노란 점선 표시) 모 수의 깊은 M6 계층에서 종료. 오른쪽에 R8 포토 리셉터 축 삭 (화살표) (녹색 점선으로 표시 된) 모 수의 외부 m 3 층에서 종료 합니다. R7 대뇌 익스프레스 중 Rh3 또는 Rh4, R8 대뇌 익스프레스 Rh6 또는 Rh563, 이후 모든 R7 또는 r 8 대뇌 단일 LacZ 취재 원 유전자를 사용 하 여 구상 될 수 없습니다. 스케일 바 = 10 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
위에서 설명한 해 부 및 시각화 방법을 immunostaining의 다양 한에서 사용할 수 있습니다 하 고 이미징 응용 프로그램을 라이브. 우리 일반 immunostaining 프로토콜을 설명 했습니다 하 고 있는 MARCM를 사용할 수 있는 개별 버섯 몸 뉴런의 axonal 형태를 시각화 하는 방법 중 하나를 강조 했습니다. 또한, 다른 뇌 영역에서 고정 된 이미지에 대 한 이러한 일반적인 절차를 사용하실 수 있습니다 또는 갓 해 부 성인 두뇌48,65. 예를 들어 증강 트랩, 리포터 유전자 또는 모방 라인66의 표현 패턴을 분석할 때 라이브 영상 보다 효율적인 접근을 제공할 수 있습니다. 방지 하기 위해 떼어낸된 조직에서 GFP의 라이브 영상 동안에 세포 죽음에서 아티팩트를 캡처, 두뇌 인산 염 버퍼 식 염 수 (PBS) 또는 HL3 미디어48x 1에 해 부, 다리 슬라이드 PBS (또는 HL3), x 1에 탑재 된 고 미만 15-20 분 관리에에서 몇 군데 또한 GFP 형광의 시각화를 방해할 수 있기 때문에, 이미징, 이전 해 부 두뇌에서 가능한 많은 기도 제거로 이동 한다.
버섯 몸과 포토 리셉터 뉴런의 형태를 평가 하기 위한 얼룩 조건이 상대적으로 잘 설립24,61,67이 셀에 대 한 관심의 특정 단백질의 지역화 하는 동안 종류는 광범위 한 문제 해결 및 최적화 필요할 수 있습니다. 특히, 항 체 희석, 차단 버퍼 구성 요소 농도, 및 고정를 포함 하 여 몇 가지 중요 한 단계는 가장 재현 가능 하 고 신뢰할 수 있는 결과를 생성 최적화 되어야 합니다. 첫째, 기본 항 체의 최적 농도 결정 되어야 합니다. 비록 상업적으로 사용할 수 있는 항 체 자주 권장된 희석 (그리고 우리는 종종 처음 그 농도 사용 하 여 시작), 초파리 조직에 이러한 값 경험적으로 결정 거의 됩니다. 따라서, 테스트 범위 위와 제조업체의 시작 제안 자주 아래 좀 더 구체적인 얼룩이 지기 귀착되는 1 차적인 항 체 희석의 시리즈. 1 차적인 항 체 희석 얼룩 정확도에 큰 영향을 미칠 수 있습니다 정확 하 게 결정 되어야, 시간 두뇌는 포함 하는 1 차적인 항 체에서 알을 품을 하는 동안 솔루션 전체 결과에 거의 영향와 상당히 달라질 수 있습니다. 잠복기 해 부 Fas2 항 체 1 차적인 항 체와 두뇌 2, 3, 4 ° c.에도 4 일 때 예를 들어 우리가 비슷한 결과 관찰 해야 적어도 2 박 권장, 하지만 우리는 밤에 대 한 1 차적인 항 체 솔루션에 두뇌를 incubated 또한 있고 재현 얼룩을 얻은. 중요 한 것은, 두뇌는 실내 온도 (또는 4 ° C에서 1 박) 3 h 이차 항 체에 알을 품을 하는 시간의 양을 제한 뇌 조직에도 일반적인 바인딩을 2 차 항 체의 도움이 됩니다.
둘째, 그것은 제거 원치 않는 배경 신호를 추가 "차단" 시 약을 사용 하 여 필요할 수 있습니다. 옵션 ~ 10%, 1-10% 소 혈 청 알 부 민 (BSA) 또는 추가 하는 차단 및 1 차/2 항 체 솔루션, 초파리 배아 (참조 4 ° C에서 하룻밤 주 항 체의 사전 흡착 NGS의 농도 증가 등 참조68, 단원 2.9, 3 단계).
모든 고정을 위한 제안 버퍼 PTN를 사용 하 여 위의 프로토콜을 작성 하는 동안 세척, 그리고 항 체 외피 단계, 조직 고정 (PLP, PEM, 자료 테이블에 나열 된) 등 다른 버퍼에 심오한 차이 발생할 수 있습니다. 신호 강도입니다. 예를 들어 이전 학문은 E 조직, PBS에 희석 하는 전통적인 4 %paraformaldehyde 고정 때 애벌레 imaginal 디스크에서 감지 되지 않습니다 하지만 조직 PLP 버퍼 (켄 Moberg, 개인 고정 때 명확 하 게 표시 됩니다 설명 했다 통신, 및69참조). 버퍼에 변화 뿐만 아니라 조직 고정도 크게 영향을 미칠 수 immunofluorescent에 대 한 시간과 온도 변경 하는 구성 요소 얼룩 하 고 필요한 경우 경험적으로 결정 될 수 있다. 일반적으로, 고정 시간 충분 세포 구성 성분의 충분 한 가교에 대 한 및 장기적인 유지 관리 하면서 전반적인 세포 형태학의 제한 이상 가교 및 단백질 epitopes의 "매장"을 방지 하기 위해 충분. 따라서, 처음 새로 구입한 1 차 항 체에 대 한 착 조건을 최적화, 우리 일반적으로 정착 시간 약 20 분을 제한 하 고 종종 추운 온도에서 조직을 고정 시킬 것 이다.
몇 가지 컨트롤이 어떤 면역 형광 실험 관찰된 표현 형에 transgenes/유전 배경 효과 뿐만 아니라 1 차 및 이차 항 체의 특이성 조사에 포함 되어야 합니다. 특히 사용 되 고 기본 항 체 관심사의 단백질을 인식 하는지 여부를 확인, 파리 부족이 단백질 또는 단백질 overexpressing 조직에서에서 조직 컨트롤로 포함 되어야 합니다. 초과 순화 된 항 원 단백질의 1 차적인 항 체 비행 두뇌에서 다른 epitopes를 인식 하는지 여부를 확인 하려면 포함할 수 있습니다. 마지막으로, 모든 형광 신호 1 차 항 체는 생략 하는 경우 현재 선택한 2 차 항 체에 의해 일반적인 바인딩 수준을 나타냅니다.
몇 가지 중요 한 컨트롤 또한 유전 배경 기여 또는 transgenes 착 강도 또는 신경 형태학의 존재를 평가 하기 위해 포함 되어야 합니다. 예를 들어 그림 5 에서 MARCM 실험에 사용 되는 파리에는 여러 transgenes (hsFLP, UAS-CD8-GFP, FRT82B, 욕조 > GAL80, 및 OK107 GAL4), 각각의 버섯 몸 형태에 대 한 효과 대 한 별도로 분석 해야 합니다. 파리의 아주 최소, 버섯 몸 형태에 OK107 GAL4 및 UAS-CD8-GFP를 분석 되어야 합니다. 열 충격의 효과 평가 하기 위해 해야 할 수도 있습니다를 Flp recombinase 생산 분석 하 여 버섯 몸 개발에 포함 하는 hsFLP 및 FRT82B 있습니다. MARCM는 주어진된 단백질 axonal 지도 제어 하는 여부에 자율적으로 중요 한 통찰력을 제공할 수 있습니다,이 결론을 정확 하 게 확인 하는 데 필요한 컨트롤 수가이 기술의 마이너 제한 수 있습니다. 덜 복잡 한 실험에서 유사한 컨트롤 또한 적용 됩니다. 예를 들어 GAL4/UAS 시스템은 모든 신경 세포의 단백질의 최저의 식 RNAi transgene와 함께에서 사용 되는 실험 걸릴. 이 실험에서 두 개 이상의 transgenes 있을 것입니다: elav GAL4 등 UAS RNAi transgene 팬 신경 GAL4 드라이버. 포함 하는 각 이러한 transgenes 혼자 파리에 버섯 몸 신경의 형태 실험 조건 어디 파리 같은 비행에 모두 transgenes 항구 이외에 조사 한다.
마지막으로, 관심사의 단백질은 버섯 몸 신경 표현 여부를 확인 하려면 Fas2 항 체와 공동 얼룩 두뇌에 일반적으로 필요가 있다. 또는, 형광 단백질 같은 GFP, RFP, 또는 막 바인딩된 CD8-GFP GAL4/UAS 시스템을 사용 하 고 관심사의 단백질을 인식 하는 항 체와 조합 사용 표현 또한 수 있습니다. Fas2 버섯 몸 α와 β 돌출부를 형성 하는 fasciculated 축 삭 인식, 이후 GAL4 기반, 막 도약 CD8-GFP를 사용 하 여 버섯 몸 뉴런을 표시 하는 데 특히 유용 했습니다.
결함 axonal 지도에 자주는 아니지만 100% 침투 하 고 심지어 두뇌 동일한 유전자 형의 몇 가지 변화를 보여줄 수 있습니다. 따라서, 새로 분석 버섯 몸 또는 포토 리셉터 길 돌연변이 체 대립 유전자 결함에 대 한 생성, 다른 대립 유전자 및 접근의 조합을 활용 합니다. 문학에서 대부분의 연구는 몇 가지 다른 방법을 단백질 axonal 지도 제어 셀 자치 역할 여부 조사를 사용 하 여: 나) 길의 분석 (선호를 사용 하 여 다른 뉴 homozygous null 파리에 결함ll 대립 유전자), ii) 길의 분석 파리의만 (일반적으로 통해 RNAi), 신경 단백질 부족에 결함 iii) 길 결함과 iv의 MARCM 분석) 구조 유전자가 homozygous null의 뉴런에서 다시 표현 하는 실험 파리. 이상적으로, 유전자 형 당 몇 다스 두뇌 신경 형태학에 결함에 대 한 분석 되어야 합니다.
프로토콜 설명 여기 고정된 조직 내에서 단백질의 immunofluorescent 지역화에 주로 초점을 맞추고, 비록이 기술의 몇 가지 미래의 애플 리 케이 션 이미지 라이브 뇌 조직에 개발 되고있다. 일단 두뇌는 (일반적으로 셀 문화 미디어)에 해 부, 그들은 다음 수 교양 25 ° c.에 몇 일 동안 이러한 비보 전 자란 메서드는 다양 한 생물 학적 과정, 부상70,71, 세포내에 따라 축 삭 재생을 촉진 하는 단백질의 활동을 조사 하기 위하여 개발 되 고 있다 신호 역학72, 그리고 신경 개발73.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
우리는 처음 가르치는 SMK 뇌 해 부 기술 Changhui 박세리 Alysia Vrailas 모 티 머를 감사 하 고 싶습니다. 우리는 또한 비판적 원고를 읽기 위한 켄 Moberg의 랩 그룹, 특히 크리스 라운드의 회원을 감사 합니다. Fas2를 인식 하는 항 체 (1D 4) 및 chaoptin (24B10) 개발 연구 Hybridoma 은행에서 입수 했다. 항 체 24B10 시 모어 관련 및 난시 Colley24,,6061로 DSHB에 예금 되었다, 항 체 1D 4 코리 굿 맨 22,,2356여는 DSHB에 예금 되었다. 플라이 주식 블루밍턴 재고 센터에서 얻은 했다. 우리는 또한 오하이오 농업 연구와 개발 센터 (OARDC) MCIC 이미징 센터 confocal 현미경의 사용에 대 한 이미지 그림 4A에서 두뇌를 감사 하 고 싶습니다 및 B. SMK NICHD에서 교부 금에 의해 지원 됩니다 (1 r 15 HD084241-01A1).
자료
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
참고문헌
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911 (2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9 (2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743 (2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141 (2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85 (2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13 (2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620 (2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121 (2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유