Method Article
流式细胞仪检测盘基柄柄Macropinocytosis 的高通量
摘要
Macropinocytosis, 大规模的非特定液体摄取, 是重要的许多领域的临床生物学包括免疫学, 感染, 癌症和神经退行性疾病。在这里, 现有的技术已经适应了允许高通量, 单细胞分辨率测量 macropinocytosis 在 macropinocytosis 模型生物盘基柄柄使用流式细胞仪。
摘要
macropinocytosis 对某些癌细胞的增殖、抗原取样、宿主细胞侵袭和神经退行性疾病的传播都具有重要的意义。柄虫盘基柄的常用实验室菌株在营养培养基中生长时具有极高的流体吸收率, 其中超过90% 是由于 macropinocytosis。此外, 哺乳动物 macropinocytosis 的许多已知核心成分也存在, 这使得它成为研究 macropinocytosis 的优秀模型系统。在这里, 用荧光葡聚糖作为标签来测量内化流体的标准技术适应了96井板格式, 用流式细胞仪分析了使用高通量取样 (高温超导) 附件的样品。
细胞被喂食非具有易点燃荧光葡聚糖的预先确定的时间长度, 浸泡在冰冷的缓冲和分离使用5毫米叠氮化钠, 这也停止胞吐作用。然后用流式细胞仪对各井的细胞进行分析。该方法还可用于测量荧光珠或细菌的膜吸收和吞噬功能。
这一方法的设计, 以允许测量流体吸收的盘基柄在高通量, 劳动力和资源有效的方式。它允许同时比较多个菌株 (如基因的挖空突变体) 和条件 (如不同培养基中的细胞或不同浓度的抑制剂) 平行和简化时间课程。
引言
macropinocytosis 的大规模非特异流体吸收在几个生物学环境中是重要的1, 包括免疫细胞抗原取样2, 病原体进入宿主细胞3, 癌细胞增殖4和传播朊病毒疾病5。在哺乳动物和盘基柄细胞中, 肌动蛋白6,7, PI (34, 5) P38,9,10 (虽然脂质的确切性质不同的两个11), 激活Ras12,13和活化 Rac14,15是重要的有效的流体吸收 macropinocytosis, 虽然仍然有许多悬而未决的问题, 关于如何 macropinocytic 补丁是形成, 组织和最终内化。发现更多的蛋白质对 macropinocytosis 重要, 并随后确定它们如何在不同的生物学环境中是重要的, 将给予更全面的理解 macropinocytosis, 并可能允许发展有针对性的治疗范围的条件。
盘基柄是研究 macropinocytosis 的理想模型系统。标准实验室菌株本构 macropinocytosis 的高水平意味着, 由于 macropinocytosis6, 流体摄取量超过90%。这使得 macropinocytosis 仅通过确定流体摄取量来测量, 不同于哺乳动物细胞, 因为 macropinocytosis 的液体摄取比例要低得多。macropinocytosis 是如此清楚地定义和容易地可视化12在这个系统相似地提供独特的好处为调查 macropinosome 的核心保守的组分在其他系统可能有多个调控信号16,17。
用于测量哺乳动物细胞 macropinocytosis 的标准技术涉及在短时间内用葡聚糖脉冲固定细胞, 然后用显微术来确定由葡聚糖阳性囊泡18所占据的细胞的面积。然而这项技术不考虑 macropinosomes 收缩的可能性, 当进入细胞, 在盘基柄19报告了, 并且只考虑了细胞的单平面, 意味容量内部化尚不清楚。一种替代技术, 计算在给定时间内内化的 macropinosomes 的数量, 有相同的缺点20。使用盘基柄避免了这些问题;然而, 现有的测量盘基柄液体摄取的技术是相对劳力密集型的, 使用大量的细胞和葡聚糖21。细胞在高密度的荧光葡聚糖和样品去除在不同的时间点, 以确定内化荧光使用 fluorimeter。这种方法制备的细胞可以通过流式细胞仪来分析, 以获得单细胞, 而不是人口级的分辨率22, 尽管这仍然是低吞吐量的。
在这里, 用荧光葡聚糖作为标签来测量内化流体的标准技术适应了96井板格式, 用流式细胞仪分析了使用高通量取样 (高温超导) 附件的样品。细胞被喂食非具有易点燃荧光葡聚糖的预先确定的时间长度, 浸泡在冰冷的缓冲和分离使用5毫米叠氮化钠, 这也停止胞吐作用。然后用流式细胞仪对各井的细胞进行分析。该方法的目的是克服上述方法的局限性, 并允许同时比较的液体吸收大量的菌株/条件, 同时使用较少的资源和减少劳动所涉及的。
研究方案
1. 细胞和材料的制备
- 在 SM 琼脂板上培养细胞与细菌如产气克雷伯杆菌, 或在营养培养基如 HL5 如所述23。
注意: 生长在 macropinocytosis 上的突变体在细菌中有缺陷有助于防止次生突变的积累, 从而增加 macropinocytosis 的发生率。将通道编号保持在4以下, 然后从库存中镀出电池以获得最佳效果。突变体应在隔离后尽快储存为冷冻储存。 - 在 sm 培养基上培养细胞, 生长K 产气以融合在 sm 介质中。添加 200–300xg ul 的细菌到 SM 琼脂板和传播。采取无菌循环的细胞 (当从另一个细菌板块转移), 并在板块的一个边缘扩散。孵育22摄氏度, 长达一周。
- 将四甲基罗丹明异硫氰酸酯 (TRITC) 葡聚糖溶于水中50毫克/毫升, 过滤器使用0.22 微米过滤器, 整除数1毫升, 贮存在-20 摄氏度。整除数可以无限期地保留下来。
注: 155 kDa 是与此方法使用的典型尺寸, 因为它可以廉价购买散装, 但较小的 dextrans 测量 macropinocytosis 就像盘基柄24一样有效。如果需要不同的显影, 则不同的非具有易点燃 dextrans (如层叠蓝色或 Alexa-647) 是可选的。
2. 将定性测量转化为定量 (可选)
-
使用悬浮液中的细胞进行液体摄取测定。
- 颗粒 axenically 生长细胞在 300 x g 3 分钟, 丢弃上清和并用重悬在营养培养基 1x107细胞/毫升。添加 TRITC-葡聚糖到0.5 毫克/毫升和动摇 180 rpm, 22 °c。
- 稀释0.8 毫升样品到0.7 毫升冰冷的 kk2在 0, 30, 60, 90, 120 分钟洗涤一次在1.5 毫升冰冷的 kk2缓冲23在一个台式离心机, 并用重悬到1毫升在同一缓冲和存放在冰上。
注: 立即洗涤, 或一旦所有样品已收集产生等效结果。
-
确定细胞内部的流体体积。
- 设置 fluorimeter 测量荧光使用544毫微米的激发波长和发射波长574毫微米与10毫微米狭缝。建立了 TRITC-葡聚糖的稀释系列, 并用它测定了葡聚糖给定体积的荧光量。创建校准曲线。
- 用0.9 毫升细胞悬浮液测量2.1 节细胞内化的荧光。使用校准曲线24计算每个细胞内化的流体体积。
- 稀释其余的细胞从每个时间点分别成0.5 毫升冰冷 KK2。过滤通过70µm 细胞过滤器到5毫升聚苯乙烯流式细胞术管。设置流式细胞仪, 使每个时间点的单元格彼此不同, 并记录其荧光 (见3.4 和3.5 节)。
- 使用上面的设置测量流式细胞仪中校准珠子的荧光, 并记录它。
注: 这是所有未来荧光测量流式细胞仪的参考: 在使用再次运行的珠子和调整设置, 使他们有相同的荧光。这将给出一个非常狭窄的定义峰值。在荧光峰周围放置一个门可以使它变得更容易。 - 重复三次并绘制2.2 和2.3 节中获得的细胞荧光数据。绘制最佳拟合线, 并利用该方程将流式细胞仪中的定性数据转换为定量单位。
3. 测量流体摄取量
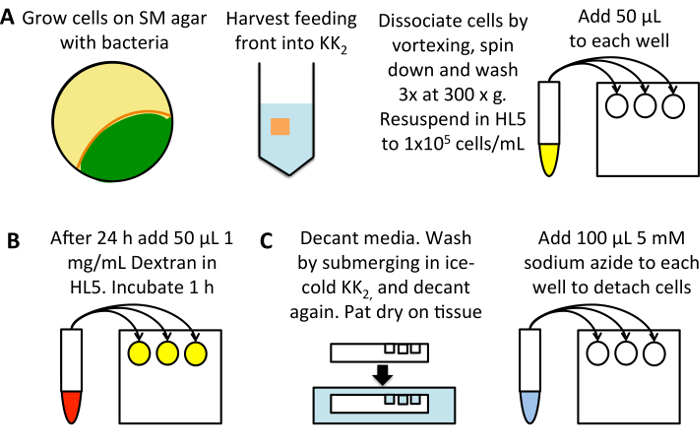
图 1: macropinocytosis 的高通量测量示意图。(A)在与K. 产气细菌 (黄色)盘基柄的 SM 板上生长。收获细胞从喂养前面 (橙色), 避免已经开发的细胞 (绿色), 成25毫升的 KK2缓冲。旋涡到离解, 颗粒3分钟离心在 300 x g, 然后洗3次在50毫升的 KK2缓冲, 每次丢弃上清。并用重悬到 1 x 105细胞/毫升在 HL5 生长介质中, 并添加50µL 到三井每个样品的平底96井板。孵育在22°c 24 小时(B)稀释 TRITC 葡聚糖到1毫克/毫升在 HL5 生长培养基从50毫克/毫升的股票溶液。添加50µL 到每个样品 (不包括0分钟摄取控制井), 并孵化22°c 1 小时后, 添加葡聚糖到0分钟摄取控制。(C)立即醒酒媒体, 在纸巾上拍上盘子, 去除多余的培养基, 浸泡在冰冷的 KK2缓冲液中, 填满水井冲洗。醒酒的缓冲和拍干再次。添加100µL 5 毫米叠氮化钠溶解在 KK2MC, 以分离细胞。采取流式细胞仪测量内化荧光。请单击此处查看此图的较大版本.
-
建立一个平底的96井组织培养板 (图 1A)。使用细菌生长的细胞, 并将其转移到 HL5 培养基 (含有100µg/毫升的双氢链霉素, 100 µg/毫升氨苄西林和50µg/毫升卡那霉素) 24 小时之前的化验;这使得 macropinocytosis 可以从24细菌生长的细胞中的低水平上调。或者, 直接从无菌培养中稀释细胞, 在化验前孵化24小时, 以减少由于细胞从不同密度稀释而产生的误差。
- 在50毫升离心管中从喂养前收获细胞到25毫升的 KK2 。分离细胞由涡流和颗粒在 300 x g 3 分钟.丢弃上清液, 并用重悬颗粒, 在 300 x克3 分钟内清洗3次, 在50毫升的 KK2, 每次丢弃上清液去除细菌。
- 确定细胞密度 (使用 hemacytometer 或其他细胞计数系统), 稀释成含有抗生素的 HL5 1 x 105细胞/毫升。吸管 50 ul 入每个井, 使用三井为每个情况。孵育22°c 为24小时. 记得设置0分钟的摄取控制。
注: 可替代培养基,如有罪、VL6。
-
用 TRITC-葡聚糖加载细胞 (图 1B)。
- 稀释葡聚糖到1毫克/毫升的培养基使用 (这可以增加到2.5–5毫克/毫升当评估细胞非常低摄取)。添加 50 ul 的每一个井 (给最终浓度0.5 毫克/毫升 TRITC 葡聚糖), 并返回到22°c 1 h, 因为这允许明显的葡聚糖积累, 但胞吐作用的葡聚糖尚未开始。
注: 中继吸管允许此步骤更快地完成, 减少错误。
- 稀释葡聚糖到1毫克/毫升的培养基使用 (这可以增加到2.5–5毫克/毫升当评估细胞非常低摄取)。添加 50 ul 的每一个井 (给最终浓度0.5 毫克/毫升 TRITC 葡聚糖), 并返回到22°c 1 h, 因为这允许明显的葡聚糖积累, 但胞吐作用的葡聚糖尚未开始。
-
为流式细胞术准备细胞 (图 1C)。
- 在洗涤之前, 增加 50 ul 含葡聚糖的媒介到0分钟摄取控制。
- 醒酒的培养基和轻拍干燥的组织。将盘子浸入冰冷的 KK2, 然后醒酒。
注意: 有些粘附缺陷的菌株可能会在这一步骤中分离出来,例如塔林 (塔拉-talB-)25的两个同系物的挖空。当使用单元格线时, 如果需要的话, 请小心连接不良和吸出介质。 - 添加 100 ul 5 毫米叠氮化钠溶解在 kk2MC (kk2 + 2 毫米 MgSO4和100微米 CaCl2)。
注意: 叠氮化钠极具毒性。使用粉尘面罩和安全眼镜时, 与粉末。总是戴手套和实验室大衣。避免加热, 不要与酸混合。
注意: 细胞迅速分离, 胞吐作用被阻止24。显微镜可以用来检查这个。
-
流式细胞仪测量流体摄取量
- 如果计划将相对值转换为绝对值, 则使用珠子标准化流式细胞仪设置 (见第2节)。或者, 使用以葡聚糖加载的单元格, 如在2节中, 以确保正确设置正散射和侧向散射以隔离单元格 (图 2A), 确保机器未被阻止, (图 2B) 并将参数调整为测量内化荧光 (图 2C)。
- 附加高通量采样系统并添加板。建立一个测量荧光的协议 (为 TRITC 葡聚糖使用黄绿色激光激发和测量在582毫微米渠道或相似) 65 ul 的细胞悬浮并且跑。
-
流式细胞术结果分析
- 使用正向散射和侧散射的单元格上的门 (图 2A)。使用 "统计" 选项计算单元格的中值荧光。使用一个示例设置这些参数, 并应用于所有示例。
注意: 使用不同的突变体或抑制剂时, 正向散射/侧向散射剖面可以改变样品。 - 确定每个条件下三井的平均值, 减去0分钟的摄取控制。使用2节中确定的等式或正常化到该控件, 可以转换为量化值。
- 使用正向散射和侧散射的单元格上的门 (图 2A)。使用 "统计" 选项计算单元格的中值荧光。使用一个示例设置这些参数, 并应用于所有示例。
4. 执行流体吸收时间-课程
- 将单元格设置为3节, 每个时间点和应变/条件有三个井。
- 按顺序将葡聚糖标记培养基添加到不同的井中。典型的时间路线测量流体吸收在 0, 30, 60, 90, 120 和180分钟. 在180分钟的时间点井中添加葡聚糖培养基, 随后60分钟后将其加入到井中, 用于120分钟时间点等(图 3A)。
- 在0分钟, 添加 50 ul 的葡聚糖培养基和立即醒酒和洗盘子, 如第3.3 节。分析如第3.5 节所述。
5. 剂量响应曲线
- 按照3节所述设置单元格, 每个应变和条件有三个井。
- 将所感兴趣的化合物稀释成含有1毫克/毫升葡聚糖的培养基, 使化合物的最大最终浓度加倍。用与第一个相同比例的葡聚糖制备第二管含培养基。漩涡混合。
- 创建一个稀释系列的兴趣化合物在 200 ul 葡聚糖含培养基每样 (图 4A)。漩涡混合。在1小时内将培养基的 50 ul 添加到每个样品中。
- 洗涤和分析, 如第3.3 节所述。
6. 吞噬和膜吸收
- 要测量膜的摄取量, 请按照3节的说明准备细胞。添加 50 ul, 其中含有20微米 FM 1-43, 最后浓度为10微米。加载后, 冲洗和准备细胞的流式细胞术, 如3.3 节。测量在 585 nm 通道或类似, 使用蓝色激光激发。
注: 由于膜的贩运速度比液相快, 10 分钟是一个较合适的时间点使用比1小时26。替代染料, 荧光只有当加入到膜可以代替。 -
使用荧光标记的珠子或细菌来测量吞噬功能.荧光酵母不能使用, 因为它们是不可分离的盘基柄的向前和侧面分散24。按照第3节中的说明设置单元格, 并按描述的27进行分析。
- 测量珠子的吞噬功能添加黄绿色标签珠, 如第3.2 节所述, 最终浓度为 5 x 107珠/毫升 (1.75 和2微米) 或 1 x 108珠/毫升 (1 和1.5 微米), 在洗涤前和准备流式细胞术之前, 如3.3 节。测量在 525 nm 通道或类似, 使用蓝色激光激发。
注意: 高浓度会导致细胞脱离。 - 为了测量细菌的吞噬功能, 添加德州红色标签大肠杆菌 bioparticles, 如3.2 至 1 x 108细菌/毫升在洗涤前1小时, 并准备流式细胞术, 如3.3 节所述。测量在 610 nm 通道或类似, 使用黄绿色激光激发。
- 测量珠子的吞噬功能添加黄绿色标签珠, 如第3.2 节所述, 最终浓度为 5 x 107珠/毫升 (1.75 和2微米) 或 1 x 108珠/毫升 (1 和1.5 微米), 在洗涤前和准备流式细胞术之前, 如3.3 节。测量在 525 nm 通道或类似, 使用蓝色激光激发。
结果
一旦该技术已经完成, 细胞被装上葡聚糖并准备进行分析 (图 1), 确保流式细胞仪不会被阻止, 并调整正散射/侧散射剖面, 看起来像图 2A所示的单元格。如果计算机被阻止, 它看起来会更像图 2B所示, 并且必须在继续之前取消阻塞。确保参数显示控制无菌细胞有较高的内化葡聚糖荧光在较长的时间点和低内化荧光在较短的 (图 2C)。
当寻找变种人之间的差异, 很可能会有三表型。变种人可能有正常的体液摄取, 他们可能有部分缺陷, 或液体摄取可以完全废除。图 2D显示了一个正常流体摄取的应变, 在这种情况下, 标准实验室应变 Ax2, 一个突变体的液体摄取量减少了 50% (Ax2 rasG-14) 和一个与被废除的液体摄取 (Ax3 gefB-28)。获得平均中流体摄取量 (3.5 节), 并使用它来计算内部流体的体积 (如图 3B所示), 或者将数据与控件 (如图 4B 和4C) 进行比较。
当执行流体吸收时间路线, 如图 3A, 内化荧光应增加 60–90 min, 之后葡聚糖开始 exocytosed 和一个高原达到 (图 3B)。使用60分钟作为标准时间点时, 比较 macropinocytosis 在不同的突变体/条件, 因此, 使一个良好的信号, 并没有失去信号, 由于胞吐作用。胞吐作用严重受阻的突变体可能需要较长的时间才能到达高原29。
当治疗细胞的抑制剂是有效的抗 macropinocytosis 在盘基柄(如图 4A), 葡聚糖内化1小时将下降到几乎没有在较高的抑制剂浓度在大多数情况下(图 4B)。一些抑制剂可能不是100% 有效的, 但是,例如nocodazole 只抑制多达50% 的液体摄取 macropinocytosis 时, 增加敏锐 (图 4C)。如果抑制剂是无效的, 细胞将内部化类似数量的葡聚糖作为控制, 并减少荧光将不会看到。这种技术允许大量不同的抑制剂和抑制剂浓度被筛选, 以影响对流体吸收的 macropinocytosis 非常迅速, 减少了花费的时间优化抑制剂处理。
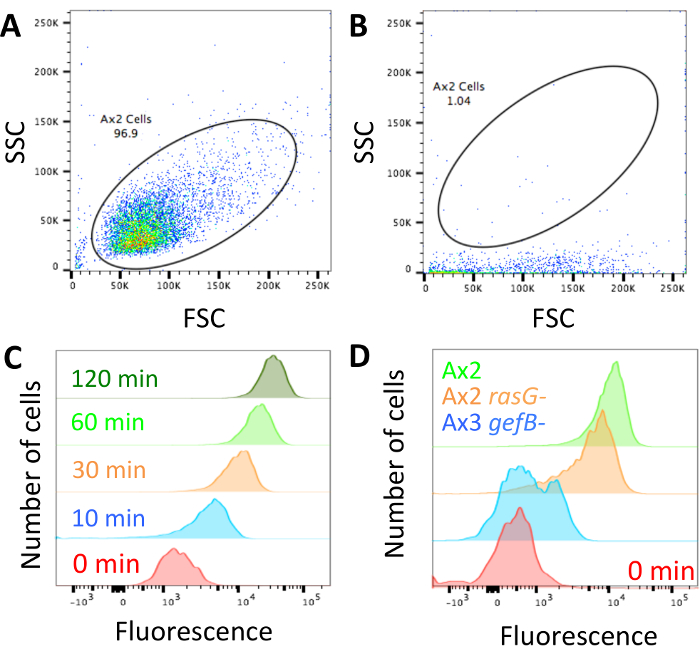
图 2: 设置流式细胞仪和代表性数据。(A)应设置细胞的正散射 (FSC) 和侧向散射 (SSC) 剖面, 以便能够很容易地区分细胞。显示 Ax2 单元格的外观的示例。(B)如果流式细胞仪被阻断, 如本例中所示, 单元格的侧向散射非常低。激光不会正确地激发显影, 机器在继续之前应该被解除阻塞。在计算机被阻止时获得的任何数据都应被丢弃。(C)应设置荧光, 使0分钟摄取样本具有低荧光, 当细胞在荧光介质中孵化时间较长时会增加, 如从威廉姆斯 & 凯 201824中抽取的例子所示。(D)以正常 macropinocytosis (Ax2、绿色)、减少 macropinocytosis (Ax2 rasG、HM172614、橙色) 和废除 macropinocytosis (Ax3 gefB) 为1小时的 TRITC 葡聚糖培养的细胞的例子,HM177628, 蓝色)。请单击此处查看此图的较大版本.
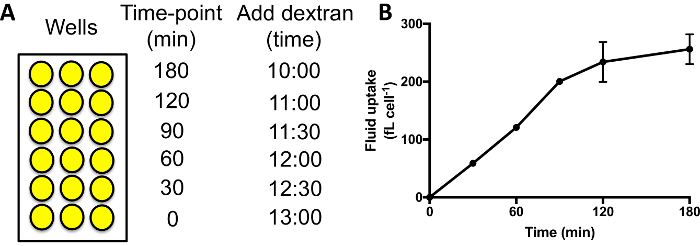
图 3: 在96井板中执行流体吸收时间-课程。(A)应按顺序将葡聚糖添加到每组样品中, 完成时间相同。然后用流式细胞仪对井进行冲洗, 分离和测量内化荧光。在这里显示添加葡聚糖的例子次数。(B)在96井板中进行的 Ax2 细胞的吸液时间过程。取自威廉姆斯 & 凯 201824, 误差条显示三独立实验的标准误差。请单击此处查看此图的较大版本.

图 4: 流体摄取剂量响应曲线。(A)增加兴趣的化合物, 在这种情况下, PI3K 抑制剂 LY294002, HL5 含有1毫克/毫升 TRITC 葡聚糖在双倍的预期最终最大浓度。与 HL5 生长培养基 + 1 毫克/毫升葡聚糖混合在不同比例单独的车辆, 以产生稀释系列200µL 培养基的每一个条件。在洗涤和测量内化荧光之前, 将井作为正常的1小时。(B)用 LY294002-containing 培养基从A中孵化的 Ax2 细胞的吸液剂量响应曲线。改编自威廉姆斯 & 凯 201824。液体摄取被规范化为未经处理的控制。误差条显示三独立实验的标准误差。(C)与 nocodazole 一起孵化的 Ax2 细胞的吸液剂量响应曲线。改编自威廉姆斯 & 凯 201824。液体摄取被规范化为未经处理的控制。误差条显示三独立实验的标准误差。请单击此处查看此图的较大版本.
讨论
而其他评估流体吸收的方法是低吞吐量,就地洗涤细胞和使用叠氮化钠分离细胞是这种方法的关键步骤, 允许高通量测量 macropinocytosis, 膜吸收, 或盘基柄吞噬。当细胞被连接到一个表面, 而培养基不是, 它们可以被附加, 而在它们周围的介质首先被抛出, 然后通过沉浸在缓冲和再次抛出。叠氮化钠, 耗尽细胞 ATP 和 depolarizes 膜30, 然后用于分离细胞, 也防止胞吐作用不影响细胞活力24。
当使用流式细胞仪测量 macropinocytosis 的盘基柄给出非常准确的测量液体摄取非常迅速, 以确定为什么一个特定的应变或条件改变了流体摄取, 进一步调查使用显微镜是必需的24。还应指出的是, 以前公布的结果在某些情况下表明, 在表面上生长的突变株 (如本例), 或在震动悬浮 (如标准议定书)31中, 液体吸收的差异。使用这种方法可能意味着, 在罕见的情况下, 明显的液体摄取缺陷被遗漏。另外, 在测量吞噬功能时, 只能使用低浓度的微粒。这种技术可以确定的吞噬功能的最大速率远远低于实际的最大值, 尽管仍然可以测量菌株与条件之间的吞噬功能的相关差异24。为了确定吞噬功能的最大速率, 必须通过备选协议27来测量震动悬浮中的吸收量。有吞噬珠子的细胞增加了侧向散射, 因此在设置流式室仪时应相应地改正。
流式细胞术可用于测量哺乳动物细胞中的液体摄取量32, 然而, 其他吞通路比盘基柄所见的更高比例的液相吸收是一个值得关注的问题。此外, 细胞通常被分离使用胰蛋白酶在37°c, 允许进一步吞进展的内聚糖酐。冰冷叠氮化钠不会导致巨噬细胞从表面分离 (威廉斯, 未发表的观察), 使得这种技术不适用于哺乳动物细胞而没有进一步的优化。
高通量测量 macropinocytosis 有可能被用来快速和廉价地筛查抑制剂, 基因突变或基因击倒在盘基柄细胞的影响。变种人应该总是和他们的直系父母相比。如果读者没有事先偏爱盘基柄菌株, 非无菌菌株, 如 DdB 或 NC4 比无菌更 "野生型", 可以有效地操作无菌菌株33。否则, Ax2 菌株是基因组重复度最少34的无菌菌株, 而 Ax4 的许多菌株塔林一个挖空, 如果可能的话, 应该避免23。大多数以前发布的菌株可以从 Dicty 股票中心订购35。
这种技术允许比以前更大的调查可能性的影响, 不同的条件, 抑制剂和突变对 macropinocytosis 的盘基柄。
披露声明
作者没有披露的利益冲突。
致谢
我们感谢英国医学研究委员会 (U105115237) 对 RRK 的核心资助。
材料
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
参考文献
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。