Method Article
Hochdurchsatz-Messung von Dictyostelium Discoideum Macropinocytosis von Flow Cytometry
In diesem Artikel
Zusammenfassung
Macropinocytosis, groß angelegte unspezifische Flüssigkeit Aufnahme, ist in vielen Bereichen der klinische Biologie, Immunologie, Infektion, Krebs und neurodegenerativen Krankheiten wichtig. Bestehende Techniken wurden hier auf Hochdurchsatz einzellige Auflösung Messung der Macropinocytosis in der Macropinocytosis Modell Organismus Dictyostelium Discoideum mit flow Cytometry zu ermöglichen.
Zusammenfassung
Groß angelegte unspezifische Flüssigkeit Aufnahme durch Macropinocytosis ist wichtig für die Verbreitung von bestimmten Krebszellen, Antigen Probenahme, Host ZELLINVASION und die Verbreitung von neurodegenerativen Erkrankungen. Die gängige Laborstämme von der Amöbe Dictyostelium Discoideum haben extrem hohe Fluid Inanspruchnahme, wenn im Nährmedium, wächst mehr als 90 % davon wegen Macropinocytosis. Darüber hinaus sind viele der bekannten Kernkomponenten von Säugetieren Macropinocytosis auch vorhanden, so dass es eine ausgezeichnete Modellsystem zur Untersuchung Macropinocytosis. Hier ist die Standardtechnik, verinnerlichten Flüssigkeit mit fluoreszierenden Dextran als Label zu messen mit den Proben analysiert, indem Durchflusszytometrie mit einem Hochdurchsatz-Probenahme (HTS) Anlage auf einem 96-Well-Platte-Format angepasst.
Zellen werden nicht einmal fluoreszierende Dextran für einen vorher festgelegten Zeitraum hinweg, durch Eintauchen in eiskaltes Puffer gewaschen und getrennt, mit 5 mM Natriumazid, das hält auch Exozytose gefüttert. Zellen in jedem Bohrloch werden dann von Durchflusszytometrie analysiert. Die Methode kann auch zur Messung von Membran-Aufnahme und Phagozytose von fluoreszierenden Perlen oder Bakterien angepasst werden.
Diese Methode zur Messung der flüssige Aufnahme ermöglichen von entworfene Dictyostelium Hochdurchsatz-, Arbeits- und Ressourcen effizient zu nutzen. Es ermöglicht den gleichzeitigen Vergleich mehrerer Stämme (z. B. ko durch Mutation entstehende Variationen eines Gens) und Bedingungen (z. B. Zellen in unterschiedlichen Medien oder mit verschiedenen Konzentrationen der Inhibitor behandelt) parallel und vereinfacht die Zeit-Kurse.
Einleitung
Groß angelegte unspezifische Flüssigkeit Aufnahme durch Macropinocytosis ist wichtig in mehrere biologische Zusammenhänge1, einschließlich Antigen Probenahme durch Immune Zellen2, Erreger Inkrafttreten Host Zellen3, Krebs Zell-Proliferation4 und die die Verbreitung von Prion-Krankheiten-5. In Säugetieren und Dictyostelium Zellen Aktin6,7, PI (3,4,5) P38,9,10 (obwohl die genaue Art der Lipid unterscheidet sich zwischen den beiden11), aktivierte RAS12,13, und aktivierten Rac14,15 sind wichtig für die effiziente Aufnahme von Flüssigkeit durch Macropinocytosis, obwohl es viele Fragen bleiben darüber, wie der Macropinocytic-patch gebildet, organisiert und schließlich verinnerlicht. Entdecken mehr Proteine wichtig für Macropinocytosis und anschließende Bestimmung dessen, wie sie in die verschiedenen biologischen zusammenhängen wichtig sind ein umfassenderes Verständnis von Macropinocytosis und potenziell Entwicklung gezielte Behandlungen für eine Reihe von Bedingungen.
Dictyostelium ist ein ideales Modellsystem zur Untersuchung Macropinocytosis. Das hohe Niveau der konstitutiven Macropinocytosis in standard laborbelastungen bedeutet, dass flüssige Aufnahme über 90 % durch Macropinocytosis6. Dadurch können Macropinocytosis gemessen werden ausschließlich durch die Bestimmung flüssige Aufnahme, im Gegensatz zu Säugerzellen, wo der Anteil der flüssigen Aufnahme aufgrund Macropinocytosis viel niedriger ist. Das Macropinocytosis ist also klar definiert und leicht visualisierte12 in diesem System ähnlich bietet deutliche Vorteile für die Untersuchung von konservierten Kernkomponenten von der Macropinosome gegenüber anderen Systemen wo möglicherweise mehrere regulatorische Signale 16 , 17.
Die Standardtechnik zur Messung der Macropinocytosis von Säugerzellen beinhaltet Befestigung Zellen nach pulsierend mit Dextran für einen kurzen Zeitraum hinweg gefolgt von Mikroskopie Bereich einer Zelle bestimmen, die von Dextran-positiven Vesikeln18besetzt ist. Diese Technik berücksichtigt jedoch nicht für die Möglichkeit der Macropinosomes schrumpft beim Betreten der Zelle, die in Dictyostelium19wurde berichtet, und nur einzelne Ebenen der Zelle, d. h. das Volumen verinnerlicht berücksichtigt ist unklar. Eine alternative Technik, zählen die Anzahl der Macropinosomes in einer gegebenen Zeit verinnerlicht hat die gleichen Nachteile20. Verwendung von Dictyostelium vermeidet diese Probleme; bestehende Techniken zur Messung der Aufnahme von Flüssigkeit durch Dictyostelium sind jedoch relativ arbeitsintensiv, mit einer großen Menge an Zellen und Dextran21. Zellen sind in hoher Dichte in fluoreszierenden Dextran und Proben entfernt zu verschiedenen Zeitpunkten zur Bestimmung der verinnerlichten Fluoreszenz mit einem Fluorimeter erschüttert. Zellen vorbereitet auf diese Weise können durch Durchflusszytometrie zu einzelnen Zelle, anstatt Populationsebene, Auflösung22, analysiert werden, obwohl dies nach wie vor niedrigen Durchsatz.
Hier ist die Standardtechnik, verinnerlichten Flüssigkeit mit fluoreszierenden Dextran als Label zu messen mit den Proben analysiert, indem Durchflusszytometrie mit einem Hochdurchsatz-Probenahme (HTS) Anlage auf einem 96-Well-Platte-Format angepasst. Zellen werden nicht einmal fluoreszierende Dextran für einen vorher festgelegten Zeitraum hinweg, durch Eintauchen in eiskaltes Puffer gewaschen und getrennt, mit 5 mM Natriumazid, das hält auch Exozytose gefüttert. Zellen in jedem Bohrloch werden dann von Durchflusszytometrie analysiert. Diese Methode wurde entwickelt, um die Grenzen der oben genannten Methoden zu überwinden und ermöglichen gleichzeitige Vergleich der Fluid-Aufnahme einer großen Zahl von Sorten/Bedingungen weniger Ressourcen und reduzieren die Arbeit beteiligt.
Protokoll
1. Vorbereitung der Zellen und Materialien
- Kultivieren Sie Zellen entweder auf SM Agarplatten in Verbindung mit Bakterien wie Klebsiella Aerogenesoder im Nährmedium wie HL5 beschrieben23.
Hinweis: Knockout-Mutanten, die Defekte in Macropinocytosis auf Bakterien sind wachsende verhindert Anhäufung von sekundären Mutationen, die Erhöhung der Macropinocytosis kann. Halten Sie die Passage unter 4 nach galvanischen Zellen aus Beständen für optimale Ergebnisse. Mutanten sollten so bald wie möglich nach Isolierung als gefrorene Vorräte gelagert werden. - Um Zellen auf Agarplatten SM zu kultivieren, wird K. Aerogenes Zusammenfluss in SM-Medium. Fügen Sie 200 – 300 μL der Bakterien auf ein SM-Agar-Platte und zu verbreiten. Nehmen Sie eine sterile Schleife Zellen (bei der Übertragung von einer anderen bakteriellen Platte) und an einer Kante der Platte verteilt. Inkubation bei 22 ° C bis zu einer Woche.
- Tetra-Methyl-Rhodamin erfolgt (TRITC)-Dextran bis 50 mg/mL in Wasser auflösen, mit 0,22-μm-Filter in 1 mL Aliquote zu filtern und speichern bei-20 ° C. Aliquote können auf unbestimmte Zeit aufbewahrt werden.
Hinweis: 155 kDa ist die typische Größe, die mit dieser Methode verwendet werden, wie es in großen Mengen Billig gekauft werden kann, aber kleinere Dextrans Macropinocytosis genauso effektiv in Dictyostelium24 Messen. Andere nicht einmal Dextrans, wie Kaskade blau oder Alexa-647, sind Alternativen, wenn verschiedene Fluorophore erforderlich sind.
2. konvertieren Qualitative Messungen in Quantitative (Optional)
-
Führen Sie eine flüssige Aufnahme-Assay mit Zellen in Suspension.
- Pellet-axenically wachsende Zellen bei 300 X g für 3 min, den überstand verwerfen und Aufschwemmen im Nährmedium, 1 x 107 Zellen/mL. 0,5 mg/mL TRITC-Dextran hinzu und schütteln mit 180 u/min, 22 ° C.
- Verdünnen Sie 0,8 mL Proben in 0,7 mL eiskaltes KK2 auf 0, 30, 60, 90, 120 min. Waschen einmal in 1,5 mL eiskaltes KK2 Puffer23 in einer Benchtop-Zentrifuge, Aufschwemmen zu 1 mL in dem gleichen Puffer und speichern auf dem Eis.
Hinweis: waschen sofort oder sobald alle Proben gesammelt wurden gleichwertige Ergebnisse liefert.
-
Bestimmen Sie das Volumen der Flüssigkeit durch die Zellen verinnerlicht.
- Festlegen der Fluorimeter zur Messung der Fluoreszenz mit einer Erregung Wellenlänge von 544 nm und Emissions-Wellenlänge von 574 nm mit 10 nm Schlitz. Eine Verdünnungsreihe von TRITC-Dextran einrichten und verwenden, um die Fluoreszenz zu messen, für bestimmte Mengen von Dextran. Erstellen einer Kalibrationskurve.
- Messung der Fluoreszenz durch die Zellen im Abschnitt 2.1 mit 0,9 mL Zellsuspension verinnerlicht. Berechnen Sie das Volumen der Flüssigkeit pro Zelle mit der Kalibrierung Kurve24verinnerlicht.
- Verdünnen Sie den Rest der Zellen aus jeden Zeitpunkt separat in 0,5 mL Eis kalt KK2. In 5 mL Polystyrol Messrohre zytometrie durch ein 70 µm Zelle Sieb filtern. Das Durchflusszytometer so einstellen, dass Zellen von jeden Zeitpunkt unterscheiden sich von einander und ihre Fluoreszenz notieren (siehe Abschnitte 3.4 und 3.5).
- Die Fluoreszenz der Kalibrierung Perlen in das Durchflusszytometer mit den obigen Einstellungen zu messen und aufzeichnen.
Hinweis: Dies ist die Referenz für alle zukünftigen Fluoreszenz-Messungen an das Durchflusszytometer: führen Sie vor erneutem Gebrauch der Perlen und passen Sie die Einstellungen, so dass sie die gleichen Fluoreszenz. Dies wird eine sehr enge definierte Spitze geben. Setzen ein Tor rund um den Fluoreszenz-Gipfel kann dies vereinfachen. - Wiederholen Sie drei Mal und Plotten der Zelle Fluoreszenz Daten in den Abschnitten 2.2 und 2.3 gegeneinander. Zeichnen einer Linie ausgleichsgerade und verwenden Sie die Gleichung, um die qualitativen Daten aus der Durchflusszytometrie in quantitative Einheiten zu konvertieren.
3. Messung der flüssige Aufnahme
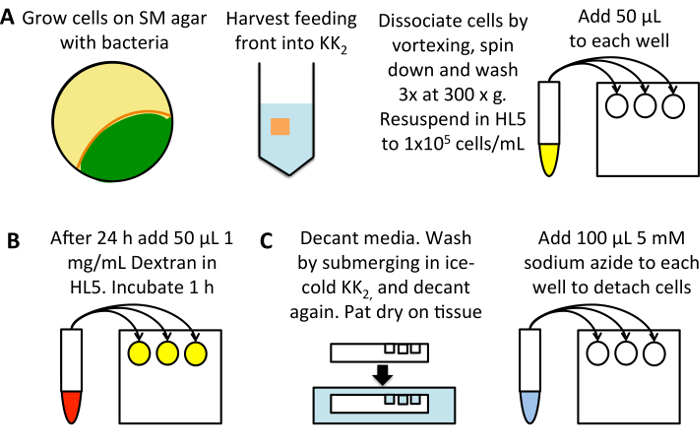
Abbildung 1: Schematische Hochdurchsatz-Messung der Macropinocytosis. (A) Grow Dictyostelium auf eine SM-Teller ausgesät mit K. Aerogenes Bakterien (gelb). Zellen von Fütterung vorne (Orange), Vermeidung von Zellen, die bereits entwickelt sind (grün), in 25 mL KK2 Puffer zu ernten. Wirbel zu distanzieren, pellet von 3 min Zentrifugation bei 300 X g, dann 3 Mal in 50 mL KK2 Puffer, verwerfen des Überstands jedes Mal waschen. 1 x 105 Zellen/ml in HL5 Wachstumsmedium aufschwemmen und 50 µL in drei Vertiefungen pro Probe von einem Flachboden-96-Well-Platte hinzufügen. Inkubation bei 22 ° C für 24 h (B) verdünnten TRITC-Dextran 1 mg/ml in HL5 Wachstumsmedium aus einer Stammlösung von 50 mg/mL. Jede Probe (mit Ausnahme der 0 min Aufnahme Kontroll-Vertiefungen) 50 µL hinzu, und inkubieren Sie bei 22 ° C für 1 h, nachdem die die Dextran 0 min Aufnahme Steuern hinzufügen. Dekantieren Sie (C) sofort das Medium, klopfen Sie die Platte auf ein Gewebe zu entfernen überschüssige Mittel und Tauchen Sie ein in ein Bad von eiskalten KK2 Puffer füllen die Brunnen zu waschen. Den Puffer zu dekantieren und wieder trocken tupfen. Fügen Sie 100 µL 5 mM Natriumazid aufgelöst in KK2MC, die Zellen zu lösen. Nehmen Sie zum flow Cytometer für die Messung der verinnerlichten Fluoreszenz. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Richten Sie einen flachen 96-Well-Zellkultur-Teller (Abbildung 1A). Verwenden Sie Zellen gewachsen auf Bakterien und übertragen sie in HL5 Medium (mit 100 µg/mL Dihydrostreptomycin, 100 µg/mL Ampicillin und 50 µg/mL Kanamycin) 24 Stunden vor dem Test; Dies ermöglicht Macropinocytosis hochreguliert den tiefen Niveaus gesehen in Zellen auf Bakterien24angebaut werden. Alternativ verdünnen Sie Zellen direkt aus der axenic Kultur, Inkubation für 24 h vor dem Test, um Fehler durch die Zellen, die Verwässerung von unterschiedlicher Dichte zu reduzieren.
- Zellen von der Fütterung Front in 25 mL KK2 in ein 50 mL Zentrifugenröhrchen zu ernten. Distanzieren von Zellen durch aufschütteln und Pelletöfen bei 300 X g für 3 min. Den überstand verwerfen, Aufschwemmen der Pellet und Waschen 3 x 300 X g für 3 min in 50 mL von KK2, verwerfen des Überstands jedes Mal um die Bakterien zu entfernen.
- Die Zelldichte (mit einem Hemacytometer oder andere Zelle Zählsystem) zu bestimmen und zu HL5 mit Antibiotika, 1 x 105 Zellen/mL verdünnen. Pipette 50 μL in jedem Brunnen mit drei Bohrungen für jede Bedingung. Inkubation bei 22 ° C für 24 h. denken Sie daran, eine 0 min Aufnahme Kontrolle einrichten.
Hinweis: Eine alternative Mittel, z. B. SIH, VL6 kann stattdessen verwendet werden.
-
Wägezellen Sie mit TRITC-Dextran (Abbildung 1 b).
- Verdünnen Sie die Dextran 1 mg/ml in das Medium verwendet (Dies kann erhöht werden, 2,5-5 mg/mL bei Zellen mit sehr niedrigen Aufnahme der Bewertung). Fügen Sie 50 μL in jede Vertiefung (was eine Endkonzentration von 0,5 mg/mL TRITC-Dextran hinzu) und 22 ° C für 1 h, die Platte wieder, da dadurch erhebliche Dextran Akkumulation sondern Exozytose von Dextran hat noch nicht begonnen.
Hinweis: eine Repeater-Pipette ermöglicht diesen Schritt schneller erfolgen Fehler reduzieren.
- Verdünnen Sie die Dextran 1 mg/ml in das Medium verwendet (Dies kann erhöht werden, 2,5-5 mg/mL bei Zellen mit sehr niedrigen Aufnahme der Bewertung). Fügen Sie 50 μL in jede Vertiefung (was eine Endkonzentration von 0,5 mg/mL TRITC-Dextran hinzu) und 22 ° C für 1 h, die Platte wieder, da dadurch erhebliche Dextran Akkumulation sondern Exozytose von Dextran hat noch nicht begonnen.
-
Bereiten Sie Zellen für Durchflusszytometrie (Abbildung 1).
- Unmittelbar vor dem Waschen, fügen Sie 50 μL Dextran-haltigen Medien 0 min Aufnahme steuert hinzu.
- Das Medium dekantieren und auf einem Papiertuch trocken tupfen. Durch Eintauchen der Platte im eiskalten KK2waschen, dann abgießen.
Hinweis: einige Stämme mit Einhaltung der Mängel können während dieses Schrittes, z. B. ein Knockout von beiden Homologen Talin abgetrennt werden (TalA-/ TalB -)25. Vorsicht beim Arbeiten mit Zelllinien, die schlecht befestigen und Aspirieren Medien bei Bedarf. - Fügen Sie 100 μL der eiskalte 5 mM Natriumazid in KK2MC (KK2 + 2 mM MgSO4 und 100 μM CaCl2) aufgelöst.
Achtung: Natriumazid ist extrem giftig. Beim Arbeiten mit dem Pulver verwenden Sie eine Staubmaske und Schutzbrille. Tragen Sie immer Handschuhe und Kittel. Vermeiden Sie Hitze und mischen Sie sich nicht mit Säure.
Hinweis: Zellen schnell lösen und Exozytose ist verhindert24. Ein Mikroskop kann verwendet werden, um dies zu überprüfen.
-
Maßnahme flüssige Aufnahme durch Durchflusszytometrie
- Falls zu den absoluten relative Werte zu konvertieren, verwenden Sie Perlen Flow Cytometer Einstellungen zu standardisieren (siehe Abschnitt 2). Alternativ Nutzung Zellen geladen mit Dextran wie in Abschnitt 2 zu gewährleisten, dass die forward Scatter und Side Scatter entsprechend festgelegt sind, um Zellen (Abbildung 2A), sicherzustellen, dass die Maschine nicht blockiert ist, zu isolieren (Abb. 2 b) und passen Sie die Parameter zu Messen Sie die verinnerlichte Fluoreszenz (Abbildung 2).
- Hochdurchsatz-Probenahme-System befestigen und Platte hinzufügen. Richten Sie ein Protokoll die Fluoreszenz Messung (für TRITC-Dextran verwenden einen gelb-grüne Laser zu begeistern und Messen im 582 nm Kanal o.ä.) von bis zu 65 μL der Zellsuspension und ausführen.
-
Flow Cytometry Ergebnisse analysieren
- Tor auf die Zellen mittels forward Scatter und Side Scatter (Abbildung 2A). Berechnen Sie die mittlere Fluoreszenz der Zellen mit der Option "Statistiken". Diese Parameter mit einer Probe und gelten für alle Proben.
Hinweis: Die forward Scatter/Seitenprofile Streuung variiert zwischen Proben bei Verwendung von verschiedenen Mutanten oder Inhibitoren. - Der Mittelwert der drei Brunnen für jede Kondition und subtrahieren 0 min Aufnahme Steuerung. Entweder in quantitative Werte unter Verwendung der Gleichung bestimmt in Abschnitt 2 konvertieren oder auf das Steuerelement zu normalisieren.
- Tor auf die Zellen mittels forward Scatter und Side Scatter (Abbildung 2A). Berechnen Sie die mittlere Fluoreszenz der Zellen mit der Option "Statistiken". Diese Parameter mit einer Probe und gelten für alle Proben.
4. durchführen flüssige Aufnahme Zeit-Kurse
- Zellen wie in Abschnitt 3, mit drei Brunnen für jeden Zeitpunkt und Belastung/Zustand eingerichtet.
- Die verschiedenen Brunnen gegenüber dem Vorquartal Dextran gekennzeichneten Medium hinzufügen. Ein typischen zeitlichen Verlauf misst flüssige Aufnahme bei 0, 30, 60, 90, 120 und 180 min. Dextran-haltigen Medium für die 180 min Zeitpunkt Brunnen, 60 min später folgte die Brunnen für die 120 min Zeitpunkt hinzufügen hinzufügen etc. (Abb. 3A).
- Fügen Sie am 0 min. 50 μL der Dextran-haltigen Medium sofort dekantieren und waschen Sie die Platte wie in Abschnitt 3.3. Analysieren Sie wie in Abschnitt 3.5 beschrieben.
(5) Dosis-Wirkungs-Kurven
- Richten Sie Zellen, wie in Abschnitt 3, mit drei Bohrungen für jede Belastung und Zustand beschrieben.
- Verdünnen Sie die Verbindung von Interesse in 1 mg/mL Dextran bei verdoppeln die gewünschten maximalen Endkonzentration der Verbindung-haltigem Medium. Bereiten Sie eine zweite Röhre mit Medium mit Dextran mit dem gleichen Anteil des Fahrzeugs wie die erste. Vortex mischen.
- Erstellen Sie eine Verdünnungsreihe der Verbindung von Interesse an 200 μL Dextran mit Medium pro Probe (Abb. 4A). Vortex mischen. Jede Probe gut für 1 h 50 μL des Mediums hinzufügen.
- Waschen Sie und zu analysieren Sie, wie beschrieben in Abschnitt 3.3 ab.
6. die Phagozytose und Membran-Aufnahme
- Zur Messung der Membran Aufnahme bereiten Sie die Zellen wie in Abschnitt 3 beschrieben. Fügen Sie 50 μL von 20 μM FM 1-43 für eine Endkonzentration von 10 μM-haltigem Medium. Nach dem laden Waschen und Durchflusszytometrie wie in Abschnitt 3.3 Zellen vorbereiten. Messen Sie in der 585 nm-Kanal oder ähnliches, mit einem blauen Laser um zu begeistern.
Hinweis: Da Membran Handel schneller als Flüssigkeit-Phase ist, 10 min ist ein geeigneter Zeitpunkt zu bedienen als 1 h26. Alternative Farbstoffe, die fluoreszieren nur dann, wenn die Membran integriert können stattdessen verwendet werden. -
Verwenden Sie entweder eindringmittel gekennzeichneten Perlen oder Bakterien Phagozytose messen. Fluoreszierende Hefe kann nicht verwendet werden, wie sie untrennbar mit Dictyostelium von Forward sind und Side scatter-24. Richten Sie Zellen wie in Abschnitt 3 beschrieben und wie beschrieben27analysieren.
- Zur Messung der Phagozytose von Perlen gelb-grün gekennzeichnet Perlen wie beschrieben in Abschnitt 3.2, eine Endkonzentration von 5 x 107 Perlen/mL (1,75 und 2 μm) oder 1 x 108 Perlen/mL (1 bis 1,5 μm) 1 h vor dem Waschen und Vorbereiten der Durchflusszytometrie wie in hinzufügen Abschnitt 3.3. Messen Sie in der 525 nm-Kanal oder ähnliches, mit einem blauen Laser um zu begeistern.
Hinweis: Höhere Konzentrationen führen zu Zelle ablösen. - Zur Messung der Phagozytose von Bakterien fügen Sie Texas Red Escherichia coli Bioparticles gekennzeichnet, wie in Abschnitt 3.2 bis 1 x 108 Bakterien/mL für 1 h vor dem Waschen und Vorbereiten der Durchflusszytometrie wie in Abschnitt 3.3 beschrieben. Messen Sie in der 610 nm-Kanal oder ähnliches, mit einem Gelb-Grün-Laser um zu begeistern.
- Zur Messung der Phagozytose von Perlen gelb-grün gekennzeichnet Perlen wie beschrieben in Abschnitt 3.2, eine Endkonzentration von 5 x 107 Perlen/mL (1,75 und 2 μm) oder 1 x 108 Perlen/mL (1 bis 1,5 μm) 1 h vor dem Waschen und Vorbereiten der Durchflusszytometrie wie in hinzufügen Abschnitt 3.3. Messen Sie in der 525 nm-Kanal oder ähnliches, mit einem blauen Laser um zu begeistern.
Ergebnisse
Sobald die Technik durchgeführt wurde und die Zellen mit Dextran geladen und bereit für die Analyse (Abbildung 1 sind), stellen Sie sicher, dass das Durchflusszytometer nicht blockiert ist und passen Sie das forward Scatter/Side Scatter Profil auszusehen wie die Zellen dargestellt in Abbildung 2A. Wenn das Gerät gesperrt ist, es sieht mehr wie die dargestellt in Abbildung 2 b und entsperrt werden muss, bevor Sie fortfahren. Die Parameter zeigen Kontrolle axenic Zellen haben hohen verinnerlichten Dextran Fluoreszenz zu längeren Zeitpunkten und niedrigen verinnerlichten Fluoreszenz bei kürzeren zu gewährleisten (Abbildung 2).
Wenn Unterschiede zwischen Mutanten suchen, ist es wahrscheinlich, dass einer der drei Phänotypen. Die Mutanten hätte normale flüssige Aufnahme, sie hätten einen teilweise defekt oder flüssige Aufnahme komplett abgeschafft werden könnte. Abb. 2D zeigt eine Sorte mit normalen flüssigen Aufnahme, in diesem Fall die standard laborstamm Ax2 eine Mutante mit ~ 50 % Rückgang der flüssige Aufnahme (Ax2 RasG-14) und eins mit abgeschafft flüssige Aufnahme (Ax3 GefB-28). Die durchschnittliche mittlere flüssige Aufnahme (Abschnitt 3.5) beziehen und verwenden, um das Volumen der Flüssigkeit (wie in Abb. 3 b) verinnerlicht zu berechnen oder vergleichen Sie die Daten an ein Steuerelement (wie in Abbildung 4 b und 4 C).
Bei der Durchführung eines Flüssigkeit Aufnahme zeitlicher Verlauf, wie in Abbildung 3A, dürfte die verinnerlichte Fluoreszenz für 60-90 min, nach denen die Dextran beginnt zu exocytosed werden und ein Plateau erreicht wird (Abb. 3 b). Mit 60 min als die Standard-Zeit-Punkt, wenn Vergleich Macropinocytosis in verschiedenen Mutanten/Bedingungen daher ermöglicht ein gutes Signal erreicht werden, und kein Signal verloren durch Exozytose geht. Mutanten wo Exozytose stark behindert wird dauern länger, ein Plateau29zu erreichen.
Bei Behandlung von Zellen mit Inhibitoren, die wirksam gegen Macropinocytosis in Dictyostelium (einrichten wie in Abbildung 4A), sind die Dextran verinnerlicht in 1 h gehen hinunter fast nichts bei höheren Inhibitor-Konzentrationen in den meisten Fällen an (Abbildung 4 b). Einige Inhibitoren können nicht 100 % wirksam, jedoch hemmt z.B. Nocodazole nur bis zu 50 % der Flüssigkeit Aufnahme von Macropinocytosis wenn akut hinzugefügt (Abbildung 4). Wenn die Inhibitoren nicht wirksam sind, die Zellen werden eine ähnliche Menge an Dextran als das Steuerelement verinnerlichen und eine Abnahme der Fluoreszenz wird nicht gesehen werden. Diese Technik ermöglicht eine große Auswahl an verschiedenen Hemmer und Inhibitor Konzentrationen auf Effekte auf flüssige Aufnahme von Macropinocytosis sehr schnell untersucht werden, reduzieren den Zeitaufwand die Inhibitor Behandlung zu optimieren.
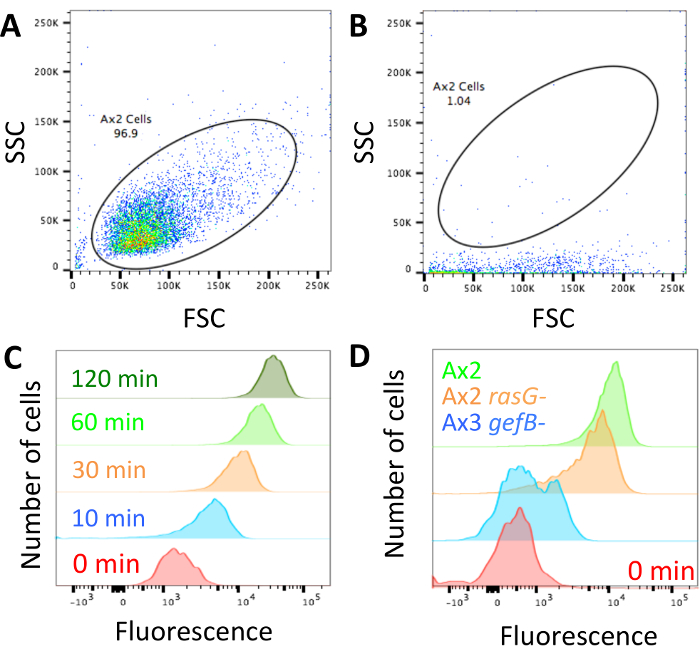
Abbildung 2: Aufbau der Bewegungsdaten Cytometer und Vertreter. (A) der forward Scatter (FSC) und Seitenprofile Scatter (SSC) der Zellen sollte eingestellt sein, damit die Zellen leicht unterschieden werden können. Ein Beispiel wie Ax2 Zellen aussehen soll. (B) wenn das Durchflusszytometer, wie in diesem Beispiel blockiert wird müssen die Zellen sehr low-Side Scatter. Der Laser wird das Fluorophore nicht richtig begeistern und das Gerät entsperrt werden sollte, bevor Sie fortfahren. Alle Daten erhalten, während die Maschine blockiert war, sollte verworfen werden. (C) die Fluoreszenz sollte festgelegt werden damit eine 0 min Aufnahme Probe hat geringe Fluoreszenz, die steigt, wenn Zellen für inkubiert worden haben länger in der fluoreszierende Mittel, wie in diesem Beispiel aus Williams & Kay 201824gezeigt. (D) Beispiele für Zellen, die mit TRITC Dextran 1 h mit normalen Macropinocytosis (Ax2, grün), inkubiert worden reduziert Macropinocytosis (Ax2 RasG -, HM172614, Orange) und Macropinocytosis (Ax3 GefB -abgeschafft HM177628, blau). Bitte klicken Sie hier für eine größere Version dieser Figur.
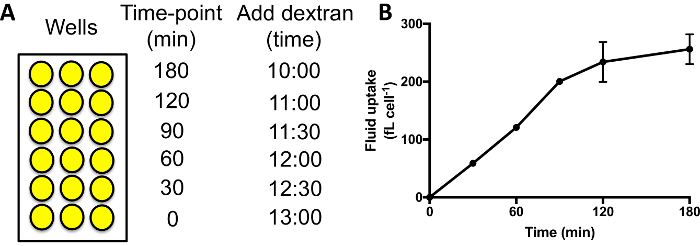
Abbildung 3: flüssige Aufnahme Mal-Kurse in 96-Well Platten durchführen. (A) Dextran sollte hinzugefügt werden jeden Satz von Proben nacheinander mit der gleichen Zeit fertig stellen. Dann waschen Sie die Brunnen, lösen Sie und Messen Sie die verinnerlichte Fluoreszenz Durchflusszytometrie. Beispielzeitung der Dextran hinzufügen finden Sie hier. (B) flüssige Aufnahme Zeitverlauf Ax2 Zellen in 96-Well Platten durchgeführt. Von Williams & Kay zeigen 201824Fehlerbalken der Standardfehler von drei unabhängigen Experimenten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: flüssige Aufnahme Dosis-Wirkungs-Kurven. (A) die Verbindung von Interesse, in diesem Fall der PI3K Inhibitor LY294002, HL5, enthält 1 mg/mL TRITC-Dextran Doppel der gewünschten maximalen Endkonzentration Add. Mischen Sie mit HL5 Wachstumsmedium + 1 mg/mL Dextran mit Fahrzeug allein in unterschiedlichen Proportionen einer Verdünnungsreihe von 200 µL Medium pro Zustand erzeugen. Brunnen als normal für 1 h vor dem Waschen und verinnerlichten Fluoreszenz Messung hinzufügen. (B) flüssige Aufnahme Dosis-Antwort-Kurve für Ax2 Zellen inkubiert mit dem LY294002-haltigen Medium von A. Adaptiert von Williams & Kay 201824. Flüssige Aufnahme ist auf einer unbehandelten Kontrolle normalisiert. Fehlerbalken zeigen den Standardfehler von drei unabhängigen Experimenten. (C) mit der Nocodazole Flüssigkeit Aufnahme Dosis-Antwort-Kurve für Ax2 Zellen inkubiert. Adaptiert von Williams & Kay 201824. Flüssige Aufnahme ist auf einer unbehandelten Kontrolle normalisiert. Fehlerbalken zeigen den Standardfehler von drei unabhängigen Experimenten. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Während andere Methoden, um flüssige Aufnahme bewerten niedriger Durchsatz, Waschen der Zellen in Situ und die Verwendung von Natriumazid, Zellen zu trennen sind die entscheidenden Schritte in dieser Methode die Hochdurchsatz-Messung von Macropinocytosis, Membran-Aufnahme zu ermöglichen oder Phagozytose von Dictyostelium. Die Zellen sind auf eine Fläche befestigt und das Medium ist nicht, können sie Links angebracht, während das Medium um sie herum zuerst abgeworfen und dann verändert durch Untertauchen im Puffer und wieder abgeworfen. Natriumazid, die zellulären ATP verbraucht und die Membran30erschüttert, wird dann verwendet, um die Zellen zu lösen und verhindert auch Exozytose ohne Zelle Lebensfähigkeit24.
Während mittels Durchflusszytometrie Macropinocytosis von Dictyostelium Messen eine sehr genaue Messung der flüssige Aufnahme gibt sehr schnell herstellen den Grund, warum eine bestimmte Belastung oder Bedingung flüssige Aufnahme verändert hat, weitere Untersuchung mit Mikroskopie ist erforderlich24. Es sollte auch beachtet werden, dass zuvor veröffentlichten Ergebnisse in einigen Fällen einen Unterschied in der Flüssigkeit Aufnahme gezeigt haben, durch mutierte Stämme wachsen entweder auf eine Oberfläche (wie in diesem Fall), oder in Suspension (wie in der standard-Protokoll)31schütteln. Mit dieser Methode kann bedeuten, dass in seltenen Fällen offensichtlich flüssige Aufnahme Mängel übersehen werden. Darüber hinaus können bei der Messung von Phagozytose nur geringe Konzentrationen von Partikeln verwendet werden. Der Höchstsatz der Phagozytose, die mit dieser Technik bestimmt werden kann liegt weit unter das wirkliche Maximum, obwohl es immer noch möglich, relevante Unterschiede in der Phagozytose zwischen Stämmen und Bedingungen24zu messen. Um die maximale Rate der Phagozytose zu bestimmen, muss Aufnahme gemessen werden in schütteln Aussetzung durch ein alternatives Protokoll27. Zellen, die Perlen phagozytiertes haben haben Side Scatter erhöht, so dass dies entsprechend korrigiert werden sollte bei der Einrichtung der Durchflusszytometer.
Durchflusszytometrie kann verwendet werden, um flüssige Aufnahme in Säugerzellen32Messen, aber der höhere Anteil von Flüssigkeit phase Aufnahme durch andere endocytic Wege als in Dictyostelium gesehen ein Anliegen ist. Darüber hinaus sind die Zellen in der Regel freistehend mit Trypsin bei 37 ° C, so dass weitere endocytic Fortschreiten der verinnerlichten Dextran. Eiskalte Natriumazid verursacht keine Makrophagen zu trennen Sie eine Oberfläche (Williams, unveröffentlicht Beobachtung), so dass diese Technik nicht anwendbar für Säugerzellen ohne weitere Optimierung.
Hochdurchsatz-Messung der Macropinocytosis hat das Potenzial, schnell und kostengünstig auf den Bildschirm für die Effekte von Inhibitoren, genetische Mutation oder gen-Knockdown auf Dictyostelium Zellen verwendet werden. Mutanten sollten immer mit Eltern direkt verglichen werden. Wenn der Leser keine vorherige Präferenz für Dictyostelium Belastung, nicht axenic Stämme wie DdB oder SC4 sind mehr "Wild-Type" als axenic, und so effektiv wie axenic Stämme33manipuliert werden. Andernfalls Ax2 Stämme sind die axenic Stämme mit den wenigsten Genom Duplikationen34, während viele Stämme von Ax4 Talin A Knockouts und sollte vermieden werden, wenn möglich23. Die meisten bisher veröffentlichten Stämme können aus dem Dicty Stock Center35bestellt werden.
Diese Technik ermöglicht größere investigative Möglichkeiten als bisher über die Auswirkungen der verschiedenen Bedingungen, Inhibitoren und Mutationen auf Macropinocytosis von Dictyostelium.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenlegen.
Danksagungen
Wir danken dem Medical Research Council UK für die Basisfinanzierung (U105115237), RRK.
Materialien
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
Referenzen
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten