Method Article
フローサイトメトリーによる細胞性粘菌キイロタマホコリカビマクロピノサイトーシスの高スループット測定
要約
マクロピノサイトーシス、大規模な非固有の流体吸収、免疫、感染症、がん、神経変性疾患を含む臨床生物学の多くの分野で重要です。ここでは、既存の手法はマクロピノサイトーシス モデル生物キイロタマホコリカビ使用マクロピノサイトーシスの計測フローサイトメトリー高スループット、単一セルの解像度を許可するように適応されています。
要約
大規模な非特異的流体吸収マクロピノサイトーシスは特定の癌細胞、抗原サンプリング、ホスト細胞浸潤、神経変性疾患の広がりの増殖にとって重要です。アメーバ細胞性粘菌キイロタマホコリカビの一般的に使用される実験室の緊張は、マクロピノサイトーシスが 90% の以上の培養液で栽培された流体吸収が非常に高いレートを持っています。また、マクロピノサイトーシスを勉強するためのエクセレント モデル システムは現在、哺乳類マクロピノサイトーシスの既知のコア コンポーネントの多く、また。ここでは、ラベルとして蛍光デキストランを用いた内面流体を測定する標準的な方法は、高速サンプリング (HTS) 添付ファイルを使用して、フローサイトメトリーで分析したサンプル 96-well 版のフォーマットに適応です。
細胞は、あらかじめ決められた時間、浸漬冷たいバッファーで洗浄、5 mM のアジ化ナトリウムがまた分泌を停止するを使用して戸建のため非水魔蛍光デキストランを供給されています。各ウェル内のセルは、フローサイトメトリーで分析しています。メソッドは、膜吸収および蛍光ビーズや細菌の貪食能を測定に適応できます。
このメソッドは、高スループット、労働およびリソース効率的に細胞性粘菌によって流体吸収の測定を許可するように設計されました。複数の菌株 (例えば遺伝子のノックアウト変異) と条件の同時比較が可能に (例えば細胞のさまざまなメディアで、阻害剤の濃度の異なる扱われます) 並行し時間コースを簡素化します。
概要
大規模な非特異的流体吸収マクロピノサイトーシスはいくつか生物学的コンテキスト1に重要な細胞によって免疫抗原サンプリングを含む2、病原体参入ホスト細胞3、癌細胞増殖4とプリオン病5の広がり。哺乳類、細胞性粘菌アクチン6、7、π (3,4,5) P38,9,10 (脂質の正確な性質が異なる 2 つの11の間) が、活性化Macropinocytic パッチの方法について多くの疑問が残っているが Ras12,13, と活性 Rac14,15がマクロピノサイトーシス、効率的な流体吸収のために重要組織化され、最終的には内面、形作られます。マクロピノサイトーシスとどのように彼らが様々 な生物学的文脈で重要のそれに続く決定の重要な多くのタンパク質を発見マクロピノサイトーシスのより包括的な理解を与える、悪意のあるの開発条件の範囲のための治療を対象とします。
細胞性粘菌は、マクロピノサイトーシスを研究するための理想的なモデル システムです。標準的な実験室の緊張の構成マクロピノサイトーシスの高レベルは、その流体吸収はマクロピノサイトーシス6により 90% を意味します。これはマクロピノサイトーシス マクロピノサイトーシスによる流体吸収の割合ははるかに低い哺乳類細胞とは異なり、流体の吸収を決定するだけで測定することができます。マクロピノサイトーシスはとてもよく定義されて、このシステムで簡単に可視化12を同様に提供を調査するための明確な利点は他のシステム上、macropinosome の保存されているコンポーネントをコア複数の規制信号があります。16,17。
18デキストラン陽性膜小胞で占められているセルの領域を決定する顕微鏡に続いて短期間のデキストランをパルス後固定セル マクロピノサイトーシスを測定する哺乳類細胞で使用される標準的な方法が含まれます。この手法はしかし macropinosomes だけ内面化ボリュームを意味セルの単一の平面を考慮し、細胞性粘菌19で報告されている細胞に入ると縮小の可能性を考慮しません不明です。Macropinosomes 与えられた時間内在化している数を数える、代替手法が同じマイナス20。細胞性粘菌を使用すると、これらの問題が回避できます。しかし、細胞性粘菌液吸収を測定するための既存の技術が比較的細胞およびデキストラン21の労働集約的な大規模な使用量です。細胞蛍光デキストランと、蛍光を使用して内面化された蛍光性の定量のための様々 な時点で削除のサンプル高密度で揺さぶられます。このまま低スループットが、解像度の22、人口レベルではなく、1 つのセルを得るためにフローサイトメトリーによる細胞はこのように調製を分析できます。
ここでは、ラベルとして蛍光デキストランを用いた内面流体を測定する標準的な方法は、高速サンプリング (HTS) 添付ファイルを使用して、フローサイトメトリーで分析したサンプル 96-well 版のフォーマットに適応です。細胞は、あらかじめ決められた時間、浸漬冷たいバッファーで洗浄、5 mM のアジ化ナトリウムがまた分泌を停止するを使用して戸建のため非水魔蛍光デキストランを供給されています。各ウェル内のセルは、フローサイトメトリーで分析しています。このメソッドより少ないリソースを使用して労力を軽減し、ながら系統/条件の多数の流体の摂取量の同時比較ができ、上記の方法の限界を克服するために設計されました。
プロトコル
1. セルと材料の準備
- 説明23として SM 寒天プレート機構の解析などの細菌と組み合わせてまたは HL5 など栄養培地での細胞を栽培してください。
注: 細菌マクロピノサイトーシスに欠陥のあるノックアウト変異体を成長マクロピノサイトーシスの率を高める可能性があります二次突然変異の蓄積を防ぐことができます。最適な結果を得るのための株式から細胞をめっき後 4 下通路の数を保持します。突然変異体の分離後できるだけ早く凍結する在庫として保存します。 - SM 寒天プレート上のセルを養う、SM 培地で合流する健食を成長します。SM 寒天上に細菌の 200-300 μ L を追加し、。(別の細菌のプレートから転送) 時細胞の生殖不能のループを取るし、プレートの 1 つの端に 。今週の 22 ° C で孵化させなさい。
- テトラ-メチル-ローダミン イソチオ シアン酸 (TRITC-) デキストランを 50 mg/mL の水に溶解、1 ml に 0.22 μ m のフィルターを使用してフィルター処理および-20 ° C で保存因数は無期限に保存することができます。
注: 155 kDa、一括で安く買うことができるより小さい dextrans の測定と同様に効果的に細胞性粘菌24マクロピノサイトーシスこのメソッドで使用される典型的なサイズです。Alexa-647、カスケード ブルーなどの異なる非水魔 dextrans は異なった fluorophores が必要な場合の選択肢であります。
2. (省略可能) を定量的に定性的な測定を変換します。
-
細胞懸濁液を用いた流体吸収分析を実行します。
- 3 分間 300 x g で axenically 成長細胞のペレット、上澄みを廃棄し、1 x 107セル/mL に培養液で再懸濁します。TRITC デキストランを 0.5 mg/mL に追加し、180 rpm、22 ° c. で振る
- サンプル 0、30、60、90、120 分の洗浄で冷たい KK2 0.7 mL に一度冷えた KK2バッファー23ベンチトップ遠心分離機の 1.5 mL で同じバッファーに 1 mL に再懸濁し、氷の上を格納 0.8 mL を希釈します。
注:相当の結果をすぐに、または収集されたすべてのサンプルの洗浄します。
-
細胞によって内面液量を決定します。
- 574 の 544 nm、発光波長の励起波長を用いた蛍光を測定する蛍光を設定 10 nm スリットの nm。TRITC デキストランの希釈系列を設定し、指定された蛍光を測定するために使用デキストランのボリューム。検量線を作成します。
- セクション 2.1 0.9 mL 細胞懸濁液を使用してのセルによって蛍光を測定します。校正曲線24を使用してセルごと内面液量を計算します。
- 0.5 mL の氷冷株式会社2に別々 にそれぞれの時点から細胞の残りの部分を薄くしなさい。5 mL ポリスチレン流れ cytometry チューブに 70 μ m セル ストレーナー フィルターします。流れの cytometer を設定時間の各ポイントから細胞は互いからはっきりとその蛍光を記録 (セクション 3.4 と 3.5 を参照)。
- 上記の設定を使用して流れの cytometer でキャリブレーション ビーズの蛍光を測定し、それを記録します。
注: これは流れの cytometer のすべての将来の蛍光測定の参照: ビーズを実行再度を使用する前に、と同じ蛍光があるので設定を調整します。これは非常に狭い定義されたピークを与えます。蛍光ピーク周辺ゲートを入れて、この容易になります。 - 3 回繰り返すし、2.2 と 2.3 互いのセクションで得られた細胞蛍光データをプロットします。ベスト フィットのラインをプロットし、cytometry 流れから質的データを定量的な単位に変換する式を使用します。
3. 測定流体吸収
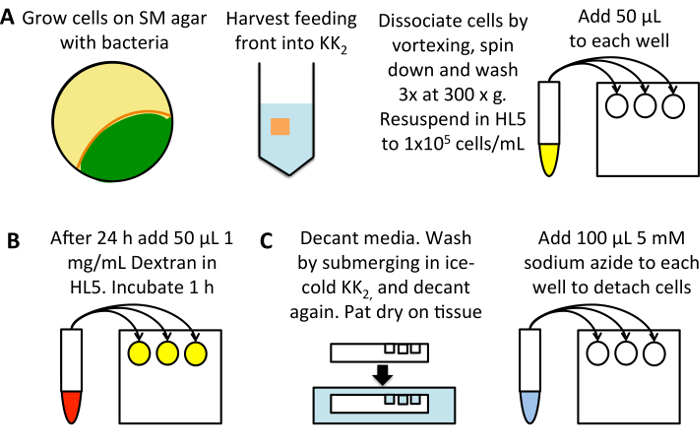
図 1: マクロピノサイトーシスの高スループット測定の概略図。(A) SM 板の成長細胞性粘菌は健食菌 (黄色) でシードします。細胞を採取供給のフロント (オレンジ)、細胞は既に開発を回避する (緑)、25 mL の KK2バッファーに。分離するに渦は 300 x gで 3 分遠心分離によってペレットしてたびに上清を廃棄 KK2バッファーの 50 mL で 3 回洗ってください。1 x 105セル/ml HL5 成長媒体に再懸濁します、フラットボトム 96 ウェル プレートのサンプルあたりの 3 つの井戸に 50 μ L を追加します。(B)希釈 TRITC デキストラン HL5 培地に 1 mg/mL に 50 mg/mL の原液から 22 ° C 24 時間インキュベートします。(0 分吸収制御井戸を除く)、各サンプルを 50 μ l 添加し、デキストランを 0 分取り込みコントロールに追加した後, 1 h, 22 ° C で。(C)はすぐにメディアをデカント、余分なメディアを取り外して洗浄する井戸を埋める冷たい KK2バッファーのお風呂で水没する組織にプレートをパットします。バッファーを捨て、再び乾燥パットします。5 mM アジ化ナトリウム KK2セルをデタッチする MC に溶解の 100 μ L を追加します。フローサイト メーターの内面化された蛍光測定のために取る。この図の拡大版を表示するのにはここをクリックしてください。
-
ティッシュ文化 96 ウェル平底プレート (図 1 a) を設定します。試金; 前に 24 h HL5 媒体 (含まれている 100 μ g/mL ジヒドロストレプトマイシン、100 μ g/mL アンピシリン 50 μ G/ml カナマイシンの) にそれらを転送する細菌の成長のセルを使用これはマクロピノサイトーシス細菌24上に成長した細胞に見られる低レベルから誘導することができます。また、培養、細胞密度の異なるから希釈されて誤差を減らすために、試金する前に 24 時間インキュベートから直接細胞を希釈します。
- KK2 50 mL 遠心管中の 25 mL に餌のフロントから細胞を採取します。ボルテックスと 3 分.の 300 x gでペレットによる細胞を分離します。上澄みを廃棄、ペレットを再懸濁します、KK の2細菌を除去するたびに上清を廃棄 50 mL で 3 分間 300 x gで 3 回洗浄しなさい。
- (、血球または他のセルのカウント システムを使用) セル密度を決定して HL5 含む抗生物質を 1 x 10 の5セル/mL に希釈します。条件ごとに 3 つの井戸を使用して各ウェルに 50 μ L をピペットします。24 時間 0 分吸収のコントロールを設定するための 22 ° C で孵化させなさい。
注: 代替メディア、例えばSIH、VL6 を代わりに使用することができます。
-
ロードセルとは TRITC デキストラン (図 1 b)。
- 1 mg/ml 使用される媒体にデキストランを希釈 (これに増加 2.5-5 mg/mL 吸収量が非常に少ないとセルを評価するとき)。(0.5 mg/mL TRITC デキストランの最終的な集中を与える) 各ウェルに 50 μ L を追加し、これにより、デキストランの重要な蓄積が、デキストランの放出はまだ始まっていない 22 ° C 1 時間にプレートを戻ります。
注:リピータ ピペット誤差の低減より急速に行われるこの手順をことができます。
- 1 mg/ml 使用される媒体にデキストランを希釈 (これに増加 2.5-5 mg/mL 吸収量が非常に少ないとセルを評価するとき)。(0.5 mg/mL TRITC デキストランの最終的な集中を与える) 各ウェルに 50 μ L を追加し、これにより、デキストランの重要な蓄積が、デキストランの放出はまだ始まっていない 22 ° C 1 時間にプレートを戻ります。
-
(図 1) フローサイトメトリー用セルを準備します。
- すぐに洗濯する前に、0 分取り込みコントロールに 50 μ L デキストランを含むメディアを追加します。
- 媒体を捨て、ティッシュで水気します。冷たい KK2プレートを水没によって洗浄し、デカントします。
注:付着欠陥を有するいくつかの系統がこの手順で、例えばタリンの両方の同族体のノックアウト剥離 (タラ-/talB -)25。不完全を添付、必要な場合は、メディアを吸引細胞を操作するときは、注意を使用します。 - 冷たい 5 mM アジ化ナトリウム KK2MC (KK2 + 2 mM MgSO4と 100 μ M CaCl2) に溶解の 100 μ L を追加します。
注意: アジ化ナトリウムは非常に有毒です。粉体を操作するときは、防塵マスク、保護メガネを使用します。常に手袋、白衣を着用します。熱を避け、酸と混ぜないでください。
注: 細胞は急速にデタッチ、開口放出が防止24.顕微鏡は、これを確認する使用できます。
-
フローサイトメトリーによる測定流体吸収
- 相対値を絶対的なものに変換する場合は、(セクション 2 を参照してください) の流れの cytometer 設定を標準化するビーズを使用します。また、使用セル搭載マシンがブロックされていないことを確認 (図 2 a) のセルを隔離する前方散乱、側方散乱が適切に設定されていることを確認する 2 のセクションとデキストラン (図 2 b) とパラメーターを調整(図 2) の内面の蛍光を測定します。
- 高速サンプリング システムを接続し、プレートを追加します。セットアップ プロトコル (TRITC デキストランは、エキサイトし、582 nm チャネルまたは類似を測定に黄緑色のレーザーを使用) の蛍光を測定するための細胞懸濁液および実行の最大 65 μ L。
-
流れの cytometry の結果を分析します。
- 前方散乱、側方散乱 (図 2 a) を使用してセルのゲート。統計情報オプションを使用してセルの中央の蛍光を計算します。1 つのサンプルを使用してこれらのパラメーターを設定し、すべてのサンプルに適用します。
注: 前方散乱/サイド散乱プロファイルは、サンプル異なる変異体または阻害剤を使用する場合によって異なります。 - 条件ごとに 3 つの井戸の意味を決定し、0 分摂取コントロールを減算します。どちらかはセクション 2 で決定方程式を使用して数量値を変換またはコントロールに正規化すること。
- 前方散乱、側方散乱 (図 2 a) を使用してセルのゲート。統計情報オプションを使用してセルの中央の蛍光を計算します。1 つのサンプルを使用してこれらのパラメーターを設定し、すべてのサンプルに適用します。
4. 流体吸収時間コースを実行します。
- セクション 3 の時点およびひずみ/条件ごとに 3 つの井戸のようにセルを設定します。
- 順次、さまざまな坑井にデキストラン ラベル付きメディアを追加します。典型的な経過を測定流体吸収 0、30、60、90、120 と 180 分追加 120 分時点の井戸へそれを追加することによって、後 60 分、180 分時間ポイント井戸デキストラン含有培地等(図 3 a)。
- 0 分でデキストラン含有の 50 μ L を追加中、すぐに捨て、セクション 3.3 のようにプレートを洗います。セクション 3.5 で説明されているように分析します。
5. 用量応答曲線
- 各ひずみと条件の 3 つの井戸を 3 で説明したようにセルを設定します。
- 化合物の二重目的の最大最終濃度1 mg/mL デキストランを含有する培地に関心の化合物を希釈します。車両の割合が第 1 として同じデキストランと媒体を含んでいる第 2 管を準備します。ミックスする渦。
- 200 μ L デキストランのサンプル (図 4 a) あたりの媒体を含んでいる興味の化合物の希釈系列を作成します。ミックスする渦。1 h は、各サンプルに媒体の 50 μ L を追加します。
- 洗って、セクション 3.3 以降で前述の分析します。
6. 貧食能および膜の取り込み
- 膜の吸収を測定するには、セクション 3 で説明したセルを準備します。培最終濃度 10 μ M、20 μ M FM 1-43 の 50 μ L を追加します。読み込み後洗浄し、3.3 節のようにフローサイトメトリー用セルを準備します。585 nm チャネルまたは同様に、エキサイトに青色レーザーを使用して測定します。
注: 膜輸送は液相よりもより高速な 10 分は 1 h26よりも使用するより適切な時点です。膜に組み込まれる場合にのみ蛍光を発する代替染料を代わりに使用することができます。 -
貪食能を測定する蛍光標識ビーズや細菌のいずれかを使用します。前方に細胞性粘菌から分離し、側散布24、蛍光酵母を使用ことはできません。セクション 3 で説明するようにセルを設定し、説明27として分析します。
- 測定するには、ビーズの貪食能黄緑ビーズ洗浄と同様にフローサイトメトリーの準備の前に 1 時間 5 x 107ビーズ/mL (1.75 と 2 μ m) または 1 × 108ビーズ/mL (1、1.5 μ m) の最終的な集中にセクション 3.2 で説明するようにラベルを追加します。セクション 3.3。525 nm チャネルまたは同様に、エキサイトに青色レーザーを使用して測定します。
注: 高濃度は、細胞の剥離をもたらすでしょう。 - 細菌の貪食能を測定するには、前述のセクション 3.2 に 1 x 10 の8細菌/mL の 1 h のために洗濯やセクション 3.3 のようにフローサイトメトリー用の準備の前に、テキサス赤ラベル大腸菌バクテリアを追加します。610 nm チャネルまたは同様に、エキサイトに黄緑色のレーザーを使用して測定します。
- 測定するには、ビーズの貪食能黄緑ビーズ洗浄と同様にフローサイトメトリーの準備の前に 1 時間 5 x 107ビーズ/mL (1.75 と 2 μ m) または 1 × 108ビーズ/mL (1、1.5 μ m) の最終的な集中にセクション 3.2 で説明するようにラベルを追加します。セクション 3.3。525 nm チャネルまたは同様に、エキサイトに青色レーザーを使用して測定します。
結果
手法が実行されているし、セル、デキストランと読み込まれ、分析 (図 1) の準備ができて、一度流れの cytometer がブロックされていないことを確認し、図 2 aに示すように細胞のように前方散乱/サイド散乱プロファイルを調整します。マシンがブロックされている場合は、 2 b を図のようになるよりになります、続行する前にブロックする必要があります。パラメーター コントロールを表示する無菌細胞より長い時点で高い内面デキストラン蛍光と短いもので低い内面化された蛍光性があることを確認 (図 2)。
突然変異体間の相違点を探して、3 つの表現型の 1 つをすることがそうです。変異体は、通常の流体の摂取量を持つことが、部分的な欠陥があってもまたは流体吸収が完全に廃止されます。この場合標準研究室ひずみ ax2 横型、変異 〜 50% と減少流体吸収 (ax2 横型rasG-14)、流体吸収 (Ax3 gefB-28) を廃止、図 2 D通常の流体の摂取量と歪みを示しています。平均中央値の流体の摂取量 (セクション 3.5) を取得し、それを使用して (図 3 b) のように内面流体の体積を計算または、データ コントロールを比較 (図 4 bのようにと4 C)。
その後、デキストランを exocytosed するのに開始、60-90 分間内面化された蛍光を増やす必要があります流体吸収時間のコースを図 3 aのようにを実行するとき、高原に達する (図 3 b)。したがってマクロピノサイトーシス異なる変異体/条件を比較することにより、達成されるべき良好な信号と信号がエキソサイトーシスにより失われないとき、標準時ポイントとして 60 分を使用します。開口放出が妨げられる深刻な突然変異体は、高原29に到達する時間がかかります。
ほとんどの場合より高い添加剤でほとんど何も下に行くとき治療細胞と細胞性粘菌( 4 a を図のようにを設定)、マクロピノサイトーシスに対する有効な阻害剤 1 h で内面化デキストラン(図 4 b)。いくつかの阻害剤は 100% 有効にできない場合があります、ただし、例えばノコダゾールのみによって抑制する流体の摂取量の 50% までマクロピノサイトーシス鋭く追加される (図 4)。阻害剤が効果がない場合、セルは、コントロールとしてデキストランのような量を内面化し、蛍光の減少は見ていません。この手法は、阻害剤治療を最適化する時間を短縮でき異なる阻害剤および非常に迅速に、マクロピノサイトーシスによって流体の吸収に及ぼす影響は上映阻害剤濃度の広い範囲をことができます。
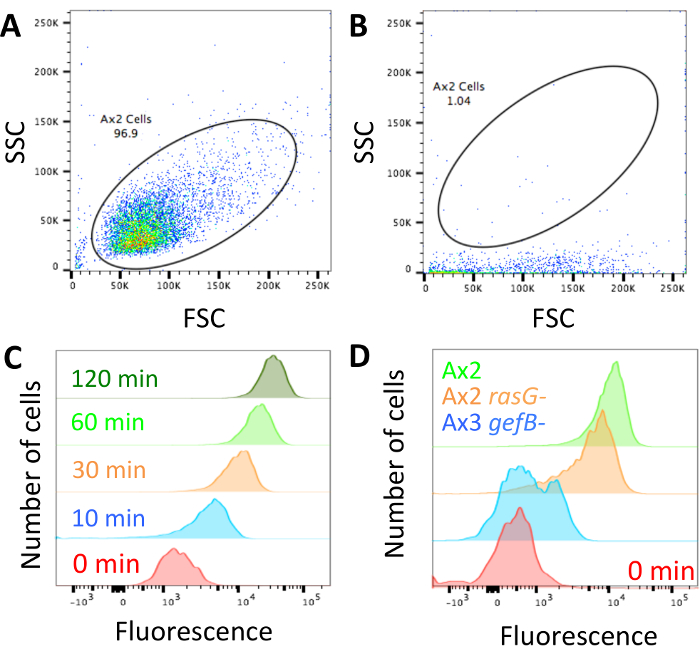
図 2: 流れの cytometer と代表データの設定。(A)セルを簡単に区別できるように、前方散乱 (FSC) と細胞の面散布 (SSC) プロファイルを設定する必要があります。Ax2 横型セルがどのように見えるべきかの例です。(B)この例のように、流れの cytometer がブロックされている場合、セルは、非常に低い側散布を持ってください。レーザーが正しく、蛍光物質を刺激しないと、マシンは続行する前にブロックできませんする必要があります。マシンがブロックされたときに取得されたすべてのデータを破棄する必要があります。(C)蛍光設定してください 0 分取り込みサンプルが増加するときに細胞が培養されている低蛍光性蛍光メジウムで長く 2018年24ウィリアムズ & ケイから取られるこの例で示すように。(D)通常マクロピノサイトーシス (ax2 横型、緑)、1 h の TRITC デキストランで培養されている細胞の例マクロピノサイトーシス (ax2 横型rasG -、HM172614, オレンジ) を削減、廃止マクロピノサイトーシス (Ax3 gefB-HM177628, 青)。この図の拡大版を表示するのにはここをクリックしてください。
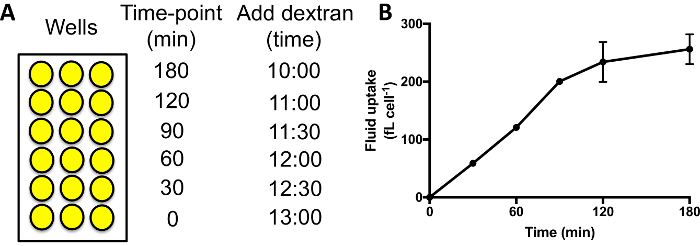
図 3: 96 ウェル プレートで流体吸収時間コースを実行します。(A)デキストランはする必要があります、順番に同じ終了時刻のサンプルの各セットに追加します。井戸を洗浄し、デタッチして、フローサイトメトリーによる内面の蛍光を測定します。例、デキストランを追加する時は以下のとおりです。(B) ax2 横型セルの流体吸収時間コースは、96 ウェル プレートで実行されます。誤差範囲 2018年24ウィリアムズ & ケイから撮影、3 つの独立実験の標準エラーが表示します。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 流体吸収線量の応答曲線。(A)の関心は、この場合、PI3K 阻害剤 LY294002、HL5 に二重目的の最終的な最大濃度で 1 mg/mL TRITC デキストランを含む化合物を追加。HL5 成長培地 + 条件あたり 200 μ L 中の希釈系列を生成する様々 な割合で単独で車を含む 1 mg/mL デキストランと混ぜます。1 h は通常井戸洗浄および内面化された蛍光を測定する前に追加します。(B) ax2 横型セルの流体吸収線量の応答曲線はAから LY294002 含有培地で培養。ウィリアムズ & ケイ 2018年24から適応。流体の摂取量は、未処理のコントロールに正規化されます。誤差範囲は、3 つの独立実験の標準誤差を表示します。(C) ax2 横型セルの流体吸収線量の応答曲線は、ノコダゾールと孵化させます。ウィリアムズ & ケイ 2018年24から適応。流体の摂取量は、未処理のコントロールに正規化されます。誤差範囲は、3 つの独立実験の標準誤差を表示します。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
流体の摂取量を評価するために他の方法は低スループットである一方マクロピノサイトーシス、膜吸収の高スループット測定をできるように、このメソッドで重要な手順は、その場で細胞と細胞をデタッチするアジ化ナトリウムの使用を洗浄または貪食細胞性粘菌。細胞が表面に付着し、媒体ではない、彼ら左周り中が最初に投げ時に取り付け、その浸漬バッファーを変更でき再びオフにスローされます。細胞の ATP の枯渇と30の膜を脱分極、アジ化ナトリウムを使用して、セルをデタッチし、も24セル実行可能性に影響を与えずに開口放出を防ぎます。
特定の株または条件が流体の摂取量を変更する理由理由を確立する非常に迅速に、流体吸収の非常に正確な測定を与えるフローサイトメトリーを使用して細胞性粘菌によってマクロピノサイトーシスを測定するそれ以上の調査を使用して顕微鏡は必要な24です。それも注意しなければならないこと以前に発行された結果、いくつかのケースで違いを示している流体吸収で突然変異系統のいずれか (この場合は) のように表面上に成長または懸濁液 (標準プロトコル) のように31の揺れ。このメソッドを使用して、まれに、明らかな流体吸収不良を逃している可能性があります。また、貪食能を測定するとき、粒子の低濃度が使用できます。菌株と条件24の貪食の関連の違いを測定することも可能だが、この手法で決定することができます食の最大レートは本当の最大値をはるかに下回るです。食の最大レートを決定するには、吸収は、代替プロトコル27によって懸濁液を振動で測定しなければなりません。この訂正されるべきのそれに応じて流れの cytometer を設定するとき、ビーズを貪食した細胞は側方散乱を増加しています。
フローサイトメトリーを使用して哺乳類セル32の流体の摂取量を測定できます、流体のより高い割合で他のエンドサイトーシス経路による吸収を相ただし細胞性粘菌に見られるよりも、心配です。また、セルは通常 37 ° c、さらに内面のデキストランのエンドサイトーシスの進行を許可するトリプシンを使用して戸建します。冷たいアジでは、この手法をさらに最適化を行う哺乳類セルには適用されません、サーフェス (ウィリアムズ、未発表観測) からデタッチするマクロファージは発生しません。
マクロピノサイトーシスの高スループット測定画面のすぐにそして安く細胞性粘菌に及ぼす阻害剤、遺伝子の突然変異や遺伝子の打撃に使用する可能性があります。変異体は、彼らの直接の親のみを常に比較必要があります。読者には、細胞性粘菌のひずみの事前設定がなければ、DdB や NC4 など非無菌系統は無菌のものよりも「野生型」より、し、、無菌系統33として効果的に操作することができます。そうでなければ、ax2 横型の系統は、無菌系統が最も少ないゲノム重複34Ax4 の多くの菌株タリン A ノックアウトする必要があります回避可能であれば23。最も以前に発行された系統は、35Dicty ストック センターから注文できます。
このテクニックには、さまざまな条件、阻害剤、細胞性粘菌によってマクロピノサイトーシスの突然変異の効果に以前可能だったより大きい調査の可能性ができます。
開示事項
著者はある利益相反を開示します。
謝辞
コア RRK (U105115237) の資金の医学研究議会イギリスに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
参考文献
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved