Method Article
Haut débit mesure de Dictyostelium discoideum macropinocytose par cytométrie en flux
Dans cet article
Résumé
Macropinocytose, absorption de fluides à grande échelle non spécifiques, est important dans de nombreux domaines de la biologie clinique y compris immunologie, infection, cancer et les maladies neurodégénératives. Ici, les techniques existantes ont été adaptées pour permettre la résolution haut-débit, cellule unique mesure de macropinocytose dans la macropinocytose modèle organisme Dictyostelium discoideum utilisant cytométrie en flux.
Résumé
À grande échelle non spécifique d’absorption fluide par macropinocytose est importante pour la prolifération de certaines cellules cancéreuses, échantillonnage de l’antigène, invasion des cellules hôtes et la propagation des maladies neurodégénératives. Les souches couramment utilisés en laboratoire de l’amibe Dictyostelium discoideum ont des taux d’absorption de liquide extrêmement élevées lorsqu’il est cultivé dans un milieu nutritif, plus 90 % d'entre eux sont en raison de la macropinocytose. En outre, de nombreux éléments base connue de macropinocytose mammifères sont également présents, ce qui en fait un système excellent modèle pour étudier la macropinocytose. Ici, la technique standard de mesure intériorisé fluide à l’aide de dextran fluorescent sous une étiquette est adaptée à un format de plaque à 96 puits, avec les échantillons analysés par cytométrie en flux à l’aide d’un accessoire d’échantillonnage haut débit (HTS).
Les cellules sont nourris non trempants dextran fluorescent pour une durée prédéterminée, baigné par immersion dans un tampon glacée et détaché à l’aide de l’azide de sodium 5 mM, qui s’arrête aussi exocytose. Dans chaque puits, les cellules sont ensuite analysées par cytométrie en flux. La méthode peut également être adaptée pour mesurer l’absorption de la membrane et phagocytose des perles fluorescentes ou des bactéries.
Cette méthode a été conçue pour permettre la mesure de l’absorption de liquide par Dictyostelium , haut débit, du travail et ressources efficacement. Il permet une comparaison simultanée de plusieurs souches (par exemple les mutants de masquage d’un gène) et les conditions (par exemple des cellules dans les différents médias ou traités avec différentes concentrations de l’inhibiteur) en parallèle et simplifie le temps-cours.
Introduction
À grande échelle non spécifique d’absorption fluide par macropinocytose est importante dans plusieurs contextes biologique1, y compris l’échantillonnage d’antigène par immunitaire des cellules2, entrée pathogène dans l’hôte cellules3, cancer cellulaire4 de la prolifération et la propagation de maladies de prion5. Dans les mammifères et les cellules de Dictyostelium , actine6,7, PI (3,4,5) P38,9,10 (bien que la nature exacte des lipides diffère entre les deux11), activés RAS12,13et activés Rac14,15 sont importants pour l’absorption de liquide efficace de macropinocytose, bien qu’il reste beaucoup de questions sans réponse sur comment le patch macropinocytic est formé, organisé et éventuellement intériorisés. Découverte de plusieurs protéines importantes pour la macropinocytose et lors de la détermination de la façon dont elles sont importantes dans les divers contextes biologiques, donnera une compréhension plus complète de macropinocytose et potentiellement permettre le développement de traitements ciblés pour un éventail de conditions.
Dictyostelium est un système de modèle idéal pour l’étude de macropinocytose. Le niveau élevé de macropinocytose constitutive dans les souches de laboratoire standard signifie que l’absorption du liquide est supérieure à 90 % en raison de la macropinocytose6. Cela permet de macropinocytose à mesurer uniquement en déterminant l’absorption liquide, contrairement aux cellules de mammifères où la proportion de l’absorption de liquide en raison de la macropinocytose est beaucoup plus faible. Macropinocytose est donc bien définie et facilement visualisée12 dans ce système de même offre des avantages distincts pour enquêter sur les éléments conservés de la macropinosome de base sur les autres systèmes où il peut y avoir plusieurs signaux réglementaires 16 , 17.
La technique standard utilisée pour mesurer la macropinocytose par les cellules de mammifères comporte la fixation des cellules après pulsé avec dextran pendant une courte période de temps suivi au microscope afin de déterminer la surface d’une cellule qui est occupée par des vésicules de dextran séropositifs18. Cette technique ne constitue pas cependant la possibilité de macropinosomes diminue en entrant dans la cellule, qui a été rapportée chez Dictyostelium19et prend uniquement en compte seul planes de la cellule, ce qui signifie que le volume intériorisé n’est pas claire. Une autre technique, de compter le nombre de macropinosomes internalisés dans un temps donné, a les mêmes inconvénients20. À l’aide de Dictyostelium évite ces problèmes ; Cependant, les techniques existantes pour mesurer l’absorption de liquide par Dictyostelium sont relativement main-d'oeuvre, à l’aide d’un grand montant des cellules et dextran21. Les cellules sont secouées à haute densité en fluorescent dextran et échantillons prélevés à des moments différents pour la détermination de la fluorescence intériorisée à l’aide d’un fluorimètre. Cellules préparées de cette manière peuvent être analysés par cytométrie à gagner unicellulaire, plutôt qu’au niveau des populations, résolution22, bien que cela reste faible débit.
Ici, la technique standard de mesure intériorisé fluide à l’aide de dextran fluorescent sous une étiquette est adaptée à un format de plaque à 96 puits, avec les échantillons analysés par cytométrie en flux à l’aide d’un accessoire d’échantillonnage haut débit (HTS). Les cellules sont nourris non trempants dextran fluorescent pour une durée prédéterminée, baigné par immersion dans un tampon glacée et détaché à l’aide de l’azide de sodium 5 mM, qui s’arrête aussi exocytose. Dans chaque puits, les cellules sont ensuite analysées par cytométrie en flux. Cette méthode a été conçue pour dépasser les limitations des méthodes ci-dessus et permettre une comparaison de l’absorption de liquide d’un grand nombre de souches/conditions tout en utilisant moins de ressources et de réduire le travail impliqué.
Protocole
1. préparation des cellules et matériaux
- Cultiver des cellules soit sur plaques de gélose SM en conjonction avec des bactéries telles que Klebsiella aerogenes, ou dans un milieu nutritif comme HL5 comme décrit23.
Remarque : Des mutants de masquage qui sont défectueux dans la macropinocytose sur les bactéries de plus en plus permet d’éviter l’accumulation de mutations secondaires qui peuvent augmenter le taux de macropinocytose. Limiter le nombre de passage inférieur à 4 après le placage des cellules provenant de stocks pour des résultats optimaux. Des mutants doivent être conservés comme stocks congelés dès que possible après l’isolement. - Pour cultiver des cellules sur plaques de gélose SM, atteindre K. aerogenes confluence dans le milieu SM. Ajouter 200 à 300 μL de bactéries sur une gélose SM et se propager. Prenez une boucle stérile des cellules (lors du transfert d’une autre plaque bactérienne) et se propager à un bord de la plaque. Incuber à 22 ° C pendant une semaine.
- Dissoudre le dextran isothiocyanate (TRITC-) tétra-méthyl-rhodamine à 50 mg/mL dans l’eau, filtrer à l’aide de 0,22 μm filtres en aliquotes de 1 mL et conserver à-20 ° C. Aliquotes peuvent être conservés indéfiniment.
NOTE : 155 kDa est la taille standard utilisée avec cette méthode, car il peut être acheté à un prix avantageux en vrac, mais plus petits dextranes mesurent macropinocytose tout aussi efficacement dans Dictyostelium24. Les dextranes non trempants différents, comme le bleu de la cascade ou Alexa-647, sont des solutions de rechange si fluorophores différents sont nécessaires.
2. conversion des mesures qualitatives dans Quantitative (facultatifs)
-
Effectuer un essai d’absorption fluide à l’aide de cellules en suspension.
- Pellet axéniques croissant de cellules à 300 g pendant 3 min, jeter le surnageant et remettre en suspension dans un milieu nutritif à 1 x 107 cellules/mL. Ajouter TRITC-dextran à 0,5 mg/mL et agiter à 180 tr/min, 22 ° C.
- Diluer 0,8 mL échantillons dans 0,7 mL glacee KK2 à 0, 30, 60, 90, 120 min. laver une fois dans 1,5 mL de2 tampon23 KK glacée dans une centrifugeuse de paillasse, remettre en suspension de 1 mL dans le tampon de la même et stockent sur la glace.
Remarque : laver immédiatement ou dès que tous les échantillons ont été prélevés donne des résultats équivalents.
-
Déterminer le volume de fluide internalisé par les cellules.
- Définissez le fluorimètre pour mesurer la fluorescence en utilisant une longueur d’onde d’excitation d’onde 544 de nm et d’émission de 574 nm avec une fente de nm 10. Mis en place une série de dilutions de TRITC-dextran et l’utiliser pour mesurer la fluorescence pour certains volumes du dextran. Créer une courbe d’étalonnage.
- Mesurer la fluorescence internalisée par les cellules dans la section 2.1 à l’aide de 0,9 mL de la suspension cellulaire. Calculer le volume de fluide internalisé par cellule à l’aide de la courbe de calibration24.
- Diluer le reste des cellules de chaque point séparément dans 0,5 mL glace froide KK2dans le temps. Filtrer à travers un tamis de cellule 70 µm dans des tubes de 5 mL polystyrène écoulement cytometry. Définissez le cytomètre en flux afin que les cellules de chaque point dans le temps sont distincts les uns des autres et d’enregistrent leur fluorescence (voir les sections 3.4 et 3.5).
- Mesurer la fluorescence des perles d’étalonnage dans le cytomètre de flux en utilisant les paramètres ci-dessus et enregistrez-le.
NOTE : Ceci est la référence pour toutes les mesures de fluorescence futures sur le cytomètre en flux : avant d’utiliser à nouveau exécuter les perles et ajuster les paramètres afin qu’ils aient la même fluorescence. Cela donnera un pic très étroit défini. Mettre une barrière autour du pic de fluorescence peut faciliter cette opération. - Répétez trois fois et tracer les données de fluorescence des cellules obtenues aux sections 2.2 et 2.3 uns contre les autres. Tracer une ligne de régression et l’équation permet de convertir les données qualitatives de la cytométrie en unités quantitatives.
3. mesurer l’absorption de liquide
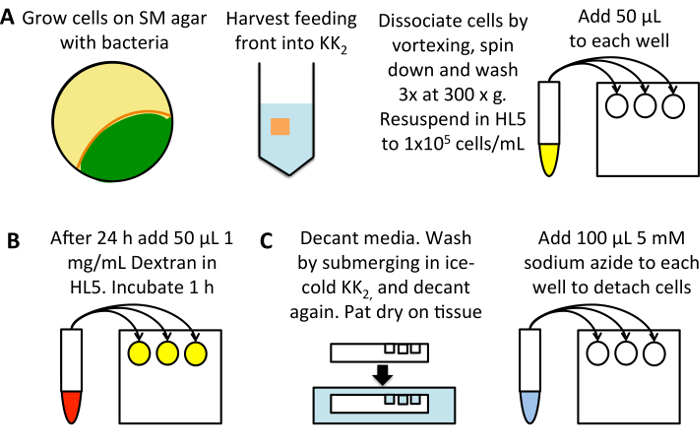
Figure 1 : schéma de mesure de haut débit de macropinocytose. (A) Grow Dictyostelium sur une plaque de SM ensemencé avec K. aerogenes bactéries (jaune). Récolter les cellules de l’alimentation avant (orange), en évitant les cellules qui sont déjà développés (vert), dans 25 mL de tampon2 KK. Vortex à dissocier, à pellets par centrifugation à 3 min à 300 x g, puis laver 3 fois dans 50 mL de tampon de2 KK, jeter le surnageant de chaque fois. Remettre en suspension à 1 x 105 cellules/mL dans le milieu HL5 et ajouter 50 µL dans trois puits par exemple d’une plaque de 96 puits de fond plat. Incuber à 22 ° C pendant 24 h. (B) diluée TRITC-dextran, à 1 mg/mL dans le milieu HL5, d’une solution mère de 50 mg/mL. Ajouter 50 µL de chaque échantillon (sauf les puits témoins d’absorption 0 min) et incuber à 22 ° C pendant 1 h, après lequel ajouter le dextran au contrôle absorption 0 min. (C) décanter immédiatement les médias, pat la plaque sur un mouchoir en papier pour enlever les excès du milieu et se plonger dans un bain de tampon de2 KK glacé, remplissage des puits se laver. Décanter le tampon et bien éponger à nouveau. Ajouter 100 µL de 5 mM d’azide de sodium dissous dans KK2MC pour détacher les cellules. Prendre à couler cytomètre pour la mesure de la fluorescence intériorisée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Mettre en place une plaque 96 puits à fond plat tissu-culture (Figure 1 a). Utiliser les cellules cultivées sur des bactéries et de les transférer sur HL5 moyen (contenant 100 µg/mL de dihydrostreptomycine, 100 µg/mL ampicilline et à la kanamycine 50 µg/mL) 24h avant le dosage ; Cela permet de macropinocytose d’être augmentée de bas niveaux observés chez les cellules cultivées sur les bactéries24. Vous pouvez également diluer les cellules directement à partir de culture axénique, incubation pendant 24 h avant le dosage, pour réduire les erreurs causées par les cellules étant dilués de densités différentes.
- Les cellules de l’alimentation avant la récolte dans 25 mL de KK2 dans un tube à centrifuger 50 mL. Dissocier les cellules par Vortex et pellet à 300 g pendant 3 min. Jeter le surnageant, resuspendre le culot et laver 3 fois à 300 g pendant 3 min dans 50 mL de KK2, jeter le surnageant de chaque fois pour enlever les bactéries.
- Déterminer la densité des cellules (en utilisant un Hémacytomètre ou autre cellule système de comptage) et diluer sur HL5 contenant antibiotiques à 1 x 105 cellules/mL. Distribuer 50 μL dans chaque puits, à l’aide de trois puits pour chaque condition. Incuber à 22 ° C pendant 24 h. n’oubliez pas de mettre en place un contrôle d’absorption 0 min.
Remarque : Un autre moyen, par exemple SIH, VL6 peut être utilisé à la place.
-
Charger les cellules avec TRITC-dextran (Figure 1 b).
- Diluer le dextran à 1 mg/mL dans le support utilisé (cela peut être augmenté à 2,5 à 5 mg/mL lors de l’évaluation des cellules avec une absorption très faible). Ajouter 50 μL de chaque puits (donner une concentration finale de 0,5 mg/mL TRITC-dextran) et retourner la plaque à 22 ° C pendant 1 h, car cela permet l’accumulation importante de dextran mais l’exocytose de dextran n’a pas encore commencé.
Remarque : une pipette de répéteur permet cette étape pour se faire plus rapidement, réduire les erreurs.
- Diluer le dextran à 1 mg/mL dans le support utilisé (cela peut être augmenté à 2,5 à 5 mg/mL lors de l’évaluation des cellules avec une absorption très faible). Ajouter 50 μL de chaque puits (donner une concentration finale de 0,5 mg/mL TRITC-dextran) et retourner la plaque à 22 ° C pendant 1 h, car cela permet l’accumulation importante de dextran mais l’exocytose de dextran n’a pas encore commencé.
-
Préparer des cellules pour la cytométrie en flux (Figure 1).
- Immédiatement avant le lavage, ajouter 50 μL dextran-milieux pour les contrôles d’absorption 0 min.
- Décanter le milieu et bien éponger sur un mouchoir en papier. Laver en immergeant la plaque glacée KK2, puis décanter.
Remarque : certaines souches présentant des défauts de conformité pourraient se détacher au cours de cette étape, par exemple un coup de grâce de deux homologues de Talin (talA-/ tarek -)25. Soyez prudent lorsque vous travaillez avec des lignées de cellules qui attachent mal et aspirer les médias si nécessaire. - Ajouter 100 μL de glacé de 5 mM d’azide de sodium dissous dans KK2MC (KK2 + 2 mM MgSO4 et 100 μM CaCl2).
ATTENTION : L’azoture de Sodium est extrêmement toxique. Utilisez un masque antipoussière et des lunettes de sécurité lorsque vous travaillez avec la poudre. Toujours porter des gants et blouse de laboratoire. Éviter la chaleur et ne pas mélanger avec de l’acide.
Remarque : Cellules détachement rapidement et exocytose est empêché24. Un microscope peut être utilisé pour vérifier cela.
-
Absorption de liquide mesure par cytométrie en flux
- Si vous voulez convertir valeurs relatives aux absolu, utilisez perles à normaliser les paramètres cytomètre de flux (voir section 2). Alternativement, utiliser les cellules chargement de dextran article 2 pour s’assurer que le scatter vers l’avant et la diffusion latérale sont définies convenablement pour isoler des cellules (Figure 2 a), assurant que la machine n’est pas bloquée, (Figure 2 b) et ajuster les paramètres de mesurer la fluorescence intériorisée (Figure 2).
- Fixez le système haut débit d’échantillonnage et ajouter la plaque. Mettre en place un protocole pour mesurer la fluorescence (pour TRITC-dextran utiliser un laser jaune-vert à exciter et à mesurer dans le chenal nm 582 ou similaire) de jusqu'à 65 μL de la suspension cellulaire et l’exécuter.
-
Analyser les résultats de cytométrie en flux
- Porte sur les cellules à l’aide de forward scatter et diffusion latérale (Figure 2 a). Calculer la médiane fluorescence des cellules à l’aide de l’option de statistiques. Régler ces paramètres à l’aide d’un échantillon et s’appliquent à tous les échantillons.
Remarque : Les profils de dispersion de nuages de points/côté avant peuvent varier entre les échantillons lors de l’utilisation des différents mutants ou inhibiteurs. - Déterminer la moyenne des trois puits pour chaque condition et soustraire au contrôle d’absorption 0 min. Soit convertir en valeurs quantitatives, à l’aide de l’équation déterminée à l’article 2 ou normaliser au contrôle.
- Porte sur les cellules à l’aide de forward scatter et diffusion latérale (Figure 2 a). Calculer la médiane fluorescence des cellules à l’aide de l’option de statistiques. Régler ces paramètres à l’aide d’un échantillon et s’appliquent à tous les échantillons.
4. effectuer l’absorption fluide temps-cours
- Mettre en place des cellules qu’à l’article 3, avec trois puits pour chaque point dans le temps et la condition de déformation /.
- Ajouter milieu marqué de dextran aux différents puits séquentiellement. Un temps typique mesure l’absorption fluide à 0, 30, 60, 90, 120 et 180 min. Ajouter milieu contenant du dextran pour les puits de point de temps 180 min, suivi de 60 min plus tard en l’ajoutant aux puits pour le point de temps 120 min, etc. (Figure 3 a).
- 0 min, ajouter 50 μL de contenant du dextran moyen et immédiatement décanter et laver la plaque qu’à l’article 3.3. Analyser comme décrit dans la section 3.5.
5. les courbes de réponse dose
- Mettre en place des cellules tel que décrit à l’article 3, avec trois puits pour chaque souche et de la condition.
- Diluer le composé d’intérêt dans un milieu contenant du dextran de 1 mg/mL à double la concentration finale maximale souhaitée du composé. Préparer un deuxième tube contenant le support avec dextran avec la même proportion de véhicules que le premier. Vortex pour mélanger.
- Créer une série de dilutions du composé d’intérêt au dextran 200 μL contenant le support par échantillon (Figure 4 a). Vortex pour mélanger. Ajouter 50 μL de la moyenne à chaque échantillon bien pendant 1 h.
- Laver et analyser tel que décrit à la section 3.3 partir.
6. la phagocytose et l’absorption de la Membrane
- Pour mesurer l’absorption de la membrane, préparer les cellules tel que décrit à l’article 3. Ajouter 50 μL de milieu contenant 20 μM FM 1-43 pour une concentration finale de 10 μM. Après le chargement, laver et préparer des cellules pour cytométrie qu’à l’article 3.3. Mesurer dans le canal de 585 nm ou similaire, en utilisant un laser bleu pour exciter.
Remarque : Comme le trafic de membrane est plus rapid que la phase liquide, 10 min est un moment plus approprié à utiliser que 1 h26. Autres colorants qui réagissent en uniquement lorsque incorporé dans la membrane peuvent être utilisés à la place. -
Utiliser perles fluorescent étiquetés ou bactéries pour mesurer la phagocytose. Fluorescent levure ne peut servir, car ils sont inséparables de Dictyostelium par vers l’avant et de côté disperser24. Mettre en place des cellules tel que décrit à l’article 3 et analyser comme décrit27.
- Pour mesurer la phagocytose des perles ajouter perles tel que décrit dans la section 3.2 à une concentration finale de 5 x 107 perles/mL (1,75 et 2 μm) ou 1 x 108 perles/mL (1 à 1,5 μm) pendant 1 h avant le lavage et la préparation de la cytométrie en flux comme dans jaune-verte section 3.3. Mesurer dans le chenal nm 525 ou similaire, en utilisant un laser bleu pour exciter.
Remarque : Des concentrations plus élevées conduira au détachement de la cellule. - Pour mesurer la phagocytose des bactéries, ajouter que Texas-rouge étiqueté Escherichia coli BIOPARTICULES comme décrit dans la section 3.2 à 1 x 108 bactéries/mL pendant 1 h avant de laver et préparer l’écoulement cytometry qu’à l’article 3.3. Mesurer dans le chenal nm 610 ou similaire, en utilisant un laser jaune-vert pour exciter.
- Pour mesurer la phagocytose des perles ajouter perles tel que décrit dans la section 3.2 à une concentration finale de 5 x 107 perles/mL (1,75 et 2 μm) ou 1 x 108 perles/mL (1 à 1,5 μm) pendant 1 h avant le lavage et la préparation de la cytométrie en flux comme dans jaune-verte section 3.3. Mesurer dans le chenal nm 525 ou similaire, en utilisant un laser bleu pour exciter.
Résultats
Une fois que cette technique a été réalisée et les cellules sont chargés avec dextran et prêts pour l’analyse (Figure 1), assurer que le cytomètre de flux n’est pas bloqué et régler le profil de nuages de points XY dispersion/côté avant pour ressembler à des cellules illustrés à la Figure 2 a. Si la machine est bloquée, il se penchera plus comme celui illustré à la Figure 2 b et doit être débloqué avant de continuer. S’assurer que les paramètres montrent contrôle axéniques cellules ont fluorescence haute dextran intériorisée à points dans le temps plus longs et faible fluorescence intériorisée à courts (Figure 2).
Lorsque vous cherchez les différences entre mutants, il est probable qu’il y aura un des trois phénotypes. Les mutants pourraient avoir absorption fluide normale, ils pourraient avoir un défaut partiel ou absorption de liquide peut être complètement abolie. Figure 2D montre une souche avec l’absorption de liquide normale, dans ce cas la souche de laboratoire standard Ax2, un mutant avec ~ 50 % de diminution de l’absorption fluide (Ax2 rasG-14) et un avec aboli l’absorption fluide (Ax3 gefB-28). Obtenir le prélèvement de liquide médian moyen (section 3.5) et utilisez-le pour calculer le volume de fluide intériorisé (comme dans la Figure 3 b) ou comparer les données à un contrôle (comme dans la Figure 4 b et 4C).
Lorsque vous effectuez une évolution absorption fluide, comme dans la Figure 3 a, la fluorescence intériorisée devrait augmenter pendant 60 à 90 min, après quoi le dextran commence à être exocytosed et un plateau est atteint (Figure 3 b). Avec 60 min comme point heure normale lorsque comparant macropinocytose dans différentes mutants/conditions donc permet un bon signal à atteindre, et aucun signal n’est perdu en raison de l’exocytose. Mutants où l’exocytose est gravement entravé peuvent prendre plus de temps pour atteindre un plateau29.
Quand traiter les cellules avec des inhibiteurs efficaces contre macropinocytose chez Dictyostelium (mis en place comme dans la Figure 4 a), le dextran internalisé en 1 h ira vers le bas pour presque rien à des concentrations plus élevées d’inhibiteur dans la majorité des cas (Figure 4 b). Certains inhibiteurs peuvent ne pas être efficace à 100 %, cependant, par exemple la nocodazole inhibe seulement jusqu'à 50 % de l’absorption de liquide par macropinocytose lorsque ajouté aiguë (Figure 4). Si les inhibiteurs ne sont pas efficaces, les cellules internaliser une quantité semblable de dextran que le contrôle et une diminution de la fluorescence n’est pas visibles. Cette technique permet une large gamme de différents inhibiteurs et des concentrations de l’inhibiteur à être projeté pour les effets sur l’absorption de liquide par macropinocytose très rapidement, réduisant le temps consacré à l’optimisation du traitement de l’inhibiteur.
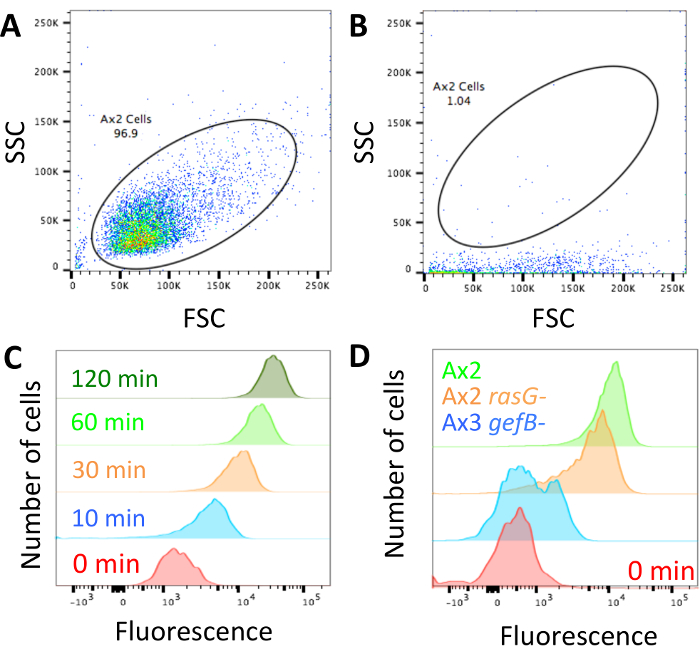
Figure 2 : mise en place des données de flux cytomètre et représentant. (A) le forward scatter (FSC) et les profils de diffusion (SSC) du côté des cellules doivent être définies afin que les cellules peuvent être aisément distinguées. Un exemple de la façon dont les cellules Ax2 devraient ressembler est montré. (B) si le cytomètre est bloqué, comme dans cet exemple, les cellules ont diffusion latérale très faible. Le laser ne va pas exciter les fluorophores correctement et la machine devrait être débloquée avant de continuer. Toutes les données obtenues pendant que la machine était bloquée devraient être jetées. (C) la fluorescence doit être définie afin qu’un échantillon d’absorption 0 min a fluorescence faible, ce qui augmente lorsque les cellules ont été incubées pendant plus longtemps dans le milieu fluorescent, comme illustré dans cet exemple tiré de Williams & Kay 201824. (D) exemples de cellules ont été incubées avec dextran TRITC pendant 1 h avec macropinocytose normal (Ax2, vert), réduit la macropinocytose (Ax2 rasG -, HM172614, orange) et abolit la macropinocytose (Ax3 gefB -, HM177628, bleu). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
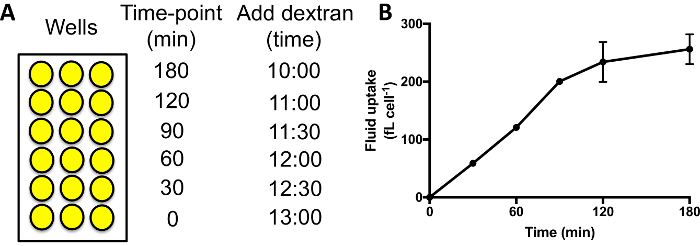
Figure 3 : exécution fluide capture temps-cours en plaques 96 puits. (A) Dextran doit être ajoutée à chaque série d’échantillons dans l’ordre, au même moment de l’arrivée. Puis laver les puits, détacher et mesurer la fluorescence intériorisée par cytométrie en flux. Fois d’exemple pour ajouter le dextran sont indiqués ici. (B) absorption fluide temporelle des cellules Ax2 réalisée en plaques 96 puits. De Williams & Kay 201824, barres d’erreur indiquent l’erreur-type de trois expériences indépendantes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : courbes de réponse dose absorption liquide. (A) ajouter le composé d’intérêt, cet inhibiteur cas du PI3K LY294002, à HL5 contenant 1 mg/mL TRITC-dextran au double la concentration maximale finale désirée. Mélanger avec le milieu de croissance HL5 + dextran de 1 mg/mL contenant le véhicule seulement dans des proportions variables pour générer une série de dilution de 200 µL de milieu par condition. Ajouter aux puits comme d’habitude pendant 1 h avant de laver et mesurer la fluorescence intériorisée. (B) courbe dose-réponse pour les cellules Ax2 absorption fluide incubées avec le milieu contenant du LY294002 de A. Adapté de Williams & Kay 201824. Absorption de liquide est normalisée à un témoin non traité. Barres d’erreur afficher l’erreur-type de trois expériences indépendantes. (C) courbe dose-réponse pour les cellules Ax2 absorption fluide incubés avec la nocodazole. Adapté de Williams & Kay 201824. Absorption de liquide est normalisée à un témoin non traité. Barres d’erreur afficher l’erreur-type de trois expériences indépendantes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Alors que les autres méthodes d’évaluation de l’absorption fluide sont débit faible, lavage de la cellules in situ et l’utilisation de l’azoture de sodium pour détacher les cellules est les étapes essentielles dans cette méthode, qui permettent de mesurer haut débit macropinocytose, absorption de membrane, ou phagocytose de Dictyostelium. Comme les cellules sont attachées à une surface et le milieu n’est pas, elles soient laissés adhérents alors que le milieu qui les entoure est tout d’abord jeté et ensuite changés par immersion dans un tampon et jetés à nouveau. Azoture de sodium, qui épuise l’ATP cellulaire et dépolarise la membrane30, est ensuite utilisé pour détacher les cellules et empêche également l’exocytose sans affecter la viabilité de cellules24.
Bien qu’utilisant l’écoulement cytometry pour mesurer la macropinocytose par Dictyostelium donne une mesure très précise de l’absorption de liquide très rapidement, à établir la raison pourquoi une condition ou un souche particulière a modifié l’absorption fluide, plus loin à l’aide de l’enquête la microscopie est nécessaire24. Il faut aussi noter que les résultats déjà publiés manifestent, dans certains cas, une différence dans l’absorption de liquide par des souches mutantes cultivées soit sur une surface (comme dans le cas présent), ou en secouant la suspension (comme dans le protocole standard)31. À l’aide de cette méthode peut signifier que, dans de rares cas, les défauts apparents absorption fluide sont manquées. En outre, lorsque vous mesurez la phagocytose, seulement de faibles concentrations de particules peuvent être utilisées. Le taux maximal de phagocytose qui peut être déterminée par cette technique est bien en deçà du maximum réel, bien qu’il soit encore possible de mesurer des différences pertinentes dans la phagocytose entre souches et conditions24. Pour déterminer le taux maximum de phagocytose, absorption doit être mesurée en secouant la suspension par un protocole alternatif27. Les cellules qui ont phagocytés perles ont augmenté de diffusion latérale, donc cela devrait être corrigé pour en conséquence lorsque vous configurez le cytomètre en flux.
Cytométrie en flux peut être utilisée pour mesurer l’absorption de liquide dans les cellules de mammifères,32, toutefois la proportion plus élevée de liquide phase absorption par d’autres voies d’endocytose que vu chez Dictyostelium est un sujet de préoccupation. En outre, les cellules sont détachent généralement à l’aide de trypsine à 37 ° C, permettant outre endocytose progression de dextran intériorisée. L’azoture de sodium glacée ne provoque pas de macrophages de se détacher de la surface (Williams, inédites d’observation), ce qui rend cette technique non applicable aux cellules mammifères sans optimisation supplémentaire.
Mesure de débit élevé de macropinocytose a le potentiel d’être utilisé pour dépister rapidement et à moindre coût les effets des inhibiteurs, mutation génétique ou de gène sur les cellules de Dictyostelium . Des mutants doivent toujours être comparées à leur parent direct seulement. Si le lecteur n’a aucune préférence préalable pour la souche de Dictyostelium , des souches non-axéniques comme DdB ou NC4 sont plus « sauvage » que les axéniques et peuvent être manipulés aussi efficacement que les souches axéniques33. Dans le cas contraire, Ax2 souches sont l’axéniques souches possédant le moins génome duplications34, tandis que de nombreuses souches de Ax4 sont débouchures de Talin A et devraient être évité si possible23. Plupart des souches publiées antérieurement peuvent être commandés auprès l' Dicty Stock Center35.
Cette technique permet de plus grandes possibilités d’investigation était auparavant impossible sur les effets de différentes conditions, des inhibiteurs et des mutations sur macropinocytose de Dictyostelium.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Nous remercions le Medical Research Council UK pour financement RRK (U105115237) de base.
matériels
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
Références
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon