Method Article
Misurazione di alto-rendimento di Dictyostelium discoideum Macropinocitosi tramite flusso Cytometry
In questo articolo
Riepilogo
Macropinocitosi, su larga scala non specifico di assorbimento fluido, sono importante in molti settori della biologia clinica tra cui immunologia, infezioni, cancro e nelle malattie neurodegenerative. Qui, le tecniche esistenti sono state adattate per consentire la risoluzione di alto-rendimento, cella singola misura di Macropinocitosi nel Macropinocitosi modello organismo Dictyostelium discoideum mediante citometria a flusso.
Abstract
Su larga scala non specifico assorbimento fluido da Macropinocitosi è importante per la proliferazione delle cellule tumorali sicure, campionamento di antigene, invasione della cellula ospite e la diffusione delle malattie neurodegenerative. I ceppi di laboratorio comunemente usati dell'ameba Dictyostelium discoideum hanno tassi estremamente alto assorbimento fluido se coltivate in terreno di coltura, oltre il 90% dei quali è dovuto Macropinocitosi. Inoltre, molti dei componenti di base conosciuta di mammiferi Macropinocitosi sono anche presenti, rendendolo un sistema eccellente modello per studiare Macropinocitosi. Qui, la tecnica standard per misurare interiorizzato fluido utilizzando destrano fluorescente come un'etichetta è adattata a un formato di piastra a 96 pozzetti, con campioni analizzati tramite citofluorimetria usando un allegato di campionamento ad alta velocità (HTS).
Le cellule sono alimentate non estinguibile destrano fluorescente per un predeterminato periodo di tempo, lavati per immersione nel buffer ghiacciata e staccata utilizzando 5 mM sodio azide, che ferma anche esocitosi. Cellule in ciascun pozzetto vengono poi analizzate tramite flusso cytometry. Il metodo può anche essere adattato per misurare l'assorbimento della membrana e la fagocitosi dei batteri o perline fluorescenti.
Questo metodo è stato progettato per consentire la misurazione dell'assorbimento fluido di Dictyostelium in modo efficiente ad alta produttività, manodopera e risorse. Permette il confronto simultaneo di più ceppi (ad es. mutanti di knockout del gene) e condizioni (ad esempio cellule nei mezzi differenti o trattate con diverse concentrazioni dell'inibitore) in parallelo e semplifica corsi di time.
Introduzione
Su larga scala non specifico assorbimento fluido da Macropinocitosi è importante in diversi contesti biologici1, tra cui il campionamento di antigene di immunitario cellule2, entrata del patogeno in host celle3, cancro delle cellule di proliferazione4 e il diffusione di malattie da prioni5. In cellule di Dictyostelium e mammiferi, actina6,7, PI (3.4.5) P38,9,10 (anche se l'esatta natura del lipido differisce tra i due11), attivato RAS12,13e attivato Rac14,15 sono importanti per l'assorbimento fluido efficiente di Macropinocitosi, anche se restano molte domande senza risposta su come è la patch macropinocytic formato, organizzato e infine interiorizzato. Alla scoperta di altre proteine importanti per Macropinocitosi e la determinazione di come essi sono importanti nei diversi contesti biologici, darà una comprensione più completa della Macropinocitosi e potenzialmente consentire lo sviluppo di trattamenti mirati per una gamma di condizioni.
Dictyostelium è un sistema modello ideale per studiare Macropinocitosi. L'alto livello di Macropinocitosi costitutiva nei ceppi di laboratorio standard significa che l'assorbimento fluido è superiore al 90% dovuto Macropinocitosi6. In questo modo Macropinocitosi essere misurata esclusivamente determinando l'assorbimento fluido, a differenza delle cellule di mammiferi dove la percentuale di assorbimento fluido dovuto Macropinocitosi è molto più bassa. Che Macropinocitosi sono così ben definito e facilmente visualizzati12 in questo sistema allo stesso modo offre vantaggi distinti per indagare conservate componenti del macropinosome core rispetto ad altri sistemi dove ci possono essere più segnali regolatori 16 , 17.
La tecnica standard utilizzata per misurare Macropinocitosi dalle cellule di mammiferi coinvolge cellule di fissaggio dopo pulsare con destrano per un breve periodo di tempo seguita da microscopia per determinare l'area di una cella che è occupata da vescicole di destrano-positivi18. Questa tecnica non tiene tuttavia conto per la possibilità di macropinosomes restringimento entrando nella cellula, che è stata segnalata in Dictyostelium19e prende in considerazione solo singoli aerei della cella, che significa il volume interiorizzato non è chiaro. Una tecnica alternativa, di contare il numero di macropinosomes interiorizzato in un dato tempo, ha la stessa nota stonata20. L'utilizzo di Dictyostelium evita questi problemi; Tuttavia, tecniche esistenti per misurare l'assorbimento fluido di Dictyostelium sono relativamente laboriosa, utilizzando una grande quantità di cellule e di destrano21. Le cellule sono scossi ad alta densità in campioni rimossi a vari intervalli di tempo per la determinazione della fluorescenza interiorizzata utilizzando un fluorimetro e destrano fluorescente. Preparati in questo modo le cellule possono essere analizzate tramite flusso cytometry per ottenere la singola cella, piuttosto che il livello di popolazione, risoluzione22, anche se questo rimane basso-velocità di trasmissione.
Qui, la tecnica standard per misurare interiorizzato fluido utilizzando destrano fluorescente come un'etichetta è adattata a un formato di piastra a 96 pozzetti, con campioni analizzati tramite citofluorimetria usando un allegato di campionamento ad alta velocità (HTS). Le cellule sono alimentate non estinguibile destrano fluorescente per un predeterminato periodo di tempo, lavati per immersione nel buffer ghiacciata e staccata utilizzando 5 mM sodio azide, che ferma anche esocitosi. Cellule in ciascun pozzetto vengono poi analizzate tramite flusso cytometry. Questo metodo è stato progettato per superare i limiti dei metodi di cui sopra e consentire un confronto simultaneo dell'assorbimento fluido di un gran numero di ceppi/condizioni, utilizzando meno risorse e riducendo il lavoro coinvolti.
Protocollo
1. preparazione delle cellule e materiali
- Coltivare le cellule sia su piastre di agar di SM in combinazione con batteri come Klebsiella aerogenes, o in mezzo nutritivo come HL5 come descritto23.
Nota: Crescita mutanti knockout che sono difettosi nella Macropinocitosi sui batteri aiuta a prevenire l'accumulo di mutazioni secondarie che possono aumentare il tasso di Macropinocitosi. Mantenere il numero di passaggio inferiore a 4 dopo il placcaggio cellule dalle scorte per ottenere risultati ottimali. Mutanti devono essere memorizzati come gli stock congelati appena possibile dopo l'isolamento. - Per coltivare le cellule su piastre di agar di SM, crescere K. aerogenes alla confluenza nel mezzo di SM. Aggiungere 200 – 300 μL di batteri su una piastra di agar di SM e diffondere. Prendere un'ansa sterile delle cellule (durante il trasferimento da un'altra piastra batterica) e la diffusione ad un orlo della piastra. Incubare a 22 ° C per fino ad una settimana.
- Sciogliere il destrano isotiocianato (TRITC-) Tetra-metil-rodamina a 50 mg/mL in acqua, filtrare utilizzando 0,22 μm filtri in aliquote di 1ml e conservare a-20 ° C. Le aliquote possono essere conservate a tempo indeterminato.
Nota: 155 kDa è la dimensione tipica utilizzata con questo metodo, come si può acquistare a buon mercato all'ingrosso, ma più piccoli destrani misurano Macropinocitosi altrettanto efficacemente in Dictyostelium24. Destrani non estinguibile differenti, come il blu cascata o Alexa-647, sono alternative se diversi fluorofori sono necessari.
2. conversione di misure Qualitative in quantitativi (opzionale)
-
Eseguire un'analisi di assorbimento fluido usando le cellule in sospensione.
- A pellet di cellule axenically crescente a 300 x g per 3 min, scartare il surnatante e risospendere in mezzo nutritivo a 1 x 107 cellule/mL. Aggiungere TRITC-destrano a 0,5 mg/mL e agitare a 180 giri/min, 22 ° C.
- Diluire 0,8 mL campioni in 0,7 mL di KK ghiacciata2 a 0, 30, 60, 90, 120 min lavare una volta in 1,5 mL di gelida KK2 buffer23 in una centrifuga da banco, risospendere a 1 mL nello stesso buffer e memorizzare sul ghiaccio.
Nota: immediatamente o una volta che tutti i campioni sono stati raccolti lavatrice produce risultati equivalenti.
-
Determinare il volume di fluido interiorizzato da parte delle cellule.
- Impostare il fluorimetro per misurare la fluorescenza usando una lunghezza d'onda di eccitazione di 544 lunghezza d'onda nm ed emissione di 574 nm con una fessura nm 10. Impostare una serie di diluizioni di TRITC-destrano e usarlo per misurare la fluorescenza per dato volumi di destrano. Creare una curva di calibrazione.
- Misurare la fluorescenza interiorizzata dalle cellule nella sezione 2.1 utilizzando 0,9 mL della sospensione delle cellule. Calcolare il volume di fluido interiorizzato per cella utilizzando la curva di calibrazione24.
- Diluire il resto delle cellule da ogni punto di tempo separatamente in 0,5 mL di ghiaccio freddo KK2. Filtrare con un colino di cella 70 µm in provetta 5 mL in polistirolo flusso cytometry. Impostare il citometro a flusso, in modo che le celle da ogni punto di tempo sono distinte gli uni dagli altri e registrare la loro fluorescenza (vedere paragrafi 3.4 e 3.5).
- Misurare la fluorescenza dei branelli di calibrazione nel citometro a flusso utilizzando le impostazioni di cui sopra e registrarlo.
Nota: Questo è il riferimento per tutte le misure di fluorescenza futuri sul citofluorimetro: prima di usare nuovamente eseguire le perline e regolare le impostazioni in modo che hanno la stessa fluorescenza. Questo vi darà un picco definito molto stretto. Mettere un cancello intorno alla vetta di fluorescenza può rendere questo più facile. - Ripetere tre volte e tracciare i dati di fluorescenza delle cellule ottenuti nelle sezioni 2.2 e 2.3 contro l'altro. Tracciare una retta di regressione e utilizzare l'equazione per convertire i dati qualitativi da flusso cytometry in unità quantitativa.
3. l'assorbimento fluido di misura
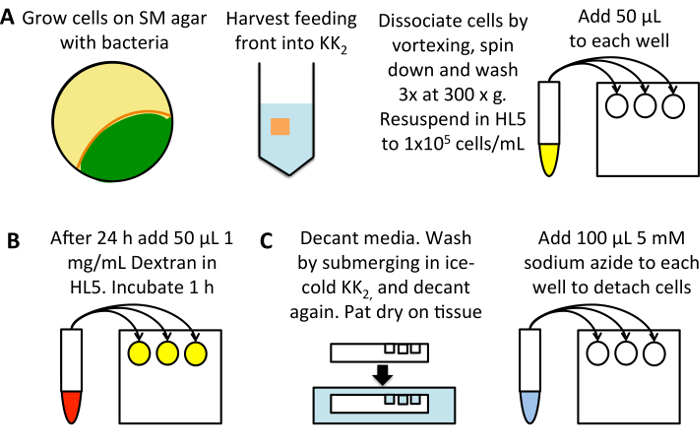
Figura 1: schematico di alto-rendimento misura della Macropinocitosi. (A) Grow Dictyostelium su una piastra di SM seminato con batteri K. aerogenes (giallo). Raccogliere le cellule dalla parte anteriore d'alimentazione (arancione), evitando le cellule che sono già state sviluppate (verde), in 25 mL di tampone2 KK. Vortice a dissociarsi, pellet mediante centrifugazione di 3 min a 300 x g, quindi lavare 3 volte in 50 mL di tampone2 KK, scartare il supernatante ogni volta. Risospendere e 1 x 105 cellule/mL in HL5 crescita medio e aggiungere 50 µ l in tre pozzi per campione di una piastra a 96 pozzetti fondo piatto. Incubare a 22 ° C per 24 h. (B) diluire TRITC-dextrano a 1 mg/mL in HL5 crescita medio da una soluzione madre di 50 mg/mL. Aggiungere 50 µ l di ciascun campione (escluse i pozzetti di controllo assorbimento 0 min) e incubare a 22 ° C per 1 h, dopo di che aggiungere il destrano al controllo assorbimento 0 min. (C) decantare immediatamente i mezzi di comunicazione, pat la piastra su un panno per rimuovere eccesso di terreno e immergerlo in un bagno di tampone di2 KK ghiacciata, riempire i pozzetti per lavare. Decantare il buffer e asciugare tamponando nuovamente. Aggiungere 100 µ l di 5mm azoturo di sodio disciolto in KK2MC per staccare le cellule. Prendere per citometro per misura della fluorescenza interiorizzata di flusso. Clicca qui per visualizzare una versione più grande di questa figura.
-
Impostare una piastra a 96 pozzetti a fondo piatto a coltura tissutale (Figura 1A). Utilizzare le cellule coltivate su batteri e di trasferirli in HL5 medie (da 100 µ g/mL di diidrostreptomicina, 100 µ g/mL ampicillina e kanamicina 50 µ g/mL) 24 h prima del dosaggio; in questo modo Macropinocitosi essere aumentata rispetto ai livelli bassi visto in cellule coltivate su batteri24. In alternativa, diluire le cellule direttamente da coltura, incubare per 24 h prima del saggio, per ridurre gli errori dovuto le cellule essendo diluite da diverse densità.
- Raccogliere le cellule dalla parte anteriore d'alimentazione in 25 mL di KK2 in una provetta da centrifuga 50 mL. Dissociare le cellule di Vortex e pellet a 300 x g per 3 min. Eliminare il supernatante e risospendere il pellet lavare 3 volte a 300 x g per 3 minuti in 50 mL di KK2, scartare il supernatante ogni volta a rimuovere i batteri.
- Determinare la densità delle cellule (utilizzando un emocitometro o altra cellula sistema di conteggio) e diluire in HL5 contenenti antibiotici a 1 x 105 cellule/mL. Pipettare 50 μL in ogni pozzetto, utilizzando tre pozzi per ogni condizione. Incubare a 22 ° C per 24 h. ricordarsi di impostare un controllo di assorbimento 0 min.
Nota: Un'alternativa medi, ad es. SIH, VL6 può essere utilizzato invece.
-
Celle di carico con TRITC-destrano (Figura 1B).
- Diluire il destrano a 1 mg/mL in mezzo utilizzato (questo può essere aumentato a 2,5-5 mg/mL nel valutare le cellule con l'assorbimento molto basso). Aggiungere 50 μL in ogni pozzetto (dando una concentrazione finale di 0,5 mg/mL TRITC-destrano) e restituire la piastra a 22 ° C per 1 h, come questo consente accumulo significativo destrano ma esocitosi di destrano non è ancora iniziata.
Nota: una pipetta a ripetizione permette questo passaggio essere fatto più velocemente, riducendo l'errore.
- Diluire il destrano a 1 mg/mL in mezzo utilizzato (questo può essere aumentato a 2,5-5 mg/mL nel valutare le cellule con l'assorbimento molto basso). Aggiungere 50 μL in ogni pozzetto (dando una concentrazione finale di 0,5 mg/mL TRITC-destrano) e restituire la piastra a 22 ° C per 1 h, come questo consente accumulo significativo destrano ma esocitosi di destrano non è ancora iniziata.
-
Preparare le celle per citometria a flusso (Figura 1).
- Immediatamente prima del lavaggio, è necessario aggiungere 50 μL contenente destrano media per i controlli di assorbimento 0 min.
- Decantare il mezzo e asciugateli su un tessuto. Lavare immergendo la piastra nella gelida KK2, poi decantare.
Nota: alcuni ceppi con difetti di adesione potrebbero staccarsi durante questo passaggio, ad esempio un knockout di entrambi gli omologhi della Talin (talA-/ sara -)25. Usare cautela quando si lavora con linee cellulari che attaccano male e aspirare media se necessario. - Aggiungere 100 μL di 5mm ghiacciata azoturo di sodio disciolto in KK2MC (KK2 + 2mm MgSO4 e 100 μM CaCl2).
Attenzione: La sodio azide è estremamente tossica. Utilizzare una maschera antipolvere e occhiali protettivi quando si lavora con la polvere. Indossare sempre guanti e camice da laboratorio. Evitare il calore e non mescolare con acido.
Nota: Le cellule rapidamente scollegare ed esocitosi è impedito24. Un microscopio può essere usato per controllare questo.
-
Assorbimento fluido di misura tramite flusso cytometry
- Se pensando di convertire valori relativi a quelli assoluto, usare le perline per standardizzare le impostazioni di cytometer di flusso (vedere sezione 2). In alternativa, utilizzare cellule caricato con destrano come sezione 2 per assicurarsi che il forward scatter e dispersione laterale sono impostate in modo appropriato per isolare le cellule (Figura 2A), assicurando che la macchina non è bloccata, (Figura 2B) e regolare i parametri al misurare la fluorescenza interiorizzata (Figura 2).
- Collegare il sistema di campionamento ad alta velocità e aggiungere piastra. Istituire un protocollo per misurare la fluorescenza (per TRITC-destrano utilizzare un laser giallo-verde per eccitare e misurare nel canale 582 nm o simili) di fino a 65 μL della sospensione cellulare ed Esegui.
-
Analizzare i risultati di citometria a flusso
- Cancello delle celle utilizzando forward scatter e dispersione laterale (Figura 2A). Calcolare la mediana fluorescenza delle cellule utilizzando l'opzione di statistiche. Impostare questi parametri utilizzando un campione e si applicano a tutti i campioni.
Nota: I profili di forward scatter/side scatter possono variare tra i campioni quando si utilizza diversi mutanti o inibitori. - Determinare la media dei tre pozzi per ogni condizione e sottrarre il controllo di assorbimento 0 min. O convertire in valori quantitativi utilizzando l'equazione determinata nella sezione 2 o normalizzare al controllo.
- Cancello delle celle utilizzando forward scatter e dispersione laterale (Figura 2A). Calcolare la mediana fluorescenza delle cellule utilizzando l'opzione di statistiche. Impostare questi parametri utilizzando un campione e si applicano a tutti i campioni.
4. di tempo di assorbimento fluido-corsi
- Impostare le celle come descritto in sezione 3, con tre pozzi per ogni punto nel tempo e sforzo/condizione.
- Aggiungere mezzo etichettati destrano pozzetti diversi in sequenza. Un tipico corso di tempo misura l'assorbimento fluido a 0, 30, 60, 90, 120 e 180 min aggiungere il dextrano contenenti terreno per i pozzi 180 min tempo punto, seguita dopo 60 min aggiungendolo ai pozzetti per il punto di tempo 120 min, ecc (Figura 3A).
- A 0 min, aggiungere 50 μL di dextrano contenenti medie e immediatamente decantare e lavare la piastra come sezione 3.3. Analizzare come descritto nella sezione 3.5.
5. dose Response Curve
- Impostare le celle come descritto nella sezione 3, con tre pozzi per ogni ceppo e condizione.
- Diluire il composto di interesse in mezzo contenente destrano 1 mg/mL a doppio la concentrazione finale di massima desiderata del composto. Preparare una seconda provetta contenente mezzo con destrano con la stessa proporzione del veicolo come il primo. Vortice di mescolare.
- Creare una serie di diluizioni del composto di maggiore interesse del dextrano 200 μL contenente mezzo per campione (Figura 4A). Vortice di mescolare. Aggiungere 50 μL del mezzo a ciascun campione bene per 1 h.
- Lavare e analizzare come descritto nella sezione 3.3 in poi.
6. fagocitosi e l'assorbimento della membrana
- Per misurare l'assorbimento della membrana, preparare le celle come descritto nella sezione 3. Aggiungere 50 μL di mezzo contenente 20 μM FM 1-43 per una concentrazione finale di 10 μM. Dopo il caricamento, lavare e preparare le celle per citometria a flusso come sezione 3.3. Misurare nel canale di 585 nm o simili, utilizzando un laser blu per eccitare.
Nota: Come traffico di membrana è più rapida di quella fase fluida, 10 min è un punto di tempo più appropriato da utilizzare oltre 1 h26. Coloranti alternativi che reagiscono solo quando incorporati nella membrana possono essere utilizzati invece. -
Utilizzare perline fluorescente etichettati o batteri per misurare fagocitosi. Fluorescente lievito non può essere utilizzato, come essi sono inseparabili da Dictyostelium da avanti e lato dispersione24. Impostare le celle come descritto nella sezione 3 e analizzare come descritto27.
- Per misurare la fagocitosi di perline aggiungere etichettati perline come descritto nella sezione 3.2 per una concentrazione finale di 5 x 107 perline/mL (1,75 e 2 μm) o 1 x 108 perline/mL (1 e 1,5 μm) per 1 h prima di lavare e preparare per citometria a flusso come in giallo-verde sezione 3.3. Misurare nel canale 525 nm o simili, utilizzando un laser blu per eccitare.
Nota: Le più alte concentrazioni porterà al distacco delle cellule. - Per misurare la fagocitosi dei batteri, aggiungere che Texas-Red etichettati Escherichia coli bioparticelle come descritto nella sezione 3.2 a 1 x 108 batteri/mL per 1 h prima di lavare e preparare per citometria a flusso come sezione 3.3. Misurare nel canale 610 nm o simili, utilizzando un laser di colore giallo-verde per eccitare.
- Per misurare la fagocitosi di perline aggiungere etichettati perline come descritto nella sezione 3.2 per una concentrazione finale di 5 x 107 perline/mL (1,75 e 2 μm) o 1 x 108 perline/mL (1 e 1,5 μm) per 1 h prima di lavare e preparare per citometria a flusso come in giallo-verde sezione 3.3. Misurare nel canale 525 nm o simili, utilizzando un laser blu per eccitare.
Risultati
Una volta che è stata eseguita la tecnica e le cellule sono caricati con destrano e pronti per l'analisi (Figura 1), verificare che il citometro a flusso non sia ostruito e regolare il profilo di dispersione di forward scatter/lato a guardare come le cellule mostrate nella Figura 2A. Se la macchina è bloccata, apparirà più come quello illustrato nella Figura 2B e deve essere sbloccato prima di continuare. Garantire i parametri Visualizza controllo axeniche cellule hanno fluorescenza alta destrano interiorizzato a intervalli di tempo più lungo e bassa fluorescenza interiorizzato a quelli più brevi (Figura 2).
Quando alla ricerca di differenze tra mutanti, è probabile che ci sarà uno dei tre fenotipi. I mutanti potrebbero avere normale assorbimento fluido, potrebbero avere un difetto parziale o l'assorbimento fluido potrebbe essere completamente abolita. Figura 2D Mostra un ceppo con il normale assorbimento fluido, in questo caso il ceppo di laboratorio standard Ax2, un mutante con un ~ 50% diminuzione nell'assorbimento del fluido (Ax2 rasG-14) e uno con abolito l'assorbimento fluido (Ax3 gefB-28). Ottenere l'assorbimento fluido mediano medio (sezione 3.5) e utilizzarlo per calcolare il volume di fluido interiorizzato (come in Figura 3B) o confrontare i dati a un controllo (come in Figura 4B e 4C).
Quando si esegue un corso di tempo di assorbimento fluido, come in Figura 3A, la fluorescenza interiorizzata dovrebbe aumentare per 60-90 min, dopo di che il destrano comincia ad essere exocytosed e un plateau è raggiunto (Figura 3B). Utilizzando 60 min come punto di tempo standard quando confrontando Macropinocitosi in diverse mutanti/condizioni di conseguenza permette un buon segnale essere raggiunto, e nessun segnale viene perso a causa di esocitosi. Mutanti dove esocitosi è gravemente ostacolato potrebbero richiedere più tempo per raggiungere un altopiano29.
Quando il trattamento delle cellule con inibitori che sono efficaci contro Macropinocitosi in Dictyostelium (impostato come in Figura 4A), il destrano interiorizzato in 1h andrà giù a quasi nulla alle più alte concentrazioni dell'inibitore nella maggioranza dei casi (Figura 4B). Alcuni inibitori potrebbero non essere efficace al 100%, tuttavia, ad esempio nocodazole inibisce solo fino al 50% dell'assorbimento fluido di Macropinocitosi quando aggiunto acutamente (Figura 4). Se gli inibitori non sono efficaci, le cellule saranno interiorizzare una quantità simile di destrano come il controllo, e non si vedrà una diminuzione in fluorescenza. Questa tecnica permette una vasta gamma di diversi inibitori e le concentrazioni dell'inibitore da sottoporre a screening per gli effetti sull'assorbimento fluido di Macropinocitosi molto rapidamente, riducendo i tempi di ottimizzare il trattamento inibitore.
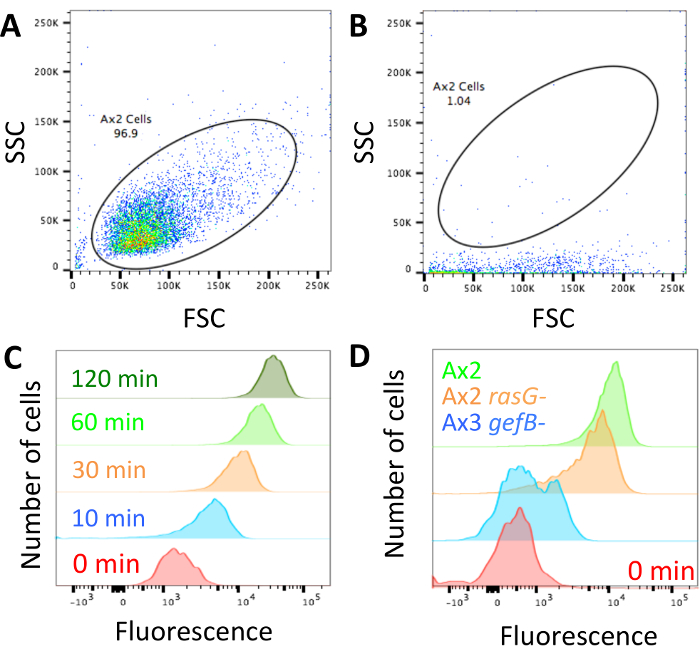
Figura 2: Set up dei dati del flusso cytometer e rappresentante. (A) il forward scatter (FSC) e profili di dispersione (SSC) laterali delle cellule devono essere impostati in modo le cellule possono essere facilmente distinti. È riportato un esempio di come dovrebbero apparire le cellule Ax2. (B) se il citometro a flusso è bloccato, come in questo esempio, le cellule hanno a dispersione molto low-side. Il laser non entusiasmeranno i fluorophores correttamente e la macchina deve essere sbloccata prima di continuare. Devono essere eliminati qualsiasi dati ottenuti mentre la macchina è stata bloccata. (C) la fluorescenza deve essere impostata affinché un campione di assorbimento 0 min ha bassa fluorescenza, che aumenta quando le cellule sono state incubate per più tempo nel mezzo di fluorescente, come mostrato in questo esempio tratto da Williams & Kay 201824. (D) esempi di cellule che sono state incubate con destrano TRITC per 1 h con normale Macropinocitosi (Ax2, verde), ridotto Macropinocitosi (Ax2 rasG -, HM172614, arancione) e abolito Macropinocitosi (Ax3 gefB -, HM177628, blu). Clicca qui per visualizzare una versione più grande di questa figura.
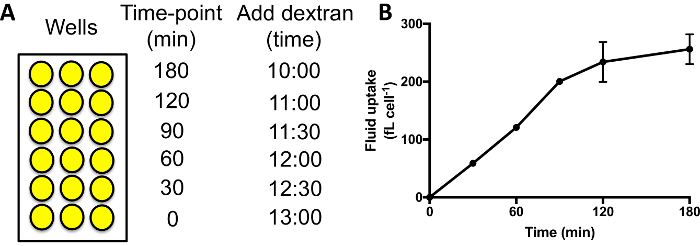
Figura 3: esecuzione di corsi di assorbimento fluido time in piastre da 96 pozzetti. (A) destrano deve essere aggiunto a ogni set di campioni in sequenza, con lo stesso tempo di finitura. Quindi lavare i pozzetti, staccare e misurare la fluorescenza interiorizzata da citometria a flusso. Orari di esempio per aggiungere il destrano sono indicati qui. (B) l'assorbimento fluido tempo-corso di cellule Ax2 eseguita in piastre da 96 pozzetti. Scattata da Williams & Kay 201824, barre di errore indicano l'errore standard di tre esperimenti indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: curve di assorbimento fluido dose risposta. (A) aggiungere il composto di interesse, in questo caso la PI3K inibitore LY294002, HL5 contenente 1 mg/mL TRITC-destrano al doppio la concentrazione massima finale desiderata. Mescolare con HL5 crescita medium + destrano 1mg/mL contenente solo in varie proporzioni per generare una serie di diluizioni di 200 mezzo µ l a condizione di veicolo. Aggiungere ai pozzetti come normale per 1 h prima di lavaggio e misurare fluorescenza interiorizzato. (B) curva dose-risposta l'assorbimento fluido per Ax2 cellule incubate con il mezzo contenente LY294002 dalla A. Adattato da Williams & Kay 201824. L'assorbimento fluido è normalizzato per un controllo non trattato. Barre di errore indicano l'errore standard di tre esperimenti indipendenti. (C) curva dose-risposta l'assorbimento fluido per Ax2 cellule incubate con il nocodazole. Adattato da Williams & Kay 201824. L'assorbimento fluido è normalizzato per un controllo non trattato. Barre di errore indicano l'errore standard di tre esperimenti indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Considerando che altri metodi per valutare l'assorbimento fluido sono basso throughput, lavare le cellule in situ e l'uso di sodio azide per staccare le cellule sono i punti critici in questo metodo, che consentono la misurazione ad alta produttività di Macropinocitosi, l'assorbimento della membrana, o fagocitosi di Dictyostelium. Come le cellule sono attaccate ad una superficie e il mezzo non è, possono essere lasciati aderenti mentre il mezzo intorno a loro in primo luogo è stato gettato fuori e poi cambiati per immersione nel buffer e gettati fuori nuovamente. Sodio azide, che impoverisce ATP cellulare e depolarizza la membrana30, viene quindi utilizzato per staccare le cellule e previene anche esocitosi senza influire sulle cellule vitalità24.
Mentre mediante citometria a flusso per misurare Macropinocitosi di Dictyostelium dà una misura molto accurata dell'assorbimento fluido molto rapidamente, per stabilire il motivo perché un particolare ceppo o condizione ha alterato l'assorbimento fluido, ulteriore indagine utilizzando la microscopia è necessari24. Inoltre precisiamo che i risultati precedentemente pubblicati hanno, in alcuni casi, mostrato una differenza nell'assorbimento del fluido di ceppi mutanti coltivato sia su una superficie (come in questo caso), o in agitazione sospensione (come il protocollo standard)31. Utilizzando questo metodo può significare che, in rari casi, l'assorbimento fluido apparenti difetti sono mancanti. Inoltre, quando si misura la fagocitosi, possono essere utilizzate solo basse concentrazioni di particelle. Il tasso massimo di fagocitosi che può essere determinato con questa tecnica è molto inferiore a quella massima reale, anche se è ancora possibile misurare differenze rilevanti nella fagocitosi tra ceppi e condizioni24. Per determinare il tasso massimo di fagocitosi, l'assorbimento deve essere misurata in agitazione la sospensione di un protocollo alternativo27. Le cellule che hanno phagocytosed perline hanno aumentato la dispersione laterale, quindi questo dovrebbe essere corretto per conseguenza quando si imposta il citometro a flusso.
Citometria a flusso può essere utilizzato per misurare l'assorbimento fluido in cellule di mammifero32, tuttavia la percentuale più alta di liquido fase l'assorbimento di altre vie di endocitosi quanto visto in Dictyostelium è una preoccupazione. Inoltre, le cellule in genere sono staccate usando tripsina a 37 ° C, permettendo ulteriori endocitico progressione di destrano interiorizzato. Ghiacciata sodio azide non causa i macrofagi staccare da una superficie (Williams, inedito osservazione), rendendo questa tecnica non applicabile per cellule di mammifero senza ulteriore ottimizzazione.
Alta velocità effettiva misura di Macropinocitosi ha il potenziale per essere utilizzato per lo screening rapido ed economico per gli effetti degli inibitori, mutazione genetica o atterramento di gene in cellule di Dictyostelium . Mutanti devono sempre essere confrontati con loro padre diretto solo. Se il lettore non ha alcuna preferenza preventiva per ceppo di Dictyostelium , non axeniche ceppi come DdB o NC4 sono più "wild-type" rispetto a quelli axeniche e possono essere manipolati efficacemente come ceppi axeniche33. In caso contrario, sono l'axeniche Ax2 ceppi ceppi con il minor numero genoma duplicazioni34, mentre molti ceppi di Ax4 sono KO A Talin e dovrebbero essere evitato se possibile23. Più sforzi precedentemente pubblicati possono essere ordinati dal Dicty Stock Center35.
Questa tecnica permette maggiori possibilità d'indagine di quanto fosse possibile in precedenza sugli effetti delle diverse condizioni, inibitori e mutazioni su Macropinocitosi di Dictyostelium.
Divulgazioni
Gli autori non hanno conflitti di interesse a divulgare.
Riconoscimenti
Ringraziamo il Medical Research Council UK per core (U105115237) di finanziamento per RRK.
Materiali
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
Riferimenti
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon