Method Article
Flow Cytometry 여 Dictyostelium discoideum Macropinocytosis의 높은 처리량 측정
요약
Macropinocytosis, 대규모 일반적인 유체 이해, 임상 생물학 면역학, 감염, 암, 및 신경 퇴행 성 질환 등의 많은 분야에서 중요 하다. 여기, 기존 기술을 높은 처리량, 단일 셀 해상도 macropinocytosis 모델 유기 체 Dictyostelium discoideum 를 사용 하 여 macropinocytosis의 측정 cytometry 흐름 수 있도록 적응 되었습니다.
초록
Macropinocytosis에 의해 대규모 일반적인 유체 통풍 관은 특정 암 세포, 항 샘플링, 호스트 세포 내 습 및 신경 퇴행 성 질환의 확산의 확산에 대 한 중요 하다. Dictyostelium discoideum 아메바의 일반적으로 사용 되는 실험실 긴장 매우 높은 유체 흡수 속도 영양소 매체, 90% 이상의 이다 macropinocytosis 때문에 성장 하는 때 있다. 또한, 많은 포유류 macropinocytosis의 알려진된 핵심 구성 요소 macropinocytosis를 공부 하는 우수한 모델 시스템을 만드는 존재도 있습니다. 여기, 형광 dextran 레이블로 사용 하 여 내 면된 유체 측정 표준 기술을 96 잘 접시 형식에 적응 cytometry 높은 처리량 샘플링 (HTS) 첨부 파일을 사용 하 여 분석 하는 샘플입니다.
셀 시간, 얼음 처럼 차가운 버퍼에 침수에 의해 세척 하 고 5mm 나트륨 아 지 드, exocytosis 중지를 사용 하 여 분리의 미리 정해진 길이 아닌 quenchable 형광 dextran은 먹인 다. 각 잘에서 셀 다음 cytometry에 의해 분석 된다. 메서드 또한 막 통풍 관 및 형광 구슬 또는 박테리아의 먹어서 측정 적용할 수 있습니다.
이 메서드는 높은 처리량, 노동 및 리소스 효율적인 방식으로 Dictyostelium 에 의해 유체 통풍 관의 측정을 허용 하도록 설계 되었습니다. 그것은 여러 변종 (예: 녹아웃 유전자의 돌연변이)의 동시 비교를 허용 한다 (예: 다른 미디어에서 세포 또는 억제제의 다른 농도로 처리) 병렬에서 시간 과정을 단순화.
서문
2세포 면역에 의해 항 원 샘플링을 포함 하 여, 병원 체 항목 호스트 셀3, 암 세포 확산4 macropinocytosis에 의해 대규모 일반적인 유체 통풍 관은 여러 생물 학적 상황1, 중요 한과 프리온 질병5의 확산. 포유류 및 Dictyostelium 세포, 말라6,7, 파이 (3,4,5) P38,,910 (비록는 지질의 정확한 본질은 두11다릅니다) 활성화 Ras12,13, 그리고 활성화 된 Rac14,15 macropinocytosis에 의해 효율적인 유동성 통풍 관에 대 한 중요 하다 macropinocytic 패치는 어떻게 하는 것에 대 한 많은 의문점이 남아 있지만 형성, 조직 되 고 결국 내 면. Macropinocytosis의 보다 포괄적인 이해를의 개발을 허용 하도록 더 많은 단백질 macropinocytosis, 그리고 어떻게 그들은 다양 한 생물학 문맥에서 중요 하다의 후속 결정에 대 한 중요 한 발견 다양 한 조건에 대 한 치료 대상.
Dictyostelium macropinocytosis을 공부에 대 한 이상적인 모델 시스템입니다. 표준 실험실 긴장에 제정 macropinocytosis의 높은 수준을 의미 그 유체 통풍 관 이상 90% macropinocytosis6인. Macropinocytosis를 전적으로 macropinocytosis 때문에 유체 통풍 관의 비율은 훨씬 낮은 포유류 세포와는 달리 액체 통풍 관을 결정 하 여 측정 될 수 있습니다. Macropinocytosis는 너무 잘 정의 하 고이 시스템에 쉽게 시각된12 마찬가지로 조사에 대 한 뚜렷한 장점을 핵심 보존된 구성 요소는 macropinosome의 다른 시스템에 제공 여러 규제 신호 될 수 있습니다 16 , 17.
포유류 세포에 의해 macropinocytosis를 측정 하는 데 사용 표준 기법 dextran 긍정적인 소포18차지 하는 셀의 영역을 결정 하는 현미경 뒤 짧은 기간 동안 dextran와 펄스 후 세포를 고정 한다. 그러나이 기술은 macropinosomes Dictyostelium19에 보고 되었습니다 하 고 내 면 볼륨을 의미 하는 셀의 단일 평면 고려만 셀을 입력 시 축소의 가능성에 대 한 고려 하지 않습니다. 명확 하지 않습니다. Macropinosomes는 주어진된 시간에, 내 면의 수를 계산의 대체 기술,20같은 단점이 있다. Dictyostelium 를 사용 하 여 이러한 문제를 피할 수 그러나, Dictyostelium 에 의해 유체 통풍 관 측정에 대 한 기존 기술을 상대적으로 노동 집약, 대형을 사용 하 여 셀 및 dextran21양의 있습니다. 셀은 형광 dextran 및 예제는 fluorimeter를 사용 하 여 내 면된 형광의 결정에 대 한 다양 한 시간 지점에서 제거에 높은 밀도에서 동요. 이 낮은 처리량 남아 있지만 cytometry 얻을 인구 수준, 해상도22, 보다는 오히려 단일 셀에 의해 셀이 방법이으로 준비를 분석할 수 있습니다.
여기, 형광 dextran 레이블로 사용 하 여 내 면된 유체 측정 표준 기술을 96 잘 접시 형식에 적응 cytometry 높은 처리량 샘플링 (HTS) 첨부 파일을 사용 하 여 분석 하는 샘플입니다. 셀 시간, 얼음 처럼 차가운 버퍼에 침수에 의해 세척 하 고 5mm 나트륨 아 지 드, exocytosis 중지를 사용 하 여 분리의 미리 정해진 길이 아닌 quenchable 형광 dextran은 먹인 다. 각 잘에서 셀 다음 cytometry에 의해 분석 된다. 이 방법은 위의 방법의 한계를 극복 하 고 적은 리소스를 사용 하 여 관련된 노동 감소 하는 동안 긴장/조건 다 수의 유체 통풍 관의 동시 비교를 허용 하도록 설계 되었습니다.
프로토콜
1입니다. 세포와 자료의 준비
- 설명된23으로 셀 Klebsiella aerogenes, 같은 박테리아와 함께에서 또는 HL5 같은 영양소 매체에 SM 한 천 배지에서 배양.
참고: 성장 하는 박테리아에 macropinocytosis에 결함이 녹아웃 돌연변이 macropinocytosis의 속도 증가 시킬 수 있습니다 이차 돌연변이의 축적을 방지 하기 도움이 됩니다. 최적의 결과 대 한 주식에서 셀 도금 후 4 아래 통로 번호를 유지. 돌연변이 격리 후 즉시 냉동된 주식으로 저장 되어야 합니다. - SM 한 천 배지에서 세포 배양을 SM 매체에 합류 K. aerogenes 성장. SM 한 천 격판덮개에 박테리아의 200-300 μ를 추가 하 고 확산. (다른 세균성 접시에서 전송) 하는 경우 셀의 메 마른 루프를가지고 고 접시의 한 가장자리에 확산. 주일에 22 ° C에서 품 어.
- 50 mg/ml 물에 Tetra-메 틸-rhodamine isothiocyanate (TRITC-) dextran을 분해, 1 mL aliquots로 0.22 μ m 필터를 사용 하 여 필터링 및-20 ° c.에 저장 Aliquots는 무기한으로 보관 될 수 있습니다.
참고: 155 kDa, 대량에서 싸게 구입할 수 있습니다 하지만 작은 dextrans 측정 macropinocytosis Dictyostelium24에 효과적으로이 방법으로 사용 되는 일반적인 크기입니다. 캐스케이드 또는 알 렉 사-647, 같은 다른 비-quenchable dextrans 다른 fluorophores 필요한 경우 대안이 있습니다.
2. (선택 사항)으로 양적 질적 측정 변환
-
현 탁 액 셀을 사용 하 여 액체 이해 분석 결과 수행 합니다.
- 300 x g 3 분에 axenically 성장 세포를 작은, 삭제는 상쾌한 고 1 x 107 셀/mL 영양소 중에 resuspend. TRITC-dextran 0.5 mg/mL을 추가 하 고 180 rpm, 22 ° c.에 흔들
- 희석 0.8 mL 샘플 얼음 주식2 0, 30, 60, 90, 120 분 세척에서 0.7 mL로 한 번 얼음 주식2 버퍼23 벤치탑 원심 분리기에서 1.5 ml, 같은 버퍼에 1 ml resuspend 및 얼음에 저장.
참고: 동일한 결과 생성 즉시 또는 모든 샘플 수집 된 일단 세척.
-
액체는 세포에 의해 내 면의 볼륨을 결정 합니다.
- 574의 544 및 방출 파장의 여기 파장을 사용 하 여 형광을 측정 하기 위해 fluorimeter을 설정 10 nm 슬릿 nm. TRITC-dextran의 희석 일련을 설정 하 고 위해 주어진 형광을 측정 하는 데 사용할 dextran의 볼륨. 보정 곡선을 만듭니다.
- 섹션 2.1 세포 현 탁 액의 0.9 mL를 사용 하 여 셀에 의해 내 면 형광을 측정 합니다. 보정 곡선24를 사용 하 여 셀 당 내 액체의 볼륨을 계산 합니다.
- 0.5 mL 얼음 차가운 주식2에 별도로 각 시간 지점에서 세포의 나머지를 희석. 5 mL 폴리스 티 렌 흐름 cytometry 튜브 70 µ m 셀 스 트레이너를 통해 필터링. 각 시간 지점에서 세포는 서로 다릅니다 그리고 그들의 형광을 기록 교류 cytometer 설정 (섹션 3.4와 3.5 참조).
- 위의 설정을 사용 하 여 교류 cytometer에서 교정 구슬의 형광을 측정 하 고 그것을 기록 합니다.
참고: 이것은 교류 cytometer에 모든 미래 형광 측정에 대 한 참조: 다시 사용 하기 전에 구슬을 실행 하 고 그래서 그들은 같은 형광 설정을 조정. 이 매우 좁은 정의 된 피크를 줄 것 이다. 주위에 형광 피크 게이트 퍼 팅 수 있습니다 쉽게이. - 세 번을 반복 하 고 2.2 및 2.3 서로 대 한 섹션에서 얻은 세포 형광 데이터. 적합 선 플롯 하 고 방정식을 사용 하 여 양적 단위로 cytometry에서 질적 데이터를 변환.
3. 측정 유체 통풍 관
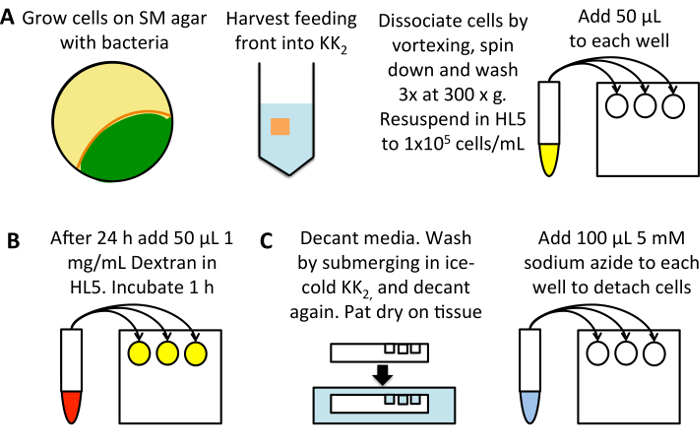
그림 1: macropinocytosis의 높은 처리량 측정의 도식. (A) SM 접시에 성장 Dictyostelium K. aerogenes 박테리아 (노란색)와 시드. 주식2 버퍼의 25 mL로 세포 먹이 앞 (오렌지), 이미 개발 된 셀 피 (녹색), 수확. 소용돌이, 해리를 300 x g에 3 분 원심 분리 하 여 펠 렛 다음 주식2 버퍼, 삭제는 상쾌한 때마다 50 mL에 3 번 세척. 1 x 105 셀/ml HL5 성장 매체에 resuspend 하 고 편평한 바닥 96 잘 접시의 샘플 당 3 개의 우물으로 50 µ L를 추가 합니다. (B) 희석 TRITC-dextran HL5 성장 매체에 1 mg/ml에서 50 mg/mL의 재고 솔루션 24 h. 22 ° C에서 품 어. (0 분 이해 컨트롤 웰 스 제외), 각 샘플에 50 µ L을 추가 하 고는 dextran 0 분 이해 컨트롤에 추가 하는 후 h 1에 대 한 22 ° C에서 품 어. (C)는 언론에 즉시 가만히 따르다, 초과 매체를 제거 하 고 씻어 웰 스 작성 얼음 주식2 버퍼의 목욕에 잠수함을 조직에 접시를 두 드려. 버퍼를 가만히 따르다 하 고 다시 건조 두 드려. 5mm 나트륨 아 지 드 주식2엠씨 셀을 분리 해체의 100 µ L를 추가 합니다. 내 면된 형광 측정 cytometer 흐름을. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
-
플랫 96-잘 조직 문화 접시 (그림 1A)를 설정 합니다. 분석 결과; 전에 24 h HL5 매체 (포함 100 µ g/mL의 dihydrostreptomycin, 100 µ g/mL 암 피 실린 및 50 µ g/mL 대)에 그들을 전송 하 고 박테리아에 성장 하는 세포를 사용 하 여 macropinocytosis를 박테리아24에 성장 하는 세포에서 낮은 레벨에서 upregulated 될 수 있습니다. 또는, 다른 밀도에서 희석되 셀 오류를 줄이기 위해 분석 결과 전에 24 h에 대 한 잠복기 axenic 문화에서 직접 셀을 희석.
- 25 mL 50 mL 원심 분리기 튜브에서 주식2 에 먹이 앞에서 베스트 셀. Vortexing와 3 분. 에 대 한 300 x g 에서 펠 릿 세포 분열 삭제는 상쾌한, resuspend 펠 릿 그리고 300 x g 주식2, 박테리아를 제거 하는 상쾌한 때마다 삭제의 50 mL에서 3 분에 3 번 세척.
- (는 hemacytometer 또는 다른 셀 카운트 시스템을 사용 하 여) 셀 밀도 결정 하 고 HL5 포함 항생제 1 x 105 셀/ml로 희석. 각 조건에 대 한 3 개의 우물을 사용 하 여 각 음에 50 μ를 플라스틱. 22 ° C 24 h. 0 분 이해 제어를 설정 하는 기억에서 품 어.
참고:는 대체 매체, 예를 들면 SIH, VL6 대신 사용할 수 있습니다.
-
TRITC-dextran (그림 1B)에 포함 된 셀을 로드 합니다.
- Dextran 사용 매체에 1 mg/mL를 희석 (이 증가 될 수 있다 2.5-5 m g/mL를 매우 낮은 통풍 관에 포함 된 셀을 평가할 때). 각 잘 (주는 TRITC-dextran 0.5 mg/mL의 최종 농도)을 50 μ를 추가 하 고 이로써 상당한 dextran 축적 하지만 dextran exocytosis 아직 시작 하지는 22 ° C 1 시간에 접시를 반환.
참고: 리피터 피 펫이이 단계 더 빠르게 할 수 오류를 줄일 수 있습니다.
- Dextran 사용 매체에 1 mg/mL를 희석 (이 증가 될 수 있다 2.5-5 m g/mL를 매우 낮은 통풍 관에 포함 된 셀을 평가할 때). 각 잘 (주는 TRITC-dextran 0.5 mg/mL의 최종 농도)을 50 μ를 추가 하 고 이로써 상당한 dextran 축적 하지만 dextran exocytosis 아직 시작 하지는 22 ° C 1 시간에 접시를 반환.
-
Cytometry (그림 1C)에 대 한 셀을 준비 합니다.
- 세척, 직전 0 분 이해 컨트롤에 50 μ dextran 포함 된 미디어를 추가 합니다.
- 매체를 가만히 따르다와 조직에 건조 두 드려. 얼음 주식2, 플레이트를 잠수 하 여 세척 한 다음 가만히 따르다.
참고: 준수 결함을 가진 일부 변종 예: 중부의 두 homologs의 녹아웃이이 단계 동안 분리 될 수 있습니다 (탈 라-/ talB-)25. 작업 셀 라인을 제대로 연결 하 고 필요한 경우 미디어를 발음을 할 때 주의 사용 합니다. - 얼음 처럼 차가운 5mm 나트륨 아 지 드 주식2MC (주식2 + 2mm MgSO4 및 100 μ M CaCl2)에 용 해의 100 μ를 추가 합니다.
주의: 나트륨 아 지 드는 매우 독성이 있습니다. 먼지가 면 및 안전 유리를 사용 하 여 분말을 작업할 때. 항상 착용 장갑 및 연구실 코트. 열을 방지 하 고 산으로 혼합 하지 마십시오.
참고: 셀 빠르게 분리 하 고 exocytosis 방해24입니다. 이것을 확인 하는 현미경을 사용할 수 있습니다.
-
Cytometry에 의해 측정 유체 통풍 관
- 값을 변환 상대적 절대 것 계획, 비즈를 사용 하 여 표준화 흐름 cytometer 설정 (섹션 2 참조). 사용 하 여 셀 (그림 2B) 섹션 2 앞으로 분산형 및 측면 분산형 설정 적절 하 게 셀 (그림 2A), 기계, 차단 되지 않습니다 보장을 dextran 함께 로드 하 고 매개 변수를 조정 하는 또는, (그림 2C) 내 면된 형광을 측정 합니다.
- 높은 처리량 샘플링 시스템을 연결 하 고 플레이트를 추가 합니다. (TRITC-dextran 노란색-녹색 레이저를 사용 하 여 자극 582 nm 채널 또는 유사한 측정을)에 대 한 형광을 측정 하는 프로토콜 설정 세포 현 탁 액 및 실행의 최대 65 μ의.
-
교류 cytometry 결과 분석
- 앞으로 분산형 및 사이드 분산형 (그림 2A)를 사용 하 여 셀에 게이트. 통계 옵션을 사용 하 여 셀의 메디아 형광을 계산 합니다. 하나의 샘플을 사용 하 여 이러한 매개 변수를 설정 하 고 모든 샘플에 적용.
참고: 앞으로 분산형/사이드 분산형 프로필 다른 돌연변이 또는 억제제를 사용 하 여 샘플 사이의 달라질 수 있습니다. - 각 조건에 대 한 3 개의 우물의 의미를 확인 하 고 빼기 0 분 이해 합니다. 중 2 절에서 결정 하는 수식을 사용 하 여 정량 값으로 변환 또는 컨트롤에 정상화.
- 앞으로 분산형 및 사이드 분산형 (그림 2A)를 사용 하 여 셀에 게이트. 통계 옵션을 사용 하 여 셀의 메디아 형광을 계산 합니다. 하나의 샘플을 사용 하 여 이러한 매개 변수를 설정 하 고 모든 샘플에 적용.
4. 유체 이해 시간-과정 수행
- 섹션 3, 각 시간 점 및 스트레인/조건에 대 한 3 개의 우물에서 세포를 설정 합니다.
- 다른 우물에 dextran 이라는 매체를 순차적으로 추가 합니다. 전형적인 시간 과정 측정 유체 이해 0, 30, 60, 90, 120 및 180 분 180 분 시간 포인트 우물, 120 분 시간 지점에 대 한 우물에 그것을 추가 하 여 다음 60 분에 나중에 대 한 매체 dextran 포함 된 추가 등 (그림 3A).
- 0 분 50 μ dextran 포함의 추가 매체 즉시 가만히 따르다와 섹션 3.3에서 접시를 씻어. 3.5 섹션에 설명 된 대로 분석 합니다.
5. 복용량 응답 곡선
- 섹션 3, 각 스트레인 및 조건에 대 한 3 개의 우물에에서 설명 된 대로 세포를 설정 합니다.
- 포함 하는 화합물의 두 번 원하는 최대 최종 농도 에서 1 mg/mL dextran 매체로 관심의 화합물을 희석. 처음으로 자동차의 동일한 비율으로 dextran와 매체를 포함 하는 두 번째 튜브를 준비 합니다. 소용돌이를 섞어입니다.
- 샘플 (그림 4A) 당 매체를 포함 하는 200 μ dextran의 화합물의 희석 시리즈를 만듭니다. 소용돌이를 섞어입니다. 매체의 50 μ 1 h 위해 각 샘플에 추가 합니다.
- 세척 및 분석 섹션 3.3 이후에 설명 된 대로.
6. 식 균 작용 및 막 이해
- 막 이해 측정, 섹션 3에에서 설명 된 대로 셀을 준비 합니다. 10 μ M의 최종 농도 20 μ M FM 1-43를 포함 하는 매체의 50 μ를 추가 합니다. 후, 세척 하 고 섹션 3.3에서 cytometry에 대 한 셀을 준비 합니다. 585 nm 채널 또는 유사한, 흥분 시키기 위해 블루 레이저를 사용 하 여 측정 합니다.
참고: 막 매매 하는 것은 액체 단계 보다 더 빠른, 10 분 1 h26보다 사용 하기 더 적절 한 시간 포인트입니다. 형광 막에 통합 하는 경우에 대체 염료 대신 사용할 수 있습니다. -
붙일 이라는 구슬 또는 박테리아를 사용 하 여 측정 하는 식 균 작용. 그들은 앞으로 하 여 Dictyostelium 에서 사이드24분산형 형광 효 모를 사용할 수 없습니다. 섹션 3에서에서 설명한 대로 셀을 설정 하 고 설명된27분석.
- 측정을 먹어서 구슬의 노란-녹색 구슬 세척 하 고 같이 cytometry 준비 하기 전에 1 h 5 x 107 구슬/mL (1.75, 2 μ m) 또는 1 x 108 구슬/mL (1, 1.5 μ m)의 최종 농도에 섹션 3.2에에서 설명 된 대로 표시 추가 3.3 섹션입니다. 525 nm 채널 또는 유사한, 흥분 시키기 위해 블루 레이저를 사용 하 여 측정 합니다.
참고: 높은 농도 세포 분리 이어질 것입니다. - 박테리아의 식 균 작용을 측정, 텍사스-레드 분류 대장균 bioparticles 세척 하 고 섹션 3.3에서 cytometry 준비 하기 전에 섹션 3.2 ~ 1 x 108 박테리아/mL 1 h에에서 설명 된 대로 추가 합니다. 610 nm 채널 또는 유사한, 자극 하는 노란색-녹색 레이저를 사용 하 여 측정 합니다.
- 측정을 먹어서 구슬의 노란-녹색 구슬 세척 하 고 같이 cytometry 준비 하기 전에 1 h 5 x 107 구슬/mL (1.75, 2 μ m) 또는 1 x 108 구슬/mL (1, 1.5 μ m)의 최종 농도에 섹션 3.2에에서 설명 된 대로 표시 추가 3.3 섹션입니다. 525 nm 채널 또는 유사한, 흥분 시키기 위해 블루 레이저를 사용 하 여 측정 합니다.
결과
일단 기술 수행을 셀 dextran 로드 되며 분석 (그림 1)에 대 한 준비 흐름 cytometer는 차단 되지 않습니다 확인 하 고 그림 2A에 표시 된 셀 처럼 앞으로 분산형/사이드 분산형 프로 파일을 조정. 컴퓨터 차단 되 면 그림 2B에 표시 하는 것을 볼 것 이다 하 고 계속 하기 전에 차단 해야. 매개 변수 표시 제어 axenic 세포는 긴 시간 지점에서 높은 내 면된 dextran 형광 및 짧은 것 들에서 낮은 내 면된 형광을 확인 (그림 2C).
돌연변이 차이점을 찾고, 그것은 가능성이 있을 것 세 가지 고기 중 하나입니다. 돌연변이 정상적인 유체 이해를 할 수 있습니다., 그들은 부분적인 결함을 가질 수 있습니다. 또는 유체 통풍 관을 완전히 폐지 될 수 있습니다. 표준 실험실 긴장 Ax2, 돌연변이 50% 감소 유체 글귀 (Ax2 rasG-14)이 경우 그림 2D 표시 정상적인 유체 글귀와 스트레인 고 하나 폐지 유체 글귀 (Ax3 gefB-28). 평균 평균 유체 통풍 관 (섹션 3.5)를 가져오고 ( 그림 3B)와 같이 내 면 액체의 볼륨을 계산 하거나 컨트롤에 데이터를 비교 하 여 그것을 사용 하 여 ( 그림 4B 에서 것과 같이 그리고 4 C).
그림 3A와 같이 유체 이해 시간 과정을 수행할 때 내 면된 형광 60-90 분, 후는 dextran exocytosed 될 시작 증가 한다 고 고원 (그림 3B)에 도달 하면. 표준 시간 포인트 60 분 사용 하는 좋은 신호를 얻을 수 있습니다 따라서 다른 돌연변이/조건에서 macropinocytosis를 비교 하 고 신호가 손실 exocytosis. 뮤턴트 exocytosis 방해 심각 고원29를 도달 하는 데 시간이 오래 걸릴 수 있습니다.
대부분의 경우에 높은 억제 물 농도에 거의 아무것도에 아래로 갈 것 이다 때 치료 세포 Dictyostelium ( 그림 4A에서최대 설정)에서 macropinocytosis에 대 한 효과적인 억제제로 1 시간에 내 면 dextran (그림 4B)입니다. 그러나 일부 억제제 100% 효과가 되지 않을 수 있습니다,, 예를 들면 nocodazole만 심하게 추가 될 때 macropinocytosis에 의해 유체 통풍 관의 50%까지를 억제 (그림 4C). 억제제는 효과가 있다면, 셀 컨트롤로, dextran의 비슷한 금액을 internalize 것입니다 그리고 형광 감소 표시 되지 않습니다. 이 기술은 억제제 치료를 최적화 소요 된 시간을 줄이고 다른 억제제와 억제 물 농도 매우 신속 하 게, macropinocytosis에 의해 유체 통풍 관에 영향에 대 한 상영 될의 큰 범위 수 있습니다.
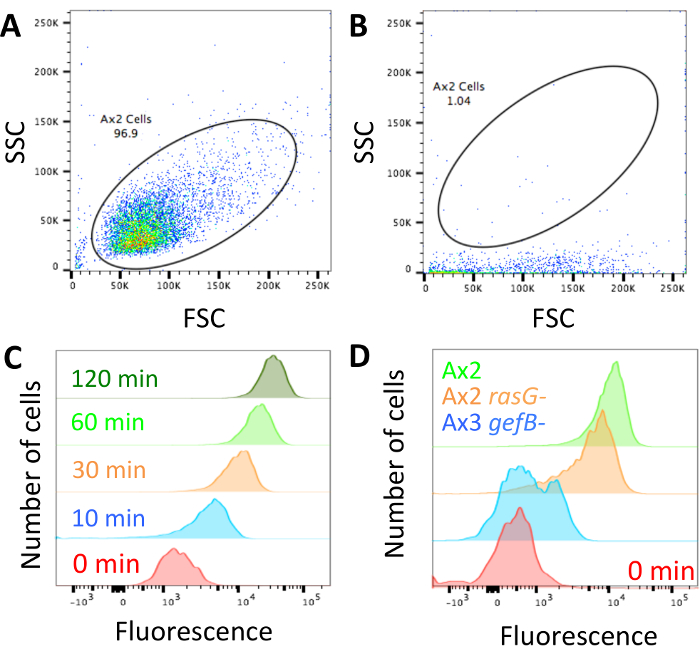
그림 2: 흐름 cytometer 및 대표 데이터의 설정. (A) 셀을 쉽게 구분할 수 있도록 앞으로 산포 (FSC) 및 셀 측면 살포 (SSC) 프로 파일을 설정 해야 합니다. Ax2 셀 모양을의 예가 표시 됩니다. (B) 교류 cytometer 차단 된 경우,이 예제와 같이 셀 매우 낮은 측면 분산형이 있다. 레이저는 fluorophores을 제대로 자극 하지 것입니다 그리고 기계 되어야 하지 차단 된 계속 하기 전에. 기계를 차단 하는 동안 얻은 모든 데이터를 폐기 해야한다. (C) 형광 설정 해야 0 분 이해 예제는 셀에 대 한 인 큐베이 팅 되었습니다 때 낮은 형광 형광 매체에 더 이상 201824윌리엄스 및 케이에서 가져온이 예제와 같이. (D) 예 정상 macropinocytosis (Ax2, 녹색)으로 1 시간에 대 한 TRITC dextran와 인 큐베이 팅 하는 셀의 macropinocytosis (Ax2 rasG-, HM172614, 오렌지)을 감소 하 고 macropinocytosis (Ax3 gefB-폐지 HM177628, 블루)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
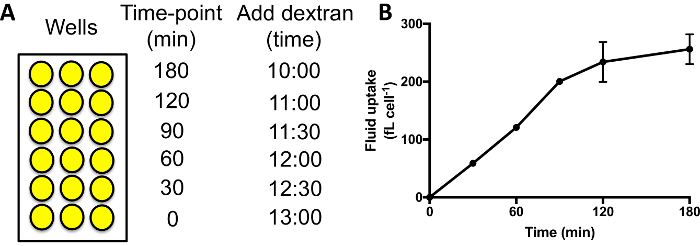
그림 3: 96 잘 접시에서 액체 이해 시간-과정을 수행. (A) Dextran 추가 해야 샘플의 각 집합에 순차적으로, 동일한 끝 시간. 다음 우물을 세척, 분리 하 고, cytometry에 의해 내 면된 형광을 측정. 예 배는 dextran을 추가 하려면 여기에 표시 됩니다. (B) 유체 이해 시간-과정 Ax2 셀의 96 잘 접시에서 수행합니다. 윌리엄스 & 케이에서 가져온 201824, 오차 막대 표시 3 개의 독립적인 실험의 표준 오차. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 유체 글귀 복용량 응답 곡선. (A) 의,이 경우는 PI3K 억제제 LY294002, HL5 1 mg/mL TRITC-dextran 이중 원하는 최종 최대 농도에서 포함 된 화합물을 추가. HL5 성장 매체 + 1 mg/mL dextran 차량 조건 당 200 µ L 매체의 희석 시리즈를 생성 하기 위해 다양 한 비율에서 혼자 포함 믹스. 세척 하 고 내 면된 형광을 측정 하기 전에 웰 스 1 h에 정상적으로 추가 합니다. ((B)) Ax2 세포 A에서 LY294002 포함 된 매체와 인 큐베이 팅에 대 한 유체 글귀 복용량 응답 곡선. 윌리엄스 & 케이 201824에서 적응. 유체 통풍 치료 컨트롤에 정규화 됩니다. 오차 막대는 3 개의 독립적인 실험의 표준 오차를 표시. ((C)) Ax2 세포는 nocodazole와 인 큐베이 팅에 대 한 유체 글귀 복용량 응답 곡선. 윌리엄스 & 케이 201824에서 적응. 유체 통풍 치료 컨트롤에 정규화 됩니다. 오차 막대는 3 개의 독립적인 실험의 표준 오차를 표시. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
다른 방법으로 유체 통풍 관을 평가 하는 낮은 처리량, macropinocytosis, 막 통풍 관의 높은 처리량 측정을 허용 하는이 방법에서는, 중요 한 단계는 제자리에서 세포와 세포를 분리 하려면 나트륨 아 지 드를 사용 하 여 세척 또는 Dictyostelium에 의해 식 균 작용입니다. 세포 표면에 부착 하 고 매체 아니다, 그들은 그들 주위 매체 처음 던져진 동안 왼쪽 연결 하 고 버퍼에 침수에 의해 변경 고 다시 던져진. 나트륨 아 지 드, 셀룰러 ATP 고갈 시킨다 고 막30depolarizes, 세포를 분리 하는 데 사용 하 고 또한 세포 생존24를 영향을 주지 않고 exocytosis를 방지 합니다.
이유 왜 특정 스트레인 또는 조건 변경 유체 통풍 관을 확립 유체 통풍 관의 매우 정확 하 게 측정을 매우 신속 하 게 준다 cytometry macropinocytosis Dictyostelium 에 의해 측정을 사용 하 여 추가 조사를 사용 하 여 현미경 검사 법은 필요한24. 또한 주목 해야 한다 그 이전에 게시 결과, 경우에 따라 표시 유체 이해에 차이 (이 경우) 처럼 표면에 성장 하는 돌연변이 체 긴장에 의해 또는 서 스 펜 션 (표준 프로토콜)로31떨고. 이 메서드를 사용 하는, 드문 경우에, 명백한 유체 글귀 결함 보고는 의미 합니다. 또한, 식 균 작용을 측정할 때 입자의 낮은 농도 에서만 사용할 수 있습니다. 먹어서가이 기법으로 판별할 수 있는 최대 속도 여전히 긴장과 조건24사이 식 균 작용에 관련 된 차이 측정 가능 하지만 실제 최대 보다 훨씬 이다. 식 균 작용의 최대 속도 확인 하려면 통풍 관 대체 프로토콜27에 의해 정지를 떨고에 측정 해야 합니다. 그래서이 수정 해야 합니다에 따라 교류 cytometer 설정할 때 셀 비즈를 phagocytosed 측면 분산형, 증가 했다.
그러나 Cytometry 포유류 세포32에서 유체 이해를 측정 하는 데 사용할 수 있습니다, 그리고 액체의 더 높은 비율 단계 이해 다른 endocytic 경로 의해 Dictyostelium 에서 보다는 관심사. 또한, 세포는 더 내 면된 dextran의 endocytic 진행 수 있도록 37 ° C에서 트립 신을 사용 하 여 분리 일반적으로. 얼음 처럼 차가운 나트륨 아 지 드 표면 (윌리엄스, 관찰 되지 않은),이 기술을 더 최적화 없이 포유류 세포에 적용 되지 않습니다 만들기에서 분리 하는 세포를 발생 하지 않습니다.
Macropinocytosis의 높은 처리량 측정 Dictyostelium 세포에 억제제, 유전자 변이 또는 유전자 최저의 효과 대 한 신속 하 고 저렴 하 게 화면에 사용 될 가능성이 있다. 돌연변이 직접 부모에 비해 항상 한다. 독자는 Dictyostelium 스트레인에 대 한 기본 설정이 없습니다 이전, DdB 등 NC4 비 axenic 긴장 더 "야생-타입" axenic 것 들 보다는 하 고 axenic 긴장33으로 효과적으로 조작할 수 있습니다. 그렇지 않으면, Ax2 긴장 되는 axenic는 적은 게놈 중복34, 동안 a x 4의 많은 변종 중부 A 녹아웃 해야와 긴장 피해 가능 하면23. 이전에 게시 긴장 가장35Dicty 재고 센터 주문할 수 있습니다.
이 기술은 다른 조건, 저 해제 및 Dictyostelium에 의해 macropinocytosis에 돌연변이의 효과로 가능 했던 것 보다 더 큰 조사 가능성을 허용 한다.
공개
저자는 공개 관심의 없습니다 충돌 있다.
감사의 말
우리는 의료 연구 위원회 영국 코어 (U105115237) RRK 자금에 대 한 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
참고문헌
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유