Method Article
Medição do elevado-throughput de Dictyostelium discoideum macropinocitose por citometria de fluxo
Neste Artigo
Resumo
Macropinocitose, em grande escala absorção de fluido não-específica, é importante em muitas áreas da patologia clínica, incluindo Imunologia, infecção, câncer e doenças neurodegenerativas. Aqui, as técnicas existentes foram adaptadas para permitir a resolução alta produtividade, célula única medição de macropinocitose no macropinocitose modelo organismo Dictyostelium discoideum utilizando citometria de fluxo.
Resumo
Captação de fluido específico em grande escala por macropinocitose é importante para a proliferação de determinadas células cancerosas, amostragem de antígeno, invasão de células do hospedeiro e a propagação de doenças neurodegenerativas. As cepas de laboratório comumente usados de ameba Dictyostelium discoideum têm taxas extremamente alta absorção de fluido quando cultivadas em meio nutritivo, mais de 90% do que é devido a macropinocitose. Além disso, muitos dos componentes principais conhecidos da macropinocitose mamíferos também estão presentes, tornando-se um sistema de excelente modelo para o estudo de macropinocitose. Aqui, a técnica padrão para medir o fluido interiorizado usando dextrano fluorescente como um rótulo é adaptada para um formato de placa de 96 poços, com as amostras analisadas por citometria de fluxo, usando um acessório de amostragem de alta produtividade (HTS).
As células são alimentadas não-extinguível dextrano fluorescente para um comprimento pré-determinado de tempo, lavado por imersão em buffer gelada e desanexado usando 5mm azida sódica também para a exocitose. Células em cada poço são então analisadas por citometria de fluxo. O método também pode ser adaptado para medir a absorção de membrana e fagocitose de grânulos fluorescentes ou bactérias.
Este método foi projetado para permitir a medição da absorção de fluido por Dictyostelium de forma eficiente da elevado-produção, trabalho e recursos. Permite comparação simultânea de várias cepas (por exemplo, os mutantes de nocaute de um gene) e condições (por exemplo, células em diferentes meios de comunicação ou tratados com diferentes concentrações do inibidor) em paralelo e simplifica o tempo-cursos.
Introdução
Captação de fluido específico em grande escala por macropinocitose é importante em diversos contextos biológicos1, incluindo amostragem de antígeno por imune células2, entrada de patógeno no hospedeiro células3, câncer de células de proliferação4 e o propagação de doenças de príon5. Em mamíferos e células de Dictyostelium , actina6,7, PI (3,4,5) P38,9,10 (embora a natureza exata dos lipídios difere entre os dois,11), registrados Ras12,13e registrados Rac14,15 são importantes para a absorção de fluido eficiente por macropinocitose, embora ainda há muitas perguntas sem resposta sobre como é o patch macropinocytic formado, organizado e eventualmente interiorizado. Descobrir mais proteínas importantes para macropinocitose e a subsequente determinação de como eles são importantes nos diversos contextos biológicos, dará uma compreensão mais abrangente da macropinocitose e potencialmente permitir o desenvolvimento de tratamentos direcionados para uma variedade de condições.
Dictyostelium é um sistema de modelo ideal para o estudo de macropinocitose. O elevado nível de macropinocitose constitutiva em cepas de laboratório padrão significa que absorção de fluido mais é 90% devido a macropinocitose6. Isso permite que o macropinocitose a ser medido unicamente pela determinação de absorção de fluidos, ao contrário de células de mamíferos onde a proporção de absorção de fluidos devido a macropinocitose é muito menor. Que macropinocitose é tão bem definido e facilmente visualizado12 neste sistema da mesma forma oferece vantagens distintas para investigar núcleo componentes conservados da macropinosome sobre outros sistemas onde pode haver múltiplos sinais de regulamentação 16 , 17.
A técnica padrão usada para medir a macropinocitose por células de mamíferos envolve reparar células depois pulsando com dextran por um curto período de tempo, seguido por microscopia para determinar a área de uma célula que é ocupada por vesículas dextran-positivo18. Esta técnica não conta no entanto para a possibilidade de macropinosomes encolhendo ao entrar da célula, que tem sido relatada em Dictyostelium19e só leva em conta única aviões da célula, ou seja, o volume internalizado Não está claro. Uma técnica alternativa, da contagem do número de macropinosomes internalizados em um determinado tempo, tem as mesmas desvantagens20. Usar Dictyostelium evita estes problemas; no entanto, técnicas existentes para medir a absorção de líquido pelo Dictyostelium são relativamente quantidade de trabalho intensivo, utilizando um grande de células e dextrano21. As células são sacudidas em alta densidade em dextran fluorescente e amostras removidas em vários pontos de tempo para determinação da fluorescência interiorizada usando um fluorímetro. Células preparadas desta forma podem ser analisadas por citometria de fluxo para ganhar a única célula, ao invés de nível populacional, resolução22, embora isto permanece baixa produtividade.
Aqui, a técnica padrão para medir o fluido interiorizado usando dextrano fluorescente como um rótulo é adaptada para um formato de placa de 96 poços, com as amostras analisadas por citometria de fluxo, usando um acessório de amostragem de alta produtividade (HTS). As células são alimentadas não-extinguível dextrano fluorescente para um comprimento pré-determinado de tempo, lavado por imersão em buffer gelada e desanexado usando 5mm azida sódica também para a exocitose. Células em cada poço são então analisadas por citometria de fluxo. Esse método foi projetado para superar as limitações dos métodos acima e permitir a comparação simultânea da absorção de fluidos de um grande número de estirpes/condições enquanto usando menos recursos e reduzir o trabalho envolvido.
Protocolo
1. preparação de células e materiais
- Cultive células em placas de ágar de SM em conjunto com bactérias como Klebsiella aerogenes, ou em meio nutritivo como HL5 como descrito23.
Nota: Crescer mutantes nocaute que defeitos de macropinocitose sobre as bactérias ajuda a evitar a acumulação de mutações secundárias que podem aumentar a taxa de macropinocitose. Manter o número de passagem abaixo de 4 depois chapear pilhas dos estoques para óptimos resultados. Os mutantes devem ser armazenados como estoques congelados logo que possível após o isolamento. - Para cultivar células em placas de ágar de SM, cresce K. aerogenes a confluência no meio de SM. Adicionar 200 – 300 μL de bactérias em uma placa de ágar de SM e espalhar. Tomar uma ansa estéril de células (quando transferir de outra placa bacteriana) e espalhe em uma borda da placa. Incube a 22 ° C por até uma semana.
- Dissolver o dextran de Tetra-metil-rodamina isotiocianato (TRITC-) a 50 mg/mL em água, usando filtros de 0,22 μm em alíquotas de 1 mL de filtro e armazenar a-20 ° C. Alíquotas podem ser mantidas indefinidamente.
Nota: 155 kDa é usado com este método, como pode ser comprado mais barato em massa, mas menores dextranos medem macropinocitose tão eficazmente em Dictyostelium24tamanho típico. Dextranos não-extinguível diferentes, tais como a cascata azul ou Alexa-647, são alternativas se diferente fluorophores são necessários.
2. como converter medidas qualitativas em quantitativos (opcionais)
-
Realize um ensaio de absorção de fluidos utilizando células em suspensão.
- Células axenically crescentes a 300 x g durante 3 min de Pelotas, desprezar o sobrenadante e ressuspender em meio nutritivo a 1 x 107 células/mL. Adicionar TRITC-dextrano a 0,5 mg/mL e agitar a 180 rpm, 22 ° C.
- Dilua a 0,8 mL amostras em 0,7 mL de gelado KK2 em 0, 30, 60, 90, 120 min. lavar uma vez em 1,5 mL de gelado KK2 amortecedor23 em uma centrífuga de bancada, Ressuspender a 1 mL no mesmo amortecedor em armazenam no gelo.
Nota: lavar imediatamente ou assim que todas as amostras foram recolhidas produz resultados equivalentes.
-
Determine o volume de fluido internalizado pelas células.
- Definir o fluorímetro medir fluorescência usando um comprimento de onda de excitação de 544 nm e emissão de comprimento de onda de 574 nm, com uma fenda nm 10. Configurar uma série de diluição do TRITC-dextran e usá-lo para medir a fluorescência para dada volumes de dextrano. Crie uma curva de calibração.
- Medir a fluorescência internalizada pelas células na secção 2.1 usando 0,9 mL de suspensão de célula. Calcule o volume de fluido interiorizado por célula usando a curva de calibração24.
- Dilua o restante das células de cada ponto de tempo separadamente em 0,5 mL gelo frio KK2. Filtrar através de um filtro de célula 70 µm para tubos de citometria de fluxo poliestireno 5 mL. Definir o citômetro de fluxo para que as células de cada ponto de tempo são diferentes um do outro e gravar sua fluorescência (ver seções 3.4 e 3.5).
- Medir a fluorescência dos grânulos de calibração no citômetro de fluxo usando as configurações acima e gravá-la.
Nota: Esta é a referência para todas as medições de fluorescência futuras sobre o citômetro de fluxo: antes de usar novamente executar os grânulos e ajustar as configurações para que eles tenham a mesma fluorescência. Isso vai dar um pico muito estreito definido. Colocar um portão em volta do pico de fluorescência pode facilitar as coisas. - Repita três vezes e plotar os dados de fluorescência celular obtidos nas seções 2.2 e 2.3 uns contra os outros. Traçar uma linha de melhor ajuste e usar a equação para converter os dados qualitativos da citometria de fluxo em unidades quantitativas.
3. absorção de fluido de medição.
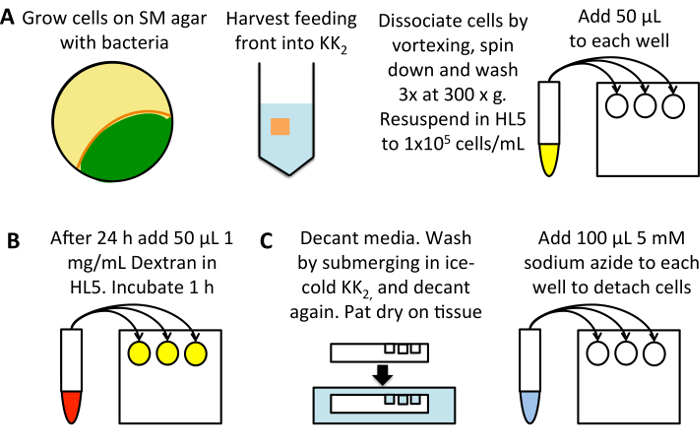
Figura 1: esquemático do elevado-throughput medição de macropinocitose. (A) Grow Dictyostelium em um prato de SM inoculado com bactérias K. aerogenes (amarelo). Colher células de alimentação frente (laranja), evitando as células que já são desenvolvidas (verde), em 25 mL de tampão de2 KK. Vórtice de dissociar, de pelotas por 3 min centrifugação a 300 x ge, em seguida, lavar 3 vezes em 50 mL de tampão de2 KK, descartar o sobrenadante de cada vez. Resuspenda a 1 x 105 células/mL em meio de crescimento HL5 e adicionar 50 µ l em três poços, por exemplo de uma placa de 96 poços de fundo plano. Incube a 22 ° C por 24 h. (B) diluído TRITC-dextrano a 1 mg/mL em meio de crescimento HL5 de uma solução stock de 50 mg/mL. Adicionar 50 µ l de cada amostra (excluindo os poços de controle de absorção de 0 min) e incube a 22 ° C, durante 1 h, depois que adicionar o dextran para o controle de absorção de 0 min. (C) decantar imediatamente os meios de comunicação, pat a placa em um lenço de papel para remover o excesso de meio e mergulhe em um banho de gelada buffer de2 KK, enchendo os poços para lavar. Decantar o buffer e seque novamente. Adicione 100 µ l de 5 mM de azida de sódio dissolvida em KK2MC para separar as células. Leve ao fluxo citômetro para medição de fluorescência interiorizada. Clique aqui para ver uma versão maior desta figura.
-
Configure uma placa de cultura de tecidos de 96 poços fundo chato (figura 1A). Usar células cultivadas sobre as bactérias e para transferi-los para HL5 médio (contendo 100 µ g/mL de Diidroestreptomicina, 100 µ g/mL ampicilina e canamicina de 50 µ g/mL) 24 h antes do ensaio; Isto permite macropinocitose ser upregulated dos níveis baixos visto em células cultivadas em bactérias24. Alternativamente, dilua as células diretamente da cultura axénica, incubando durante 24 h antes do ensaio, para reduzir os erros devido as células sendo diluídos de diferentes densidades.
- Colheita de células da parte dianteira de alimentação em 25 mL de KK2 em um tubo de centrífuga de 50 mL. Dissociar as células pela utilização do Vortex e pelota a 300 x g durante 3 min. Desprezar o sobrenadante e ressuspender o lavar 3 vezes a 300 x g por 3 min em 50 mL de KK2, descartar o sobrenadante de cada vez para remover as bactérias.
- Determinar a densidade celular (usando um hemacytometer ou outro celular que conta o sistema) e diluir em HL5 contendo antibióticos a 1 x 105 células/mL. Pipete 50 μL para cada poço, usando três poços para cada condição. Incube a 22 ° C por 24 h. Lembre-se de configurar um controle de absorção de 0 min.
Nota: Uma alternativa médio, por exemplo, SIH, VL6 pode ser usado em vez disso.
-
Carregar as células com TRITC-dextrano (figura 1B).
- Diluir o dextran para 1 mg/mL no meio utilizado (pode ser aumentada para 2,5-5 mg/mL ao avaliar as células de absorção muito baixa). Adicionar 50 μL de cada poço (dando uma concentração final de 0,5 mg/mL TRITC-dextran) e devolve a chapa de 22 ° C, durante 1 h, como este permite acumulação significativa de dextrano mas exocitose de dextrano ainda não começou.
Nota: uma pipeta repetidor permite que este passo deve ser feito mais rapidamente, reduzindo o erro.
- Diluir o dextran para 1 mg/mL no meio utilizado (pode ser aumentada para 2,5-5 mg/mL ao avaliar as células de absorção muito baixa). Adicionar 50 μL de cada poço (dando uma concentração final de 0,5 mg/mL TRITC-dextran) e devolve a chapa de 22 ° C, durante 1 h, como este permite acumulação significativa de dextrano mas exocitose de dextrano ainda não começou.
-
Prepare células por citometria de fluxo (Figura 1).
- Imediatamente antes da lavagem, adicione 50 μL contendo dextrano meios de comunicação para os controles de absorção 0 min.
- Decantar o meio e seque em um tecido. Lave submergindo a placa numa gelada KK2e, em seguida, decantar.
Nota: algumas estirpes com defeitos de adesão podem desprender-se durante esta etapa, por exemplo, um nocaute de ambos homologs de Talin (Teixeira-/ Teles -)25. Tenha cuidado ao trabalhar com linhas de célula que anexar mal e aspirar a mídia, se necessário. - Adicione 100 μL de 5mm gelada de azida de sódio dissolvida em KK2MC (KK2 + 2 mM de MgSO4 e 100 μM CaCl2).
Atenção: A azida de sódio é extremamente tóxica. Use uma máscara de poeira e óculos de segurança quando se trabalha com o pó. Use sempre luvas e jaleco. Evitar calor e não se misturam com o ácido.
Nota: As células rapidamente desanexar e exocitose é impedido de24. Um microscópio pode ser usado para verificar isto.
-
Absorção de fluido medida por citometria de fluxo
- Se planeja converter valores relativos aos absoluto, use grânulos para padronizar configurações de citômetro de fluxo (ver secção 2). Alternativamente, uso células carregadas com dextran como na seção 2 para garantir que a dispersão para a frente e dispersão de lado estão definidas adequadamente para isolar as células (Figura 2A), garantindo que a máquina não estiver bloqueada, (Figura 2B) e ajustar os parâmetros para medir a fluorescência interiorizada (Figura 2).
- Conectar o sistema de amostragem de alta produtividade e adicionar a placa. Criar um protocolo para medir a fluorescência (para TRITC-dextrano usam um laser verde-amarelo para excitar e medir no canal 582 nm ou similar) de até 65 μL da suspensão de células e executar.
-
Analisar os resultados de citometria de fluxo
- Portal sobre as células usando a dispersão para a frente e dispersão lateral (Figura 2A). Calcule a mediana da fluorescência das células usando a opção de estatísticas. Definir esses parâmetros usando uma amostra e se aplicam a todas as amostras.
Nota: Os perfis de dispersão de dispersão para a frente/lateral podem variar entre amostras quando usando diferentes mutantes ou inibidores. - Determinar a média dos três poços para cada condição e subtrair o controle de absorção de 0 min. Também converter valores quantitativos utilizando a equação determinada seção 2 ou normalizar para o controle.
- Portal sobre as células usando a dispersão para a frente e dispersão lateral (Figura 2A). Calcule a mediana da fluorescência das células usando a opção de estatísticas. Definir esses parâmetros usando uma amostra e se aplicam a todas as amostras.
4. realizando o tempo de absorção de fluido-cursos
- Configure as células como na seção 3, com três poços para cada ponto de tempo e tensão/condição.
- Adicione meio rotulados de dextrano nos poços diferentes sequencialmente. Um curso típico de tempo mede a absorção de fluido em 0, 30, 60, 90, 120 e 180 min. adicionar meio contendo dextrano para os poços de ponto de tempo 180 min, seguido de 60 min depois adicionando-os poços para o ponto de tempo 120 min, etc (Figura 3A).
- Em min 0, adicionar 50 μL de dextrano contendo médio e imediatamente decantar e lavar a placa como na seção 3.3. Analise, conforme descrito na seção 3.5.
5. curvas de resposta de dose
- Configure as células conforme descrito na seção 3, com três poços para cada estirpe e condição.
- Dilua o composto de interesse em meio contendo dextrano de 1 mg/mL em dobro a máxima concentração final desejada do composto. Prepare um segundo tubo contendo meio com dextran com a mesma proporção de veículos como o primeiro. Vórtice de misturar.
- Crie uma série de diluição do composto de interesse em dextran 200 μL contendo meio por amostra (Figura 4A). Vórtice de misturar. Adicione 50 μL de médio porte para cada amostra bem por 1h.
- Lave e analisar como descrito na seção 3.3 em diante.
6. a fagocitose e a captação de membrana
- Para medir a absorção de membrana, prepare as células conforme descrito na seção 3. Adicione 50 μL de meio contendo 20 μM FM 1-43 para uma concentração final de 10 μM. Após o carregamento, lavar e preparar células por citometria de fluxo como na seção 3.3. Medir no canal 585 nm ou similar, usando um laser azul para excitar.
Nota: Como tráfico de membrana é mais rápido do que o fluido-fase, 10 min é um ponto de tempo mais apropriado para usar-se do que 1 h26. Corantes alternativos que fluorescem somente quando incorporada à membrana podem ser usados em vez disso. -
Usar fluorescente etiquetados grânulos ou bactérias para medir fagocitose. Levedura fluorescente não pode ser usada, como eles são inseparáveis do Dictyostelium pelo frente e lado scatter24. Configurar as células conforme descrito na seção 3 e analisar como descrito27.
- Para medir a fagocitose de grânulos adicionar rotulados grânulos conforme descrito na seção 3.2 para uma concentração final de 5 x 107 grânulos/mL (1.75 e 2 μm) ou 1 x 108 grânulos/mL (1 e 1,5 μm) para 1 h antes de lavar e preparar-se para citometria de fluxo, como em verde-amarelo seção 3.3. Medir no canal de 525 nm ou similar, usando um laser azul para excitar.
Nota: Concentrações mais elevadas conduzirá ao desprendimento de células. - Para medir a fagocitose de bactérias, adicione que Texas-vermelho rotulados Escherichia coli bioparticles, conforme descrito na seção 3.2 a 1 x 108 bactérias/mL para 1 h antes de lavar e preparar-se para citometria de fluxo como na seção 3.3. Medir no canal de 610 nm ou similar, usando um laser verde-amarelo para excitar.
- Para medir a fagocitose de grânulos adicionar rotulados grânulos conforme descrito na seção 3.2 para uma concentração final de 5 x 107 grânulos/mL (1.75 e 2 μm) ou 1 x 108 grânulos/mL (1 e 1,5 μm) para 1 h antes de lavar e preparar-se para citometria de fluxo, como em verde-amarelo seção 3.3. Medir no canal de 525 nm ou similar, usando um laser azul para excitar.
Resultados
Uma vez que a técnica tem sido realizada e as células são carregados com dextran e prontos para análise (Figura 1), certifique-se do que citômetro de fluxo não é bloqueado e ajustar o perfil de dispersão de dispersão para a frente/lado para olhar como o mostrado na Figura 2Adas células. Se a máquina está bloqueada, ele vai olhar mais como mostrada na Figura 2B e deve ser desbloqueado antes de continuar. Certifique-se de parâmetros mostram controle axénica células têm alta dextrano interiorizado fluorescência em pontos de tempo mais longos e baixa fluorescência interiorizada em curtos (Figura 2).
Ao olhar para as diferenças entre os mutantes, é provável que haja um dos três fenótipos. Os mutantes podem ter absorção de fluido normal, poderiam ter um defeito parcial ou absorção de fluido pode ser completamente abolida. Figura 2D mostra uma estirpe de absorção de fluido normal, neste caso a cepa padrão de laboratório Ax2, um mutante com um ~ 50% diminuição na captação de fluidos (Ax2 rasG-14) e um com aboliu a absorção de fluido (Ax3 gefB-28). Obter a média absorção de fluido mediana (seção 3.5) e usá-lo para calcular o volume de fluido internalizado (como na Figura 3B) ou comparar os dados a um controle (como na Figura 4B e 4C).
Ao realizar um curso de tempo de absorção de fluidos, como na Figura 3A, a fluorescência interiorizada deve aumentar para 60 – 90 min, após o qual o dextran começa a ser exocytosed e um platô é atingido (Figura 3B). Usando 60 min como o ponto de hora padrão quando comparar macropinocitose em mutantes/condições diferentes, portanto, permite um bom sinal para ser alcançado, e nenhum sinal é perdido devido a exocitose. Os mutantes onde exocitose é severamente obstruído podem demorar mais para atingir um platô29.
Quando tratando as células com inibidores que são eficazes contra macropinocitose em Dictyostelium (configurar como na Figura 4A), o dextrano internalizado em 1 h vai para baixo quase nada em altas concentrações de inibidor na maioria dos casos (Figura 4B). Alguns inibidores podem não ser 100% eficaz, no entanto, por exemplo, nocodazole apenas inibe até 50% de absorção de fluidos por macropinocitose quando adicionado de forma aguda (Figura 4). Se os inibidores não são eficazes, as células vão internalizar uma quantidade semelhante de dextrano como o controle, e uma diminuição na fluorescência não será vista. Esta técnica permite uma grande variedade de diferentes inibidores e concentrações do inibidor para ser rastreada para efeitos na absorção de fluido por macropinocitose muito rapidamente, reduzindo o tempo gasto, otimizando o tratamento inibidor.
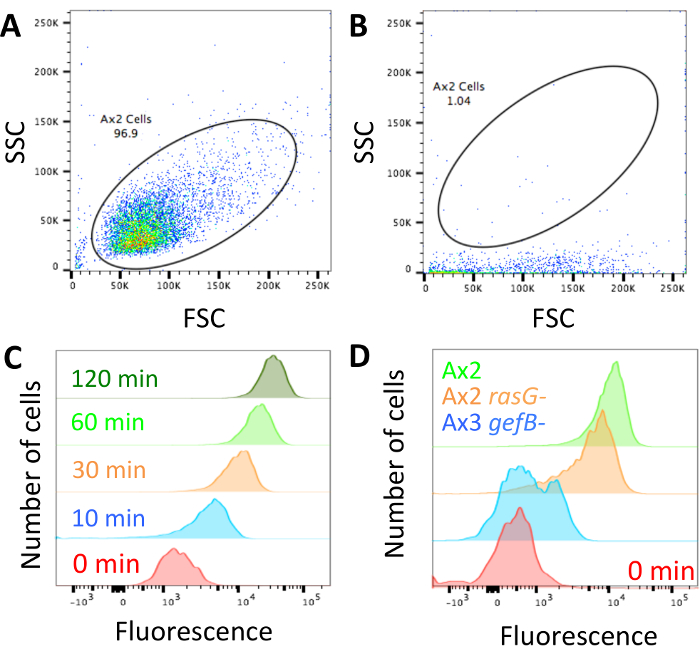
Figura 2: configuração do fluxo citômetro e representante de dados. (A) a dispersão para a frente (FSC) e perfis de dispersão (SSC) do lado de células devem ser definidos para que as células podem ser facilmente distinguidas. É mostrado um exemplo de como as células Ax2 devem procurar. (B) se o citômetro de fluxo é bloqueado, como neste exemplo, as células possuem dispersão lateral muito baixa. O laser não excitará os fluorophores correctamente e a máquina deve ser desbloqueada antes de continuar. Quaisquer dados obtidos enquanto a máquina foi bloqueada devem ser descartados. (C) a fluorescência deve ser definida para que uma amostra de absorção 0 min tem baixa fluorescência, que aumenta quando as células têm sido incubadas durante mais tempo no meio de fluorescente, como mostrado neste exemplo tirado de Williams & Kay 201824. (D) exemplos de células que têm sido incubados com dextran TRITC para 1 h com normal macropinocitose (Ax2, verde), reduzido a macropinocitose (Ax2 rasG -, HM172614, laranja) e aboliu a macropinocitose (Ax3 gefB -, HM177628, azul). Clique aqui para ver uma versão maior desta figura.
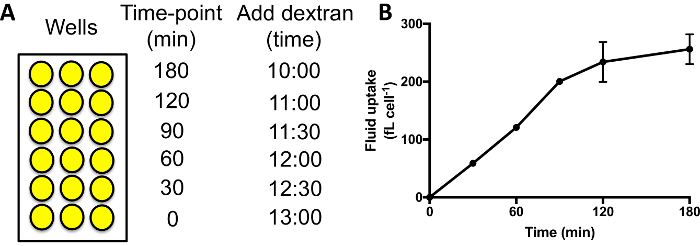
Figura 3: executando o tempo de absorção de fluidos-cursos em placas de 96 poços. (A) Dextran deve ser adicionado para cada conjunto de amostras sequencialmente, com o mesmo tempo de chegada. Em seguida, lavar os poços, desanexar e medir a fluorescência interiorizada por citometria de fluxo. Vezes de exemplo, para adicionar o dextrano são mostrados aqui. (B) absorção de fluido tempo-curso de Ax2 células realizada em placas de 96 poços. Tiradas de Williams & Kay 201824, barras de erro mostram o erro-padrão de três experimentos independentes. Clique aqui para ver uma versão maior desta figura.

Figura 4: curvas de resposta de dose de absorção de fluidos. (A) adicionar o composto de interesse, neste caso a PI3K inibidor da LY294002, para HL5 contendo 1 mg/mL TRITC-dextrano pelo dobro da concentração máxima final desejado. Misture com HL5 crescimento médio + dextran de 1 mg/mL, contendo o veículo sozinho em diferentes proporções para gerar uma série de diluição do meio de 200 µ l por condição. Adicione aos poços como normal por 1h antes da lavagem e medição de fluorescência interiorizada. (B) curva de resposta de dose de absorção de fluidos para Ax2 células incubadas com o meio contendo LY294002 de A. Adaptado de Williams & Kay 201824. Absorção de fluido é normalizada para um controle não tratado. Barras de erro mostram o erro-padrão de três experimentos independentes. (C) curva de resposta de dose de absorção de fluidos para Ax2 células incubadas com o nocodazole. Adaptado de Williams & Kay 201824. Absorção de fluido é normalizada para um controle não tratado. Barras de erro mostram o erro-padrão de três experimentos independentes. Clique aqui para ver uma versão maior desta figura.
Discussão
Considerando que outros métodos para avaliar a absorção de fluido são a baixa taxa de transferência, lavar as células em situ e a utilização de azida de sódio para separar as células é as etapas críticas neste método, que permitem alta produtividade medida da macropinocitose, absorção de membrana, ou fagocitose por Dictyostelium. Como as células são anexadas a uma superfície e o meio não é, podem ser anexados à esquerda enquanto o meio ao redor deles primeiro é jogado fora e então mudou por imersão em buffer e jogados fora novamente. Azida sódica, esgota o ATP celular e depolarizes a membrana30, é usada para separar as células e também impede que a exocitose, sem afetar de viabilidade celular24.
Enquanto usando citometria de fluxo para medir macropinocitose por Dictyostelium dá uma medida muito exata de absorção de fluidos muito rapidamente, para estabelecer a razão por que uma estirpe ou condição alterou a absorção de líquidos, promover a investigação usando a microscopia é necessário24. Também note que resultados publicados anteriormente, em alguns casos, mostraram uma diferença na captação de fluidos por cepas mutantes crescidas ou sobre uma superfície (como neste caso), ou em suspensão (como o protocolo padrão)31a tremer. Usar este método pode significar que, em casos raros, absorção de fluido aparente defeitos são perdidos. Além disso, quando se mede a fagocitose, somente a baixas concentrações de partículas podem ser usadas. A taxa máxima de fagocitose que pode ser determinado com esta técnica é muito abaixo do máximo real, embora ainda é possível medir diferenças relevantes na fagocitose entre estirpes e condições24. Para determinar a taxa máxima de fagocitose, captação deve ser medida numa suspensão a tremer por um protocolo alternativo de27. As células que têm fagocitados grânulos aumentaram dispersão de lado, então isso deve ser corrigido para em conformidade ao configurar o citômetro de fluxo.
Citometria de fluxo pode ser usada para medir a absorção de fluido em células de mamíferos32, no entanto a maior proporção de fluido fase captação por outras vias endocítica do visto em Dictyostelium é uma preocupação. Além disso, células normalmente são desanexadas usando tripsina a 37 ° C, permitindo que mais endocítica progressão de dextrano interiorizado. Azida de sódio gelado não causa macrófagos para desconectar-se de uma superfície (Williams, inédita de observação), fazendo com que esta técnica não se aplica às células dos mamíferos sem mais otimização.
Medição de alta taxa de transferência de macropinocitose tem potencial para ser usado para a tela de forma rápida e barata para os efeitos de inibidores, mutação genética ou knockdown do gene em células de Dictyostelium . Os mutantes sempre devem ser comparados ao seu progenitor direto só. Se o leitor não tem nenhuma preferência prévia para Dictyostelium estirpe, cepas não-axénica como DdB ou NC4 são mais "wild-type" do que os axénica e podem ser manipuladas tão eficazmente como cepas axénica33. Caso contrário, Ax2 cepas são o axénica tensões com o menor genoma duplicações34, enquanto muitas cepas de Ax4 são nocautes Talin A e devem ser evitado, se possível,23. Mais cepas previamente publicadas podem ser encomendadas a partir o Dicty Stock Center35.
Esta técnica permite maiores possibilidades de investigação do que era anteriormente possível sobre os efeitos de diferentes condições, inibidores e mutações na macropinocitose por Dictyostelium.
Divulgações
Os autores têm sem conflitos de interesse a divulgar.
Agradecimentos
Agradecemos o Medical Research Council UK para núcleo de financiamento (U105115237) para RRK.
Materiais
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
Referências
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados