Method Article
用不连续密度梯度用胶囊分离细菌
摘要
我们展示了使用不连续密度梯度来根据胶囊生产分离细菌种群。该方法用于比较培养物间的胶囊数量, 分离具有特定胶囊表型的突变体, 或鉴定胶囊调节剂。这里描述的是该分析的优化和运行。
摘要
胶囊是许多细菌的主要毒力因子, 它调节免疫逃避和抵抗各种身体压力。虽然有许多方法可以量化和比较不同菌株或突变体之间的胶囊生产, 但没有广泛使用的方法根据细菌产生的胶囊数量对其进行分类。我们已经开发了一种方法来分离细菌的胶囊量, 使用不连续的密度梯度。该方法用于半定量比较培养物间的胶囊数量, 分离改变胶囊生产的突变体, 并从复杂样品中纯化胶囊细菌。该方法还可以与转座子插入测序相结合, 以识别参与胶囊调节的基因。在这里, 详细介绍了该方法, 包括如何优化新的细菌种类或菌株的梯度条件, 以及如何构造和运行密度梯度。
引言
许多细菌种类产生多糖胶囊, 保护细菌细胞免受各种物理压力, 免受免疫系统的识别和杀死。在肺炎克雷伯菌中, 胶囊生产是感染 1,2的绝对要求。肺炎胶囊介导对抗菌肽的耐药性、对补充介导的杀灭的耐药性、预防吞噬和抑制先天免疫反应3。过量胶囊的生产与增加的毒力和社区获得 (而不是医院) 感染4有关.
有一系列定量和定性测试可用于研究胶囊生产。对于k洗糖菌物种, 这些包括字符串测试5, 其中一个牙签接触到一个殖民地被拉向上, 并产生的字符串长度测量, 和粘液粘度试验6, 其中涉及缓慢的离心一种培养物, 然后测量上清液的光学密度。这些方法简单、快速, 但在经典克雷伯菌菌株上使用时缺乏敏感性, 而不是胶囊过度产菌株。胶囊定量的另一种方法是尿酸测定, 这在技术上具有挑战性, 需要使用浓缩硫酸1。最后, 胶囊是直接可见的显微镜 (图 1a)。在这些方法中, 只有显微镜允许用户观察单个群体中不同的胶囊状态, 而这些方法都不能物理分离胶囊和非胶囊细菌。
梯度离心法基于密度的分离通常用于细胞生物学中纯化不同类型的真核细胞 7, 但很少用于微生物研究。克雷伯菌的粘液粘度检测是基于高度胶囊化的细菌需要更多的时间来通过离心颗粒, 我们推断, 这可能是由于胶囊细胞的整体密度降低。本文采用密度梯度离心法, 采用胶囊量物理分离肺炎 k. 肺炎种群的方法 (图 1)。该方法成功地应用于肺炎链球菌, 表明该方法适用于其他细菌种类。饱和转座子突变体库的密度梯度分离, 加上转座子插入测序 (密度-----几分几分), 已被用来识别参与胶囊生产和调节8的基因。同样, 该方法与单个菌落的随机原代聚合酶链反应 (pcr) 结合使用, 分离出非胶囊的肺炎 k . 突变体。该方法还可用于快速比较不同人群和条件之间的胶囊生产, 或从复杂样品中纯化胶囊细菌 (图 1 b)。最后, 还可以选择检测影响密度的其他表型, 如细胞大小或聚集。
这份手稿演示了如何优化新的细菌种类或菌株的程序, 并演示了一个不连续的密度梯度的结构和运行, 以分离超胶囊, 胶囊和非胶囊细菌。
研究方案
请注意:在培养和处理样品时, 确保遵守适用于细菌菌株的任何风险评估。请注意, 一次设置过多的渐变会导致肌肉骨骼紊乱, 因为所涉及的缓慢移液对关节造成的压力。计划工作并采取预防措施以避免受伤。
1. 菌种或突变体库的制备
-
将要在适当的琼脂板上测试的菌株流出来。这些是用于实验的股票板。
- 在所需的温度下将板材连夜培育, 以实现单个菌落。本实验在37°c 的尿液 (lb) 琼脂上培养k.肺炎 (ntuh-k2044 和 atcc43816 菌株), 在37°c 加湿蜡烛罐中的血琼脂上培养肺炎 k .肺炎 (ntuh-k2044 和 atcc43816 菌株).
-
从油盘 (步骤 1.1) 中选择一个单一的菌落, 使用无菌循环或鸡尾酒棒接种10毫升适当的肉汤。为筛选随机突变库, 用10μl 的随机突变库 (trdis 库) 接种肉汤。
- 在37°c 低盐 lb 培养基中培养肺炎 k.菌株, 并在37°c 下静态培养脑心脏输液 (bhi) 培养基中的肺炎 s 菌株。
- 将隔夜培养物转移到15毫升管和离心机中的台式离心机中, 以 3200 x g 的速度在带有 15 ml 管插入物和气雾剂紧凝盖的摆动桶中, 持续10分钟。
- 丢弃上清液, 在1x 磷酸盐缓冲盐水 (pbs) 的2毫升中重新悬浮颗粒。
请注意:在实验室中通过适当的液体生物废物途径处理上清液。离心和再悬浮步骤 (1.2.2 和 1.2.3) 的目的是浓缩细菌, 以便于在梯度上进行可视化。细菌培养可以直接加载到梯度, 如果需要。胶囊重的菌株可能不会形成一个紧密的颗粒。如果发生这种情况, 在不去除任何细菌细胞的情况下去除尽可能多的上清液, 在5毫升的最终体积中添加1x 的 pbs, 然后重新悬浮颗粒。继续执行步骤1.2.5 的协议。 - 对于非粘液菌株, 请转到步骤2。
- 按照步骤1.2.2 中所述离心管。
- 丢弃上清液, 在 1x pbs 的2毫升中重新悬浮颗粒。单元格现在可以使用了。
请注意:细菌细胞悬浮液的密度并不重要, 但需要足以在梯度可视化。建议至少 od600 (光学密度为600纳米) 为4。
2. 梯度稀释的制备和微梯度试验
-
准备梯度稀释。
请注意:密度梯度所需的密度梯度介质 (例如, percoll) 的精确浓度将因所使用的细菌菌株和生长条件而异。首先进行微梯度测试, 以确定能提供最佳分离的浓度。这些包括500μl 的单稀释在2毫升管。如果细菌将从梯度中提取并进行亚培养, 用于下游应用, 则应在无菌条件下执行这些步骤。- 将密度梯度介质与 1x pbs 结合, 进行密度梯度稀释。稀释20%、30%、40%、50%、60%、70% 和 80% (例如,密度梯度介质2毫升加上 1x pbs 的8毫升 = 20% 密度梯度介质的10毫升)。
- 对于要测试的每个菌株, 将20% 梯度稀释的500μl 注入 2 ml 管 (例如, 4 株 = 4 管, 其中含有500μl 的20% 梯度稀释)。
- 对其余的梯度稀释重复步骤2.1.2。
-
在梯度上应用细菌。
- 按照以下步骤将1.2.3 步骤和1.2.6 的细菌细胞应用100μl。
- 使用200μl 移液器取出100μl 的细胞, 并将移液器尖端放在小梯度半月板下方的管的一侧。
- 将细菌细胞吸收到梯度上的速度非常缓慢, 使它们在梯度的顶部形成一层, 而不会混合任何界面。
- 重复2.2.1.1 步骤–2.2.1.2 测试所有菌株。
- 使用气雾剂紧盖的固定角度转子, 在 8, 000 x g 的情况下, 用微型离心机将制备的管离心10分钟。
- 离心后, 将管道转移到机架上, 以可视化离心后保留细胞在梯度层上方所需的最小梯度稀释。
- 如果结果不清楚, 请重复最小梯度测试, 将5% 的密度梯度介质稀释量高于或低于步骤2.1.1 中定义的浓度 (例如,如果30% 的结果不明确, 则应测试25% 和35% 的稀释)。
请注意:有关单密度梯度介质稀释的典型结果, 请参见图 2a. - 使用步骤2.2.3 的结果–2.2.4 确定理想的梯度稀释剂, 用于在更大规模的不连续梯度中分离细胞。
- 按照以下步骤将1.2.3 步骤和1.2.6 的细菌细胞应用100μl。
3. 主要实验细胞的制备
-
如步骤1.2 所述, 接种10毫升适当的肉汤, 准备新鲜的隔夜培养物。
- 按照步骤1.2.1 中所述, 在适当的条件下培养培养物。
- 按照步骤1.2.2 中所述的隔夜文化颗粒。
- 按照步骤1.2.3 中的说明清洗细胞。
- 丢弃上清液, 在 1x pbs 的1毫升中重新悬浮颗粒。如果菌株是粘液状的, 并且不容易颗粒状, 请将颗粒重新悬浮在 pbs 或残留介质的2毫升中。单元格现在可以使用了。
4. 不连续密度梯度的制备
请注意:步骤7介绍了使用移液器从底部 (最集中) 到顶部 (最集中) 的梯度制备的另一种方法。
-
移液器1毫升的最稀释密度梯度稀释成5毫升聚丙烯圆形底管, 形成顶部、最稀释层的梯度。
注:随后的层更集中梯度稀释将添加到此层下面使用的针头, 以避免中断层。建议至少有两个和最多三个梯度层, 每个层1毫升, 以实现细菌的鲁棒分离和简单的可视化。- 使用连接1.5 英寸针头的1毫升一次性注射器, 将下一个最集中的密度梯度介质的1毫升放入注射器中。避免占用任何空气, 因为气泡会破坏梯度层。
- 将针头末端放在包含第一层的管的底部。将注射器内装物非常缓慢地吸入, 以避免混合界面。
请注意:随着更集中的梯度稀释的加入, 这两种稀释的界面会上升。通过将界面保持在灯光或外部窗口的角度来观察接口。如果未观察到不同的接口, 请放弃渐变并重新开始。- 将针头从渐变中非常轻轻地取出, 以免干扰不同梯度稀释之间的界面。将管子放在合适的机架上, 使其保持直立。
- 如果使用三种不同的稀释, 重复步骤4.1.1 – 4.1.2.1, 使最密集的稀释在底部。如果已成功构造渐变, 则将有三个不同的层, 在接口上不进行混合。
5. 在梯度中添加制备的细胞, 并通过离心分离
- 如步骤2.2 所述, 将从步骤3.3 到管中梯度顶部的600μl 添加到管中的梯度顶部, 而无需混合界面。
-
将管置入管适配器, 并称重组合的适配器和管, 以确保它们是平衡的。
- 将管适配器放置在台式离心机内的固定角度转子中。离心 30分钟, 3000xg.
- 离心后, 小心取出管道, 将其放置在合适的机架上, 并将结果作为记录拍照。
-
按照步骤6恢复用于尿酸定量或 dna 提取的细菌组分。
- 如果不需要下游应用,请在实验室中通过适当的液体生物废物途径处置样品梯度。
请注意:验证新种细菌的分离是非常重要的。应通过显微镜、尿酸测定 (第8步) 或其他合适的定量测定来确定每个分数的胶囊表型, 以确定梯度中的单个分数。如果目的是根据聚合或细胞大小进行分离, 则应使用独立的适当检测。
- 如果不需要下游应用,请在实验室中通过适当的液体生物废物途径处置样品梯度。
6. 恢复样本分数和可选的外部增长步骤
-
如果该层内不存在细菌分数, 则通过从顶部稀释中去除和丢弃任何液体来从梯度中恢复分数。
- 要去除顶部, 请使用 p200 移液器, 轻轻地将移液器尖端通过梯度传递到该分数, 并将该部分占用。将分数放入 1.5 ml 管中, 并适当贴标签。
- 为了恢复进一步的分数, 仍然使用 p200 移液器, 通过梯度轻轻插入尖端的分数, 并恢复分数到一个新鲜的 1.5 ml 管。在访问渐变下方的分数时, 删除多余的渐变。
- 如果需要从含有非常低细胞数的分数中提取 dna (例如, 密度-tradisort), 则通过遵循步骤6.2 中的协议对该分数进行亚培养, 以获得更多细胞。
请注意:当分数从上到下被移除时, 梯度顶部的细胞将有很低的结转水平。通过仔细工作, 以避免混合梯度, 通过使用针去除较低的分数, 并通过执行对非常低丰度样品的重新纯化, 在结转可能会影响结果的情况下, 最大限度地减少这种情况。
-
将细胞从6.1.1 的低丰度分数中转移到适当液体介质的5毫升中, 6.1.2。放置在孵化器中, 在37°c 下生长2小时。
- 生长2小时后或样品达到 od600的 1时, 将培养物转移到15毫升管。在离心机中离心管 10分钟, 在 3200 x g的情况下, 用摆动的桶和气雾剂紧盖。放弃上清液
- 在 1x pbs 的1毫升中重新选择细胞颗粒。
-
在5毫升聚丙烯管中制备新鲜的单浓度密度梯度。使用梯度浓度从刚刚以上的分数在原来的梯度 (例如, 用于纯化图 2d 所示的a 突变体, 将使用15% 的密度梯度介质)。
注:此重新提纯步骤是可选的。- 如步骤2.2 和5.1 中所述, 将单元格应用于渐变顶部和离心机。
- 从离心机上取下管道, 放在适当的机架中。拍摄梯度, 并恢复 dna 提取的分数, 如 6.1-6.1.2 中所述。
请注意:该样本现已准备就绪, 可用于 dna 提取或其他下游应用。
7. 使用移液器从底部 (最集中) 到顶部 (最不集中) 的梯度制备的替代方法
-
使用2.2.3 步骤中确定的梯度稀释。使用 1, 000μl 移液器, 在5毫升管中加入1毫升的最密集梯度稀释。
- 使用200μl 移液器, 在管内层的顶部非常缓慢地添加下一次密集梯度稀释的 200μl, 以免混合界面。再加入 200μl, 然后再添加最终 600μl. 添加多个较小的体积可以更好地控制移液速度, 并防止接口的混合。如果接口混合, 请放弃并重新开始。
- 如果使用三种稀释剂, 重复步骤7.1.1 使用第三, 最不密集的梯度浓度。根据步骤2.2.3 的结果, 管现在应该有2毫升或3毫升的梯度。
- 转到协议的第5步以添加单元格并继续实验。
8. 尿酸测定胶囊的含量
- 用 pbs 稀释, 将每个回收分数的 od600调整到4.0。继续对尿酸进行量化, 如先前公布的 1。
结果
有代表性的结果如图 2所示。确切的结果将取决于细菌的种类, 密度梯度的设置, 以及用户是否正在检查单个菌株或一个突变体池。大多数菌株将迁移到渐变中的单个位置, 如图 2 a和2A 所示.将该方法应用于细菌突变文库将产生梯度上方的一个主要带, 一个分布在梯度最上层的密度较低的带, 以及在底部的一个较小的囊状分数 (图 2b)。这些分数在胶囊含量上有所不同, 如尿酸测定所示 (图 2b)。单个组分的转移子插入测序可使特定突变体在不同梯度分数内清晰定位, 如肺炎 k. atcc43816 (图 2c) 的胶囊生物合成位点所示。图 2 d 显示了ntuh-k2044 和肺炎 s.的纯培养的代表性结果, 以及不同的胶囊生物合成或调节突变体。
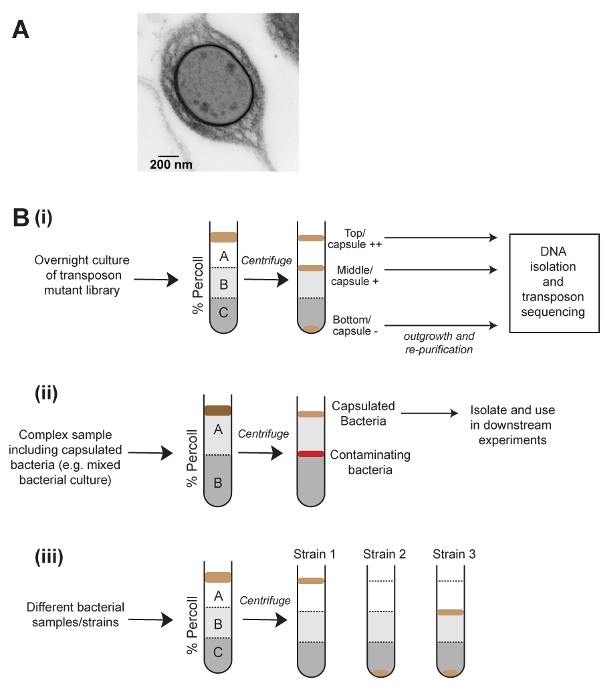
图 1: 基于胶囊分离细菌的密度离心方法示意图及其应用.(a) 肺炎克雷伯菌胶囊细胞的电子显微镜图像。胶囊在细胞外部是可见的致密层。(b) 密度离心在胶囊细菌研究中的应用。(bi)密度分离可用于生成转座子突变库的高、低和无胶囊组分, 然后进行转座子插入测序, 以定义影响胶囊生产的基因。(比伊)从复杂样品中纯化胶囊细菌。(biii)使用密度为基础的分离, 快速比较样品之间的胶囊量。这种方法还允许在细菌群体中的异质胶囊生产的可视化, 如 (biii) 所示。请点击这里查看此图的较大版本.
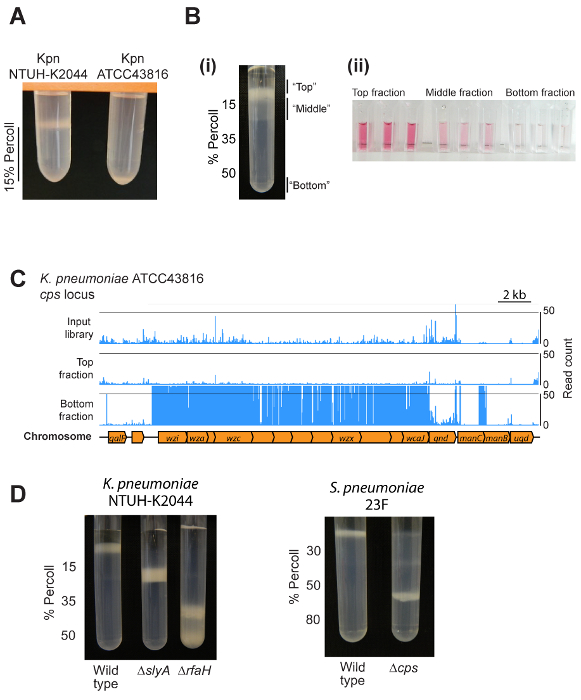
图 2: 具有代表性的结果.(a) 小型梯度测试的输出示例。在15% 密度梯度介质的1毫升上离心了两种不同的肺炎k. 菌株。超粘气的 ntuh-k2044 菌株保留在密度梯度介质层上方, 而 atcc43816 (使胶囊较少) 迁移到层的底部。(bi)使用密度梯度将转座子突变库分成三个分数。请注意, 底部分数包含的突变体比例较低, 在此图片中不可见。(比伊)使用尿酸检测方法验证顶部、中间和底部的不同胶囊含量。从顶部、中间和外径底部组分的细胞在 pbs 中被分离并重新悬浮到 od600的 4个, 然后提取胶囊多糖和测定尿酸 1.(c) 密度示例------------------------------确定的突变位置由染色体上方的蓝线显示。缺乏胶囊的突变体可以被确定为那些存在于输入库中, 但在顶部被耗尽, 而在底部的部分被耗尽, 如这里所示的胶囊生物合成位点8。(d) 利用密度梯度离心法比较 ntuh-k2044 k和肺炎 s 的野生类型和突变菌株的胶囊数量的实例. 请点击这里查看此图的较大版本.
讨论
胶囊是许多细菌中的重要毒力因子, 包括肺炎 k.3、肺炎链球菌9、不动杆菌10和neisseria 11 种。虽然细菌胶囊的定量和可视化方法多种多样, 但目前还没有广泛使用的方法对胶囊和非胶囊细胞进行物理分离。在本文中, 我们展示了一种基于胶囊的细菌群体分离的可靠方法, 结合不同的上游或下游协议, 具有多种潜在应用。
表面胶囊的存在可以降低细菌细胞密度, 从而允许通过密度梯度离心分离 (图 2d)。我们在 ntuh-k2044 12 k. 肺炎 k.和 atcc4381613 以及肺炎链球菌23f14及其 cps 突变体15中验证了该方法的有效性.这种方法使用 percoll 16 作为密度梯度的主要成分, 即悬浮涂层胶体二氧化硅颗粒, 具有低粘度和对细菌没有毒性-原则上, 符合这些标准的其他物质可以是用于建立密度梯度。
这可能是一个挑战, 以确保不同密度的层不混合时, 构造密度梯度, 如果混合确实发生, 分离方法不会给出干净的结果。我们已经包括了两种替代方法来浇注渐变, 使用针头或移液器--这两种方法都是有效的, 使用哪种方法只是一个偏好的问题。对于所有涉及将物质 (细菌悬浮液或更稀薄的梯度层) 移液到梯度层上方的步骤, 将体积较小的多个等量移入可以更容易地实现尖锐的界面, 而无需任何混合层。
该协议的一个局限性是, 其与其他细菌物种的性能无法得到保证。因此, 在检查一种新的细菌种类或菌株时, 使用一种额外的、独立的胶囊定量方法来验证基于密度的分离是至关重要的。用适当的胶囊污渍用显微镜来可视化每个部分中存在的细菌是一种可靠的方法, 有详细的协议17。或者, 含有尿酸的胶囊 (如大肠杆菌和肺炎 k 酸的胶囊) 可以通过特定的测定进行量化, 如图 2b1 所示。基于离心的粘液粘度试验不适合作为一种独立的验证方法, 因为这种检测也取决于细菌细胞的密度。
这种方法的另一个局限性是胶囊的生产对培养条件非常敏感, 即使生长介质、温度或曝气的微小变化也可能影响这种试验的结果。为了最大限度地减少这个问题, 研究人员可以使用定义的生长介质或批次一致的复杂介质, 在实验之间保持所有其他生长参数相同, 并包括适当的控制应变, 以便能够解释意外结果.一些细菌胶囊是脆弱的, 可以剪掉远离细胞时, 培养物移液。为避免胶囊的剪切, 在准备梯度加载过程中, 培养物应离心并重新悬浮不超过两次。如果在培养过程中失去胶囊仍然存在问题, 细菌培养物可以直接应用于密度梯度, 必要时添加更大的细菌悬浮液量, 以便进行可视化。
这种方法今后的应用是将其应用于其他细菌物种, 并将这种分离与不同的上游和下游技术结合使用。除了密度-tradisort8, 我们建议密度梯度分离胶囊细菌可用于分离突变体与改变胶囊, 纯化胶囊细胞从混合培养物或复杂的样品, 并胶囊生产在多个菌株中的快速分析。最后, 该技术可用于检测其他细菌表型, 如聚集。
披露声明
提交人没有经济利益可披露。
致谢
我们感谢王金镇和苏珊娜·索尔特供应毒株, 并感谢帕克希尔集团成员进行有益的讨论。这项工作由 well友邦 sanger 研究所 (well项赠款 206194) 和亨利·惠康爵士博士博士后研究金资助。医学博士由 wellis sanger 大学博士生提供支持。
材料
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17-0891-01 | |
| Centrifuge 5810R with Rotor A-4-81 and 500 mL buckets | Eppendorf | 5810 718.007 | |
| Adapters for 15 mL tubes | Eppendorf | 5810 722.004 | |
| Fixed andgle rotor F-34-6-38 | Eppendorf | 5804 727.002 | |
| 2.6 to 7 mL tube adapter | Eppendorf | 5804 739.000 | |
| Centrifuge 5424 including Rotor FA-45-24-11 | Eppendorf | 5424 000.460 | |
| 2 mL tubes | Eppendorf | 0030 120.094 | |
| 1.5 mL tubes | Eppendorf | 0030 120.086 | |
| 5 mL polypropylene round bottom tube | Falcon | 352063 | |
| 1 mL disposable syringe Luer slip | Becton Dickinson | 300013 | |
| AGANI Needle 21G Green x 1.5" | Terumo | AN 2138R1 | |
| P1000 pipette and tips | |||
| P200 pipette and tips |
参考文献
- Favre-Bonté, S., Licht, T. R., Forestier, C., Krogfelt, K. A. Klebsiella pneumoniae capsule expression is necessary for colonization of large intestines of streptomycin-treated mice. Infection and Immunity. 67 (11), 6152-6156 (1999).
- Bachman, M. A., et al. Genome-wide identification of Klebsiella pneumoniae fitness genes during lung infection. mBio. 6 (3), 1-9 (2015).
- Paczosa, M. K., Mecsas, J. Klebsiella pneumoniae: Going on the offense with a strong defense. Microbiology and Molecular Biology Reviews : MMBR. 80 (3), 629-661 (2016).
- Shon, A. S., Bajwa, R. P. S., Russo, T. A. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae. Virulence. 4 (2), 107-118 (2014).
- Fang, C. -. T., Chuang, Y. -. P., Shun, C. -. T., Chang, S. -. C., Wang, J. -. T. A novel virulence gene in Klebsiella pneumoniae. strains causing primary liver abscess and septic metastatic complications. The Journal of Experimental Medicine. 199 (5), 697-705 (2004).
- Lai, Y. -. C., Peng, H. -. L., Chang, H. -. Y. RmpA2, an activator of capsule biosynthesis in Klebsiella pneumoniae CG43, regulates K2 cps gene expression at the transcriptional level. Journal of Bacteriology. 185 (3), 788-800 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in Teflon-coated cell culture bags. Journal of Visualized Experiments. (91), 1-10 (2014).
- Dorman, M. J., Feltwell, T., Goulding, D. A., Parkhill, J., Short, F. L. . The capsule regulatory network of Klebsiella pneumoniae defined by density-TraDISort. , (2018).
- Geno, K. A., et al. Pneumococcal capsules and their types: Past, present, and future. Clinical Microbiology Reviews. 28 (3), 871-899 (2015).
- Weber, B. S., Harding, C. M., Feldman, M. F. Pathogenic Acinetobacter: From the cell surface to infinity and beyond. Journal of Bacteriology. 1986 (6), 880-887 (2016).
- Mubaiwa, T. D., Semchenko, E. A., Hartley-Tassell, L. E., Day, C. J., Jennings, M. P., Seib, K. L. The sweet side of the pathogenic Neisseria.: The role of glycan interactions in colonisation and disease. Pathogens and Disease. 75 (5), 1-9 (2017).
- Wu, K. -. M. M., et al. Genome sequencing and comparative analysis of Klebsiellapneumoniae. NTUH-K2044, a strain causing liver abscess and meningitis. Journal of Bacteriology. 191 (14), 4492-4501 (2009).
- Broberg, C. A., Wu, W., Cavalcoli, J. D., Miller, V. L., Bachman, M. A. Complete genome sequence of Klebsiellapneumoniae. Strain ATCC 43816 KPPR1, a rifampin-resistant mutant commonly used in animal, genetic, and molecular biology studies. Genome Announcements. 2 (5), (2014).
- Croucher, N. J., et al. Role of conjugative elements in the evolution of the multidrug-resistant pandemic clone Streptococcuspneumoniae Spain23F ST81. Journal of Bacteriology. 191 (5), 1480-1489 (2009).
- Croucher, N. J., et al. Selective and genetic constraints on Pneumococcal serotype switching. PLoS Genetics. 11 (3), 1-21 (2015).
- Pertoft, H., et al. Density gradients prepared from colloidal silica particles coated by polyvinylpyrrolidone (Percoll). Analytical Biochemistry. 88, 271-282 (1978).
- Breakwell, D. P., Moyes, R. B., Reynolds, J. Differential staining of bacteria: Capsule stain. Current Protocols in Microbiology. 15 (1), 1-4 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。